高压氧干预对高海拔移居者睡眠质量、抑郁状况及HRV的调节效应
2024-06-23马海林杨熙玥苏瑞李昊
马海林 杨熙玥 苏瑞 李昊


摘要:为了探讨高压氧干预是否可以改善高原移居者的睡眠质量、抑郁状况和自主神经系统的平衡性,选取成年后移居高海拔地区的44名大学生作为研究对象,随机分为实验组和对照组.两组被试者在20次高压氧干预前、干预后和干预后第15天分别测评匹兹堡睡眠质量指数量表(PSQI)、流调中心抑郁量表(CES-D)及心率变异性(HRV).结果发现:1) 经过20次的高压氧干预,实验组的PSQI、CES-D得分显著下降(Ps<0.05);2) 实验组HRV中的HF(高频功率)数值显著提高(P<0.05)、LF(低频功率)及LF/HF数值显著下降(Ps<0.05);而对照组的前后所测各指标之间均不存在显著性差异(Ps>0.05).结论:高压氧干预改善了高原移居者睡眠、抑郁状况及自主神经系统的平衡性,且存在明显的预后效应.
关键词:高海拔; 高压氧; 睡眠质量; 心率变异性
中图分类号:R459.6 文献标志码:A 文章编号::1001-8395(2024)05-0569-07
缺氧会影响人们的生活质量.通常,当人体动脉中的氧分压数值低于7.98 kPa时可以保证基本的生理活动,而青藏高原的平均氧分压数值高于16 kPa [1],严重影响了高原居住者的正常生活.长期高海拔暴露不仅会造成生理,记忆、表象、情绪及注意等认知功能的损伤 [2-4],同时,还可能引起中枢神经紊乱,破坏大脑兴奋抑制的平衡性 [5].由于长期的供氧不足,大脑睡眠控制区域损伤,睡眠结构发生改变,引发高原移居者的睡眠质量下降 [6],造成个体的呼吸、消化、内分泌、生殖等多个系统的器质性或功能性损伤.同时,也会导致心理健康问题以及认知能力的下降,产生焦虑、抑郁等情绪障碍,影响生理功能和作业效能 [7].
失眠群体通常表现出脑电活动、代谢、心率及交感神经兴奋性的增加 [8],其脑细胞长期处于慢性缺氧状态,这是临床应用高压氧治疗失眠的首要考虑靶点 [9].高压氧干预通过增大氧弥散率及氧弥散距离来促进血氧含量及血氧张力的增加,改善机体对缺氧的耐受性,增加肌体储氧能力,预防人体高原缺氧所导致的睡眠质量下降,常用来治疗进入高原后人群所引起的睡眠障碍 [10].此外,高压氧还可以增加椎动脉血流和脑干网状激活系统的血供,缓解植物神经功能紊乱征状,改善大脑皮质的内抑制过程的弱化现象,有效调节交感和迷走神经的平衡性.血氧分压的提高,增强了脑组织有氧代谢能力,加速葡萄糖的转换和能量合成,从而提高了脑细胞的功能和活性,促进失调的大脑皮层生理活动的恢复 [11].
睡眠是由人体交感神经和副交感神经相互协调控制的结果 [12],受自主神经系统调节.心率变异性(heart rate variability,HRV)是评价自主神经活动的重要指标 [13].本研究主要关注HRV频域的高频功率(high-frequency,HF)和低频功率(low-frequency,LF).高频功率(HF,0.15~0.4 Hz)受迷走神经系统调节,是迷走神经活性的主要指标,数值越大代表睡眠深度越大 [14].低频功率(LF,0.04~0.15 Hz)反映交感与迷走神经的复合调节作用,数值越小代表深度睡眠的时间越长 [15].低频功率与高频功率的比值(LF/HF),代表自主神经功能的平衡性,LF/HF的值的增加反映了交感神经兴奋性的增强,数值越小,睡眠质量越好 [16].静息状态下的心率变异性代表的是一种在情绪调节状态下所需要的心理资源,静息态的HF能够预测一年后的抑郁状况,静息态的HF数值越高,一年后的抑郁状况越轻 [17].在抑郁状态下通常会出现副交感神经系统功能障碍,抑郁个体在受刺激时,副交感神经系统不能正常激活,因此,副交感神经系统的增强对于改善焦虑抑郁状态具有重要意义 [18].低氧暴露使机体产生应激代偿反应,引起心律变异下降,交感神经兴奋性提高,迷走神经活性降低,LF、LF/HF数值升高,HF数值降低 [19].研究表明,当人进入3 000 m左右海拔高度环境时,机体的迷走神经活性会显著减弱,兴奋抑制平衡能力也会下降 [20].
综上,长期的高海拔暴露影响高原移居者的睡眠质量,高压氧干预能够帮助机体迅速恢复储氧能力.为研究高压氧干预是否能够改善高海拔移居者的睡眠质量,本研究采用20次的高压氧干预,考察其对睡眠质量、抑郁状况以及自主神经系统的影响.
1 研究方法
1.1 被试者 在西藏大学招募并选取44名汉族被试者,随机分为实验组和控制组.实验组:男13人、女9人,年龄范围在19~21岁之间,平均年龄(19.77±0.68)岁,在拉萨(海拔3 680 m)居住时间为(1.59±0.50)年;控制组:男13人、女9人,年龄范围在19~21岁之间,平均年龄(20.09±0.68)岁,在拉萨居住时间为(1.50±0.51)年.两组被试者在年龄、居住时间上均不存在显著性差异(Ps>0.05).入组标准:1) 出生于海拔1 000 m以下的低海拔地区,并且成年前没有在高海拔地区长期居住和生活的经历;2) 没有长期吸氧的历史及近期没有进入氧舱及吸氧的经历;3) 在拉萨居住时间为1~2 a,除寒暑假外没有因休学及交换学习等特殊原因而长期离开拉萨的历史;4) 能够调整时间配合完成实验安排;5) 排除精神分裂、情感障碍、精神发育迟滞等严重精神疾患以及重大躯体和神经系统疾病患者.本实验获得西藏大学伦理委员会批准,实验前所有被试者签署了知情同意书,实验结束后获得一定报酬.
1.2 工具
1.2.1 匹兹堡睡眠质量指数量表 匹兹堡睡眠质量指数量表(pittsburgh sleep quality index,PSQI) [21]共包含7个维度、19个项目.每个因素按0~3等级计分,累积各因素得分为睡眠质量的总分,总分范围为0~21分,得分越高表示睡眠质量越差.该量表具有较高的信度与效度,克隆巴赫α系数为0.73,分半信度系数为0.66.
1.2.2 流调中心抑郁量表 流调中心抑郁量表(center for epidemiological studies depression scales,CES-D)由Radloff [22]于1997年编制,侧重于评估被试者的抑郁情感和心境.共包含20个条目,每个条目按0~3等级计分,其中有4个条目的用词指向非抑郁,以防止测试者乱答,总分范围为0~60分,分数越高抑郁出现的频度越高.该量表克隆巴赫α系数为0.87,斯皮尔曼-布朗系数为0.82,内部一致性系数为0.85.
1.2.3 心率变异性的测量 采用BIOPAC的MP150多导生理记录仪对被试者的心电数据进行采集,采样率为1 000 Hz,测试时将传感器固定于胸前,受试者静息坐立20 min实时监测,记录标准导联心电图,后期采用Kubio HRV Standard分析软件进行5 min短时程频域分析,选用傅里叶变换算法,以频域指标HF与LF的标准化矫正单位(n.u.)与(%)来衡量自主神经系统活性的量化改变,以LF(ms2)与HF(ms2)的比值LF/HF来衡量自主神经系统的平衡性.其中:LF(n.u.)与LF(%)反映人体交感神经系统活性,且
LF(n.u.)=LF(ms2)HF(ms2)+LF(ms2)-VLF(ms2),LF(%)=LF(ms2)HF(ms2)+LF(ms2)*100%;
HF(n.u.)与HF(%)反映人体迷走神经系统活性,且
LF(n.u.)=LF(ms2)HF(ms2)+LF(ms2)-VLF(ms2),HF(%)=HF(ms2)HF(ms2)+LF(ms2)*100%.
1.3 高压氧舱 本研究采用负离子软体氧舱进行高压氧干预,舱体为椭圆形,高2.13 m,宽2.55 m,底面积为7.88 m2.干预压力为0.11 MPa,氧气质量分数为25%,氧气流量为10 L/min,氧分压峰值为27.86 kPa.
1.4 研究流程 所有被试者在正式实验前采用匹兹堡睡眠质量指数PSQI、流调中心抑郁量表CES-D评定睡眠质量及抑郁状态,并采用生理多导仪测量心率变异性.实验组在30 d内完成20次高压氧干预.每次干预时,升压40 min后氧分压达到峰值,此后恒压吸氧60 min,最后减压20 min出舱.在实验组完成第20次的高压氧干预出舱后,有10 min左右的时间让被试者各项生理指标得以恢复,接着对所有被试者进行心率变异性、睡眠指数及抑郁状态的评定.实验组在完成干预后第15天,再次进行评定.控制组不进行任何干预,两组被试者3次测试的时间间隔相同.
1.5 数据处理 数据采用SPSS 20.0软件统计.采用2(组别:实验组、控制组)×3(时间:第1次、第2次、第3次)重复测量方差分析,被试者间因素为组别,被试者内因素为时间.方差分析的P值(<0.05)采用Greenhouse-Geisser法校正.
2 研究结果
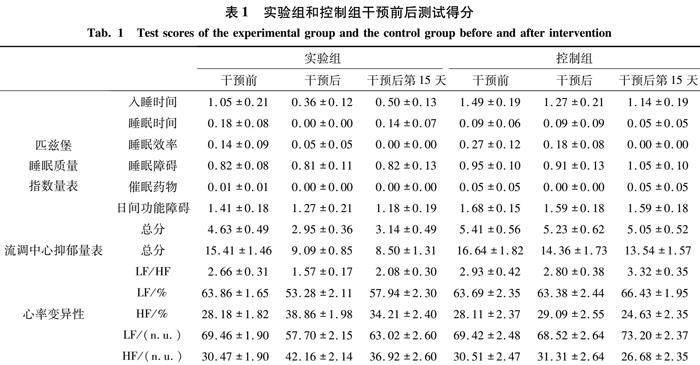
2.1 干预前后两组PSQI得分结果 本研究对PSQI的总分和各维度评分进行2(组别)×3(时间)的重复测量方差分析.在PSQI总分上,时间的主效应显著
[F(2,41)=16.07,P<0.001,η2=0.44],
组别的主效应显著
[F(1,42)=5.60,P<0.05,η2=0.13],组别和时间的交互作用显著
[F(2,41)=9.82,P<0.001,η2=0.32].
简单效应分析显示:
1) 干预前,两组被试者的基线水平无显著差异(P>0.05);
2) 高压氧舱显著改善了实验组的睡眠状况,体现在实验组在干预结束和干预结束后第15天的PSQI总分均显著低于第1次测试水平(Ps<0.001);控制组的PSQI总分在3次测试之间均不存在显著差异(Ps>0.05);
3) 在第2次和第3次测试时,实验组的PSQI总分显著低于控制组(P<0.001,P<0.01).
在睡眠质量上,时间的主效应显著
[F(2,84)=3.99,P<0.05,η2=0.09],
组别的主效应显著
[F(1,42)=8.06,P<0.01,η2=0.16],
组别和时间的交互作用显著
[F(2,84)=12.36,P<0.001,η2=0.23].
简单效应分析显示:
1) 干预前,两组被试者的基线水平无显著差异(P>0.05);
2) 实验组在干预结束和干预结束后15天的睡眠质量得分均显著低于第1次测试水平(Ps<0.001);控制组的睡眠质量得分在3次测试之间均不存在显著差异(Ps>0.05);
3) 在第2次和第3次测试时,两组睡眠质量存在显著差异,实验组显著优于控制组(P<0.001,P<0.01).
在入睡时间上,时间的主效应显著
[F(2,84)=15.32,P<0.001,η2=0.27],
组别的主效应显著
[F(1,42)=7.35,P<0.05,η2=0.15],
组别和时间的交互作用显著
[F(2,84)=5.11,P<0.01,η2=0.11].
简单效应分析显示:
1) 干预前,两组被试者的基线水平无显著差异(P>0.05);
2) 实验组在干预结束和干预结束后第15天的入睡时间得分显著均低于第1次测试水平(Ps<0.001);控制组的入睡时间得分在3次测试之间均不存在显著差异(Ps>0.05);
3) 在第2次和第3次测试时,实验组的入睡时间显著低于控制组(P<0.001,P<0.01).
在睡眠效率上,时间的主效应显著
[F(2,41)=3.70,P<0.05,η2=0.15],
组别的主效应不显著
[F(1,42)=1.39,P=0.245,η2=0.03],
组别和时间的交互作用不显著
[F(2,41)=1.00,P=0.375,η2=0.05].
对睡眠时间、睡眠障碍、催眠药物、日间功能障碍4个维度进行重复测量方差分析,发现主效应和交互作用均不显著(Ps>0.05).
2.2 干预前后两组CES-D得分结果 对CES-D得分进行2(组别)×3(时间)的重复测量方差分析结果显示,两组CES-D得分时间的主效应显著
[F(2,41)=17.27,P<0.001,η2=0.46],
组别的主效应显著
[F(1,42)=4.31,P<0.05,η2=0.09],
组别和时间的交互作用显著
[F(2,41)=3.61,P<0.05,η2=0.15].
简单效应分析显示:
1) 干预前,两组被试者的基线水平无显著差异(P>0.05);
2) 实验组在干预结束和干预后第15天的CES-D得分均显著低于第1次测试水平(Ps<0.001);控制组的得分在3次测试之间均不存在显著差异(Ps>0.05);
3) 在第2次、第3次测评时,实验组CES-D总分均显著低于控制组(Ps<0.01).
2.3 干预前后两组HRV指标 对HRV频域各指标分别进行2(组别)×3(时间)的重复测量方差分析发现,在LF(ms2)/HF(ms2)指标上,时间的主效应显著
[F(2,41)=3.40,P<0.05,η2=0.07],
组别的主效应显著
[F(1,42)=8.72,P<0.01,η2=0.17],
组别和时间的交互作用不显著
[F(2,41)=1.98,P=0.149,η2=0.05].
在LF(%)指标上,时间的主效应显著
[F(2,84)=4.19,P<0.05,η2=0.09],
组别的主效应显著
[F(1,42)=11.56,P<0.001,η2=0.22],
组别和时间的交互作用显著
[F(2,84)=3.79,P<0.05,η2=0.08].
简单效应分析显示:
1) 干预前,两组被试者的基线水平无显著差异(P>0.05);
2) 实验组在干预结束和干预结束后第15天的LF(%)数值显著高于第1次测试水平(P<0.001,P<0.01);控制组的LF(%)数值在3次测试之间均不存在显著差异(Ps>0.05);
3) 在第2次和第3次测试时,实验组LF(%)数值显著高于控制组(Ps<0.01).
在HF(%)指标上,时间的主效应显著
[F(2,84)=4.68,P<0.05,η2=0.10],
组别的主效应显著
[F(1,42)=10.79,P<0.01,η2=0.20],
组别和时间的交互作用显著
[F(2,84)=4.23,P<0.05,η2=0.09].
简单效应分析显示:
1) 干预前,两组被试者的基线水平无显著差异(P>0.05);
2) 实验组在干预结束和干预结束后第15天的HF(%)数值显著高于第1次测试水平(P<0.001,P<0.01);控制组的HF(%)数值在3次测试之间均不存在显著差异(Ps>0.05);
3) 在第2次和第3次测试时,实验组HF(%)数值显著高于控制组(Ps<0.01).
在LF(n.u.)指标上,时间的主效应显著
[F(2,84)=4.98,P<0.01,η2=0.10],
组别的主效应显著
[F(1,42)=11.83,P<0.001,η2=0.22],
组别和时间的交互作用显著
[F(2,84)=4.49,P<0.05,η2=0.10].
简单效应分析显示:
1) 干预前,两组被试者的基线水平无显著差异(P>0.05);
2) 实验组在干预结束和干预结束后第15天的LF(n.u.)数值显著高于第1次测试水平(P<0.001,P<0.01);控制组的LF(n.u.)数值在3次测试之间均不存在显著差异(Ps>0.05);
3) 在第2次和第3次测试时,实验组的LF(n.u.)数值显著高于控制组(Ps<0.001).
在HF(n.u.)指标上,时间的主效应显著
[F(2,84)=4.88,P<0.01,η2=0.10],
组别的主效应显著
[F(1,42)=11.89,P<0.001,η2=0.22],
组别和时间的交互作用显著
[F(2,84)=4.55,P<0.05,η2=0.10].
简单效应分析显示:
1) 干预前,两组被试者的基线水平无显著差异(P>0.05);
2) 实验组在干预结束和干预结束后第15天的HF(n.u.)数值显高于第1次测试水平(P<0.001,P<0.01);控制组的HF(n.u.)数值在3次测试之间均不存在显著差异(Ps>0.05);
3) 在第2次和第3次测试时,实验组的HF(n.u.)数值显著高于控制组(Ps<0.001).
综上讨论结果如表1和图1所示.
3 讨论
本研究采用20次高压氧干预考察其对高海拔
移居者睡眠质量、抑郁和自主神经系统的均衡性的影响.结果显示,干预后实验组睡眠质量与抑郁状况优于对照组,实验组心率变异性频域指标中的LF、LF/HF数值显著下降,HF数值显著提高,而对照组前后测各指标间均不存在显著性差异.这表明,高压氧干预能够提高睡眠质量,增强自主神经系统平衡性,改善睡眠质量,减轻抑郁焦虑症状,并且在干预后15 d仍然存在明显的预后效应.
高压氧干预使得机体得到了充分的氧供,有利于细胞内一氧化氮及三磷酸腺苷的生成,提高抗氧化酶活性,促进新陈代谢及血液循环 [23].研究发现,在海拔3 700 m左右,将室内氧气质量分数提高到24%,可明显增加深睡眠比例与慢波睡眠比率,缩短周期性呼吸时间,减少呼吸暂停次数 [24].加压状态下氧的穿透性强,能够使氧气更好地溶于血液,这种高压富氧可能是实验组PSQI得分显著下降的关键因素.睡眠与焦虑抑郁情绪具有双向调节作用,睡眠质量的提升有利于改善情绪状态.高压氧干预下,高浓度的氧气供应,使大脑得到充足的氧气供应,从而提高了中枢神经的功能和活性,与情绪密切相关的垂体、边缘系统的功能将得到改善 [25].抑郁情绪与HRV也存在着密切的联系,自主神经系统的失衡会对情绪调节能力造成一定影响,健康个体相对于抑郁症患者HF数值通常更高,迷走神经张力更强 [26].高压氧干预可能是通过改善自主神经系统,增强交感迷走神经平衡性,从而改善了抑郁情绪.
氧气对心率变异性存在极大的影响,多次给氧干预能够改善心肌缺血,提高心脏排出量与血管舒缩功能,从而调节自主神经系统的功能 [27].谢元攀 [28]通过对女子拳击运动员进行高压氧干预,发现干预后被试者的迷走神经活性增强、交感神经张力减弱、交感和迷走神经平衡性得到改善,同时提高了睡眠效率,降低了睡眠转换次数和觉醒次数,这与本研究结果相一致.在低压低氧的高海拔环境中,HRV会随着血氧饱和度(SpO2)的升高而增强,高压氧能够快速恢复移居者血氧含量,起到增强其迷走神经活性的作用 [29].缺氧与HRV的变化及睡眠结构的破坏程度具有显著的相关性,高原影响睡眠质量的重要原因在于低氧引起的机体应激反应,使细胞兴奋性过高,从而造成迷走神经受损,导致自主神经系统失衡.而失眠患者通常表现出交感神经的过度兴奋,处于一种高度觉醒的状态.当这种过度激活得到有效改善时,睡眠质量也将有所提升 [30],这可能是本研究改善移居者睡眠质量的内在机制之一.
如前所述,长期的高海拔暴露影响高原移居者的睡眠质量,研究通过20次高压氧干预探讨其对高原移居者睡眠质量的调节作用,发现高压氧可以有效调节移居者自主神经系统功能,改善睡眠状况与抑郁焦虑症状.这为提高高原移居者的睡眠质量提供了有效方案,有望切实提高他们的生活质量,对由于长期的高海拔暴露导致的认知能力的损伤或许也将起到一定的提升作用.
然而,本研究仍然存在需要完善的地方.首先,仅探讨了高压氧干预对移居者HRV的影响,是否还会引起其他生理生化指标的变化有待进一步确认.其次,采用问卷法评定被试者的睡眠和抑郁状况可能带有一定主观性,未来可以借助多导睡眠仪等获取客观评价指标进行测评.此外,最适用于高原移居者人群的干预时间和压力值有待进一步确认.最后,虽然20次的氧舱干预在干预后15 d的效果仍然存在,但后续的持续时程尚不明确,下一步将对持续时间和持续效果作进一步研究,以确认高压氧干预的最优方案.
参考文献
[1] 史培军,陈彦强,张安宇,等. 青藏高原大气氧含量影响因素及其贡献率分析[J]. 科学通报,2019,64(7):715-724.
[2] MA H L, ZHANG D L, LI X B, et al. Long-term exposure to high altitude attenuates verbal and spatial working memory: evidence from an event-related potential study[J]. Brain and Behavior,2019,9(4):e01256.
[3] ZHANG D L, ZHANG X J, MA H L, et al. Competition among the attentional networks due to resource reduction in Tibetan indigenous residents: evidence from event-related potentials[J]. Scientific Reports,2018,8(1):610.
[4] MA H L, LI X Y, LIU M, et al. Mental rotation effect on adult immigrants with long-term exposure to high altitude in Tibet: an ERP study[J]. Neuroscience,2018,386:339-350.
[5] VIRUS-ORTEGA J, GARRIDO E, JAVIERRE C, et al. Human behaviour and development under high-altitude conditions[J]. Developmental Science,2006,9(4):400-410.
[6] 陈勇胜,王生成. 高原低氧环境对睡眠和脑功能的影响[J]. 空军医学杂志,2012,28(3):150-153.
[7] ISSA A N, HERMAN N M, WENTZ R J, et al. Association of cognitive performance with time at altitude, sleep quality, and acute mountain sickness symptoms[J]. Wilderness & Environmental Medicine,2016,27(3):371-378.
[8] MIGLIS M G. Autonomic dysfunction in primary sleep disorders[J]. Sleep Medicine,2016,19:40-49.
[9] 刘阳,黄丽平,袁新,等. 高压氧治疗在失眠障碍中的应用[J]. 国际精神病学杂志,2020,47(5):894-896.
[10] 刘彦山,贾敏,药永红,等. 高压氧联合红景天预防高原睡眠障碍效果观察[J]. 解放军预防医学杂志,2013,31(4):364.
[11] 袁记霞. 高压氧治疗对小儿脑瘫睡眠障碍的影响[J]. 按摩与康复医学(下旬刊),2011,2(6):26.
[12] 吴钟琪,卫生部医政司医用高压氧岗位培训中心. 高压氧临床医学[M]. 长沙:中南大学出版社,2003:243-244.
[13] ALTIMIRAS J. Understanding autonomic sympathovagal balance from short-term heart rate variations. Are we analyzing noise?[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology,1999,124(4):447-460.
[14] BROWN T E, BEIGHTOL L A, KOH J, et al. Important influence of respiration on human R-R interval power spectra is largely ignored[J]. Journal of Applied Physiology,1993,75(5):2310-2317.
[15] FURLAN R, GUZZETTI S, CRIVELLARO W, et al. Continuous 24-hour assessment of the neural regulation of systemic arterial pressure and RR variabilities in ambulant subjects[J]. Circulation,1990,81(2):537-547.
[16] 齐华. 心率变异与睡眠质量关系的研究[D]. 北京:北京体育大学,2009:21-36.
[17] 隆敏,覃军,黄岚,等. 男性青年急进高原初期心率变异性的变化及意义[J]. 第三军医大学学报,2008,30(9):855-857.
[18] CORNOLO J, MOLLARD P, BRUGNIAUX J V, et al. Autonomic control of the cardiovascular system during acclimatization to high altitude: effects of sildenafil[J]. Journal of Applied Physiology,2004,97(3):935-940.
[19] VAZQUEZ L, BLOOD J D, WU J, et al. High frequency heart-rate variability predicts adolescent depressive symptoms, particularly anhedonia, across one year[J]. Journal of Affective Disorders,2016,196:243-247.
[20] 杜艺炜,王高华,王惠玲,等. 抑郁障碍患者自主神经功能研究进展[J]. 临床精神医学杂志,2020,30(1):67-69.
[21] 刘贤臣,唐茂芹,胡蕾,等. 匹兹堡睡眠质量指数的信度和效度研究[J]. 中华精神科杂志,1996,29(2):103-107.
[22] RADLOFF L S. The CES-D scale: a self-report depression scale for research in the general population[J]. Applied Psychological Measurement,1977,1(3):385-401.
[23] FERNANDEZ-MENDOZA J, VGONTZAS A N, BIXLER E O, et al. Clinical and polysomnographic predictors of the natural history of poor sleep in the general population[J]. Sleep,2012,35(5):689-697.
[24] 哈振德,何通晗,张西洲,等. 富氧对高原移居者睡眠结构的影响[J]. 中华内科杂志,2004,43(5):368-370.
[25] 房广才. 临床高压氧医学[M]. 北京:华文出版社,1995:345-347.
[26] AGORASTOS A, KELLNER M, STIEDL O, et al. The 5-HTTLPR genotype modulates heart rate variability and its adjustment by pharmacological panic challenge in healthy men[J]. Journal of Psychiatric Research,2014,50:51-58.
[27] OKEEFFE K M, GANDER P H, SCOTT W G, et al. Insomnia treatment in New Zealand[J]. The New Zealand Medical Journal,2012,125(1349):46-59.
[28] 谢元攀. 吸氧干预对女子拳击运动员睡眠质量的影响[D]. 北京:首都体育学院,2016.
[29] SAITO S, TANOBE K, YAMADA M, et al. Relationship between arterial oxygen saturation and heart rate variability at high altitudes[J]. The American Journal of Emergency Medicine,2005,23(1):8-12.
[30] PRZYBYOWSKI T, ASHIRBAEV A, LE ROUX J, et al. Effect of 2 000 m descent simulated in a hyperbaric chamber on arterial blood oxygen saturation and sleep quality in workers of a gold mine situated at an altitude of 3 800-4 200 m above sea level[J]. Pneumonologia i Alergologia Polska,2003,71(7/8):314-319.
The Improvement of Sleep Quality, Depression and HRV in Young Immigrants in Tibet by Hyperbaric Oxygen Treatment
MA Hailin 1,2, YANG Xiyue 1,2, SU Rui 1,2, LI Hao 1,2
(1. Plateau Brain Science Research Center, Tibet University, Lhasa 850000, Tibet;2. Key Laboratory of High Altitudes Brain Science and Environmental Acclimation, Tibet University, Lhasa 850000, Tibet)
To explore whether hyperbaric oxygen intervention can improve the sleep quality, mitigate depression and promote the balance of autonomic nervous system of plateau immigrants, forty-four college students migrating to plateau area as adults were selected as the research objects, who were randomly divided into an experimental group and a control group. The Pittsburgh Sleep Quality Index (PSQI), Center for Epidemiological studies Depression Scales (CES-D) and the indicators of heart rate variability (HRV) of the two groups were documented pre-and-post intervention and two weeks after the intervention. The results showed that: 1) after twenty times of hyperbaric oxygen intervention, the PSQI and CES-D scores of the experimental group dropped dramatically(Ps<0.05). 2) The experimental group showed remarkable decrease in the values of LF and LF/HF(Ps<0.05), and significant increase in the value of HF in HRV(P<0.05); while no prominent differences were found between the indicators in the control group pre-and-post intervention(Ps>0.05). Conclusion: hyperbaric oxygen intervention improved the sleep quality, alleviated depression and enhanced the balance of autonomic nervous system of plateau immigrants, with obvious prognostic effects.
high altitude; hyperbaric oxygen; sleep quality; HRV
(编辑 余 毅)
基金项目:国家自然科学基金(32260212和U23A20476)和西藏自治区重点研发项目(2023ZYJM001)
第一作者简介:马海林(1979—),男,教授,博导,青年长江学者,主要从事高原脑科学的研究,E-mail:david_ma79@163.com
*通信作者简介:李 昊(1988—),男,博士,讲师,主要从事高原脑科学的研究,E-mail:futanghu888@126.com
引用格式:马海林,杨熙玥,苏瑞,等. 高压氧干预对高海拔移居者睡眠质量、抑郁状况及HRV的调节效应[J]. 四川师范大学学报(自然科学版),2024,47(5):569-575.
