心房颤动与窦性心律的风湿性心脏瓣膜病病人左心耳长链非编码RNA表达差异研究
2024-06-18谭宏伟李劲平熊琪聂永梅廖斌于风旭
谭宏伟 李劲平 熊琪 聂永梅 廖斌 于风旭

摘要 目的:探讨风湿性心脏瓣膜病合并慢性心房颤动或窦性心律病人左心耳长链非编码RNA(lncRNAs)的表达差异。方法:选取风湿性心脏瓣膜病心房颤动病人和风湿性心脏病窦性心律病人各3例,术中取少许左心耳组织,通过高通量二代测序、基因本体(GO)富集分析、京都基因和基因组百科全书(KEGG)通路显著性富集分析对lncRNAs靶基因进行生物功能分析,反向推测lncRNAs功能。结果:心房颤动组和窦性心律组比较存在差异lncRNAs共38条(P<0.05),表达上调15条,表达下调23条,心房颤动组较窦性心律组有显著性差异的mRNAs有1 475条(P<0.05),表达上调635条,表达下调840条。结论:风湿性心脏瓣膜病病人左心耳中与心房颤动相关的差异表达的lncRNAs可能与心房颤动电重构、钙处理异常机制有关,且可能与代谢途径、心肌收缩、心肌细胞肾上腺素能信号传导、丝裂原活化蛋白激酶(MAPK)信号通路、环磷酸鸟苷(cGMP)-蛋白激酶G(PKG)信号通路、钙信号通路相关。
关键词 心房颤动;风湿性心脏瓣膜病;窦性心律;长链非编码RNA;左心耳
doi:10.12102/j.issn.1672-1349.2024.11.004
Expression Difference of lncRNAs in Left Atrial Appendage in Rheumatic Valve Disease Patients with Atrial Fibrillation and in Patients with Sinus Rhythm
TAN Hongwei, LI Jinping, XIONG Qi, NIE Yongmei, LIAO Bing, YU Fengxu
The Affiliated Hospital of Southwest Medical University, Luzhou 646000, Sichuan, China
Corresponding Author YU Fengxu, E-mail: yuluchuan@163.com
Abstract Objective:To explore the expression difference of long non-coding RNA(lncRNAs) in Left atrial appendage of patients with rheumatic valvular heart disease complicated with chronic atrial fibrillation and sinus rhythm.Methods:Three patients with rheumatic heart valvular atrial fibrillation and rheumatic heart disease with sinus rhythm were selected.A small amount of left atrial appendage tissue was taken during the operation and passed high-throughput second-generation sequencing,Gene Otology enrichment analysis,Kyoto Encyclopedia of Genes and Genomes Pathway significant enrichment analysis analyzed the biological function of lncRNAs target genes,and infers the role of lncRNAs.Results:A total of 38 lncRNAs were different between the atrial fibrillation group and the sinus group(P<0.05),with 15 up-regulated expressions and 23 down-regulated expressions.There were 1 475 mRNAs in atrial fibrillation group were significantly different from the sinus group(P<0.05),with 635 up-regulated expressions and 840 down-regulated expressions.Conclusion:Differentially expressed lncRNAs related to atrial fibrillation in rheumatic valvular heart disease may be related to atrial fibrillation electrical remodeling and abnormal calcium processing mechanisms.They may be related to metabolic pathways,myocardial contraction,cardiomyocyte adrenergic signaling,and mitogen-activated protein kinase(MAPK) signaling pathway,cyclic guanosine phosphate(cGMP) -protein kinase G(PKG) signaling pathway,and calcium signal pathway.
Keywords atrial fibrillation; rheumatic heart valve disease; sinus rhythm; long non-coding RNA; left atrial appendage
心房颤动(atrial fibrillation,AF)是心房规则有序
基金项目 四川省科技厅重点项目(No.2018JY0405);泸州市人民政府-西南医科大学科技战略合作项目(No.2018LZXNYD-ZK40,2018LZXNYD-ZK27);四川省心血管疾病防治协同创新中心项目(No.xtcx2016-20,xtcx2019-03,xtcx2019-04)
通讯作者 于风旭,E-mail:yuluchuan@163.com
引用信息 谭宏伟,李劲平,熊琪,等.心房颤动与窦性心律的风湿性心脏瓣膜病病人左心耳长链非编码RNA表达差异研究[J].中西医结合心脑血管病杂志,2024,22(11):1941-1950.
的电节律性活动消失,代之以快速无序的颤动波的心房电节律性活动紊乱。据2017年美国心脏协会资料显示,全球心房颤动病人约3 350万人[1],且心房颤动在器质性心脏病病人中发病率达40%[2]。心房颤动常发生于原有心血管疾病者,如高血压、风湿性心脏瓣膜病、缺血性心脏病、心肌病及其他心脏疾病[3]。其中,合并风湿性心脏瓣膜病的心房颤动病人高达30%[4]。目前对于心房颤动的治疗方案仍存在局限,受到副作用、手术相关并发症的限制。鉴于心房颤动会明显增加病人围术期脑卒中、心力衰竭、恶性心律失常、死亡的风险,降低病人远期生活质量,现有治疗方法效果欠佳,所以,深入研究心房颤动进展中的关键调控因素显得至关重要。
非编码RNA是细胞代谢的重要调控因子,并对免疫系统疾病、心血管疾病、肿瘤等多种疾病有重要影响。作为非编码RNA家族重要成员之一的长链非编码RNA(long noncoding RNAs,lncRNAs)已被证实在心脏发育、心力衰竭、心肌梗死、心肌肥厚、心肌损伤中有重要调节作用[5]。以往研究证明,lncRNAs可以通过调节染色质构象与转铁蛋白(TF)或与mRNA、miRNA结合来调控基因表达[6]。YY1诱导的lncRNA KCNQ1OT1上调通过miR-384b/CACNA1C轴调节血管紧张素Ⅱ诱发心房颤动。显然,lncRNAs与许多心脏疾病有关,但是在心房颤动进展中的作用目前尚未被阐明。本研究收集风湿性心脏瓣膜病手术病人的部分左心耳组织,采用高通量测序技术检测心房颤动和窦性心律病人左心耳lncRNAs表达,并筛选出表达差异明显的lncRNAs,初步验证并预测其功能,以寻找与心房颤动发病机制相关的lncRNAs,希望能够对心房颤动的发病机制研究提供新的思路。
1 资料与方法
1.1 一般资料
选取2018年12月—2019年4月西南医科大学附属医院行心脏瓣膜置换手术切除的部分左心耳组织,其中心房颤动3例,窦性心律3例。6例病人均签署知情同意书,本研究获得西南医科大学医学伦理委员会批准。
1.2 试剂与设备
NucleoZol RNA提取试剂(MNG,德国);6×DNA Loading buffer(碧云天生物技术有限公司,中国);1kb plus DNA ladder(碧云天生物技术有限公司,中国);Takara反转录试剂盒(上海浩然生物技术有限公司,中国);SYBR Green(荧光染料,碧云天生物技术有限公司,中国);心脏彩色超声多普勒仪(XMATRIX iU22飞利浦,荷兰);心电图机(CT-086 Beneware,中国);高通量测序仪(Illumina Hiseq 2500 Illumina,美国);超微量紫外分光光度计(ND-2000NanoDrop,美国);bioanalyzer Agilent 2100(Agilent,美国);实时荧光定量聚合酶链式反应(PCR)仪(CFD-3220 MJ,美国);基因扩增仪(qTOWER3G IVD Analytik Jena,德国)。
1.3 方法
对入选病人进行心脏彩色多普勒超声检查,确诊为风湿性心脏瓣膜病并排除其他器质性心脏病变。然后进行心电图检测,再根据检查结果分为心房颤动组和窦性心律组。术中取病人部分左心耳组织,并加入RNA保存液,最终于-80 ℃低温冰箱保存。对左心耳样本分别进行总RNA提取、lncRNAs高通量测序和生物信息学分析。
1.3.1 lncRNAs高通量测序
心房颤动组和窦性心律组各收集3例左心耳样本,应用Illumina Hiseq 2500测序平台测序。使用Ballgown、Cuffdiff、edgeR软件进行转录本差异表达量分析,P<0.05的转录本被指定为差异表达。
1.3.2 lncRNAs靶基因预测
通过Pearson相关系数法计算出lncRNAs与编码蛋白基因之间的表达相关系数(COR)和P值,筛选出∣COR∣>0.9且P<0.05的lncRNA-mRNA,通过基因数据库对mRNA的生物学功能注释和基因本体(GO)、京都基因和基因组百科全书(KEGG)分析反向预测lncRNAs生物学功能。
1.3.3 GO分析
从生物过程(BP)、细胞组分(CC)及分子功能(MF)3个层面对lncRNAs靶基因进行统计分析,P<0.05的GO条目被认为是差异表达基因的显著富集。
1.3.4 KEGG通路分析
通过将差异表达基因与KEGG数据库的通路上的已有基因进行比对,应用超几何检验进行统计分析,筛选出最相关的生物通路。P<0.05的通路定义为在差异表达基因显著富集的通路。通过将差异表达基因与KEGG数据库的通路上的已有基因进行比对,应用超几何检验进行统计分析,筛选出最相关的生物通路。P<0.05的通路定义为在差异表达基因显著富集的通路。
1.4 统计学处理
采用SPSS 17.0软件进行统计分析。符合正态分布的定量资料以均数±标准差(x±s)表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
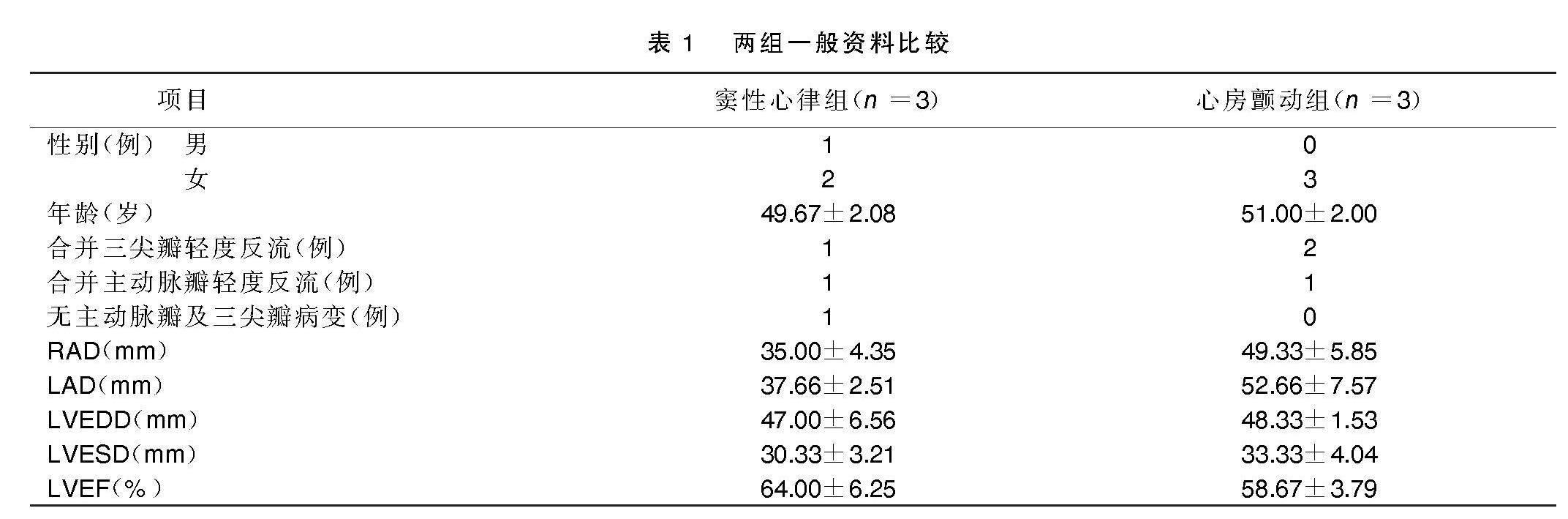
2.1 两组一般资料比较
两组病人年龄及性别分布情况见表1。术前经胸心脏超声证实两组病人主要以二尖瓣狭窄伴关闭不全病变为主,心房颤动组病人心房颤动持续时间>1年。两组病人左房内径(LAD)及右房内径(RAD)、左室射血分数(LVEF)、左室收缩末期内径(LVESD)、左室舒张末期内径(LVEDD)见表1。
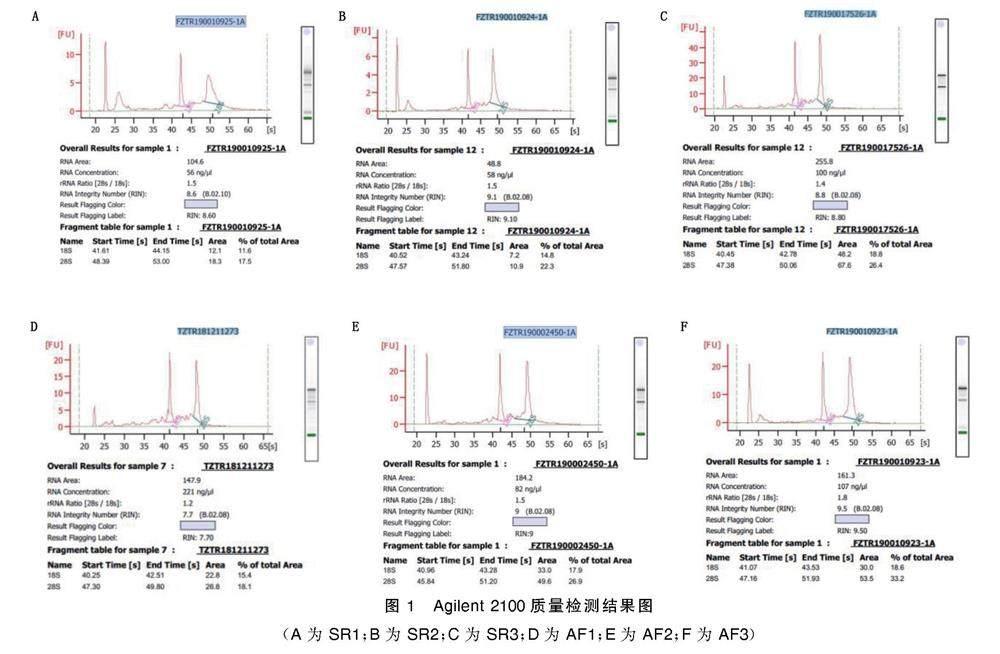
2.2 样本总RNA质量
总RNA质量检测结果显示,两组OD260/280值均在1.8~2.2,RNA 28S/18S≥1.2,RIN≥7.0,总RNA质量检测结果可靠,满足建库测序要求。详见图1。
2.3 两组lncRNAs及mRNAs的差异表达
通过高通量测序技术,共扫描出两组中有表达差异的lncRNAs 9 691条,其中P<0.05的lncRNAs共38条,与窦性心律组相比,心房颤动组有15条表达上调,23条表达下调;以差异倍数(fold change,FC)≥2且P<0.05为条件筛选,共有10条lncRNAs差异表达,心房颤动组较窦性心律组4条表达上调,6条表达下调;在差异表达的lncRNA中,LNC_002786(FC=131.25)、ENST00000523617.5(FC=5.83)、LNC_004253(FC=5.59)表达明显上调,LNC_003618(FC=7.77)、LNC_002602(FC=6.53)、LNC_000201(FC=3.34)表达明显下调。选取心房颤动组较窦性心律组FC≥2.00、P<0.05的lncRNA见表2。
心房颤动组较窦性心律组P<0.05的mRNAs差异的有1 475条,心房颤动组较窦性心律组有635条表达上调,840条表达下调。两组中P<0.01的mRNA有374条,心房颤动组较窦性心律组有160条表达上调,214条表达下调。以FC≥2.00及P<0.01为条件筛选,两组有172条mRNAs差异表达,心房颤动组较窦性心律组89条表达上调、83条表达下调;以FC≥64.00及P<0.01为条件筛选,有21条mRNAs差异表达,心房颤动组较窦性心律组13条表达上调及8条表达下调;其中ENST00000275607、ENST00000271688、ENST00000309615表达明显上调,ENST00000420959、ENST00000340545、ENST00000427738表达明显下调。心房颤动组较窦性心律组FC≥64.00及P<0.01的mRNAs见表3。
筛选P<0.05的差异基因,将FC以2为底取对数值作为横坐标,P以10为底取负对数作为纵坐标。根据结果绘制火山图(见图2)。差异表达lncRNAs和mRNAs聚类分析结果热图见补充材料。
选取测序结果获得的FC≥2.00及P<0.05的lncRNAs,采用实时荧光定量逆转录聚合酶链式反应(qRT-PCR)方法进行验证,探究其表达趋势是否与测序结果一致。结果显示LNC_003618表达下调,ENST00000523617.5、LNC_002786表达上调,和测序结果一致;LNC_002602、LNC_000201、ENST00000639542.1、ENST00000595005.1、ENST00000634611.1上调或下调趋势与测序结果一致,但P>0.05;ENST00000488000.6表达趋势与测序结果相反;LNC_004253由于序列原因无法设计出合适引物,未产生结果。详见图3。
2.4 差异lncRNAs的靶向mRNAs预测
对差异表达lncRNAs的靶基因与差异表达的mRNAs进行交集分析,当lncRNAs的靶基因同时也是显著差异的mRNAs时,该差异mRNAs受到lncRNAs直接或间接调控作用的可能性更大。对筛选出心房颤动组较窦性心律组FC≥2的mRNAs,进一步通过识别其中与心房颤动电重构、结构重构、肾素-血管紧张素系统(RAS)效应、钙处理异常机制相关的mRNAs。并根据Pearson相关法计算lncRNAs-mRNAs相关性及P值、lncRNAs-mRNAs是否富集到差异显著的KEGG通路进行筛选。发现lncRNA LNC_003618与mRNA CACNA2D2、CLIC4,lncRNA ENST00000523617.5与mRNA SLC8A1、KCNB1,lncRNA LNC_002786与mRNA NKX2-5、KCNB1、KCNE4表达具有相关性。对得到的lncRNAs-mRNAs关联对是否富集到与心脏相关的KEGG通路进行再次筛选,获得可能与心房颤动发生过程相关的LNC_003618-CACNA2D2(编码电压依赖性钙通道复合物的alpha-2/delta亚基)、ENST00000523617.5-SLC8A1(参与心肌细胞钠钙交换)两对关联对。
2.5 GO分析结果
GO富集分析结果显示:lncRNAs靶向的mRNAs富集到的差异显著的GO_accession数目共有1 838条,其中生物过程、细胞组成及分子功能分别为1 332、246、260条。mRNAs参与细胞内代谢(cellular metabolic process,CMP)、转运(intracellular transport,IT)、电子链传递(electron transport chain,ETC)、生物发生(biogenesis)等生物过程;参与细胞器(organelle)、细胞质(cytoplasm)、线粒体(mitochondrion)等细胞组成;参与蛋白结合(protein binding,PD)、RNA结合(RNA binding)、氧化还原酶活性(oxidoreductase activity,OA)、催化活性(catalytic activity,CA)等分子功能;LNC_003618靶向的mRNA CACNA2D2与细胞代谢、生物发生、结合等GO条目相关;ENST00000523617.5靶向的mRNA SLC8A1与细胞内转运、线粒体、结合等GO条目相关。lncRNAs靶向的mRNAs在生物过程、细胞组成及分子功能中富集度最高的前20条GO条目见图4~图6。
2.6 KEGG通路富集分析
lncRNAs靶向的mRNAs KEGG富集分析结果显示:mRNAs被富集到的KEGG通路有氧化磷酸化(oxidative phosphorylation)、心肌收缩(cardiac muscle contraction)、代谢途径(metabolic pathways)、心律失常相关的右心室心肌病(arrhythmogenic right ventricular cardiomyopathy,ARVC)、肥厚型心肌病(hypertrophic cardiomyopathy,HCM)等,详见图7。LNC_003618靶向的mRNA CACNA2D2被富集到代谢途径(metabolic pathways)、心肌收缩(cardiac muscle contraction)、心肌细胞肾上腺素能信号传导(adrenergic signaling in cardiomyocytes)、丝裂原活化蛋白激酶(MAPK)信号通路(MAPK signaling pathway)。ENST00000523617.5靶向的mRNA SLC8A1被富集到代谢途径、心肌收缩、环磷酸鸟苷(cGMP)-蛋白激酶G(PKG)信号通路(cGMP-PKG signaling pathway)、钙信号通路(calcium signaling pathway)。mRNA KCNB1被富集到味觉转导(taste transduction),该通路在心房颤动组和窦性心律组差异无统计学意义(P>0.05)。mRNA CLIC4、KCNB1、NKX2-5、KCNE4未被富集到差异显著的通路。
3 讨 论
本研究鉴定lncRNAs表达谱的同时也检测了心房颤动组与窦性心律组mRNAs的差异表达谱,对筛选出心房颤动组较窦性心律组FC≥2的mRNAs,通过识别其中与心房颤动电重构、结构重构、RAS效应、钙处理异常机制相关的mRNAs,同时结合FC、聚类分析、lncRNAs-mRNAs共表达关系预测、KEGG通路富集分析等方法共同筛选目的mRNAs,借助对mRNAs功能研究反向阐述lncRNAs功能,获得了可能与心房颤动发生过程相关的LNC_003618-CACNA2D2(编码电压依赖性钙通道复合物的alpha-2/delta亚基)、ENST00000523617.5-SLC8A1(参与心肌细胞钠钙交换)两对关联对。
CACNA2D2(alpha-2-delta-2)已被证实是编码电压依赖性钙通道复合物的alpha-2/delta亚基,能够调节钙电流和通道活化/失活动力学。心房重构早期改变是电生理和离子通道改变,而CACNA2D2是电压依赖性钙通道编码基因,其失调可以诱发心律失常,Zhang等[7]研究证实miR-1231通过靶向心肌梗死中的钙通道基因CACNA2D2来加剧心律失常。CACNA2D2与电压依赖性钙通道相关,又是差异显著lncRNA LNC_003618的共表达mRNA,由此推断LNC_003618是否能够通过CACNA2D2参与心房颤动早期电重构的调控,值得进一步研究探索。
溶质载体家族8成员A1(SLC8A1)在心脏中广泛表达,已被证实参与心肌细胞钠钙交换,在调节钙离子浓度、维持钙离子稳态中起重要作用。心房肌细胞跨膜离子流改变是心房电重构基础,而SLC8A1能调节钠钙交换,说明其与电重构关系密切。Sano等[8]在SLC8A1敲除小鼠中证实了其对窦房结、心房和房室结传导的调节作用。Ashrafi等[9]研究发现,SLC8A1参与了2型糖尿病致心律失常基因重塑,导致动作电位持续时间延长,钠钙交换电流增加,促进了心律失常发生。Kim等[10]研究发现,SLC8A1中的常见变体与心电图QT间期的持续时间相关,而心电图QT间隔的延长,容易诱发心律失常。据此推断lncRNA ENST00000523617.5可能通过调控其共表达mRNA SLC8A1参与心房颤动电重构调控。
本研究通过与差异显著lncRNAs共表达的mRNAs进行GO分析,GO分析能够体现差异基因在细胞中的位置、参与的生物过程及分子功能。GO分析结果显示,靶向mRNA参与了细胞内代谢、转运、电子链传递、生物发生等生物过程;参与了细胞器、细胞质等组成;参与了蛋白结合、RNA结合、氧化还原酶活性、催化活性等分子功能。而细胞内代谢、电子链传递、转运、氧化还原等这些生物学作用和功能均与心房颤动病理生理密不可分。在慢性缺氧和心力衰竭期间,心脏代谢从脂肪酸转化为葡萄糖的利用[11]。这表明代谢相关过程在心脏维持生理功能及疾病发生发展中有着重要的作用。但这些过程的改变在心房颤动发生、发展进程中具体作用机制尚不清楚。初步推测心肌细胞能量代谢紊乱,可能影响线粒体功能、高能磷酸盐代谢及底物利用等,继而与心房纤颤有关。
通过KEGG通路显著性富集能确定特定基因参与的最主要生化代谢途径和信号转导途径。基因富集的KEGG通路分析显示,LNC_003618-CACNA2D2被富集到与心房颤动相关的通路有代谢途径、心肌收缩、心肌细胞肾上腺素能信号传导、MAPK信号通路。ENST00000523617.5-SLC8A1被富集到与心房颤动相关的通路有代谢途径、心肌收缩、cGMP-PKG信号通路、钙信号通路。
心房颤动与代谢途径、心肌收缩密切相关。黄从新等[12]研究发现,许多代谢性疾病,如高血压、糖尿病等都可诱发心房颤动。Brandenburg等[13]研究发现,心率过快或心律失常持续存在,会使房室心肌细胞代谢负担急剧增加,影响能量代谢,导致不良蛋白的修饰,如活性氧(ROS)自由基过度产生等。Pizzetti等[14]研究显示,心肌梗死后会导致心肌收缩能力下降,易诱发心力衰竭,致心房心室发生重构,增加心房颤动易感性。而LNC_003618-CACNA2D2、ENST00000523617.5-SLC8A1两个关联对经过KEGG通路富集分析显示与代谢途径、心肌收缩相关,而本研究GO富集分析也得到了相似结果。
KEGG通路富集结果中LNC_003618-CACNA2D2在心肌细胞肾上腺素能信号传导、MAPK信号通路2条通路中也被富集。进一步分析发现,这两条通路也和心房颤动发生有着密切关系。RAS系统失调会增加心房颤动易感性。RAS系统在高血压和心力衰竭中的激活通过血管紧张素Ⅱ导致左房压升高,增加的压力会导致左心房扩张,导致离子通道的改变,这是电重构的特点[15]。而RAS的持续激活也会导致心肌组织中血管紧张素转换酶(ACE)水平升高,引发炎症和纤维化,或结构重塑[15]。MAPK信号通路可能与离子通道改变或电重构相关。Cheng等[16]研究显示,MAPK途径可能在L型钙通道开放中起重要作用,并且MAPK分子表达的改变可能会影响离子通道的表达和重塑,增加了心房颤动易感性。以上研究表明,心肌细胞肾上腺素能信号传导、MAPK信号通路与心房颤动相关,而 LNC_003618-CANCA2D2也与这两条通路相关,提示LNC_003618-CANCA2D2可能参与这两条通路介导心房颤动发生。
KEGG通路富集结果中ENST00000523617.5-SLC8A1被富集到了cGMP-PKG信号通路、钙信号通路两条通路。cGMP是细胞内重要的第二信使,Guo等[17]报道了SLC8A1可通过激活cGMP-PKG信号通路来预防心肌损伤。但是SLC8A1是否能通过cGMP-PKG信号通路介导心房颤动发生尚不清楚,仍需要做进一步研究。钙信号通路与心房颤动相关,2016年Husser等[18]通过KEGG分析确定了钙信号通路是左房直径(LAD)、低电压区(LVA)和心房颤动类型的共同途径,且全基因组关联分析(GWAS)确定了该途径中存在与LAD、LVA和心房颤动类型均相关的39个基因,其中就有SLC8A1。而钙信号异常与心房纤维化有关,后者是心房颤动维持和进展的主要驱动因素[19-20]。表明ENST00000523617.5-SLC8A1可能通过cGMP-PKG信号通路、钙信号通路调控心房颤动发生。
参考文献:
[1] BENJAMIN E J,BLAHA M J,CHIUVE S E,et al.Heart disease and stroke statistics--2017 update:a report from the American Heart Association[J].Circulation,2017,135(10):e146-e603.
[2] KRIJTHE B P,KUNST A,BENJAMIN E J,et al.Projections on the number of individuals with atrial fibrillation in the European Union,from 2000 to 2060[J].European Heart Journal,2013,34(35):2746-2751.
[3] KANNEL W B,WOLF P A,BENJAMIN E J,et al.Prevalence,incidence,prognosis,and predisposing conditions for atrial fibrillation:population-based estimates[J].The American Journal of Cardiology,1998,82(8A):2N-9N.
[4] European Heart Rhythm Association,European Association for Cardio-Thoracic Surgery.Guidelines for the management of atrial fibrillation:the task force for the management of atrial fibrillation of the European Society of Cardiology (ESC)[J].European Heart Journal,2010,31(19):2369-2429.
[5] MA Y D,MA W Y,HUANG L N,et al.Long non-coding RNAs,a new important regulator of cardiovascular physiology and pathology[J].International Journal of Cardiology,2015,188:105-110.
[6] KATAOKA M,WANG D Z.Non-coding RNAs including miRNAs and lncRNAs in cardiovascular biology and disease[J].Cells,2014,3(3):883-898.
[7] ZHANG J F,WU L L,LI Z W,et al.MiR-1231 exacerbates arrhythmia by targeting calciumchannel gene CACNA2D2 in myocardial infarction[J].American Journal of Translational Research,2017,9(4):1822-1833.
[8] SANO M,KAMITSUJI S,KAMATANI N,et al.Genome-wide association study of electrocardiographic parameters identifies a new association for PR interval and confirms previously reported associations[J].Human Molecular Genetics,2014,23(24):6668-6676.
[9] ASHRAFI R,MODI P,OO A Y,et al.Arrhythmogenic gene remodelling in elderly patients with type 2 diabetes with aortic stenosis and normal left ventricular ejection fraction[J].Experimental Physiology,2017,102(11):1424-1434.
[10] KIM J W,HONG K W,GO M J,et al.A common variant in SLC8A1 is associated with the duration of the electrocardiographic QT interval[J].American Journal of Human Genetics,2012,91(1):180-184.
[11] HOROWITZ J D,CHIRKOV Y Y,KENNEDY J A,et al.Modulation of myocardial metabolism:an emerging therapeutic principle[J].Current Opinion in Cardiology,2010,25(4):329-334.
[12] 黄从新,张澍,黄德嘉,等.心房颤动:目前的认识和治疗的建议-2018[J].中国心脏起搏与心电生理杂志,2018,32(4):315-368.
[13] BRANDENBURG S,ARAKEL E C,SCHWAPPACH B,et al.The molecular and functional identities of atrial cardiomyocytes in health and disease[J].Biochimica et Biophysica Acta,2016,1863(7 Pt B):1882-1893.
[14] PIZZETTI F,TURAZZA F M,FRANZOSI M G,et al.Incidence and prognostic significance of atrial fibrillation in acute myocardial infarction:the GISSI-3 data[J].Heart,2001,86(5):527-532.
[15] NAIR G M,NERY P B,REDPATH C J,et al.The role of renin angiotensin system in atrial fibrillation[J].Journal of Atrial Fibrillation,2014,6(6):972.
[16] CHENG W,ZHU Y,WANG H D.The MAPK pathway is involved in the regulation of rapid pacing-induced ionic channel remodeling in rat atrial myocytes[J].Molecular Medicine Reports,2016,13(3):2677-2682.
[17] GUO G L,SUN L Q,SUN M H,et al.LncRNA SLC8A1-AS1 protects against myocardial damage through activation of cGMP-PKG signaling pathway by inhibiting SLC8A1 in mice models of myocardial infarction[J].Journal of Cellular Physiology,2019,234(6):9019-9032.
[18] HUSSER D,UEBERHAM L,DINOV B,et al.Genomic contributors to atrial electroanatomical remodeling and atrial fibrillation progression:pathway enrichment analysis of GWAS data[J].Scientific Reports,2016,6:36630.
[19] YUE L X,XIE J,NATTEL S.Molecular determinants of cardiac fibroblast electrical function and therapeutic implications for atrial fibrillation[J].Cardiovascular Research,2011,89(4):744-753.
[20] MA J,CHEN Q X,MA S Y.Left atrial fibrosis in atrial fibrillation:mechanisms,clinical evaluation and management[J].Journal of Cellular and Molecular Medicine,2021,25(6):2764-2775.
(收稿日期:2022-10-10)
(本文编辑郭怀印)
