丹参酮ⅡA通过调节PI3K/AKT及MAPK信号通路保护癫痫大鼠神经元损伤的作用机制
2024-06-18韩卫南石露露韩博
韩卫南 石露露 韩博

摘要 目的:探讨丹参酮ⅡA保护癫痫模型大鼠神经元损伤的作用机制。方法:将126只成年雄性大鼠随机分为假手术组(Sham组)、红藻氨酸注射组(KA组)、假手术+丹参酮ⅡA组(Sham+TA组)、KA+丹参酮ⅡA组(KA+TA组)、KA+丹参酮ⅡA+二硫代氨基甲酸二乙酯(DDC)组(KA+TA+DDC组)、KA+50 mg/kg氯喹(CQ)组(KA-CQ组)。采用免疫荧光染色评价海马CA3区中心区域内神经元染色反应,检测大鼠脑组织中超氧化物歧化酶(SOD)活性。提取大鼠的海马区组织,采用蛋白免疫印记(Western Blot)法检测SOD1、SOD2、微管相关蛋白轻链Ⅰ/Ⅱ(LC3Ⅰ/Ⅱ)、磷脂酰肌醇3-激酶(PI3K)、蛋白激酶B(AKT)、丝裂原活化蛋白激酶(MAPK)和Beclin1蛋白的相对表达量。结果:免疫荧光检测显示,KA组NeuN+细胞的免疫反应水平明显低于Sham组和Sham+TA组,尤其是在海马CA3区;KA+TA组NeuN(+)细胞的免疫反应水平明显高于KA组。双染色结果发现,KA组大鼠海马CA3区LC3Ⅰ/Ⅱ表达明显增加,KA+TA组神经元LC3Ⅰ/Ⅱ表达水平降低。Western Blot检测结果显示,KA组SOD1和SOD2蛋白表在水平明显低于Sham组,KA+TA组SOD1和SOD2蛋白水平高于KA组,Beclin1表达低于KA组。与Sham组相比,KA组和KA+TA+DDC组大鼠海马CA3区NeuN(+)细胞较少。与Sham组相比,KA+TA+DDC组LC3Ⅰ/Ⅱ和Beclin1蛋白水平明显高于Sham组和KA组。KA+TA组大鼠海马区PI3K蛋白表达水平明显高于KA组和KA+TA+DDC组,而KA+TA+DDC组大鼠海马区PI3K蛋白表达水平低于KA组和KA+TA组。结论:丹参酮ⅡA预处理对KA诱导的大鼠颞叶癫痫模型神经元损伤具有保护作用,这可能是通过激活PI3K/AKT和MAPK通路调节自噬活性相关。
关键词 癫痫;丹参酮ⅡA;神经元损伤;红藻氨酸;磷脂酰肌醇3-激酶;蛋白激酶B;丝裂原活化蛋白激酶;超氧化物歧化酶;实验研究
doi:10.12102/j.issn.1672-1349.2024.11.008
癫痫是大脑神经元突发性异常放电导致短暂的大脑功能障碍的一种慢性疾病,其引起的神经毒性可导致海马CA3区神经元损伤[1]。注射红藻氨酸(kainic acid,KA)诱导的大鼠癫痫模型可导致类似于颞叶癫痫(temporal lobe epilepsy,TLE)病人的行为发作和神经病理损害。丹参酮ⅡA是从中药丹参中提取出来的一种有效成分,具有清热解毒、活血化瘀、散结的功效。有研究发现,丹参酮ⅡA对帕金森病、神经行为障碍、神经兴奋剂毒性和脑缺血损伤等神经系统疾病具有潜在的治疗,同时具有一定保护神经元损伤的作用[2]。癫痫的发病机制复杂,氧化应激在癫痫的诱导中发挥重要作用。在癫痫发作期间,大脑中活性氧(reactive oxygen species,ROS)的产生会明显增加,ROS的大量积累可以直接破坏蛋白质等大分子,降解细胞结构,最终导致细胞凋亡[3]。自噬是一种分解代谢过程,通过细胞内溶酶体的作用降解物质,在神经元损伤中发挥关键作用[4],ROS广泛参与了自噬的诱导,作为一
基金项目 河北省中医药管理局科研计划项目(No.2019539)
引用信息 韩卫南,石露露,韩博.丹参酮ⅡA通过调节PI3K/AKT及MAPK信号通路保护癫痫大鼠神经元损伤的作用机制[J].中西医结合心脑血管病杂志,2024,22(11):1967-1975.
种独特的信号分子发挥作用,而丹参酮ⅡA具有一定的清除氧自由基的效应。在前期的研究中发现,丹参酮ⅡA可通过诱导正核因子-E2相关因子2(Nrf2)依赖的血红素加氧酶-1(HO-1)活化来抑制氧化应激所致的神经元损伤,其神经保护作用是通过调节一氧化氮(NO)信号通路来实现的[5]。虽然丹参酮ⅡA具有抗癫痫损伤的神经保护作用,但其潜在的机制仍不清楚。因此,本研究探讨丹参酮ⅡA对癫痫大鼠模型神经元损伤的潜在作用机制,以期为其临床应用提供参考。
1 材料与方法
1.1 实验动物及分组
126只8~10周成年雄性美国癌症研究所(Institute of Cancer Research,ICR)大鼠购于河北省实验动物中心,生产许可证号:SCXK(冀)2021-002,体质量(270±10)g,饲养环境温度为(25±2)℃,光/暗周期为12 h。可自由获得食物和水,适应性喂养1周后进行实验。丹参酮ⅡA(纯度≥98%)由上海源叶生物科技有限公司(中国上海)提供。红藻氨酸(KA)、二硫代氨基甲酸二乙酯(DDC)和氯喹(CQ)由扬州科能生物科技有限公司(扬州)提供。将大鼠随机分为6组:假手术组(Sham组)、KA注射组(KA组)、假手术+丹参酮ⅡA组(Sham+TA组)、KA+丹参酮ⅡA组(KA+TA组)、KA+丹参酮ⅡA+DDC组(KA+TA+DDC组)、KA+50 mg/kg CQ组(KA-CQ组)。Sham+TA组、KA+TA组和KA+TA+DDC组均于手术前给予50 mg/kg丹参酮ⅡA灌胃,连续灌胃3 d。KA+TA+DDC组于手术前7 d腹腔注射DDC 700 mg/kg。KA-CQ组于手术前7 d腹腔注射50 mg/kg的CQ。大鼠麻醉满意后,拔除头顶毛发,固定于定位器。对头顶进行消毒,并对皮肤进行纵向或横向切割,以定位前穹窿。然后定位Bregma点,用于将头部固定螺钉定位在相对于Bregma 1.0 mm腹侧0.22 mm、深度3.0 mm的位置。用微量注射器注射KA,把注射器放在定位器上,小心地将针放到头盖骨上洞下面3 mm的位置进行注射,之后将针固定在原地3 min,然后缓慢退出以确保KA的适当吸收。注射后,所有大鼠都被移到笼子里。30 min后评估大鼠癫痫发作的严重程度,按改进的Racine(1975)标准进行分级,0级:处于安静和平状态;1级:抽搐、眨眼、咀嚼、流涎;2级:有节律性点头、似湿狗抖动;3级:单侧前肢阵挛;4级:双侧前肢阵挛和站立;5级:全身强直痉挛、持续站立、坠落等;6级:奔腾、尖叫或死亡。24 h后处死动物。
1.2 免疫组化染色
大鼠完全麻醉后,用磷酸缓冲盐溶液(PBS)经心灌流15 min,再用4%多聚甲醛经心灌流15 min。用手术钳取出脑组织,在4%多聚甲醛中后处理6 h,然后在30%蔗糖中浸泡过夜。最后,用低温恒温仪将大脑连续切成30 μm的冠状切片,并将这些冠状切片转移到4 ℃含PBS的6孔板上。脑切片依次用0.3%过氧化氢在PBS中处理20 min,然后将切片与稀释的兔抗神经元特异核蛋白(NeuN)在4 ℃下孵育过夜。第2天孵育二抗,通过在0.01 mol/L的PBS中加入3,3′-二氨基联苯胺四盐酸盐进行显色。为确定染色的特异性,用血清代替一抗进行了阴性对照试验。阴性对照证实所有结构中均无免疫反应。用光密度(OD)评价NeuN的染色强度。
1.3 免疫荧光染色
将脑切片在0.5%Triton X-100中浸泡10 min,然后在含有0.2%Triton X-100和5%BSA的PBS中浸泡1 h,然后分别与兔抗微管相关蛋白轻链Ⅰ/Ⅱ(LC3Ⅰ/Ⅱ)、鼠抗NeuN、鼠抗Beclin和兔超氧化物歧化酶(SOD)-2共同孵育12 h,而后分别与羊抗鼠抗体和异硫氰酸荧光素标记的羊抗兔抗体孵育2 h,在PBS中清洗两次后密封。用AxioM1光学显微镜捕拍摄海马体的荧光图像,使用图像分析系统(Optimas 6.5软件)在靠近海马CA3区中心的区域内观察神经元染色反应。
1.4 SOD活性检测
提取大鼠的海马区组织,在4 ℃下保存过夜,然后将组织按1∶9的比例加入生理盐水中,在3 000×g、4 ℃的条件下离心10 min,获得上清。用黄嘌呤氧化酶法测定SOD活性,利用WST-1细胞增殖检测试剂盒检测SOD活性。
1.5 蛋白免疫印迹法(Western Blot)检测
从大鼠大脑中取出海马体,组织匀浆后提取蛋白质,然后使用二喹啉甲酸(BCA)方法进行定量。用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法分离蛋白质,转移到聚偏二氟乙烯(PVDF)膜上,与5%牛血清白蛋白孵育1 h。然后,将膜与兔SOD-1、SOD-2、磷脂酰肌醇3-激酶(PI3K)、蛋白激酶B(AKT)、丝裂原活化蛋白激酶(MAPK)、LC3Ⅰ/Ⅱ和Beclin1抗体在4 ℃下孵育过夜。用羊抗兔免疫球蛋白G(IgG)孵育2 h。Western Blot结果用Quantity One Analysis软件(BioRad)进行分析,确定相对光密度(Rod),以百分比为单位校准Rod比率。通过计算目的蛋白灰度值与β-肌动蛋白灰度值的比值来评价目的蛋白的相对表达量。
1.6 统计学处理
采用SPSS 20.0软件进行统计分析。符合正态分布的定量资料用均数±标准差(x±s)表示,两组间比较采用t检验,多组比较采用单因素方差分析(ANOVA)和Dunnett检验。以P<0.05为差异有统计学意义。
2 结 果
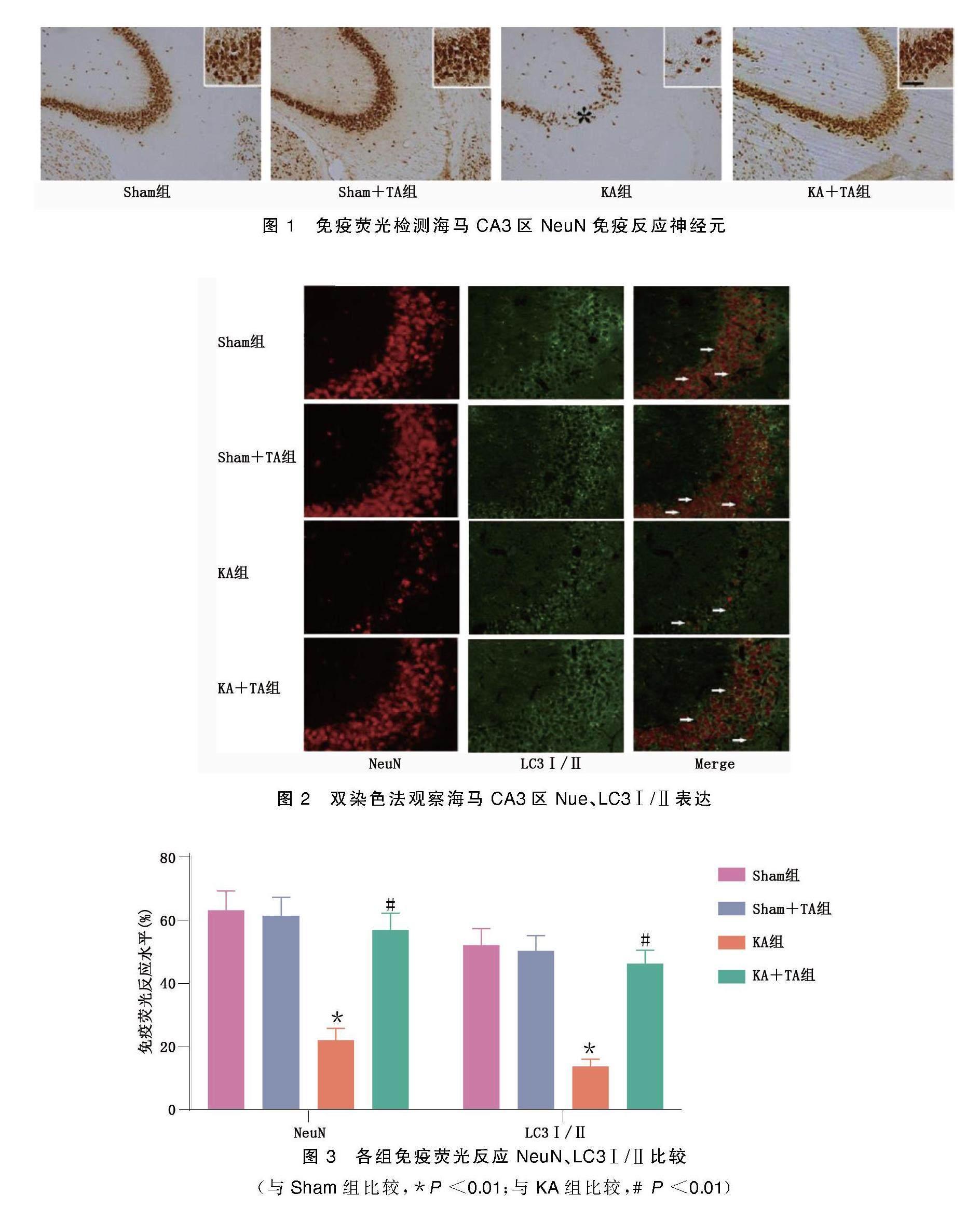
2.1 海马CA3区NeuN免疫反应神经元、NeuN、LC3Ⅰ/Ⅱ免疫荧光检测
免疫荧光检测显示,KA组NeuN+细胞的免疫反应水平明显低于Sham组和Sham+TA组,尤其是在海马CA3区;KA+TA组NeuN(+)细胞的免疫反应水平明显高于KA组。采用双染色法观察TA对海马CA3区神经元内聚集的自噬小体数量的影响,结果发现,KA组大鼠海马CA3区LC3Ⅰ/Ⅱ表达明显增加,表明KA致痫后神经元LC3Ⅰ/Ⅱ表达百分率明显增加;相反,与KA组相比,KA+TA组神经元的LC3Ⅰ/Ⅱ水平降低。表明50 mg/kg的TA预处理减轻了KA致痫后海马CA3区神经元损伤,并伴有LC3Ⅰ/Ⅱ表达减少。详见图1~图3。
(与Sham组比较,*P<0.01;与KA组比较,#P<0.01)
2.2 海马CA3区SOD1、SOD2、LC3Ⅰ/Ⅱ和Beclin1蛋白的表达
Western Blot检测结果显示,KA组SOD1和SOD2蛋白表达水平明显低于Sham组(P<0.01),KA+TA组SOD1和SOD2蛋白水平高于KA组(P<0.01)。表明TA预处理提高了KA致痫神经元损伤后海马区的抗氧化指标水平。KA组自噬相关蛋白C3Ⅰ/Ⅱ、Beclin1蛋白表达水平高于Sham组(P<0.01),而KA+TA组海马区自噬相关蛋白C3Ⅰ/Ⅱ、Beclin1蛋白表达水平低于KA组(P<0.01)。表明TA预处理降低了KA致痫损伤后的自噬水平。详见图4~图6。
(与Sham组比较,*P<0.01;与KA组比较,#P<0.01)
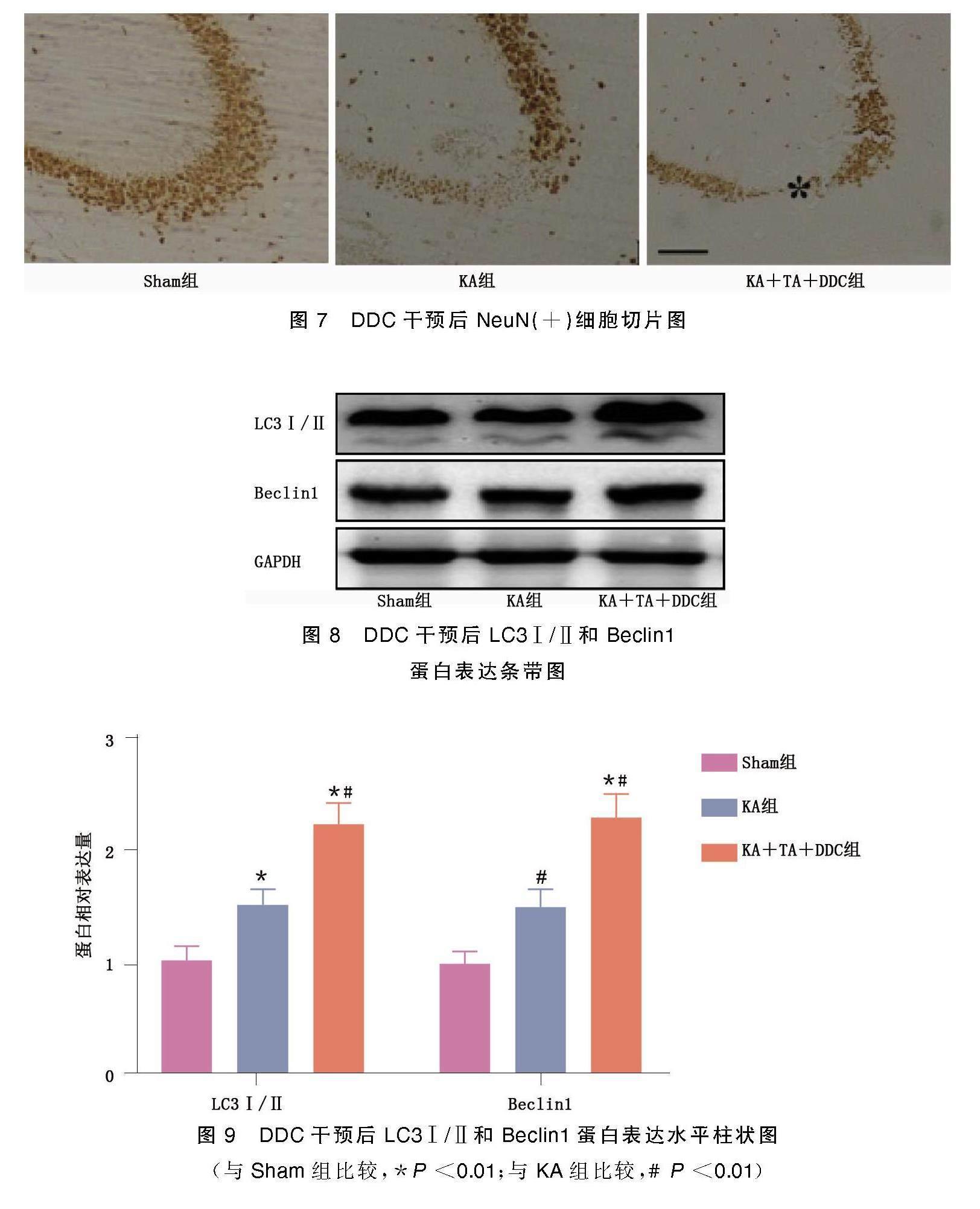
2.3 DDC干预后海马区Neu免疫反应神经元及海马CA3区LC3Ⅰ/Ⅱ和Beclin1蛋白表达水平
DDC是一种有效的SOD活性抑制剂。DDC干预后,与Sham组相比,KA组和KA+TA+DDC组大鼠海马CA3区NeuN(+)细胞较少。此外,KA+TA+DDC组LC3Ⅰ/Ⅱ和Beclin1蛋白表达水平明显高于Sham组和KA组(P<0.01)。表明TA对KA致痫神经元损伤的神经保护作用与抗氧化酶表达增强介导的自噬减弱密切相关。详见图7~图9。
(与Sham组比较,*P<0.01;与KA组比较,#P<0.01)
2.4 DDC干预后海马CA3区PI3K/AKT和MAPK通路相关蛋白表达
Western Blot检测结果显示,KA组PI3K蛋白表达、p-AKT/AKT、p-MAPK/MAPK比值均明显低于Sham组(P<0.01);而KA+TA+DDC组大鼠海马区PI3K蛋白表达、p-AKT/AKT、p-MAPK/MAPK比值低于KA组和KA+TA组(P<0.01),P-AKT/AKT和p-MAPK/MAPK蛋白比值与PI3K表达变化一致。表明TA对KA诱导的癫痫神经元损伤的保护作用与激活PI3K、AKT和MAPK通路有关。详见图10、图11。
(与Sham组比较,*P<0.01;与KA组比较,#P<0.01;与KA+TA组比较,△P<0.01)
2.5 CQ干预后海马CA3区Neu免疫反应神经元及LC3Ⅰ/Ⅱ和Beclin1蛋白水平
CQ是一种自噬小体-溶酶体融合抑制剂。与Sham组相比,KA组海马CA3区NeuN(+)阳性细胞数量明显减少;与KA组相比,KA+TA组和KA-CQ组NeuN(+)阳性细胞数量均明显增加,LC3Ⅰ/Ⅱ和Beclin1蛋白水平均明显降低(P<0.01)。表明TA对KA所致癫痫神经元损伤的神经保护作用与减少自噬有关。详见图12~图14。
(与Sham组比较,*P<0.01;与KA组比较,#P<0.01)
3 讨 论
本研究分析TA在KA诱导的癫痫大鼠模型中的干预效应。结果发现,50 mg/kg的TA对KA诱导的神经元损伤有明显的保护作用。这与之前的研究发现TA保护神经元免受损伤和皮质神经元免受神经毒性的影响是一致的。本研究表明,50 mg/kg的TA可减轻KA诱导的颞叶癫痫模型中海马区CA3区神经元损伤。小胶质细胞和星形胶质细胞等神经胶质细胞的激活与神经元死亡密切相关的细胞毒物质的释放有关[6]。在癫痫的发病机制中,增殖的星形胶质细胞和小胶质细胞分泌过量的有害物质,可能损害神经元[5]。本研究发现,在KA诱导的癫痫大鼠模型中,星形胶质细胞和小胶质细胞被激活。TA可明显抑制KA诱导的星形胶质细胞和小胶质细胞的激活。有研究发现,一些药物包括利培酮和阿司匹林-氢杨醇复合物,可通过抑制星形胶质细胞和小胶质细胞的反应性增殖,在神经元中发挥神经保护作用[7]。本研究中,海马CA3区小胶质细胞和星形胶质细胞的激活减弱可能与TA对KA所致癫痫神经元损伤的神经保护作用有关。癫痫引起的神经元损伤与脑组织中的ROS有关[8]。抗氧化剂作为一种潜在的治疗药物,减轻ROS引起的神经元损伤中发挥重要作用[9]。目前的结果表明,50 mg/kg的TA维持海马区SOD1和SOD2蛋白表达水平。同样,一些抗氧化剂,如2-环丙基亚氨基-3-甲基-1,3-噻唑啉盐酸盐,对神经元损伤具有神经保护作用。另一方面,先前的研究发现,SOD水平的下降明显加速了沙土鼠海马齿状回神经元损伤[10]。在不同的SOD亚型中,SOD1存在于细胞质中,而SOD2存在于线粒体基质中。线粒体自噬在神经元存活中起关键作用,线粒体自噬的过度表达可以导致神经元死亡,这种死亡可以通过使用抗氧化应激疗法来减轻,这有助于恢复自噬的保护作用[11]。因此,提高抗氧化剂水平和减少过度激活的自噬水平对神经元的生存至关重要。本研究结果表明TA可以通过提高SOD水平来抑制过度激活的线粒体自噬。因此,海马CA3区SOD水平的升高可能与TA对癫痫所致神经元损伤的神经保护作用有关。
自噬通过清除细胞内的废物来维持细胞的正常新陈代谢,这是细胞生存所必需的[12]。自噬标志物的水平升高,包括LC3和Beclin1,表明自噬被激活。自噬在细胞中扮演着两个截然不同的角色,其效果严重依赖于疾病进展的不同阶段、细胞微环境的变化和治疗措施的不同[13]。在正常情况下,自噬在大多数细胞中发生的水平相对较低。外部因素的刺激可以启动清除受损线粒体所需的自噬过程,从而保护细胞免受进一步损害。然而,自噬的过度激活也会导致细胞损伤。自噬参与了癫痫引起的神经元损伤过程,而自噬的缺失会导致神经元变性或死亡[14]。自噬过程的过度激活也可能导致神经元损伤。癫痫发作尤其是癫痫状态对海马神经元的损伤机制复杂多样。自噬调节因子,包括微管相关蛋白1的轻链3(LC3)和Beclin1,可以促进大鼠脑神经元自发性癫痫的发生[15]。本研究发现,TA通过减少过度激活的自噬水平,对癫痫诱导的神经元损伤具有神经保护作用,因此,TA具有细胞保护作用,部分是通过维持氧化应激和自噬之间的平衡。先前的研究表明,ROS的积累可导致神经元的自噬。同时,癫痫损伤会导致ROS的过度积累,这可能会导致随后诱导自噬,试图清除受影响的细胞成分。包括SOD在内的抗氧化酶的增强和维持可以降低自噬水平,并保护神经元免受损伤。本研究发现,TA明显增加海马区SOD表达,而降低自噬相关蛋白如LC3Ⅰ/Ⅱ和Beclin1水平。而当DDC抑制SOD活性时,LC3Ⅰ/Ⅱ和Beclin1水平明显升高。因此,本研究结果表明,TA对KA诱导的癫痫神经元损伤的神经保护作用与抗氧化酶生成增加而导致的自噬降低密切相关。
本研究还发现,与KA组相比,KA-CQ组NeuN(+)细胞数量急剧增加。表明通过给予自噬抑制剂CQ来抑制自噬,能够提供类似于TA预处理后的保护作用,以对抗KA诱导的癫痫损伤,而抑制自噬可以保护神经元免受损伤。此外,增加抗氧化剂水平可以减少自噬引起的神经元损伤。因此,在KA诱导的大鼠颞叶癫痫模型中,抗氧化剂水平的增加和自噬水平的降低可能与TA的神经保护作用密切相关。PI3K/AKT和MAPK通路对癫痫损伤后神经元的存活至关重要[16]。AKT的激活可以抑制神经元的自噬,促进神经元的增殖和存活,有研究表明,PI3K/AKT信号通路的激活可以抑制神经元损伤[17]。在本研究中,预先给予50 mg/kg的TA可通过激活PI3K/AKT通路来保护神经元免受癫痫损伤和氧化应激。此外,MAPK通路被证实参与了有害的应激刺激(高渗透压、氧化应激、低渗透压),在ROS和自噬过程中发挥着关键作用。先前的研究表明,ROS介导的PI3K/AKT和MAPK通路的磷酸化上调抑制了自噬。本研究发现,TA预处理上调了PI3K/AKT和MAPK通路相关蛋白水平,而下调了自噬相关蛋白的表达。然而,在DDC干预后,TA对PI3K/AKT或MAPK通路相关蛋白水平都没有影响。因此,TA通过激活PI3K/AKT和MAPK通路来抑制癫痫所致的神经元损伤。
综上所述,TA预处理对KA诱导的大鼠颞叶癫痫模型神经元损伤具有保护作用。此外,TA的神经保护作用可能与通过激活PI3K/AKT和MAPK通路维持抗氧化水平和自噬密切相关。
参考文献:
[1] WU Q,YI X W.Down-regulation of long noncoding RNA MALAT1 protects hippocampal neurons against excessive autophagy and apoptosis via the PI3K/AKT signaling pathway in rats with epilepsy[J].Journal of Molecular Neuroscience,2018,65(2):234-245.
[2] WANG L,SONG L F,CHEN X Y,et al.MiR-181b inhibits P38/JNK signaling pathway to attenuate autophagy and apoptosis in juvenile rats with kainic acid-induced epilepsy via targeting TLR4[J].CNS Neuroscience & Therapeutics,2019,25(1):112-122.
[3] ATTIA G M,ELMANSY R A,ELSAED W M.Neuroprotective effect of nilotinib on pentylenetetrazol-induced epilepsy in adult rat hippocampus:involvement of oxidative stress,autophagy,inflammation,and apoptosis[J].Folia Neuropathologica,2019,57(2):146-160.
[4] HOSSEINZADEH M,NIKSERESHT S,KHODAGHOLI F,et al.Cannabidiol post-treatment alleviates rat epileptic-related behaviors and activates hippocampal cell autophagy pathway along with antioxidant defense in chronic phase of pilocarpine-induced seizure[J].Journal of Molecular Neuroscience,2016,58(4):432-440.
[5] PENG J T,WU S H,GUO C,et al.Effect of ibuprofen on autophagy of astrocytes during pentylenetetrazol-induced epilepsy and its significance:an experimental study[J].Neurochemical Research,2019,44(11):2566-2576.
[6] DU T T,ZHU G Y,CHEN Y C,et al.Anterior thalamic nucleus stimulation protects hippocampal neurons by activating autophagy in epileptic monkeys[J].Aging,2020,12(7):6324-6339.
[7] HUSSEIN A M,ADEL M,EL-MESERY M,et al.L-carnitine modulates epileptic seizures in pentylenetetrazole-kindled rats via suppression of apoptosis and autophagy and upregulation of Hsp70[J].Brain Sciences,2018,8(3):45.
[8] XIE N C,LI Y J,WANG C,et al.FAM134B attenuates seizure-induced apoptosis and endoplasmic reticulum stress in hippocampal neurons by promoting autophagy[J].Cellular and Molecular Neurobiology,2020,40(8):1297-1305.
[9] XIAO D,LV J D,ZHENG Z G,et al.Mechanisms of microRNA-142 in mitochondrial autophagy and hippocampal damage in a rat model of epilepsy[J].International Journal of Molecular Medicine,2021,47(6):98.
[10] HAMDY M,ANTAR A,EL-MESERY M,et al.Curcumin offsets PTZ-induced epilepsy:involving inhibition of apoptosis,Wnt/β-catenin,and autophagy pathways[J].Egyptian Journal of Basic and Applied Sciences,2020,7(1):240-251.
[11] WU Q,ZHANG M,LIU X Y,et al.CB2R orchestrates neuronal autophagy through regulation of the mTOR signaling pathway in the hippocampus of developing rats with status epilepticus[J].International Journal of Molecular Medicine,2020,45(2):475-484.
[12] WU J M,CHEN L Q,WANG S,et al.Negative regulation of autophagy in activating nucleotide-binding oligomerization domain-like receptor family pyrin domain-containing 3 inflammasomes in the hippocampus of an epilepsy rat model[J].Nanoscience and Nanotechnology Letters,2019,11(7):947-959.
[13] WANG J,LIU Y,LI X H,et al.Curcumin protects neuronal cells against status-epilepticus-induced hippocampal damage through induction of autophagy and inhibition of necroptosis[J].Canadian Journal of Physiology and Pharmacology,2017,95(5):501-509.
[14] HU F,SHAO L,ZHANG J,et al.Knockdown of ZFAS1 inhibits hippocampal neurons apoptosis and autophagy by activating the PI3K/AKT pathway via up-regulating miR-421 in epilepsy[J].Neurochemical Research,2020,45(10):2433-2441.
[15] WANG J,LI Y,HUANG W H,et al.The protective effect of aucubin from Eucommia ulmoides against status epilepticus by inducing autophagy and inhibiting necroptosis[J].The American Journal of Chinese Medicine,2017,45(3):557-573.
[16] WEN X,HAN X R,WANG Y J,et al.MicroRNA-421 suppresses the apoptosis and autophagy of hippocampal neurons in epilepsy mice model by inhibition of the TLR/MYD88 pathway[J].Journal of Cellular Physiology,2018,233(9):7022-7034.
[17] WU M Q,LIU X Y,CHI X S,et al.Mitophagy in refractory temporal lobe epilepsy patients with hippocampal sclerosis[J].Cellular and Molecular Neurobiology,2018,38(2):479-486.
(收稿日期:2022-11-07)
(本文编辑郭怀印)
