载银氧化壳聚糖的制备与抑菌性能研究
2024-06-16纪蕾刘天红王颖李晓李红艳孙元芹姜晓东
纪蕾 刘天红 王颖 李晓 李红艳 孙元芹 姜晓东


摘要:为制备一种高效抑菌剂,以壳聚糖(chitosan,CS)为原料,采用漆酶/2,2,6,6-四甲基哌啶-1-氧自由基(2,2,6,6-tetramethylpiperidine-1-oxyl,TEMPO)体系制备6-羧基壳聚糖(6-carboxyl chitosan,C-COS),然后与硝酸银反应制备载银氧化壳聚糖(silver-carried oxidized chitosan,C-COS-Ag),对其抑菌性能进行研究。结果表明,与CS相比,C-COS-Ag的抑菌效果明显提高,其对大肠杆菌和金黄色葡萄球菌的抑菌圈直径分别为(22.75±1.50)和(13.75±2.50) mm,最小抑菌质量浓度均为6.10 μg·mL-1。细菌生长曲线试验证实,C-COS-Ag能明显降低大肠杆菌和金黄色葡萄球菌的生长速率;细胞内容物渗透试验表明,C-COS-Ag能够破坏细菌的细胞膜和细胞壁形态,导致核酸、蛋白质等大分子物质渗出,碱性磷酸酶活性上升,β-半乳糖苷酶活性下降,半乳糖合成途径受阻,细菌正常代谢受到影响。以上研究结果为C-COS-Ag的应用提供了理论依据。
关键词:壳聚糖;硝酸银;抑菌性;大肠杆菌;金黄色葡萄球菌
doi:10.13304/j.nykjdb.2022.0769
中图分类号:TS201.3 文献标志码:A 文章编号:1008‐0864(2024)03‐0214‐09
壳聚糖(chitosan, CS)是甲壳素脱乙酰基的产物,具有优异的生物和物理化学性质,如凝胶性、生物降解性、抑菌性等[1-4],在医疗保健、环境保护等领域具有广泛应用。壳聚糖通过破坏细菌的细胞壁、细胞膜及干扰细胞新陈代谢等途径达到抑菌作用[5-9]。尽管壳聚糖拥有广谱抗菌活性,但其抗菌效果仍低于已有的化学合成抗菌剂。由壳聚糖分子结构特点可知,其伯羟基、仲羟基以及氨基等基团具有较强的反应活性,是结构修饰的理想位点,可通过化学改性或与抗菌材料复配提高其抗菌活性[10-12]。吴慧清等[13]合成了壳聚糖锌,与壳聚糖相比其抑菌性能明显提高。牛梅等[14]制备了载银壳聚糖复合抗菌剂,发现其对大肠杆菌(Escherichia coil)和金黄色葡萄球菌(Staphylococcusaureus)有明显的抑制作用。
漆酶/2,2,6,6-四甲基哌啶-1-氧自由基(2,2,6,6-tetramethylpiperidine-1-oxyl,TEMPO)体系可以选择性将壳聚糖C-6伯羟基氧化成羧基,生成6-羧基壳聚糖(6-carboxyl chitosan,C-COS),且整个过程无副反应发生,无有害物产生,减少了环境污染,是一种壳聚糖绿色改性方法。本研究采用漆酶/TEMPO体系制备C-COS,然后与硝酸银反应制备了载银氧化壳聚糖(silver-carried oxidizedchitosan,C-COS-Ag),研究其对大肠杆菌、金黄色葡萄球菌的抑菌性能及作用机制,利用细菌生长曲线表征C-COS-Ag的抑菌效果,通过细胞内容物渗透(小分子、核酸、蛋白质)和细菌胞内酶(碱性磷酸酶、β-半乳糖苷酶)活性的变化,分析细菌细胞膜的通透性及完整性,探究其抗菌机制,为C-COS-Ag在抑菌领域的应用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 试验材料 壳聚糖,脱乙酰度95%,购自上海源叶生物科技有限公司。
1.1.2 试验试剂 大肠杆菌( 编号:ATCC25922)、金黄色葡萄球菌(编号:ATCC 11779),青岛高科技工业园海博生物技术有限公司;漆酶,诺维信(中国)生物技术有限公司;2,2,6,6-四甲基哌啶-1-氧自由基(TEMPO),默克Sigma-Aldrich 公司;总蛋白(total protein,TP)测定试剂盒、碱性磷酸酶活性检测试剂盒, 南京建成生物工程研究所;β-半乳糖苷酶活性检测试剂盒,北京索莱宝科技有限公司;营养琼脂、营养肉汤,北京陆桥技术有限责任公司。
1.1.3 试验仪器 VERTEX70傅里叶变换红外光谱仪,德国布鲁克公司;UV-2450 紫外分光光度计,日本岛津仪器有限公司;S-4800N型扫描电子显微镜,日本日立公司;Victor-Rivo5s多功能酶标仪,美国珀金埃尔默公司;Orion VERSA STAR多参数测量仪,美国赛默飞世尔科技公司;SX-500高压灭菌锅,日本Kagoshima Seisakusyo Inc公司;CR21N高速冷冻离心机,日本日立公司;JTM1812/30-1多功能膜小型试验机,大连屹东有限公司;FD-1-50真空冷冻干燥机,北京博医康医学设备有限公司;ZNCL-DLS磁力加热锅,上海科升有限公司。
1.2 试验方法
1.2.1 载银氧化壳聚糖的制备 取2 g CS 和0.08 g TEMPO溶于200 mL pH 4.6的乙酸-乙酸钠缓冲溶液中,添加200 μL漆酶,40 ℃水浴锅中通氧反应18 h。反应后离心去除不溶物,过超滤膜浓缩滤液后加入适量无水乙醇析出产物,过滤、真空干燥,制得C-COS。称取0.24 g 样品,溶于30mL 乙酸- 乙酸钠缓冲溶液中,加入25 mL 0.01mol·L-1的硝酸银溶液,50 ℃下反应1.5 h。经丙酮析出沉淀、滤膜抽滤、乙醇多次洗涤、真空干燥得到C-COS-Ag。
1.2.2 培养基的制备 称取33 g营养肉汤于1 L蒸馏水中,加热搅拌至溶解,高压灭菌、冷却后备用。
1.2.3 菌悬液的制备 挑取平板活化18~24 h的培养菌落,接种于营养肉汤液体培养基中培养,用无菌生理盐水校正菌液浊度,使其含量范围在106 CFU·mL-1左右备用。
1.2.4 红外光谱检测 将样品放于红外光谱仪上进行KBr压片法检测。红外检测扫描的波数范围设定为4 000~500 cm-1,分辨率为4 cm-1,扫描次数为16次。
1.2.5 超微结构的测定 将少量的待测样品通过导电胶粘贴在固定台上,喷金后放入样品腔内,抽真空,打开灯丝,在控制软件中设定参数,用扫描电子显微镜观察其表观形貌。
1.2.6 抑菌性能的测定 参照卞能源等[15]的方法,采用牛津杯叠法测定抑菌效果。将200 μL活化的大肠杆菌菌悬液均匀涂布于平板,平板放置4个牛津杯(十字直径摆放,保证每孔之间的距离不小于2 cm),然后每孔加入200 μL抗菌剂溶液(称取0.02 g的样品置于EP管中,分别加入4 mL醋酸-醋酸钠缓冲溶液),最后正置放入生化培养箱中,37 ℃培养24 h,用游标卡尺测量抑菌圈直径,每孔取不同方向测量3次, 取平均值。
参照吴增华[16]的方法,采用二倍稀释法测定最小抑菌浓度(minimal inhibit concentration,MIC)。取无菌96孔酶标板,每孔加入100 μL灭菌液体培养基;第1孔中加入100 μL C-COS-Ag溶液,充分混匀后取出100 μL混合液加入到第2孔中,如此逐级稀释,然后加入100 μL菌悬液;阴性对照组分别加入100 μL灭菌液体培养基和C-COS-Ag溶液,不加菌悬液;将最后1行设为阳性对照组,不加C-COS-Ag溶液,分别加入100 μL 培养基和菌悬液,混匀后置于37 ℃培养24 h。培养后观察并判定是否长菌(其中浑浊表示显著长菌,澄清表示未长菌),确定MIC。
1.2.7 生长曲线的测定 参考梅佳林等[17]的方法略作修改。将C-COS-Ag加入营养肉汤液体培养基中,使其终水平分别为1×MIC、2×MIC,空白对照组不添加C-COS-Ag。每管中9 mL溶液,再向每个试管加入1 mL 1×106 CFU·mL-1的菌液,在37 ℃下培养,分别在培养0、2、4、6、8、12、24 h时测定吸光度OD600值,并绘制微生物的生长曲线,重复3次。
1.2.8 细菌胞内小分子物质泄漏(电导率)的测定 参考梅佳林等[17]的方法测电导率。取培养至对数生长期的菌液,8 000 r·min-1离心10 min,弃上清收集菌体,用PBS洗涤3次形成重悬液。向重悬液中分别加入1×MIC和2×MIC的C-COS-Ag,于摇床中100 r·min-1 培养6 h,每小时取样测电导率。
1.2.9 细菌胞内核酸类物质泄漏的测定 按1.2.8中的方法制备重悬液并分别加入1×MIC和2×MIC 的C-COS-Ag,然后在37 ℃、100 r·min-1 摇床中培养6 h,取菌悬液于6 000 r·min-1 离心10 min,滤膜过滤。使用酶标仪测定其OD260值。
1.2.10 细菌胞内蛋白质泄漏的测定 按1.2.8中的方法制备重悬液并分别加入1×MIC 和2×MIC的C-COS-Ag,然后摇床中100 r·min-1培养6 h,每2 h取菌悬液离心,上清液用蛋白测定试剂盒(考马斯亮蓝法[18])测蛋白质含量。
1.2.11 细菌胞内酶活性的测定 按1.2.8 中的方法制备重悬液并分别加入1×MIC 和2×MIC 的C-COS-Ag,然后在37 ℃、100 r·min-1 摇床中培养4 h,参照测试盒说明书方法,分别测定碱性磷酸酶(alkaline phosphatase,AKP)活性和β-半乳糖苷酶(β-galactosidase, β-GAL)活性。
2 结果与分析
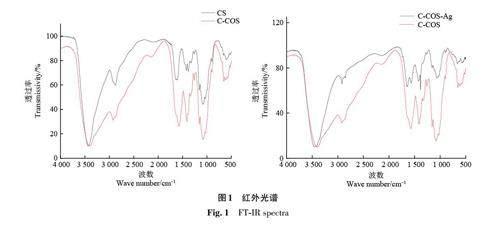
2.1 红外光谱检测分析
C-COS的红外光谱图特征吸收峰与CS基本一致,但有以下不同:波数为3 600 cm-1到3 200 cm-1处,C-COS比CS的吸收峰谱带明显变宽,且向低频方向迁移,推测C-COS形成了更多的氢键,导致吸收峰发生了上述变化;在1 643 cm-1处出现强度明显高于酰胺Ⅱ谱带的羧酸根C=O伸缩振动峰,另外在1 410 和1 070 cm-1处吸收峰强度增强,表明存在羧酸根、C-O的伸缩振动效应。以上结果表明,CS在漆酶/TEMPO体系中经氧化反应引入了羧基。
由图1 可知,C-COS 中N-H 和O-H 伸缩振动偶合形成一宽峰,吸收峰在3 400 cm-1处。与Ag+结合后,在C-COS-Ag 的谱图中向低频方向移动到3 300 cm-1 处,且峰形略有变化,说明C-COS 上的-NH2 或-OH 可能参与了配位。C-COS-Ag 在1 643 cm-1处羧酸根C=O的伸缩振动峰面积变小,说明羧基与Ag+发生了反应。
2.2 超微结构的测定分析
通过扫描电子显微镜观察CS、C-COS 和C-COS-Ag的表面形貌(图2)发现,其表面结构发生了明显变化。CS表面粗糙,颗粒尺寸不均匀,材料彼此紧密重叠(图2A、B)。C-COS具有相对松散的分子结构,其表面主要由堆积的球形颗粒组成(图2C、D)。以上结果表明,CS分子中引入的羧基增强了分子内的相互作用力,有利于其自身双螺旋结构的大空间卷曲。C-COS-Ag表面粗糙,大量粒状材料分散在表面上(图2E、F),因此可以推断Ag已配位到C-COS上。
2.3 抑菌性能的分析
由CS、C-COS-Ag 的抑菌效果(表1)可知,C-COS-Ag对大肠杆菌、金黄色葡萄球菌的抑菌圈直径分别为(22.75±1.50)和(13.75±2.50) mm,与CS相比,C-COS-Ag的抑菌效果明显增强,这是由于CS经氧化及与硝酸银的配位,进一步提高了其抑菌性。基于C-COS-Ag的抑菌效果,通过二倍稀释法测定其对大肠杆菌和金黄色葡萄球菌的MIC均为6.10 μg·mL-1,明显低于CS。
2.4 抑菌机理分析
2.4.1 C-COS-Ag 对细菌生长的影响 由图3、4可知,随着时间的延长,对照组大肠杆菌、金黄色葡萄球菌生长繁殖逐渐加快,基本符合细菌的典型生长规律(S型生长);而加入C-COS-Ag后,1×MIC、2×MIC组中2种细菌的OD600均无明显变化,表明C-COS-Ag能延迟对数期的到来,降低菌株的生长速率,有效抑制大肠杆菌、金黄色葡萄球菌的生长繁殖。C-COS-Ag含量越高,抑制效果越好,这种现象与其他抑菌物质对细菌的生长抑制效果一致[19]。
2.4.2 C-COS-Ag对细菌胞内小分子物质泄漏(电导率)的影响 图5、6反映了C-COS-Ag对大肠杆菌、金黄色葡萄球菌电导率的影响,当细菌细胞膜受损时,通透性增加,会导致胞内钾盐、磷酸盐等小分子渗出,使菌液电导率升高[20]。可以看出,随着时间的延长,对照组菌液电导率无明显变化,表明细菌细胞膜的通透性保持较好;加入1×MIC和2×MIC的C-COS-Ag后菌液电导率逐渐上升,表明C-COSAg破坏了大肠杆菌、金黄色葡萄球菌的细胞膜,使其通透性增加,导致菌液电导率明显上升。
2.4.3 C-COS-Ag对细菌胞内核酸类物质泄漏的影响 如图7、8所示,含C-COS-Ag菌悬液的OD260值随时间的延长迅速升高,而对照组变化不明显,说明C-COS-Ag会使细菌细胞膜发生破损,导致核酸类物质泄露出来,表明其对细菌细胞产生不良影响。这与肉桂醛会破坏大肠杆菌和金黄色葡萄球菌的细胞膜完整性,导致内容物释放的结论[21-22]类似。
2.4.4 C-COS-Ag对细菌胞内蛋白质泄漏的影响 蛋白质是生命活动的主要载体,具有运送营养物质、维持新陈代谢等重要功能,是机体不可或缺的重要部分, 当细胞结构遭到破坏,细胞膜渗透性增加,蛋白等大分子物质会大量渗出[23]。由大肠杆菌及金黄色葡萄球菌的胞外蛋白含量变化(图9、10)可知,由于细菌的正常生长繁殖消耗,导致对照组培养基中蛋白质含量有所降低,而经过C-COS-Ag作用后,细菌胞外蛋白质含量逐渐上升,说明C-COS-Ag使细胞膜的通透性增大,甚至可以损坏细胞膜,导致蛋白质流出。
2.4.5 C-COS-Ag对细菌胞内酶活性的影响 细胞壁完整性主要是通过AKP和β-GAL活性测定。AKP是一种位于细胞壁和细胞膜之间的细胞内酶,在正常情况下,细胞外环境中无法检测到其活性,但如果细胞壁受损,则会导致其泄漏到细胞外环境中,从而提高环境中的酶活性[24]。β-GAL活性主要是针对细胞壁代谢中降解的多糖、糖蛋白以及半乳糖残基的水解,通过测定释放出的半乳糖物质进行分析,β-GAL活性明显下降说明菌株细胞壁受损,半乳糖合成途径受阻[25]。从表2可以看出,经过C-COS-Ag处理后,AKP的活性与对照组相比有所增加,β-GAL活性有所下降,表明C-COS-Ag使细胞壁受损,从而抑制细菌生长。
3 讨论
目前,纤维素中C-6羟基选择性氧化的最常见方法是在碱性条件下通过自由基TEMPO 与NaBr/NaOCl 结合,该技术较成熟,且得到一定应用,但反应过程存在一些缺点,例如反应条件较复杂,反应过程中会产生溴代副产物以及氯代副产物等,且反应产生的大量氯气会污染环境[26‐27]。在工业过程中使用酶技术可以减少其对环境和经济的负面影响。漆酶/TEMPO 介导的氧化比TEMPO/NaBr/NaClO 处理在更温和的条件下进行,产生的环境有害残留物更少[28‐29],符合国家工业绿色低碳转型的发展理念。
将壳聚糖及其衍生物与无机抗菌剂复配,其协同作用可有效改善抑菌效果,银是无机抗菌材料,可通过缓慢释放作用,改善其抗菌的持久性。王祖华等[30]制备了载银壳聚糖,发现其对大肠杆菌和金黄色葡萄球菌的MIC为80 μg·mL-1,明显高于本研究制备的载银氧化壳聚糖,表明载银氧化壳聚糖的抑菌性能优于载银壳聚糖。赵儒男等[31]利用新型壳聚糖乳液对丁香酚进行直接包载,研究其抑菌效果,发现其能够显著抑制大肠杆菌和金黄色葡萄球菌的生长,MIC为312.5 μg·mL-1,也明显高于本研究制备的载银氧化壳聚糖,表明载银氧化壳聚糖的抑菌性能优于丁香酚-壳聚糖乳液。朱丽[32]制备了溶菌酶/TEMPO/漆酶壳聚糖抑菌剂、溶菌酶/壳聚糖酶-TEMPO/漆酶壳聚糖抑菌剂、肉桂醛/TEMPO/漆酶壳聚糖抑菌剂和肉桂醛/壳聚糖酶-TEMPO/漆酶壳聚糖抑菌剂,并对这4种抑菌剂的抑菌效果进行研究,发现溶菌酶-TLCS抑菌剂对金黄色葡萄球菌和大肠杆菌的抑菌效果最好,抑菌圈直径分别为13.89和13.13 mm,抑菌效果均低于本研究制备的载银氧化壳聚糖。
本研究通过抑菌活性试验及抗菌机理的探索,进一步验证了载银氧化壳聚糖对大肠杆菌和金黄色葡萄球菌具有显著抑菌效果,其原理是通过改变细胞膜的通透性,使菌液电导率升高,核酸、蛋白质等大分子物质渗出,AKP活性上升,细胞壁受损,β-GAL活性下降,半乳糖合成途径受阻,细菌正常代谢受到影响,从而抑制细菌的生长。研究结果可为壳聚糖资源的利用提供理论依据。未来,关于载银氧化壳聚糖的稳定性以及对霉菌和真菌的作用有待进一步研究。
参考文献
[1] 姚剑松, 左华江, 徐然, 等. 壳聚糖的抗菌改性及应用[J]. 广
东化工, 2019, 46(21): 70-71, 77.
YAO J S, ZUO H J, XU R, et al .. Antibacterial modification
and application of chitosan [J]. Guangdong Chem. Ind., 2019,
46(21): 70-71, 77.
[2] SHARIATINIA Z. Carboxymethyl chitosan: properties and
biomedical applications [J]. Int. J. Biol. Macromol., 2018, 120(7):
1406 -1419.
[3] 崔升, 袁美玉, 付俊杰, 等. 抗菌用壳聚糖及其金属粒子复
合材料研究进展[J]. 精细化工, 2021, 38(9): 1757-1764.
CUI S, YUAN M Y, FU J J, et al .. Research progress of
chitosan and its metal particle composite materials for
antibacterial application [J]. Fine Chem., 2021, 38(9): 1757-
1764.
[4] RAGHAVENDRA G M, JUNG J, KIM D, et al .. Chitosanmediated
synthesis of flowery-CuO, and its antibacterial and
catalytic properties [J]. Carbohyd. Polym., 2017, 172: 78-84.
[5] 李晓芳, 冯小强, 杨声. 壳聚糖对革兰氏阴性菌抑菌机理的
初步研究[J]. 食品科学, 2010, 31(13): 148-153.
LI X F, FENG X Q, YANG S. A mechanism of antibacterial
activity of chitosan against gram-negative bacteria [J]. Food
Sci., 2010, 31(13): 148-153.
[6] 路振香, 路颖, 商常发, 等. 壳聚糖对5种细菌体外的抑制试
验[J].动物医学进展, 2006,27(3): 62-64.
LU Z X, LU Y, SHANG C F, et al .. The experiement of
bacteriostases of chitosan in vitro [J]. Progress Veterin. Med.,
2006, 27(3): 62-64.
[7] 韩永萍, 李可意, 杨宏伟, 等. 壳聚糖的抗菌机理及其化学
改性研究[J]. 化学世界, 2012, 53(4): 248-252.
HAN Y P, LI K Y, YANG H W, et al .. Research on
antibacterial mechanism of chitosan and its chemical
modification [J]. Chem. World, 2012, 53(4): 248-252.
[8] TANG H, ZHANG P, KIEFT T L, et al .. Antibacterial action of
a novel functionalized chitosan-arginine against Gram-negative
bacteria [J]. Acta Biomater., 2010, 6(7): 2562-2571.
[9] MELLEGRD H, STRAND S P, CHRISTENSEN B E, et al ..
Antibacterial activity of chemically defined chitosans: influence
of molecular weight, degree of acetylation and test organism [J].
Int. J. Food Microbiol., 2011, 148(1): 48-54.
[10] FAZLI W, WANG H S, LU Y S, et al .. Preparation,
characterization and antibacterial applications of carboxymethyl
chitosan/CuO nanocomposite hydrogels [J]. Int. J. Biol. Macromol.,
2017, 101(4): 690-695.
[11] LUO P F, NIE M, WEN H G, et al .. Preparation and
characterization of carboxymethyl chitosan sulfate/oxidized
konjac glucomannan hydrogels [J]. Int. J. Biol. Macromol.,
2018, 54(7): 1024-1031.
[12] 开梓翔, 刘春, 刘宇翔, 等. 羧甲基壳聚糖复合纳米银、纳
米氧化铜的制备及抑菌性研究[J]. 生物医学工程研究,
2021, 40(1): 38-42.
KAI Z X, LIU C, LIU Y X, et al .. Preparation and
bacteriostatic properties of carboxymethyl chitosan composite
Ag nanoparticles or CuO nanoparticles [J]. J. Bio. Eng. Res.,
2021, 40(1): 38-42.
[13] 吴慧清, 吴清平, 石立三, 等. 壳聚糖及其金属锌配位络合
物的抑菌性能研究[J]. 食品科学, 2006,11(12): 75-78.
WU H Q, WU Q P, SHI L S, et al .. Study on antimicrobial
capability of chitosan-Zn complex and chitosan [J]. Food Sci.,
2006, 11(12):75-78.
[14] 牛梅, 戴晋明, 侯文生, 等. 载银壳聚糖复合物的结构及其
抗菌性能研究[J]. 材料导报, 2011, 25(10): 15-26.
NIU M, DAI J M, HOU W S, et al .. Study on the structure and
antibacterial activity of Ag-loading chitosan composites [J].
Mater. Rev., 2011, 25(10): 15-26.
[15] 卞能源, 潘玙璠, 张新莉, 等. 载银氧化壳聚糖复合物的制
备及其抑菌性能的研究[J]. 功能材料, 2019, 50(12): 12118-
12125.
BIAN N Y, PAN Y F, ZHANG X L, et al .. Preparation of silverloaded
oxidized chitosan complex and study on its antibacterial
properties [J]. J. Funct. Mater., 2019, 50(12): 12118-12125.
[16] 吴增华. 几种中草药对大肠杆菌抑菌抗病作用及对绵羔羊
的增重免疫实验研究[D].北京:中国农业科学院,2013.
WU Z H. A study on bacteriostatic effect of several kinds of
chinese herbal medicine against Escherichia coli and lamps
liveweight gain [D]. Beijing: Chinese Academy of Agricultural
Sciences, 2013.
[17] 梅佳林, 李婷婷, 张星晖, 等. 芳樟醇对三文鱼源莓实假单
胞菌的抑菌机理[J]. 食品科学, 2022, 43(9): 199-206.
MEI J L, LI T T, ZHANG X H, et al .. Antibacterial mechanism
of linalool against Pseudomonas fragi from salmon [J]. Food
Sci., 2022, 43(9): 199-206.
[18] CUI H, ZHANG C, LI C, et al .. Antibacterial mechanism of
oregano essential oil [J]. Ind. Crops Prod., 2019, 139(8):
111-125.
[19] 何柳, 王云鹏, 谢卫红, 等. 艾叶水提物和酸提物的抗氧化
及抗菌活性比较[J]. 现代食品科技,2021,37(10): 205-213.
HE L, WANG Y P, XIE W H, et al .. Comparetive of antioxidat
and antibacterial activities of aqueous and acid extracts from
artemisia argyi [J]. Mod. Food Sci. Technol., 2021, 37(10):
205-213.
[20] National Committee for Clinical Laboratory Standards. Methods
for dilution antimicrobial susceptibility tests for bacteria that
grow aerobically [S]. USA: Clinical and Laboratory Standards
Institute, 2000.
[21] OU P, SUN M, HE X, et al .. Sclareol protects Staphylococcus
aureus-induced lung cell injuryvia inhibiting alpha-hemolysin
expression [J]. J. Microbiol. Biotechnol., 2016, 27(1): 19-25.
[22] 张赟彬, 刘笑宇, 姜萍萍, 等. 肉桂醛对大肠杆菌和金黄色
葡萄球菌的抑菌作用及抑菌机理研究[J]. 现代食品科技,
2015, 31(5): 31-35.
ZHANG Y B, LIU X Y, JIANG P P, et al .. Mechanism and
antibacterial activity of cinnamaldehyde against Escherichia
coli and Staphylococcus aureus [J]. Mod. Food Sci. Technol.,
2015, 31(5): 31-35.
[23] 卫梦绮. 枯茗醛对黄曲霉生长的抑制作用及机理初探[D].
西安: 陕西科技大学, 2019.
WEI M Q. The inhibitory activity and preliminary mechanism
of cuminaldehyde on the growth of Aspergillus flavus [D]. Xian:
Shaanxi University of Science & Technology, 2019.
[24] 蓝蔚青, 车旭, 谢晶, 等. 复合生物保鲜剂对荧光假单胞菌
的抑菌活性及作用机理[J]. 中国食品学报, 2016, 16(8):
159-165.
LAN W Q, CHE X, XIE J, et al .. Antibacterial activity and
mechanism of composite biological preservatives against
Pseudomonas fluorescens [J]. J. Chin. Inst. Food Sci. Technol.,
2016, 16(8): 159-165.
[25] 赵莉. 痰细胞细菌培养的临床意义[J]. 黑龙江医药科学,
2013, 36(5):9-10.
ZHAO L. The clinical value of bacterial culture of sputum cells [J].
Heilongjiang Med. Pharm., 2013, 36(5):9-10.
[26] GERT E V, TORGASHOV V I, ZUBETS O V, et al ..
Preparation and properties of enterosorbents based on carboxylated
microcrystalline cellulose [J]. Cellulose, 2005, 12(5): 517-526.
[27] SAITO T, ISOGAI A. Introduction of aldehyde groups on
surfaces of native cellulose fibers by TEMPO-mediated
oxidation [J]. Colloids Surf. A, 2006, 289(1-3): 219-225.
[28] ARACRI E, VIDAL T. Enhancing the effectiveness of a
laccase-TEMPO treatment has a biorefining effect on sisal
cellulose fibres [J]. Cellulose, 2012, 19(3): 867-877.
[29] ARACRI E, VIDAL T, RAGAUSKAS A J. Wet strength development
in sisal cellulose fibers by effect of a laccase-TEMPO
treatment [J]. Carbohydr. Polym., 2011, 84(4): 1384-1390.
[30] 王祖华, 刘萍, 杨瑞先, 等. 绿色合成载银壳聚糖及其等温
线、动力学及抑菌性[J].人工晶体学报, 2021, 50(12): 2307-
2315.
WANG Z H, LIU P, YANG R X, et al .. Synthesis of Agchitosan
by green route and its isotherms, kinetic and
antimicrobial activity [J]. J. Synth. Cryst., 2021, 50(12): 2307-
2315.
[31] 赵儒男, 李艳. 丁香酚-壳聚糖乳液的制备及其抑菌性评
价[C]//中国食品科学技术学会第十六届年会暨第十届中美
食品业高层论坛. 武汉,中国食品科学技术学会, 2019:
426-427.
[32] 朱丽. 壳聚糖基抑菌剂的制备、性能及在草莓和鲜银耳抑
菌保鲜中的应用研究[D].长春: 吉林大学,2019.
ZHU L. Preparation and properties of chitosan-bacteriostatic
agents and their application in strawberry and fresh tremella
fuciformis bacteriostatic preservation [D]. Changchun: Jilin
University, 2019.
(责任编辑:胡立霞)
