甘青青兰根际土壤理化性质及微生物群落结构特征分析
2024-06-16张二豪刘盼盼何萍简阅徐雨婷陈诚欣禄亚洲兰小中索朗桑姆
张二豪 刘盼盼 何萍 简阅 徐雨婷 陈诚欣 禄亚洲 兰小中 索朗桑姆
摘要:为研究甘青青兰根际土壤理化性质与根际土壤细菌和真菌群落结构组成特征,以西藏自治区工布江达县(GB)、卡诺区(KR)和洛隆县(LL)的甘青青兰根际土壤微生物为研究对象,采用Illumina MiSeq高通量测序技术对根际土壤细菌和真菌群落结构组成进行分析,同时测定根际土壤的理化性质,并与根际土壤核心微生物菌群进行相关性分析。结果表明,不同地区甘青青兰根际土壤理化性质差异显著。甘青青兰根际土壤共获得3 900个细菌OTUs和1 990个真菌OTUs,不同地区间土壤微生物多样性存在明显差异。在门水平,GB、KR 和LL 样品的优势细菌门均为放线菌门(Actinobacteria),GB 样品的优势真菌门是担子菌门(Basidiomycota),KR和LL样品的优势真菌门是子囊菌门(Ascomycota);在属水平,不同地区甘青青兰根际土壤优势微生物菌群存在明显差异。主成分分析显示,不同地区甘青青兰根际土壤细菌和真菌群落结构组成差异较大。核心微生物菌群分析表明,甘青青兰根际土壤核心细菌菌群有257个属;核心真菌菌群有102个属。相关性分析表明,核心微生物菌群的改变与根际土壤理化因子间存在不同程度的相关性,且土壤全钾、全磷、全氮、速效钾和速效氮含量是影响甘青青兰根际土壤微生物群落结构组成的重要因子。综上所述,不同地区甘青青兰根际土壤微生物群落结构组成存在显著差异,且根际土壤微生物群落结构的变化与土壤理化因子密切相关,为甘青青兰人工种植及筛选有益微生物菌群提供了理论依据。
关键词:甘青青兰;土壤理化性质;高通量测序;微生物群落;核心微生物;相关性分析
doi:10.13304/j.nykjdb.2022.0741
中图分类号:S154.3 文献标志码:A 文章编号:1008‐0864(2024)03‐0201‐13
甘青青兰(Dracocephalum tanguticum Maxim.)又名“唐古特青兰”,是唇形科(Lamiaceae)青兰属(Dracocephalum)的一种多年生草本植物,主要分布在海拔1 900~4 600 m的西藏东南、青海东部和四川西部等地。甘青青兰作为一种藏医药临床常用藏药材,具有清热解毒、止咳化痰、和胃舒肝等功效[1]。研究表明,甘青青兰含有丰富的药用化学成分,如黄酮及黄酮苷类、萜类、挥发油、多糖和无机元素等[2-4],具有抗缺氧、降血糖、抗菌和消炎等药理活性[5-8]。
药用植物的品质与植物品种、根际土壤微生物、土壤理化性质及气候等因素密切相关[9‐10]。根际土壤是指受植物根系及根系分泌物影响的离根轴数毫米的微区域,根际土壤微生物是根际土壤微生态的重要组成部分,在物质循环、能量转换、植物生长发育、抗病和抗逆境等方面扮演重要角色[11]。研究表明,紫萁小菇(Mycena osmundicola)和蜜环菌(Armillariella mellea)能促进天麻(Gastrodia elata Bl.)种子的萌发[12];假单胞菌属(Pseudomonas)、醋杆菌属(Acrtobacter)、肠杆菌属(Enterobacter)和芽孢杆菌属(Bacillus)等能促进药用植物对土壤养分的吸收和利用,进而促进植物的生长发育[11]。Kim等[13]从人参根际分离的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)AK‐0能抑制人参锈腐病菌(Cylindrocarpon destructans)的繁殖。Egamberdieva 等[14] 研究表明根瘤菌(Mesorhizobium sp.)和假单胞菌(Pseudomonasextremorientalis)能增强甘草对盐的耐受性。研究表明,丛枝菌根真菌能促进药用植物中酚类、萜类和生物碱的合成和积累[15];枯草芽孢杆菌(Bacillus subtilis)能提高党参的生物量[16];印度梨状芽孢杆菌能促进药用植物黄花蒿中青蒿素的合成[17]。根际土壤微生物群落结构的变化与土壤理化性质密切相关。研究表明,土壤养分含量、pH和含水率是影响珍珠猪毛菜根际土壤细菌群落结构组成的重要因子[18];土壤pH及氮、磷含量等影响喜马拉雅紫茉莉根际土壤细菌的群落结构及多样性[19]。因此,研究药用根际土壤微生物群落结构组成及根际土壤理化性质,对药材种植及分离筛选益生微生物类群具有重要意义。
甘青青兰作为一种传统藏药材,其相关研究主要集中在其药用化学成分及药理学活性等方面,而有关根际土壤微生物群落结构组成及土壤理化性质的研究尚未见报道。为进一步探讨甘青青兰根际土壤微生物群落结构组成差异与土壤理化性质的关联性,本研究采用高通量测序技术结合土壤理化性质测定,对3个地区的甘青青兰根际土壤微生物群落结构组成进行分析,旨在揭示其核心微生物类群与土壤理化性质间的关系,以期为甘青青兰人工种植和益生微生物的筛选提供理论依据。
1 材料与方法
1.1 样本采集
2020 年8 月于西藏昌都市卡若区(Karuo,KR)、昌都市洛隆县(Luolong,LL)和林芝市工布江达县(Gongbujiangda,GB)分别采集2年生甘青青兰根际土壤样品(表1)。在每个采样点,根据随机采样原则,随机选择9株长势良好的甘青青兰植株,采用“抖根法”收集根际土壤样品,每个采样点3个重复,并过直径为2 mm的过滤筛以除去残枝落叶,装入无菌袋并混合均匀,置于液氮中并带回实验室,-80 ℃保存备用。
1.2 根际土壤理化性质分析
参照《土壤农化分析》[20]操作方法测定根际土壤pH、总磷(total phosphorus,TP)、速效磷(available phosphorus, AP)、总钾(total potassium,TK)、速效钾(available potassium,AK)、总氮(totalnitrogen,TN)、速效氮(available nitrogen,AN)和土壤有机质(soil organic matter,SOM)含量。
1.3 根际土壤样品总DNA 提取、PCR 扩增及Illumina 测序
根据土壤基因组DNA提取试剂盒(TIANGEN)操作说明提取根际土壤细菌和真菌总DNA,1%琼脂糖凝胶电泳检测DNA质量,用紫外分光光度计NanoDrop ND-2000(Thermo Scientific, Wilmington,USA)测定DNA 含量和纯度。利用通用引物338F(5-ACTCCTACGGGAGGCAGCA-3)和806R(5-GGACTACHVGGGTWTCTAAT-3)扩增细菌16S rRNA 基因V3~V4 区,利用通用引物ITS1F(CTTGGTCATTTAGAGGAAGTAA)和ITS2R(GCTGCGTTCTTCATCGATGC)扩增真菌内源转录间隔区(internally transcribed spacer,ITS)。PCR体系为20 μL,包含2×Taq PCR MasterMix 10 μL、10 mmol·L-1正反向引物各1 μL、基因组DNA模板1 μL、ddH2O 7 μL。PCR 程序:94 ℃ 5 min;94 ℃30 s,55 ℃ 30 s,72 ℃ 1 min,35 个循环;72 ℃10 min,4 ℃保存。2%琼脂糖凝胶电泳检测PCR扩增产物,胶回收扩增产物后委托上海派森诺科技股份有限公司进行高通量测序。
1.4 数据分析
利用QIIME2(2019.4)对Illumina MiSeq 测序数据进行去噪、拼接和质控;在97%相似度水平下,利用Vsearch(v2.13.4)对高质量序列进行OTU(operational taxonomic unit)聚类分析;基于Greengenes 数据库(Release 13.8,http://greengenes.secondgenome. com/)和UNITE 数据库(Release8.0,https://unite.ut.ee/)分别对根际土壤细菌和真菌OTUs 代表序列进行物种分类学注释;利用QIIME2(2019.4)和R 语言进行分类学组成、α 多样性和β多样性分析。其中α多样性包括Chao1指数、Simpson 指数、Shannon 指数和Shannoneven指数;β 多样性分析包括主成分分析(principalcomponent analysis,PCA)和样本层级聚类。基于R语言进行相关性Heatmap分析;利用SPSS 25.0软件对土壤理化性质和alpha多样性指数进行单因素方差分析。
2 结果与分析
2.1 样品根际土壤理化性质分析
由图1可知,KR 样品pH 呈偏碱性,而LL 和GB样品呈偏酸性;LL样品中的SOM含量显著高于GB 样品,但与KR 样品无显著差异,且KR 与GB间无显著差异;GB、KR和LL样品中TN和TP含量差异显著,且KR 中含量最高,GB中含量最低,KR样品中AN和AP含量显著高于GB,但KR样品与LL样品中AN含量无显著差异,GB和LL样品中AP含量无显著差异;GB、KR和LL样品中TK含量差异显著,且LL样品中最高,KR次之,GB最低;KR和LL样品中AK含量最高,且显著高于GB样品,但样品KR和LL间无显著差异。由此表明,不同地区甘青青兰根际土壤理化性质差异显著。
2.2 样品序列统计及alpha 多样性分析
高通量测序结果(表2)表明,3个地区甘青青兰根际土壤细菌共产生48 763条有效序列,其中,GB、KR和LL分别产生15 316、16 714和16 733条有效序列,序列平均长度376 bp,测序覆盖度为97.11%~97.78%;根际土壤真菌共产生143 744条有效序列,其中,GB、KR 和LL 分别产生42 048、51 312和50 384条有效序列,序列平均长度260 bp,测序覆盖度为99.67%~99.85%。由此说明,测序结果能基本反应样品真实微生物群落结构组成。
在97%相似度水平下,3个地区甘青青兰根际土壤共获得3 900个细菌OTUs和1 990个真菌OTUs,其中,GB、KR、LL样品分别注释到的细菌OTUs 和真菌OTUs 分别为1 149、1 473、1 278 和489、883和618个。韦恩图(图2)分析显示,3个地区共有的细菌OTUs和真菌OTUs分别为667和91个,分别占总数的17.10%和4.57%;GB、KR和LL样品特有的细菌OTUs分别为190、417和280个,特有的真菌OTUs分别为242、556和347个。由此说明,不同地区甘青青兰根际土壤微生物群落结构组成存在差异。
α多样性结果(图3)表明,KR样品根际土壤细菌和真菌的丰富度指数最高,显著高于LL 和GB,GB样品根际土壤细菌和真菌的丰富度指数最低,显著低于LL样品;KR样品根际土壤细菌多样性指数最高,显著高于GB样品,但与LL样品无显著差异;LL 样品根际土壤真菌多样性指数最高,但与KR样品无显著差异,GB样品多样性指数最低,且显著低于LL和KR样品。以上结果表明,不同地区甘青青兰根际土壤微生物α多样性存在明显差异。
2.3 样品微生物种群归类分析
由表3可知,根际土壤细菌共注释到27门、74纲、177目、269科、492属,其中GB样品注释到26门、62纲、133目、197科、360属;KR样品注释到26门、68纲、159目、237科、415属;LL样品注释到23门、55纲、125目、193科、332属。根际土壤真菌共注释到11门、38纲、99目、213科、387属,其中GB样品注释到10门、28纲、66目、132科、190属;KR样品注释到9门、31纲、83目、163科、276属;LL样品注释到8门、29纲、62目、137科、225属。不同种源地甘青青兰根际土壤微生物在各分类等级上的数量存在明显差异,说明不同种源地甘青青兰根际土壤微生物群落结构组成存在差异。
2.4 样品微生物群落结构组成分析
在门水平,3个地区甘青青兰根际土壤细菌和真菌群落结构组成如图4所示。对于细菌群落,放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和绿弯菌门(Chloroflexi)的相对丰度较高。其中,在GB样品中,相对丰度>1%的有3个菌门,分别是放线菌门(45.41%)、变形菌门(19.20%)和厚壁菌门(30.63%);在KR 和LL 样品中,相对丰度>1%的有4个菌门,分别是放线菌门(57.84%和67.44%)、变形菌门(28.92%和16.69%)、厚壁菌门(3.84% 和3.57%)和绿弯菌门(3.09% 和6.06%);说明3个地区甘青青兰根际土壤优势细菌门类型基本相同,但相对丰度差异较大。对于真菌群落,GB 样品中的优势真菌门为担子菌门(Basidiomycota,85.43%)、子囊菌门(Ascomycota,10.01%)和被孢霉门(Mortierellomycota,2.84%);KR和LL 样品中的优势真菌门是子囊菌门(67.86%和75.25%)、担子菌门(19.89% 和15.89%)、被孢霉门(10.83% 和7.17%)和unclassified_k_Fungi(1.21%和1.10%),说明3个地区甘青青兰根际土壤中的优势真菌门组成相似,但相对丰度差异较大。
在属水平,3个地区甘青青兰根际土壤细菌和真菌群落结构组成如图5所示。在相对丰度>1%条件下,GB样品有5个细菌属,其中能准确分类的有4 个,分别是膨胀芽孢杆菌属(Tumebacillus, 8.46%) 、短芽孢杆菌属(Brevibacillus, 8.43%) 、土壤红杆菌属(Solirubrobacter,7.22%)和芽孢杆菌属(Bacillus,6.03%);KR和LL样品各有3个细菌属,其中能准确分类的有2 个,分别是土壤红杆菌属(Solirubrobacter,6.05% 和8.37%)和芽孢杆菌属(2.56%和2.52%),说明KR和LL样品中的优势细菌属相同,但与GB样品存在明显差异。在相对丰度>1%条件下,GB样品有6个真菌属,分别是湿伞属(Hygrocybe,78.31%) 、产油菌属(Solicoccozyma,6.40%)、被孢霉属(Mortierella,2.84%)、毛壳菌属(Chaetomium,1.80%)、锥毛壳属(Coniochaeta,1.29%)和青霉菌属(Penicillium,1.16%);KR样品中有15个真菌属,其中能准确分类的有11个,分别是产油菌属(15.22%)、被孢霉属(10.83%)、赤霉菌属(Gibberella,7.74%)、寡囊盘菌属(Thelebolus,6.51%) 、蜡盘菌属(Rutstroemia,6.03%)、青霉菌属(3.83%)、枝孢瓶霉属(Cladophialophora,3.29%)、锥毛壳属(3.14%)、Knufia(2.20%)、Dactylonectria(1.70%)和外瓶柄霉属(Exophiala,1.28%);LL样品中有15个真菌属,其中能准确分类的有9 个,分别是Montagnula(14.75%)、被孢霉属(7.17%)、背芽突霉属(Cadophora,6.13%)、枝孢瓶霉属(5.62%)、瓶霉属(Phialophora,4.19%)、镰刀菌属(Fusarium,2.95%)、Knufia(2.73%)、产油菌属(2.32%)和锥毛壳属(1.92%)。以上结果表明,不同种源地甘青青兰根际土壤优势真菌属存在明显差异。
2.5 样品微生物β 多样性分析
为了分析不同样品间根际土壤细菌和真菌群落结构组成差异,对甘青青兰根际土壤微生物进行基于非加权组平均法(unweighted pair groupmethod with arithmetic mean,UPGMA)的样本层级聚类和主成分分析(principal component analysis,PCA),结果如图6和图7所示。由图6可知,每个地区根际土壤细菌和真菌单独聚为1个类群,相对而言,KR和LL样品距离较近。由图7可知,主成分1(PC1)和主成分2(PC2)对根际土壤细菌的差异贡献率分别为33.09% 和26.08%,累计贡献率为59.17%;对根际土壤真菌的差异贡献率分别为87.64%和9.2%,累计贡献率为96.84%,能较好地区分不同地区甘青青兰根际土壤样品,说明不同地区甘青青兰根际土壤细菌和真菌群落结构组成差异较大。
2.6 样品微生物核心菌群分析
甘青青兰根际土壤细菌和真菌在属分类水平韦恩图见图8。由图8可知,甘青青兰根际土壤细菌共注释到492个属,其中核心细菌菌群有257个属,占总细菌属的52.24%,能准确分类的核心细菌菌群有133个属;甘青青兰根际土壤真菌共注释到387个属,其中核心真菌菌群有102个属,占总真菌属的26.36%,能准确分类的核心真菌菌群有72个属。
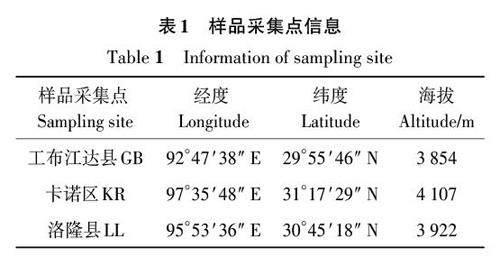
为了分析根际土壤理化因子与核心微生物菌群间的相互关系,基于Pearson算法对根际土壤理化因子与相对丰度前20的核心微生物菌群进行相关性分析,结果如图9所示。TK和AK与红游动菌属(Rhodoplanes)、Gaiella 属和假诺卡氏菌属(Pseudonocardia)等8个属的相对丰度呈显著正相关,而与芽孢杆菌属(Bacillus)、膨胀芽孢杆菌属、短芽孢杆菌属、链霉菌属(Streptomyces)和类芽孢杆菌属(Paenibacillus)的相对丰度呈显著负相关;SOM 与红游动菌属、Gaiella 和假诺卡氏菌属等8个属的相对丰度呈显著正相关,而与芽孢杆菌属、链霉菌属和假诺卡氏菌属的相对丰度呈显著负相关;TP 与假诺卡氏菌属、微小杆菌属(Microvirga)、芽球菌属(Blastococcus)和节杆菌属(Arthrobacter)的相对丰度呈显著正相关,而与固定杆菌属(Conexibacter)和慢生根瘤菌属(Bradyrhizobium)的相对丰度呈显著负相关;AP和pH与微小杆菌属和芽球菌属的相对丰度呈显著正相关,而与固定杆菌属呈显著负相关;TN和AN与假诺卡氏菌属、芽球菌属和节杆菌属等呈显著正相关,而与固定杆菌属、 慢生根瘤菌属和类芽孢杆菌属等呈显著负相关。锤舌菌属(Leohumicola) 、Fusicolla、乳突赤壳属(Thelonectria)、锥毛壳属和外瓶柄霉属与AP、pH、TN、TP和AN呈显著正相关;枝孢瓶霉属、Knufia和异茎点霉属(Paraphoma)与TK、AK 和SOM 呈显著正相关;镰刀菌属、瓶霉属和背芽突霉属与TK 和SOM 呈显著正相关;湿伞属与AK、SOM、TK、TN和AN呈显著负相关;毛壳菌属与AK、TK、和AN呈显著负相关。以上结果表明,根际土壤理化性质影响根际土壤核心微生物菌群的相对丰度。
2.7 根际土壤微生物多样性指数与土壤理化因子的相关性分析
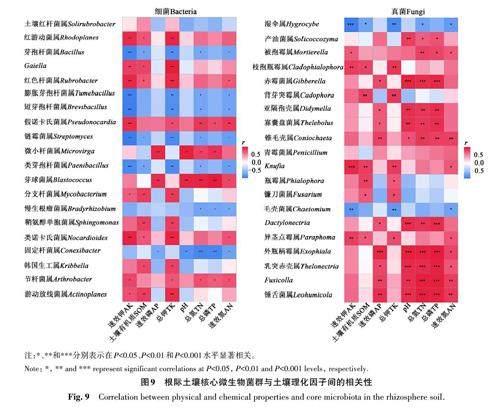
由图10可知,AK、TP、TN 和AN 与根际土壤细菌的Chao1指数、香农指数和Shannoneven均匀度指数呈显著正相关;TK与根际土壤细菌的香农指数和Shannoneven 均匀度指数呈显著正相关;pH与根际土壤细菌的Chao1指数呈显著正相关;辛普森指数与根际土壤的TK、AK、TN和AN含量呈显著负相关。根际土壤真菌的香农指数和Shannoneven均匀度指数与TK、AK、TN和AN含量呈显著正相关;Chao1 指数与AP、pH、TN、TP 和AN 呈显著正相关;辛普森指数与AK、SOM、TK、TN和AN呈显著负相关。以上结果表明,根际土壤中AK、TK、TP、TN和AN含量是影响甘青青兰根际土壤微生物群落多样性的重要因子。
3 讨论
微生物作为根际土壤物质循环和能量转换的主要驱动因子,在植物根际土壤微生态中发挥重要作用。植物类型及根际土壤理化因子在很大程度上影响根际土壤微生物群落的结构组成。研究表明,土壤pH、TK、TN、AN、TP和AP是影响喜马拉雅紫茉莉根际土壤细菌群落组成和多样性的重要因子[19]。魏艳晨等[18]研究表明,土壤养分含量、pH和含水率影响珍珠猪毛菜根际土壤细菌多样性。李茜等[21]研究发现,根际土壤理化性质与不同栽培年限人参根际土壤细菌群落结构的改变关系密切。李毳等[22‐23]研究发现,土壤环境因子和植物种类是影响药用植物根际土壤微生物群落结构组成和多样性的重要因素。本研究表明,3个种源地甘青青兰根际土壤理化性质及根际土壤微生物多样性存在显著差异,且根际土壤的AK、TK、TP、TN和AN含量是影响甘青青兰根际土壤微生物群落多样性的重要因子。Burns等[24]研究发现,植物种类、土壤理化因子和空间因素对土壤微生物群落多样性有显著影响。综上所述,根际土壤理化因子和空间因素是导致不同地区甘青青兰根际土壤微生物群落多样性差异的关键因素。
3个地区甘青青兰根际土壤的优势细菌类群是放线菌门、变形菌门、厚壁菌门和绿弯菌门。研究表明,土壤优势细菌类群主要集中在变形菌门、放线菌门和厚壁菌门等10个门[25],与本研究结果一致。放线菌作为一类重要的生防菌,能产生多种抗生素,进而增强植物的抗病能力[26];变形菌门和厚壁菌门具有固氮、土壤修复和物质降解等功能,有助于提高药用植物的质量和抗逆境能力[27‐28]。这3个菌门的细菌在甘青青兰根际土壤中的富集可能参与了甘青青兰的生长发育、抗逆和药用成分合成等。李洁等[29]研究表明,白首乌根际土壤中的优势真菌门是子囊菌门、被孢霉门、担子菌门、球囊菌门(Glomeromycota)、类原生动物门(Rozellomycota)和梳霉门(Kickxellomycota),与本研究结果存在差异。本研究结果表明,子囊菌门和担子菌门是甘青青兰根际土壤中的优势真菌门,说明植物类型是影响根际土壤真菌类型的关键因素。研究表明,子囊菌门和担子菌门是参与土壤有机质分解的主要真菌群落,且与植物根际氮循环、植物菌根形成及植物生长发育息息相关[30]。由此说明,子囊菌门和担子菌门的富集有助于甘青青兰的生长发育。
本研究结果表明,在属水平,3个地区的甘青青兰根际土壤优势微生物菌群差异明显,这与样本层级聚类和主成分分析结果一致,说明土壤环境因子和气候类型等因素是影响根际土壤微生物群落组成的关键因素[24]。核心微生物菌群是一类影响宿主健康和生态系统功能的关键物种,在植物生长发育和物质代谢调控中发挥重要作用[31]。本研究将3个地区甘青青兰根际土壤中共有的微生物确定为核心菌属,从根际土壤微生物种类和分布规律来看,甘青青兰根际土壤核心细菌菌群种类明显多于核心真菌类群。芽孢杆菌属、假诺卡氏菌属、链霉菌属、慢生根瘤菌属、鞘氨醇单胞菌属和节杆菌属等是甘青青兰根际土壤细菌中的核心菌属;被孢霉属、赤霉菌属、背芽突霉属、亚隔孢壳属、青霉菌属、镰刀菌属和毛壳菌属等是根际土壤真菌中的核心菌属。研究表明,芽孢杆菌有促进植物生长和增加药用成分合成的作用[32‐33];假诺卡氏菌属中的许多成员能够产生抗生素、维生素和酶制剂活性物质[34];鞘氨醇单胞菌属能促进大豆的生长和抗渗透胁迫[35];节杆菌属和链霉菌属能增强植物的抗逆境胁迫[36‐39];被孢霉属具有产不饱和脂肪酸和抗植物病原菌的潜在功能;毛壳菌属在自然界中广泛存在,具有潜在生防功能[40];青霉菌属具有抑制植物病害的功效,并能促进樱桃和玉米等植物的生长[41‐42]。以上结果表明,甘青青兰根际土壤富含丰富的、具有潜在生物学功能的核心微生物菌群。根际土壤理化因子与根际土壤核心微生物菌群相关分析表明,根际土壤理化因子与核心微生物菌群存在一定程度的相关性,为甘青青兰的人工种植提供了理论依据。综上所述,甘青青兰根际土壤富含丰富的微生物资源,研究不同地区甘青青兰根际土壤微生物群落结构组成,分析核心微生物菌群与土壤理化因子间的相互关系,对充分挖掘益生微生物资源和指导甘青青兰人工种植具有重要理论意义。
参考文献
[1] 中华人民共和国卫生部药典委员会.卫生部药品标准·藏
药分册[M].北京:人民卫生出版社,1995.
[2] LI Q, LIU Y Q, HAN L F, et al .. Chemical constituents and
quality control of two Dracocephalum species based on highperformance
liquid chromatographic fingerprints coupled with
tandem mass spectrometry and chemometrics [J]. J. Separaton
Sci., 2016, 39(21):4075-4081.
[3] 左马怡,杨超,田倩,等. 青兰属植物甘青青兰化学成分研
究[J].云南民族大学学报(自然科学版),2015,24(2):101-103.
ZUO M Y, YANG C, TIAN Q, et al .. Chemical constituents of
Dracocephalum tanguticum Maxim. of genus Dracocephalum [J].
J. Yunnan Minzu Univ. (Nat. Sci.), 2015, 24(2):101-103.
[4] 刘建英,刘玉梅.青兰属植物的化学成分及药理作用研究进
展[J].食品科学,2012,33(13):314-319.
LIU J Y, LIU Y M. Research advance in chemical compositions
and pharmacological effects of Dracocephalum [J]. Food Sci.,
2012, 33(13):314-319.
[5] 谢建锋,朱林燕,孔子铭,等.唐古特青兰总黄酮的提取及其
体外抗氧化活性的研究[J]. 华西药学杂志,2015,30(4):
422-424.
XIE J F, ZHU L Y, KONG Z M, et al .. Study on the extraction
of total flavonoids from Dracocephalumn tanguticum and its
activity in vitro [J]. West China J. Pharm. Sci., 2015, 30(4):
422-424.
[6] 李永芳,李延斌,杨梅,等.唐古特青兰对低氧性肺动脉高压
大鼠ET-1和NO的影响[J].中成药,2016,38(10):2260-2262.
[7] YAO H, ZHOU L C, TANG L L, et al .. Protective effects of
luteolin-7-O-glucoside against starvation-induced injury
through upregulation of autophagy in H9c2 Cells [J]. Biosci.
Trends., 2017, 11(5):557-564.
[8] 胡君茹,姜华,李喜香.对藏药甘青青兰4种提取物抑菌作用
的研究[J].西部中医药,2014,27(6):10-12.
HU J R, JIANG H, LI X X. Study on antibacterial activity of four
kinds of extracts from Tibetan medicine Ganqing Qinglan [J].
Western. J. Tradition Chin. Med., 2014, 27(6):10-12.
[9] 杨毅,田侃,倪新兴,等.中药材品质影响因素实证研究[J].中
药材,2016,39(6):1251-1256.
[10] 罗守杨,田春杰,张加凡,等.根际微生物对药材道地性的影
响及应用前景展望[J].时珍国医国药,2022,33(4):948-950.
[11] CARDONE L, CASTRONUOVO D, PERNIOLA M, et al ..
Evaluation of corm origin and climatic conditions on saffron
(Crocus sativus L.) yield and quality [J]. J. Sci. Food Agric.,
2019, 99(13):5858-5869.
[12] 徐锦堂,郭顺星,范黎,等.天麻种子与小菇属真菌共生萌发
的研究[J].菌物学报,2001(01):137-141.
XU J T, GUO S X, FAN L, et al .. Symbiotic germination
between Gasterodia elata and fungal species of Mycena [J].
Mycosystema, 2001(01):137-141.
[13] KIM Y S, BALARAJU K, JEON Y. Biological characteristics
of Bacillus amyloliquefaciens AK‐0 and suppression of ginseng
root rot caused by Cylindrocarpon destructans [J]. J. Appl.
Microbiol., 2017, 122(1):166-179.
[14] EGAMBERDIEVA D, LI L, LINDSTROM K, et al .. A
synergistic interaction between salt-tolerant Pseudomonas and
Mesorhizobium strains improves growth and symbiotic
performance of liquorice (Glycyrrhiza uralensis Fish.) under salt
stress [J]. Appl. Microbiol. Biotechnol., 2016, 100(6):2829-2841.
[15] KHALEDIYAN N, WEISANY W, SCHENK P M. Arbuscular
mycorrhizae and rhizobacteria improve growth, nutritional
status and essential oil production in Ocimum basilicum and
Satureja hortensis [J/OL]. Ind. Crops Prod., 2020, 160:113163
[2022-08-10]. https://doi.org/10.1016/j.indcrop.2020.113163.
[16] RUI H R, CHEN Y L, PARE P W, et al .. Beneficial soil
microbe promotes seed germination, plant growth and
photosynthesis in herbal crop Codonopsis pilosula [J]. Crop
Pasture Sci., 2016, 67(1):91-98.
[17] ARORA M, SAXENA P, CHOUDHARY D K, et al .. Dual
symbiosis between Piriformospora indica and Azotobacter
chroococcum enhances the artemisinin content in Artemisia
annua L. [J]. World J. Microbiol. Biotechnol., 2016, 32(2):1-10.
[18] 魏艳晨,陈吉祥,王永刚,等.荒漠植物珍珠猪毛菜根际土壤
细菌多样性与土壤理化性质相关性分析[J].中国农业科技
导报,2022,24(5):209-217.
WEI Y C, CHEN J X, WANG Y G, et al .. Analysis of bacterial
diversity in the rhizosphere soil of Salsola passerina and its
correlation with the soil physical and chemical properties [J]. J.
Agric Sci Technol., 2022, 24(5):209-217.
[19] 张二豪,赵润东,禄亚洲,等.不同种源地喜马拉雅紫茉莉根
际土壤理化性质及细菌群落结构组成分析[J].山东农业科
学,2022,54(4): 82-89.
ZHANG E H, ZHAO R D, LU Y Z, et al .. Soil physiochemical
properties and microbial community structure of mirabilis
himalaica rhizosphere from different provenances [J].
Shandong Agric Sci., 2022, 54(4): 82-89.
[20] 鲍士旦.土壤农化分析 [M].第2版.北京:中国农业出版社,
1999:34-108.
[21] 李茜,徐瑞蔓,陈迪,等.不同栽培年限人参根际土壤细菌群
落与土壤理化性质和酶活性的相关性[J].植物营养与肥料
学报,2022,28(2):313-324.
L X, XU R M, CHEN D, et al .. Correlation of bacterial
community with soil physicochemical properties and enzyme
activities in rhizosphere soil under different cultivation years of
Ginseng (Panax ginseng C. A. Mey.) [J]. J. Plant Nutr. Fert.,
2022, 28(2):313-324.
[22] 李毳,刘怡,刘晋仙.药用植物根际细菌群落多样性驱动因素
分析[J].生态环境学报,2020,29(10):1988-1993.
LI C, LIU Y, LIU J X. Analysis of driving factors of rhizosphere
bacterial community diversityin three genuine medicine plants [J].
Ecol. Environ. Sci., 2020, 29(10):1988-1993.
[23] 李毳,刘怡.晋东南3种道地药材植物根际真菌群落特性[J].
生态环境学报,2019,28(7):1388-1393.
LI C, LIU Y. Characteristics of rhizosphere fungal community
of three genuine medicinal plants in southeast Shanxi province
[J]. Ecol. Environ. Sci., 2019, 28(7):1388-1393.
[24] BURNS J H, ANACKER B L, STRAUSS S Y, et al .. Soil
microbial community variation correlates most strongly with
plant species identity, followed by soil chemistry, spatial
location and plant genus [J]. AoB Plants, 2015, 7(3):207-240.
[25] PHILIPPOT L, ANDERSSON S G E, BATTIN T J, et al .. The
ecological coherence of high bacterial taxonomic ranks [J]. Nat.
Rev. Microbiol., 2010, 8(7):523-529.
[26] MENENDEZ E, CARRO L. Actinobacteria and their role as
plant probiotics//giri b, prasad r, wu qs, varma a. biofertilizers
for sustainable agriculture and environment [J]. Biofert. Sust.
Agric. Environ., 2019, 55:333-351.
[27] 宋兆齐,王莉,刘秀花,等.云南4处酸性热泉中的变形菌门细
菌多样性[J].河南农业大学学报,2016,50(3):376-382.
SONG Z Q, WANG L, LIU X Y, et al .. The diversities of
proteobacteria in four acidic hot springs in Yunnan [J]. J.
Henan Agric. Univ., 2016, 50(3):376-382.
[28] 郭凤仙,刘越,唐丽,等.药用植物根际微生物研究现状与展
望[J].中国农业科技导报,2017,19(5):12-21.
GUO F X, LIU Y, TANG L, et al .. Research status and
prospect on rhizosphere microbiome of medicinal plants [J]. J.
Agric. Sci. Technol., 2017, 19(5):12-21.
[29] 李洁,林莹,徐美玉,等.泰山白首乌根际土壤真菌多样性分
析[J].中国农业科技导报,2022,24(6):70-81.
LI J, LIN Y, XU M Y, et al .. Sequencing analysis of fungal
diversity in rhizosphere soil of Cynanchum bungei Decne [J]. J.
Agric. Sci. Technol., 2022, 24(6):70-81.
[30] YELLE D J, RALPH J, LU F, et al .. Evidence for cleavage of
lignin by a brown rot basidiomycete [J]. Environ. Microbiol.,
2010, 10(7):1844-1849.
[31] 许国琪,刘怡萱,曹鹏熙,等. 青藏高原冰川棘豆(Oxytropis
glacialis)内生菌核心微生物组的界定及其互作网络分析[J].
微生物学通报,2020,47(9):2746-2758.
XU G Q, LIU Y X, CAO P X, et al .. Core microflora and
endophytic interaction network of Oxytropis glacialis in Qinghai-
Tibet plateau [J]. Microbiol. China, 2020, 47(9):2746-2758.
[32] LIU Y H, WEI Y Y, MOHAMAD O, et al .. Diversity,
community distribution and growth promotion activities of
endophytes associated with halophyte Lycium ruthenicum
Murr [J/OL]. 3 Biotech., 2019, 9(4):144 [2022-08-10]. https://
doi.org/10.1007/s13205-019-1678-8.
[33] SONG X, WU H, YIN Z, et al.. Endophytic bacteria isolated from
panax ginseng improves ginsenoside accumulation in adventitious
ginseng root culture [J/OL]. Molecules, 2017, 22(6):837 [2022-08-
10]. https://doi.org/10.3390/molecules22060837.
[34] 吕志堂,刘志恒.假诺卡氏菌科的分类学研究进展[J].微生
物学通报,1999(3):210-215.
[35] ASAF S, KHAN A L, KHAN M A, et al .. Osmoprotective
functions conferred to soybean plants via inoculation with
Sphingomonas sp. LK11 and exogenous trehalose [J/OL].
Microbiol. Res., 2017:135 [2022-08-10]. https://doi.org/10.1016/
j.micres.2017.08.009..
[36] NIU X G, SONG L C, XIAO Y N, et al .. Drought-tolerant plant
growth-promoting rhizobacteria associated with foxtail millet in
a semi-arid agroecosystem and their potential in alleviating
drought stress [J/OL]. Front. Microbiol., 2018, 8:2580 [2022-
08-10]. https://doi.org/10.3389/fmicb.2017.02580.
[37] DIAS M P, BASTOS M S, XAVIER V B, et al .. Plant growth
and resistance promoted by Streptomyces spp. in tomato [J].
Plant Physiol. Biochem., 2017, 118(9):479-493.
[38] 金航. 丝状真菌被孢霉生长群体感应的初步研究[D].武汉:
华中科技大学,2016.
JIN H. A preliminary research on the quorum-sensing of
filamentous Mortierella [D]. Wuhan: Huazhong University of
Science and Technology, 2016.
[39] 于帮红,徐慧,张传博.一株冬虫夏草来源真菌的鉴定及抑菌
活性检测[J].中国实验方剂学杂志,2016,22(8):36-40
YU B H, XU H, ZHANG C B. Identification of fungi from
Cordyceps sinensis and its antibacterial activity [J]. Chin. J.
Exp. Tradit. Med. Form., 2016, 22(8):36-40.
[40] 黄晓丽.毛壳菌(Chaetomium spp.)生防菌株的筛选及其生物
防治机制研究[D].雅安:四川农业大学,2009.
HUANG X L. Screens biocontrol strains from Chaetomium spp.
and studies on biocontrol mechanisms of Chaetomium spp. [D].
Yaan: Sichuan Agricultural University, 2009.
[41] LIU X, CUI X, JI D, et al .. Luteolin-induced activation of the
phenylpropanoid metabolic pathway contributes to quality
maintenance and disease resistance of sweet cherry [J/OL].
Food Chem., 2020, 342(1): 128309 [2022-08-10]. https://doi.
org/10.1016/j.foodchem.2020.128309.
[42] WANG X Y, ZHANG X H, YANG M X, et al.. Multi-Site
evaluation of accumulated temperature and rainfall for maize yield
and disease in Loess plateau [J/OL]. Agriculture, 2021, 11(4):373
[2022-08-10]. https://doi.org/10.3390/agriculture11040373.
(责任编辑:张冬玲)
