混合盐碱胁迫对骏枣叶片结构和光合荧光特性的影响
2024-06-16闫敏王艳王程成郭松超卢登洋吴翠云
闫敏 王艳 王程成 郭松超 卢登洋 吴翠云

摘要:为进一步探究骏枣对混合盐碱胁迫的生理响应机制,在骏枣盛果期分别设计0、60、120、180、240、300 mmol·L-1的NaCl和NaHCO3混合盐溶液来模拟土壤盐碱复合胁迫环境,分析不同胁迫水平下骏枣叶片的显微结构、超微结构及光合、荧光参数的变化。结果表明,在混合盐碱胁迫下,骏枣叶片的厚度、角质层厚度、表皮厚度和栅栏组织厚度均随着胁迫水平的增加呈先上升后下降趋势;海绵组织厚度和细胞结构疏松度呈逐渐下降趋势。在混合盐溶液高于180 mmol·L-1时,叶绿体内的嗜锇颗粒数量明显增多,且体积变大,基质片层结构松散;同时,随着胁迫水平的增加,叶片的净光合速率、气孔导度与蒸腾速率逐渐降低,胞间CO2浓度升高,光合限制以非气孔因素为主。在240、300 mmol·L-1高胁迫水平处理下,叶片初始荧光(F0)显著升高,而最大荧光(Fm)、Fv/Fm、Fv/F0显著降低,单位反应中心吸收的光能(ABS/RC)、用于还原QA的能量(TRo/RC)、热耗散的能量(DIo/RC)均呈先下降后上升趋势,而用于电子传递的能量呈持续下降趋势。综上,较高水平的盐碱胁迫会使骏枣叶片的超微结构发生明显变化,抑制其光合能力,使嗜锇小体增多、变大,并出现淀粉粒。以上结果为深入研究枣的耐盐机制提供了理论基础。
关键词:混合盐碱胁迫;枣;显微结构;超微结构;光合日变化;荧光参数
doi:10.13304/j.nykjdb.2022.0865
中图分类号:S665.1 文献标志码:A 文章编号:1008‐0864(2024)03‐0057‐09
土壤盐碱化是长期制约植物生长发育的主要逆境之一,植物在盐碱化环境下首先遭受渗透胁迫,然后造成离子毒害,继而引起细胞膜脂过氧化及一系列生理代谢的紊乱等,使植株生长缓慢、叶片黄化,严重影响品质和产量,甚至造成植株死亡[1-3]。枣具有较强的耐盐碱性和适应性,目前已成为新疆盐碱地区栽培的支柱性林果产业之一[4]。然而,严重的土壤盐碱化是限制南疆枣树生长和品质发育的主要因素[5]。因此,研究枣的耐盐碱机理对于提高其耐盐性具有重要意义。
研究表明,盐碱胁迫不仅影响植株生长,也会诱导植物内部结构发生一定变化,其叶片一般具有发达的微管组织和泡状细胞的结构特征,也会呈现叶片肉质化、叶片厚度增加、栅栏组织的层数增加、气孔下陷等现象[6-8]。叶绿体对盐碱变化尤为敏感,在高水平盐碱胁迫下,叶绿体会发生质壁分离、基粒结构消失、类囊体肿胀、嗜锇颗粒聚集成堆等现象[9‐10]。光合作用将光能转变为化学能,主要依赖于光系统Ⅰ(photosystemⅠ,PSⅠ)和光系统Ⅱ(photosystemⅡ,PSⅡ),盐碱胁迫下,PSⅡ反应中心受到损伤,植株的光合作用受到抑制[11-13]。也有研究认为在非光抑制条件下植物PSⅡ对盐碱胁迫并不敏感[14]。不过在盐胁迫与强光胁迫共同发生时,PSⅡ会快速失去活性[15]。研究表明,光合下降可能是气孔限制或非气孔限制[16‐17]。气孔因素导致的光合速率下降主要是由于气孔导度下降或气孔关闭,导致二氧化碳摄入不足,例如,在低水平盐胁迫下小麦光合速率的下降主要是由气孔限制引起[18]。非气孔因素是通过改变光系统和碳同化过程关键酶活性的方式来影响光合作用,比如,盐胁迫使黄瓜和野生大豆光合作用降低就是非气孔限制引起的[19‐20]。
目前,关于混合盐碱胁迫下枣光合荧光特性和叶片结构的研究报道较少。因此,本研究以南疆主栽品种骏枣为试验材料,选用NaCl 和NaHCO3混合溶液来模拟盐碱胁迫,研究不同水平混合盐碱处理对其叶片结构及光合、荧光参数的影响,以期阐明骏枣响应混合盐碱胁迫的结构基础,为深入研究骏枣耐盐碱机制提供一定的理论基础和科学依据。
1 材料与方法
1.1 试验地点与材料
试验地位于新疆生产建设兵团第一师十团七连(40°58′N、81°28′E),光热资源丰富。试验树为10 a 生骏枣树,以酸枣为砧木,株行距1.5 m×3.0 m,树高2.0~2.5 m,冠幅1.8~2.2 m,树形为开心形。胁迫处理前,在各处理的行间挖90 cm深的长沟,四周及底部铺双层塑料薄膜隔离,以防止处理间相互渗透影响,并于上方设有两侧通风的塑料遮雨棚。胁迫处理前控制灌水,以利于滴灌的盐碱溶液迅速扩散。
1.2 试验设计
试验采用单因素完全随机设计,依据阿拉尔垦区枣园盐碱土壤特点,以中性盐NaCl 和碱性盐NaHCO3按摩尔比3∶1混合,分别设计60(T60)、120(T120)、180(T180)、240(T240)和300 mmol·L-1(T300)共6个混合盐碱胁迫处理,以清水为对照(CK)。于2021年7月1日,选取长势一致的骏枣植株开始胁迫处理,每个处理15株枣树。为防止发生盐激伤害,盐碱溶液从各处理的1/2开始加入,每2 d递增1次梯度,2次后累计达到设定水平,至7月4日全部处理达到设定盐碱胁迫水平时开始计算胁迫时间,7月24日补充浇灌盐碱溶液1次。
于胁迫处理40 d后,在晴天(8月16日)各处理分别选取长势、大小基本一致且无病虫害的3株枣树,每株枣树随机从树冠中上部外围选取枣吊中部生长成熟的3张向阳面叶片做好标记,用于光合参数和荧光参数的测定。测定光合参数后的叶片立即带回实验室,洗净擦干,于靠近叶脉基部1/3处取材(2 mm×2 mm),置于FAA 固定液(百奥莱博)中24 h后用于制作石蜡切片;另避开叶片主脉,在4 ℃、2.5%戊二醛溶液中固定24 h,用于透射电子显微镜(日立)检测。
1.3 测定项目及方法
1.3.1 叶片显微结构测定 取固定好的叶片,经70%乙醇(24.0 h以上)→85%乙醇(2.0 h)→95%乙醇(2.0 h)→无水乙醇(2.0 h)→无水乙醇(1.5 h)脱水,再经过1/3 二甲苯+2/3 无水乙醇(1.5~2.0h)→1/2 二甲苯+1/2 无水乙醇(1.5~2.0 h)→纯二甲苯(1.5 h)→纯二甲苯(1.5 h)透明,将处理好的材料置于石蜡中,42 ℃烘箱中敞口过夜,用石蜡包埋完全凝固,切片机(YD-335,金华益迪)切片,横切片厚度8 μm,烘干完全后用二甲苯脱蜡,1%番红和0.5% 固绿染色后,使用荧光显微镜(BX53,OLYMPUS)测微尺测量叶片的角质层、上下表皮、栅栏组织和海绵组织厚度及主脉厚度、叶片厚度,并拍照。每处理观测30个视野,取平均值。计算叶片结构的紧密度和疏松度。
1.3.2 叶片超微结构测定 在2.5%戊二醛溶液中4 ℃固定24 h以上,0.1 mol·L-1磷酸缓冲液(pH7.0)漂洗3次,每次15 min;1%锇酸后固定2 h,再次重复磷酸缓冲液漂洗步骤;之后用30%、50%、70%、80%、90%、95%、无水乙醇逐级脱水30 min;最后用 EPON812 环氧树脂浸透、包埋、聚合,用莱卡EMUC6 超薄切片机切片(厚度为70~90 nm)。将切片收集到镍网上,经醋酸铀、柠檬酸铅双重染色后,利用日立H-600透射电镜进行观察、拍片。
1.3.3 叶片光合特性测定 于10:00—20:00,采用LI-6400便携式光合作用仪测定叶片光合参数。各处理分别选取长势基本一致的3株枣树,在树冠外围中上部枝条选取枣吊中部向阳、健康、成熟的叶片做好标记,每株3片。测定时保持叶片的叶倾角和方位角不变,每个叶片计数3次,每隔2h 测定1 次。测定净光合速率(net photosyntheticrate,Pn)、蒸腾速率(transpiration rate,Tr)、胞间CO2 浓度(intercellular CO2 concentration,Ci)和气孔导度(stomatal conductance,Gs),计算水分利用效率(water use efficiency,WUE)。
1.3.4 叶片荧光参数测定 叶绿素荧光参数测定与光合参数测定日期保持一致。于10:00—13:00,用便携式调制叶绿素荧光仪MP-100测定做好标记叶片的基本荧光参数。测定前暗处理30 min,测定初始荧光(initial fluorescence,Fo)、最大荧光(maximum fluorescence, Fm)、光系统Ⅱ的潜在活性(Fv/Fo)、最大光化学效率(Fv/Fm)及PSⅡ反应中心的4个活性参数,包括单位反应中心吸收的光能(ABS/RC)、单位反应中心捕获的用于还原QA 的能量(TRo/RC)、单位反应中心热耗散的能量(DIo/RC)、单位反应中心捕获的用于电子传递的能量(ETo/RC)。
1.4 数据处理与统计分析
采用Microsoft Excel 2007 整理数据,用DPS7.55软件进行统计分析,用Duncans 新复极差法检验差异显著性,利用Graphpad prism 8绘图。
2 结果与分析
2.1 混合盐碱胁迫对骏枣叶片显微结构的影响
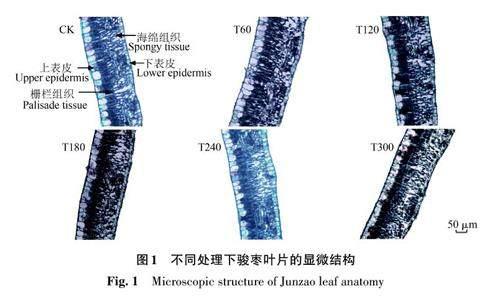
如图1所示,CK处理的骏枣叶片具有蜡质角质层;上、下表皮细胞均呈不规则的长椭圆形,由单层薄壁细胞紧密排列组成,与上表皮细胞相比,下表皮细胞较小;栅栏组织细胞呈不规则长柱形,排列紧密,海绵组织细胞形状不规则,排列疏松。在混合盐碱胁迫下,叶片角质层增厚,表皮细胞除整体变薄外,细胞形状无规则,排列紧密,海绵组织细胞变短,细胞间隙变大,且随胁迫水平的增加,这种变化更加明显。
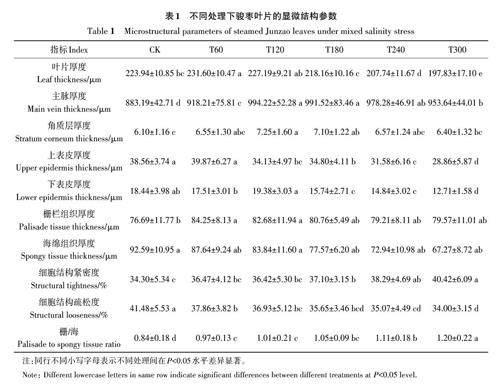
由表1可知,随着胁迫水平的增加,叶片厚度、主脉厚度、角质层厚度、表皮厚度和栅栏组织厚度均呈先上升后下降的趋势;栅栏组织厚度与海绵组织厚度的比值以及细胞结构紧密度呈逐渐上升趋势;海绵组织厚度和细胞结构疏松度呈逐渐下降趋势。其中,T240 和T300 处理的叶片厚度较CK显著降低7.23%和11.66%。与CK相比,盐碱处理组叶片的主脉厚度和角质层厚度分别增加3.97%~12.57%和4.94%~18.78%,海绵组织厚度降低5.35%~27.34%;T180和T300处理的上、下表皮厚度分别较CK 显著降低9.75%~25.14% 和14.64%~31.08%;T60和T120处理的下栅栏组织厚度较CK显著增加9.86%和7.81%。
2.2 混合盐碱胁迫对骏枣叶片超微结构的影响
不同处理下骏枣叶片超微结构如图2所示。CK处理叶肉细胞中叶绿体呈长椭圆形,叶绿体被膜紧贴细胞壁,基粒片层结构整齐排列,且叶绿体中的淀粉粒和嗜锇颗粒数量较少,体积较小,线粒体清晰可见,呈较规则的球状或椭圆状(图2A和B)。在低水平胁迫(T60和T120)下,叶肉细胞及叶绿体整体结构仍较为规整,叶绿体内淀粉粒和嗜锇颗粒数量增多,体积较大(图2C~F)。T180处理的嗜锇颗粒在叶绿体中集聚成堆出现(图2G 和H)。随着胁迫水平的持续增加,叶绿体外膜开始变得逐渐模糊不清,基粒和基质片层界限模糊不清,结构松散,类囊体排列出现紊乱、扭曲的现象(图2I~L)。T300处理的叶绿体开始发生严重的膨胀、变形,淀粉粒只有少量可见(图2K和L)。在混合盐碱胁迫下,线粒体结构虽大小不一,出现极少数空泡现象(图2J),但未发生明显的破裂。
2.3 混合盐碱胁迫对骏枣光合日变化的影响
如图3所示,CK与盐碱处理组叶片净光合速率(Pn)、蒸腾速率(Tr)和气孔导度(Gs)的日变化均呈单峰型曲线,且均在14:00—16:00出现最高峰;各处理的胞间CO2浓度(Ci)均成不规则的“W”形,呈现上午和晚间高、中午低的现象;水分利用效率(WUE)从10:00—14:00呈迅速下降趋势,14:00—20:00趋于平缓。
随着胁迫水平的增加,Pn 整体呈下降趋势,14:00时降幅明显,T60处理的Pn较CK显著降低9.47%~28.43%。在10: 00—18: 00,T180、T240、T300 处理的Tr 和Gs 均较CK 显著降低17.34%~55.29%和17.34%~55.29%。在18:00之前,T300处理的Ci显著高于CK;在18:00时,各处理的Ci下降至最低谷,之后有缓慢起伏,尤其是T240处理增幅明显。在14:00前,T300处理的WUE增幅明显。
2.4 混合盐碱胁迫对骏枣叶绿素荧光参数的影响
由图4可知,随着盐碱胁迫水平的增加,初始荧光(Fo)呈先小幅度下降后上升趋势,而最大荧光(Fm)、最大光化学效率(Fv/Fm)、潜在光化学效率(Fv/Fo)均呈现先上升后下降趋势。T240、T300处理的Fo 较CK 分别显著提高12.10%、24.77%。与CK 相比,T60 处理的Fm 显著提高10.48%;而T240、T300 处理的Fm 显著降低10.70%、12.92%。T240和T300处理的Fv/Fm、Fv/Fo较CK分别显著降低12.67%~15.15%、25.99%~32.50%。
2.5 混合盐碱胁迫对骏枣PSⅡ反应中心活性的影响
从图5可知,随着盐碱胁迫水平的增加,骏枣叶片单位反应中心吸收的光能(ABS/RC)、用于还原QA的能量(TRo/RC)、热耗散的能量(DIo/RC)整体均呈先下降后上升趋势,且均在T120处理下达到最低值;而用于电子传递的能量(ETo/RC)呈持续下降趋势。在180~300 mmol·L-1 高盐碱处理下ABS/RC、TRo/RC 分别较CK 显著增加15.77%~48.76%、5.91%~20.84%。与CK相比较,DIo/RC在T120处理下显著降低45.18%;在T240处理下显著升高29.74%。盐处理组的ETo/RC较CK显著降低11.83%~38.67%。
3 讨论
盐碱胁迫对植物水分和养分的吸收、积累及分布均会产生影响,从而引发植物的形态发生变化,这是植物在逆境中的自我保护机制[21]。在一定水平的混合盐碱胁迫下,骏枣为适应胁迫环境,其叶肉细胞的细胞壁与细胞质膜以及叶绿体和线粒体结构发生较大改变,与冯帆[22]研究结果一致。本研究表明,随着胁迫水平的增加,骏枣叶片细胞质膜开始褶皱,或在细胞质膜周围突起形成小泡,这种现象的发生与张慧芳等[23]在唐古特白刺的研究结果一致,出现这种现象的原因可能是为了减小失水面积,防止叶片过度脱水造成的细胞损伤。赵曼容等[24]发现,嗜锇颗粒是脂类物质聚集的结果,嗜锇颗粒和淀粉粒的增加一方面提高了渗透压,保证了水和无机盐类的吸收;另一方面弥补了因胁迫造成的能量供应不足。除此之外,嗜锇颗粒的增加还可以提供脂质供膜更新,以保持膜结构的完整性,使修复与损伤达到动态平衡,从而抵御胁迫[25]。本研究表明,随着盐碱胁迫水平的增加,骏枣叶片叶绿体中的嗜锇颗粒和淀粉粒数量较CK增多,体积变大,这表明骏枣对混合盐碱胁迫有较强的适应能力;另外,随着胁迫水平的持续增加,线粒体结构仍较完整,未发生明显变化,这与马晓蓉等[26]在宁夏枸杞中的研究结果一致,说明线粒体对盐逆境的敏感性低于叶绿体。
研究表明,盐碱胁迫对植物Pn、Gs与Tr具有一定的抑制作用[27‐28]。本研究显示,在0~180 mmol·L-1混合盐碱处理下,Pn的最高峰出现在14:00;在240和300 mmol·L-1 处理下,Pn 在16:00达到峰值;随着胁迫水平的增加,Pn、Gs整体呈下降趋势,而Ci呈上升趋势,说明在混合盐碱胁迫下骏枣叶片的净光合速率降低是由非气孔因素引起的,如叶绿素含量降低、叶面积减小、光合酶受损等。束靖等[29]研究发现,低盐胁迫下(0~51 mmol·L-1 NaCl)樱桃幼苗光合能力的下降是由于气孔限制;而高盐胁迫下(86~120 mmol·L-1)是由于非气孔限制。张潭等[30]研究表明,碱胁迫对枸杞光合能力的抑制作用比盐胁迫更强。可见,不同植物的光合特性对盐胁迫的响应不同,这可能与植物的遗传特性及胁迫的盐类型等都紧密相关。
研究表明,在正常环境下,大部分枣类植株的Pn 日变化通常呈现“双峰型”,且在12:00—14:00具有明显的“午休”现象[31‐32];但也有研究表明,伏脆蜜和毛叶枣叶片的Pn呈“单峰型”曲线[33‐34]。本研究表明,骏枣叶片在CK和盐碱处理的Pn 日变化均呈单峰型曲线。研究表明,遮阴处理(透光率为10%和15%)会打破骏枣叶片“午休”[35]。因此,推测本研究中CK处理Pn日变化呈“单峰型”曲线是由于防雨棚造成轻度遮阴所致。
参 考 文 献
[1] 赖小连,颜玉娟,颜立红.NaCl胁迫对黄檀幼苗生长及生理特
性的影响[J].植物生理学报,2020,56(2):309-316.
LAN X L, YAN Y J, YAN L H. Effects of NaCl stress on the
growth and physiological characteristics of seedlings of
Pterocarpus indicus [J]. Plant Physiol. J., 2020, 56(2):309-316.
[2] 王志强,吴翠云,杨哲,等.盐碱胁迫对酸枣幼苗生长及生理
生化特性的影响[J].干旱地区农业研究,2018,36(2):153-160.
WANG Z Q, WU C Y, YANG Z, et al .. Effects of saline-alkali
stress on growth, physiological and biochemical characteristics
of wild jujube seedlings [J]. Agric. Res. Arid Areas, 2018,
36(2):153-160.
[3] 闫敏,王艳,鲍荆凯,等.混合盐碱胁迫对骏枣渗透调节物质
和抗氧化酶活性的影响[J].山东农业科学,2022,54(5):37-43.
YAN M, WANG Y, BAO J K, et al .. Effects of mixed salinealkali
stress on osmotic regulation substances and antioxidant
enzymes activities of Ziziphus jujube cv. Junzao [J]. Shandong
Agric. Sci., 2022, 54(5):37-43.
[4] 吴翠云,常宏伟,林敏娟,等.新疆枣产业发展现状及其问题
探讨[J].北方果树,2016(6):41-44.
WU C Y, CHANG H W, LIN M J, et al .. Discussion on the
development status of Xinjiang date industry and its problems
[J]. North Fruit, 2016(6):41-44.
[5] 柳维扬,蒋学玮,曹琦,等.盐胁迫对南疆滴灌枣园红枣生长
的影响[J].北方园艺,2018(1):67-71.
LIU W Y, JIANG X W, CAO Q, et al .. Effect of salt stress on
growth in drip irrigation yard in Southern Xinjiang [J]. North
Hortic., 2018(1):67-71.
[6] ZHU Y F, WU Y X, HU Y, et al .. Tolerance of two apple
rootstocks to short-term salt stress: focus on chlorophyll
degradation, photosynthesis, hormone and leaf ultrastructures [J].
Acta Physiol. Plantarum, 2019, 41(6):87-90.
[7] 罗达,吴正保,史彦江,等.盐胁迫对3种平欧杂种榛幼苗叶片
解剖结构及离子吸收、运输与分配的影响[J]. 生态学报,
2022,42(5):1876-1888.
LUO D, WU Z B, SHI Y J, et al .. Effects of salt stress on leaf
anatomical structure and ion absorption, transportation and
distribution of three Ping'ou hybrid hazelnut seedlings [J].
Acta Ecol. Sin., 2022, 42(5):1876-1888.
[8] HAMEED M, ASHRAF M, NAZ N. Anatomical adaptations to
salinity in cogon grass [Imperata cylindrica (L.) Raeuschel] from
the Salt Range, Pakistan [J]. Plant Soil, 2009, 322:229-238.
[9] 张慧芳,闫海冰,冯帆,等.碱胁迫对唐古特白刺生长及叶片
超微结构的影响[J].中国水土保持科学,2021,19(1):35-42.
ZHANG H F, YAN H B, FENG F, et al .. Effects of alkali stress
on the growth and ultrastructure of Nitraria tangutorum [J].
Sci. Soil Water Conserv., 2021, 19(1):35-42.
[10] PARIDA A K, DAS A B, MOHANTY P. Defense potentials to
NaCl in a mangrove, Bruguiera parviflora: differential changes
of isoforms of some antioxidative enzymes [J]. J. Plant Physiol.,
2004, 161(5):531-542.
[11] 张若溪,蔡亚南,李庆卫.混合盐胁迫对栾树光合生理指标的
影响[J].西北植物学报,2022,42(1):98-106.
ZHANG R X, CAI Y N, LI Q W. Effect of mixed salt stress on
photosynthetic physiological indexes of Koelreuteria paniculata
[J]. Acta Bot. Bor-Occid. Sin., 2022, 42(1):98-106.
[12] SANTOS C V. Regulation of chlorophyll biosynthesis and
degradation by salt stress in sunflower leaves [J]. Sci. Hortic.,
2004, 103(1):93-99.
[13] SUN Q, YAMADA T, HAN Y, et al .. Influence of salt stress on
C4 photosynthesis in Miscanthus sinensis Anderss [J]. Plant
Biol., 2020, 23(1):44-56.
[14] LU C, JIANG G, WANG B, et al .. Photosystem Ⅱ
photochemistry and photosynthetic pigment composition in saltadapted
halophyte Artimisia anethifolia grown under outdoor
conditions [J]. J. Plant Physiol., 2003, 160(4):403-408.
[15] 王彩娟,李志强,王晓琳,等.室外盆栽条件下盐胁迫对甜高
粱光系统Ⅱ活性的影响[J]. 作物学报,2011,37(11):2085-
2093.
WANG C J, LI Z Q, WANG X L, et al .. Effect of salt stress on
photosystem Ⅱ activity in sweet Sorghum seedings grown in
pots outdoors [J]. Acta Agron. Sin., 2011, 37(11):2085-2093.
[16] BRUGNOLI E, LAUTERI M. Effects of salinity on stomatal
conductance, photosynthetic capacity and carbon isotope
discrimination of salt-tolerant (Gossypium hirsutum L.) and saltsensitive
(Phaseolus vulgaris L.) C3 non-halophytes [J]. Plant
Physiol., 1991, 95: 628-635.
[17] 葛江丽,石雷,谷卫彬,等.盐胁迫条件下甜高粱幼苗的光合
特性及光系统Ⅱ功能调节[J]. 作物学报,2007, 33(8):1272-
1278.
GE J L, SHI L, GU W B, et al .. Photosynthetic properties and
regulation of photosystem Ⅱ function in sweet sorghum
seedlings under salt stress conditions [J]. Acta Agron. Sin.,
2007, 33(8):1272-1278.
[18] 王振华,裴磊,郑旭荣,等.盐碱地滴灌春小麦光合特性与耐
盐指标研究[J].农业机械学报,2016,47(4):65-72,104.
WANG Z H, PEI L, ZHENG X R, et al .. Photosynthetic
characteristics and salt-tolerance indexes of spring with drip
irrigation in saline-alkali soil [J]. Tran. Chin. Soc. Agric.
Mach., 2016, 47(4):65-72,104.
[19] KAO W Y, TSAI T T, SHIH C N. Photosynthetic gas exchange
and chlorophyll a fluorescence of three wild soybean species in
response to NaCl treatments [J]. Photosynthetica, 2003, 41(3):
415-419.
[20] ZHANG R H, LI J, GUO S R, et al .. Effects of exogenous
putrescine on gas-exchange characteristics and chlorophyll
fluorescence of NaCl-stressed cucumber seedlings [J]. Photosynth
Res., 2009, 100(3):155-162.
[21] IMADA S, YAMANAKA N, TAMAI S. Efects of salinity on the
growth, Na partitioning, and Na dynamics of a salt-tolerant
tree, Populus alba L. [J]. J. Arid Environ., 2009, 73:245-251.
[22] 冯帆.盐胁迫下白刺叶片超微结构的改变及耐盐代谢机制
研究[D].太原:山西农业大学,2019.
FENG F. Changes of ultrastructure and salt-tolerant metabolism
of salt tolerant metabolism of Nitraria leaves under the salt
stress [D]. Taiyuan: Shanxi Agricultural University, 2019.
[23] 张慧芳,闫海冰,冯帆,等.不同盐分处理对唐古特白刺超微
结构及生长、生理指标的影响[J].干旱区资源与环境,2021,
35(6):161-169.
ZHANG H F, YAN H B, FENG F, et al .. Effects of salt stress
on ultrastructure, growth and physiological indexes of Nitraria
tangutorum [J]. J. Arid Land Resour. Environ., 2021, 35(6):
161-169.
[24] 赵曼容,贾恢先.几种典型盐地植物超微结构的研究[J].干
旱区资源与环境,1993, 7(3,4):334-337.
[25] 郝明灼,马健,梁有旺,等.NaCl胁迫对5个引自北美的树种叶
肉细胞超微结构的影响[J]. 植物资源与环境学报,2012,
21(1):52-57.
HAO M Z, MA J, LIANG Y W, et al.. Effect of NaCl stress on
ultrastructure of mesophyll cells of five tree species introduced from
North America [J]. J. Plant Resour. Environ., 2012, 21(1):52-57.
[26] 马晓蓉,杨淑娟,姚宁,等.NaCl胁迫对宁夏枸杞叶和幼根显微
及超微结构的影响[J].西北植物学报,2021,41(12):2087-2095.
MA X R, YANG S J, YAO N, et al .. Effect of NaCl stress on
the microstructure and ultrastructure of leaves and young roots
in Lycium barbarum [J]. Acta Bot. Bor-Occid. Sin., 2021,
41(12):2087-2095.
[27] 巩志勇,辛建华,商小雨,等.盐碱胁迫下香椿幼苗光合及抗
逆生理特性[J].西北植物学报,2021,41(7):1199-1209.
GONG Z Y, XIN J H, SHANG X Y, et al .. Photosynthetic
characteristics and stress tolerance physiology of Toona
sinensis seedlings under saline-alkali stress [J]. Acta Bot. Bor-
Occid. Sin., 2021, 41(7):1199-1209.
[28] 尹勇刚,袁军伟,刘长江,等.NaCl胁迫对葡萄砧木光合特性
与叶绿素荧光参数的影响[J]. 中国农业科技导报,2020,
22(8):49-55.
YIN Y G, YUAN J W, LIU C J, et al .. Effects of NaCl stress on
leaf photosynthesis and chlorophyll fluorescence parameters of
Vitis sp. rootstocks [J]. J. Agric. Sci. Technol., 2020, 22(8):
49-55.
[29] 束靖,刘素慧,张爱花,等.NaCl胁迫对设施樱桃幼苗光合特
性、叶绿素荧光及渗透调节物质的影响[J].山西农业科学,
2021,49(7):834-838.
SHU J, LIU S H, ZHANG A H, et al .. Effects of NaCl stress on
photosynthetic characteristics, chlorophyll fluorescence and
osmotic adjustment substances of cherry seedlings in
greenhouse [J]. J. Shanxi Agric. Sci., 2021, 49(7):834-838.
[30] 张潭,唐达,李思思,等.盐碱胁迫对枸杞幼苗生物量积累和
光合作用的影响[J].西北植物学报,2017,37(12):2474-2482.
ZHANG T, TANG D, LI S S, et al .. Responses of growth and
photosynthesis of Lycium barbarum L. seedling to salt-stress
and alkali-stress [J]. Acta Bot. Bor-Occid. Sin., 2017, 37(12):
2474-2482.
[31] 刁凯,李宏,程平,等.不同枣树品种光合特性日变化测定与
分析[J].西南农业学报,2016,29(6):1296-1301.
DIAO K, LI H, CHENG P, et al .. Diurnal variations of
photosynthetic characteristics of different jujube varieties [J].
Southwest China J. Agric. Sci., 2016, 29(6):1296-1301.
[32] 程晓建,王林云,周顺元,等.3种鲜食枣品种光合作用日变化
及光响应特征[J].安徽农业大学学报,2012,39(6):998-1002.
CHENG X J, WANG L Y, ZHOU S Y, et al .. Diurnal variation
and light response of photosynthesis in three types of fresh
jujube [J]. J. Anhui Agric. Univ., 2012, 39(6):998-1002.
[33] 杨磊,靳娟,冯贝贝,等.高温环境下枣光合特性及相关生理
指标日变化[J].新疆农业科学,2018,55(9):1639-1646.
YANG L, JIN J, FENG B B, et al .. Study on diurnal variation of
photosynthetic characteristics and related physiological indexes of
jujube under high temperature environment [J]. Xinjiang Agric.
Sci., 2018, 55(9):1639-1646.
[34] 姜小文,易干军,霍合强,等.毛叶枣光合特性研究[J].果树学
报,2003(6):479-482.
JIANG X W, YI G J, HUO H Q, et al .. Studies on
photosynthetic characteristics of Ziziyphus mauritiana Lam. [J].
J. Fruit Sci., 2003(6):479-482.
[35] 李湘钰,高疆生,吴翠云,等.不同光照强度对骏枣叶片光合
作用的影响研究[J].新疆农业科学,2014,51(2):227-234.
LI X Y, GAO J S, WU C Y, et al .. Study on the photosynthetic
of Junzao leaves under different light intensities [J]. Xinjiang
Agric. Sci., 2014, 51(2):227-234.
(责任编辑:张冬玲)
