基于单细胞测序分析脓毒症早期血小板数量和功能变化
2024-05-18王仙琦张斌张琪代铮张锦鑫梁晓丽李琳吴林刘善收
王仙琦 张斌 张琪 代铮 张锦鑫 梁晓丽 李琳 吴林 刘善收
1空军军医大学第一附属医院急诊科(西安 710032);2西安市秦皇医院急诊科(西安 710699)
脓毒症是因感染引起宿主炎症反应失调导致危及生命的器官功能障碍,是急诊科和重症医学科常见且高致死率的病种[1]。全球范围每年脓毒症相关死亡病例为1 100万,占全部死亡人数的19.7%[2],重症患者病死率高达55.7%[3];国内医院ICU脓毒症患者病死率达35.5%[4]。最新专家共识强调在脓毒症早期积极治疗预防多脏器功能衰竭[5],要求医生认真梳理脓毒症发病早期的临床特征,筛选不良预后的高危因素预警危重患者,有效提升脓毒症治疗效果。
脓毒症早期最显著的病理特征是固有免疫细胞活化释放炎症因子有助于杀灭病原菌,但过度应激时免疫细胞死亡释放大量损伤分子相关模式(DMAPs)致内皮细胞受损,引起血小板黏附聚集形成微血栓,诱发弥散性血管内凝血(DIC)甚至多脏器功能衰竭[6]。临床调查发现血小板减少与脓毒症患者病死率相关[7-8],此外,血小板还可能介导白细胞功能参与机体免疫应答[9-10]。以前受限于技术手段,脓毒症早期血小板内核心分子表达量和功能变化尚未完全阐明;近年学者们开始借助单细胞高通量测序和生物信息学技术分析疾病状态下血小板的病理变化[11-12]。
本课题首先建立脓毒症单病种数据库进行前瞻性病例对照研究,比较不同预后组患者疾病早期的临床特征,筛选死亡相关的独立危险因素。然后,采集健康志愿者和脓毒症患者外周静脉血,分选富含白细胞和血小板的样本做单细胞高通量测序;然后,借助生物信息学技术,分析脓毒症早期血小板内分子表达量和核心功能的变化,为脓毒症精准治疗提供科学依据,现报告如下。
1 资料与方法
1.1 伦理声明 本课题临床实验遵守《赫尔辛基宣言》,研究获得空军军医大学第一附属医院伦理委员会批准(编号:KY20212172 和NCT05229328);单细胞测序组受试者均自愿参与本研究并签署知情同意书。质控员负责数据管理,全程督导并协调落实受试者权益。为控制误差偏倚,对患者采取同质化治疗,组织学习最新脓毒症诊断标准和治疗规范[13-14]。
1.2 脓毒症纳入和排除标准 国内外指南尚未明确定义“脓毒症早期”,一般指炎症反应明显但尚未出现多脏器功能衰竭的早期阶段,常为发病后数小时至数天。本研究纳入标准:(1)脓毒症 =感染+ 序贯器官衰竭评分(SOFA) ≥ 2;(2)出现感染症状 < 72 h,诊断时间 < 24 h;(3)18 ~ 80 岁,签署知情同意书;(4)无严重慢性疾病史(硅沉着病、心功能不全Ⅲ-Ⅳ级、肿瘤、血液疾病或免疫疾病等)。排除标准:(1)妊娠期、哺乳期或新发现的肿瘤患者;(2)3 个月内服用免疫和凝血功能类药物;(3)各种原因导致治疗中断或中途退出者;(4)随访脱失(90 d)或资料不全。
1.3 患者临床特征数据采集 临床科研专职人员负责患者入组,收集空军军医大学第一附属医院急诊科收治的脓毒症患者临床数据,包括一般信息、入室生理指标、实验室检验指标、疾病评分(SOFA、NEWS)及90 d预后。2021年1月至2023年6 月期间共收治605 例,纳入257 例,排除30 例,失访3 例,最终224 例患者入组。男145 例(64.7%),女79 例(35.3%);感染部位以呼吸系统为主151 例(67.4%),其次为消化系统44 例(19.6 %),泌尿生殖系统27 例(12.1 %),神经系统和皮肤软组织感染较少,各1 例。139 例(62.1%)患者病情危重入住监护室;发病90 d 随访,158 例(70.5%)存活,66 例(29.5%)死亡,不同预后组患者的临床特征比较见表1。

表1 不同预后组脓毒症患者疾病早期临床特征的比较Tab.1 Comparison of clinical characteristics of sepsis patients in the early stages between different prognostic groups M(P25,P75)
1.4 外周静脉血采集和处理 自肘静脉采集健康者和脓毒症患者血样8 mL,颠倒混匀后转移至淋巴细胞分离管中(DAKEWE 生物技术公司,深圳,中国)。室温下离心15 min(400g),分为3 层:血浆位于上层;白细胞和血小板位于中层;红细胞和分离液在下层。
1.5 单细胞RNA 测序 外周血细胞样本送至广州基迪奥生物技术公司行单细胞测序。简要步骤:(1)采用10×基因组学测序仪(Illumina Novaseq 6000)进行测序,构建基因文库。(2)细胞注释分群,筛选疾病组与健康组血小板差异基因(倍数变化≥ 2 倍且P< 0.05)。(3)借助GO 术语和KEGG 信号通路数据库进行功能富集,分析疾病早期血小板功能改变。
1.6 统计学方法 使用SPSS 28.0软件进行统计分析,借助GraphPad Prism 9.0绘图。首先采用Kolmogorov-Smirnov对连续性变量进行正态性检验,非正态数据以M(P25,P75)表示,Mann WhitnyU检验比较组间差异;正态数据以(均数±标准差)表示,组间比较采用t检验。多因素logistic回归分析脓毒症患者死亡的危险因素,ROC 工作曲线检测预测效能。P< 0.05认为差异有统计学意义。
2 结果
2.1 不同预后组患者疾病早期临床特征及死亡高危因素分析 死亡组患者早期心率、呼吸频率、NEWS 评分、SOFA 评分、血浆总胆红素、肌酐和乳酸较存活组显著增高;平均动脉压和血小板计数则降低。将上述9 个指标进行logistic 回归(向后法)分析死亡的危险因素,结果血乳酸、SOFA、平均动脉压和血小板计数进入回归方程,统计数据见表2。采用ROC 曲线评估预测效能,血乳酸、SOFA、血小板计数和平均动脉压的ROC 曲线下面积(AUC)分别为0.85、0.73、0.71 和0.69;血小板计数+血乳酸+SOFA三因素联合预测时AUC = 0.89。
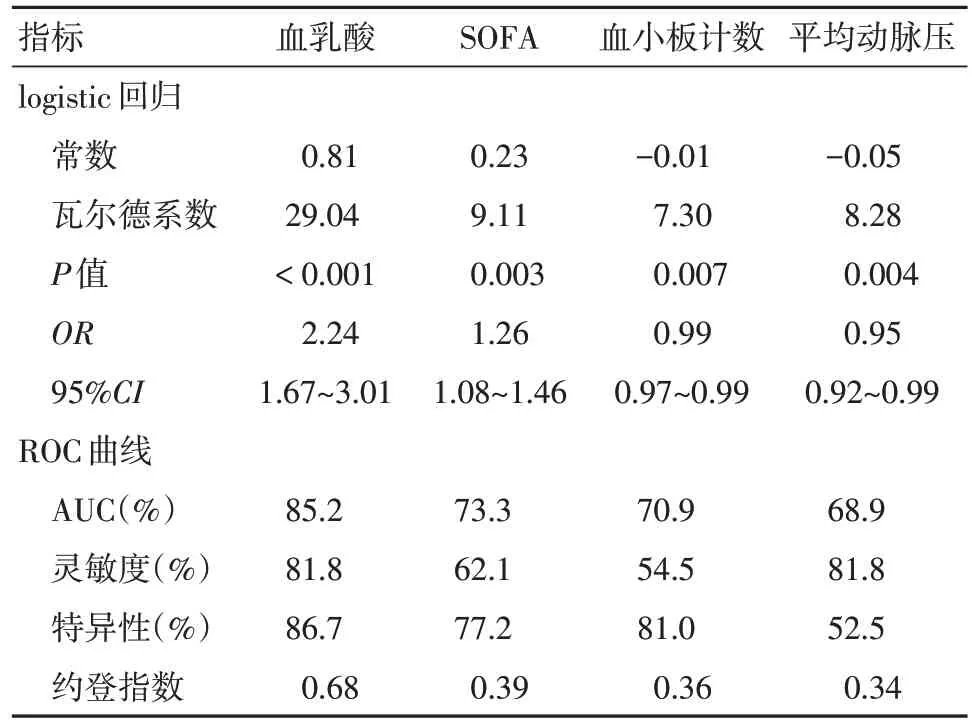
表2 Logistic 回归纳入临床指标的统计学参数及其ROC 曲线指标Tab.2 Statistical parameters and ROC curve indicators for clinical indicatorsthat included in logistic regression
2.2 单细胞测序组受试者的临床特征 为系统分析脓毒症时血小板功能的变化,课题组收集3 例健康志愿者和3 例脓毒症早期患者的外周血细胞样本进行单细胞测序。3 例脓毒症患者感染部位及病原微生物培养结果:病例1 系双下肺感染,痰培养见铜绿假单胞菌生长;病例2 为胰腺炎合并左下肺感染,痰培养和血培养均回报大肠埃希菌;病例3 系急性肾盂肾炎,尿液培养见大肠埃希菌生长。获得细菌培养和药敏实验结果后,主管医生从早期经验性治疗转为敏感抗生素的精准治疗,90 d 随访均存活。
2.3 细胞注释分群及其脓毒症时差异基因数量借助标志性分子对细胞注释分为6 群,单核细胞-CD14/CD16/CD68/CD163/CSF1R/S100A12;树突状细胞-CD11b/CD11c/CD15/CD83/CLEC4C/CD83/LYZ;中性粒细胞-S100A8/S100A9;B 细胞-CD19/CD79a/CD79b/BLNK/MS4A1;T 细胞和自然杀伤细胞(NK细胞)-CD3d/CD3e/CD8a/CD27/CD28/NKG7/GZMB;血小板-CD41/CD42a/CD61(图1)。重点关注参与固有免疫反应的炎性细胞(单核细胞、中性粒细胞和树突状细胞)以及与凝血功能密切相关的血小板,发现脓毒症早期固有免疫细胞数量占比较健康组显著升高(2.15∶1);与之相反,血小板数量占比则显著下降(0.31∶1)。
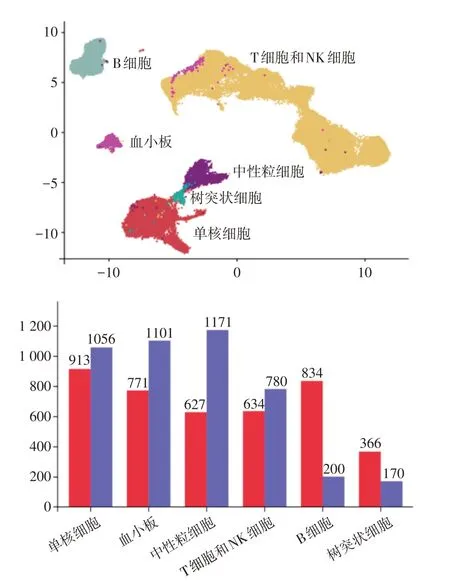
图1 细胞注释分群及脓毒症早期各细胞亚群差异基因数量Fig.1 Annotation and grouping of cells using biomarkers and the number of differentially expressed genes in various cell subpopulations during early sepsis
比较各亚群细胞脓毒症早期较健康状态时显著差异的基因数量,单核细胞差异基因最多1 969 种,其次为血小板(1 872 种)和中性粒细胞(1 798 种),再次为T 细胞NK 细胞和B 细胞,树突状细胞差异基因数量最少为536种(图1)。
2.4 血小板标志分子的特异性分析 本研究将ITGA2B(CD41)、GP9(CD42a)和ITGB3(CD61)作为血小板的标志性分子,联合诊断能较好地注释血小板使其独立成群。上述3 种分子在血小板特异性丰度表达,且脓毒症时血小板内表达量进一步显著上调;与之不同,无论在健康组还是脓毒症组受试者,CD41/CD42a/CD61 在外周血各类型免疫细胞中的表达量均极低,图2。以上提示CD41/CD42a/CD61 可作为血小板的特异性标志分子。
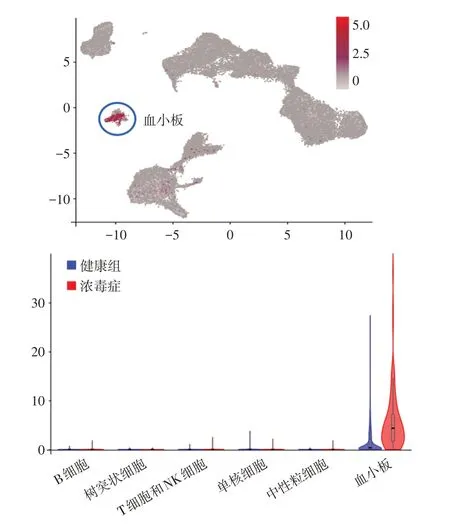
图2 血小板标志分子(CD41/CD42a/CD61)特异性的分析Fig.2 Analysis of the specificity of platelet marker molecules(CD41/CD42a/CD61)
2.5 脓毒症时血小板内表达量显著差异的基因脓毒症时,血小板内771 种基因显著上调,按照差异显著性依次为HPSE、TIMP1、CLEC1B、PF4、HBB、S100A8、PPBP、ZYX、SELP 和FCGR2A;1101种基因显著下调,按照差异显著性依次为EEF1A1、RPS3、TXNIP、RPS6、CD3E、H3-3B、PTPRC、IL32、GZMA 和IFITM1(图3)。其中ZYX、SELP和PTPRC与细胞黏附功能密切相关;PF4、PPBP 和IL32 是细胞因子互作以及趋化作用相关信号通路的核心分子;CLEC1B、S100A8 和IFITM1 参与免疫功能调节;FCGR2A 和RPS3 与致病性大肠杆菌感染相关。
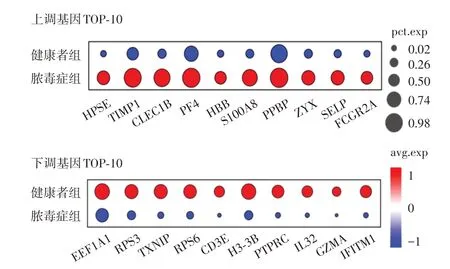
图3 脓毒症时血小板内表达量显著上调和下调的基因Fig.3 Genes significantly up-regulated and down-regulated in platelets during sepsis
2.6 血小板差异基因的功能富集分析 课题组借助生物信息学分析技术,进一步探索了脓毒症发病早期血小板的功能变化情况。差异基因富集的TOP-20 信号通路多与人类疾病相关(8 条),其次为器官系统变化(7 条),4 条为基因信号转导相关通路,另外包括1 条涉及机体代谢功能的信号通路(图4)。
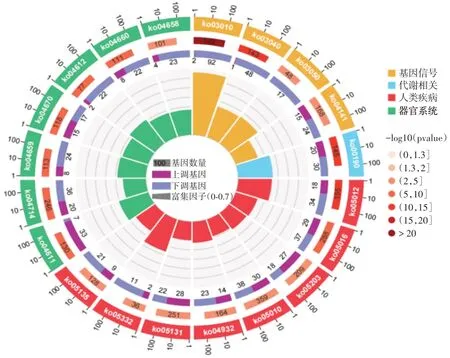
图4 脓毒症时血小板差异基因富集的信号通路(TOP-10)Fig.4 Signal pathways enriched with differentially expressed genes in platelets during sepsis (TOP-10)
GO 功能分析提示脓毒症早期血小板差异基因富集于多种凝血相关功能(血小板生成、活化、脱颗粒、聚集以及凝血过程),并且还与机体免疫功能密切相关(固有免疫反应、白细胞黏附、趋化作用、淋巴细胞增殖和细菌感染应答),见图5。KEGG 功能富集进一步提示脓毒症早期血小板参与细胞氧化磷酸化、白细胞趋化、抗原提呈和肠道感染相关信号通路,此外血小板还参与铁死亡以及焦亡相关的NOD 样受体信号通路(图5)。以上功能分析提示脓毒症早期血小板介入凝血级联反应、免疫应答以及炎性细胞病理性死亡。
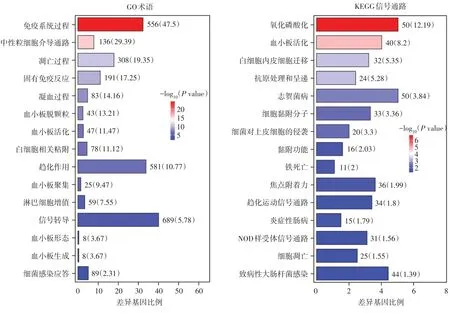
图5 脓毒症早期血小板差异基因GO 和KEGG 功能富集分析(列出通路均P < 0.05)Fig.5 Functional enrichment analysis of GO and KEGG for differentially expressed genes in platelets during early sepsis(P < 0.05 for all pathways listed)
3 讨论
脓毒症发病率高病情进展快,本组224 例患者中62.1%需要入住监护室进行治疗,90 d 病死率为29.5%,稍低于国内多中心调查数据(35.5%)[4]。提示脓毒症目前仍是急诊科和重症医学科医生面临的重大挑战,需要认真开展真实世界临床研究,寻找脓毒症疾病早期与死亡相关的高危因素,预警危重病例并及时给予加强监护治疗,阻断疾病进展为多脏器功能衰竭,从而有效改善患者预后。
本研究不同预后组患者发病早期的9 项指标差异有统计学意义,且高乳酸、高SOFA、低平均动脉压和低血小板计数是预后不良的独立危险因素;血乳酸的预测效能较好,乳酸+SOFA+血小板计数三者联合诊断时效能更高。血乳酸增高是因微循环灌注不足,细胞缺血缺氧所致,血乳酸被推荐为评估脓毒症病情严重程度和指导临床治疗的核心指标[15-16]。多项研究证实高乳酸血症与患者高病死率密切相关[17-18],这也与本研究结果一致。
本课题借助单细胞测序和生信分析技术,鉴定出CD41、CD42a 和CD61 特异性丰度表达于血小板,且脓毒症时含量进一步显著上调,可以作为血小板的标志性分子。CD41 又名ITGA2B,中文名称整合素α2b,通过调节血小板聚集在血液凝固过程中起着至关重要的作用,可用做鉴别血小板来源外泌体[19]。CD42a 又名GP9,中文名称血小板膜糖蛋白IX,该基因缺陷时血小板形态异常增大且功能障碍,临床患者有出血倾向。Martins 将CD42a 作为标志分子,借助共聚焦激光扫描显微镜观察癌细胞摄取血小板的过程[20]。CD61 又名ITGB3,中文名称整合素亚单位β3,参与细胞黏附以及细胞表面信号传导,该基因缺陷将导致血小板无力症[21]。此外,CD41、CD42a 和CD61 抗体常被用作流式细胞计数实验来探索疾病状态下血小板功能变化[22-23]。
本研究发现脓毒症早期血小板占比较健康组显著降低(0.31∶1);血小板内差异基因数量与主要固有免疫细胞内差异基因数量相当(单核细胞和中性粒细胞)。血小板内显著上调和显著下调的基因包括介导细胞黏附、趋化作用和免疫应答等重要功能的核心分子。进一步探索差异基因富集的TOP-20 信号通路,与人类疾病、器官功能变化和细胞信号转导相关;GO 和KEGG 功能分析提示脓毒症早期血小板密切参与凝血级联、免疫应答以及免疫细胞死亡等重要的病理变化,以上病理过程均消耗外周血小板导致其数量显著减少。
脓毒症炎症应激会导致免疫细胞死亡,引发免疫抑制或二次感染造成不良预后。近年,脓毒症时免疫细胞内多种死亡相关分子上调和死亡信号通路激活引起学者对免疫细胞程序性死亡的关注,包括焦亡、铁死亡、自噬和胞外陷阱相关细胞死亡(METosis/NETosis)[24-25]。脓毒症早期巨噬细胞和中性粒细胞在血小板介导下变得扁平,细胞膜破裂胞内染色质、组蛋白和细胞质成分被挤压成网状结构,即胞外陷阱网(METs/NETs),能够捕获并杀死病原菌;然而,BOE 和YIPP 研究指出胞外陷阱网杀菌时细胞裂解成游离DNA 和组蛋白而死亡,即METosis/NETosis,释放的DNA 和组蛋白是DAMPs 的主要来源[26-27],激活凝血引发DIC 和MODS[28]。多项研究提示血小板介导的METosis/NETosis 与免疫细胞、上皮细胞和内皮细胞损伤密切相关[29],在脓毒症的发生和进展中发挥重要作用。
总之,本研究通过临床前瞻性病例对照研究发现脓毒症早期血小板计数减少是不良预后的独立危险因素;借助先进的单细胞高通量测序和生物信息学分析技术,鉴定出CD41/CD42a/CD61 是血小板的标志分子;并发现疾病早期血小板不仅介导细胞黏附和凝血级联,还参与免疫细胞趋化、炎性应答和细胞病理性死亡等功能变化。不足之处:临床研究为单中心,仅是观察性研究;单细胞测序纳入病例数较少,未开展基础实验对结果进行验证。因此,有必要开展多中心随机对照性研究进一步证实疾病早期血小板计数与脓毒症预后的关系;需要更深入的基础研究继续探索脓毒症早期血小板核心功能变化并开发相关靶向治疗策略。
【Author contributions】WANG Xianqi performed the experiments and wrote the article. ZHANG Bin, ZHANG Qi, DAI Zheng, ZHANG Jinxin, and LIANG Xiaoli performed the experiments. LI Lin and WU Lin revised the article. LIU Shanshou designed the study and reviewed the article. All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
