circRNA SIPA1L1修饰牙髓干细胞来源外泌体促血管生成能力的机制
2024-05-18刘景冷春涛王艳
刘景 冷春涛 王艳
新疆医科大学第五附属医院口腔科(乌鲁木齐 830011)
牙髓病和根尖周病是两种最常见的口腔疾病,通常是由于剧烈刺激如龋齿、意外创伤、医源性感染等原因对牙髓造成不可逆损伤[1-2]。牙髓是一种高度血管化和神经支配的组织,位于刚性牙本质壁内,能够执行多种功能,例如提供营养和通过矿化修复牙髓来改善神经元敏感性[3]。因此,牙髓损伤会导致牙齿活力丧失,需要及时进行牙髓治疗。存在于牙髓组织中心的牙髓干细胞(human dental pulp stem cell, hDPSC)在牙髓组织损伤修复中扮演重要角色,已成功应用于牙髓再生[4]。然而,干细胞的体内移植具有一定风险,例如诱导心肌梗死和促进肿瘤发展,此外,其临床应用还面临获取、扩增、运输和储存等因素的限制[5-7]。外泌体(exosome, Exo)是一种细胞外囊泡,其中包含多种信号分子,例如蛋白质、miRNA、mRNA 和脂质等,在细胞间通讯中发挥重要作用。此外,Exo 还具有与其亲本细胞相似的生物学功能,由于其不增殖和低免疫原性[8-9],在牙髓再生中具有更广阔的临床应用前景。
环状RNA(circRNA)是一种生物活性核酸分子,以闭环RNA 形式存在,属于内源性非编码RNA。circRNA 参与胚胎发育、细胞活动和多种人类疾病的发生发展,并通过协调多种分子和信号通路来调节牙髓再生[10-12]。信号诱导增殖相关蛋白1 样蛋白1(SIPA1L1)是由人类14 号染色体上编码circSIPA1L1 的转录本产生,能够促进hDPSC的成骨分化[13]。然而,关于SIPA1L1 对牙髓血管生成是否具有促进作用尚未明确。基于此,本研究通过将circSIPA1L1 转染至hDPSC 后分离出Exo,观察circSIPA1L1 修饰hDPSC 来源的Exo 对人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)血管生成的影响。
1 材料与方法
1.1 临床标本 收集我院口腔科2021 年8 月至2022 年6 月10 例患者因正畸治疗拔除的恒牙,年龄在12 ~ 18 岁。在无菌条件下取离体牙的牙髓组织,进行hDPSC 的分离培养。本研究通过医院伦理委员会审核与批准实施(伦理批号:K-2021128)。
1.2 主要试剂 HUVEC 购于武汉诺普赛生命科技有限公司,Ⅰ型胶原酶购于无锡欣润生物科技有限公司,青霉素-链霉素、胎牛血清、胰蛋白酶及DMEM 培养基购于美国Gibco 公司,Lipofectamine 2000 转染试剂盒和Trizol 试剂盒购于美国Invitrogen 公司,外泌体提取试剂盒购于上海翌圣生物科技公司,反转录试剂盒和实时荧光定量PCR检测试剂盒购于日本Takara 公司,RIPA 裂解液、BCA 蛋白定量检测试剂盒、化学发光试剂液及硝酸纤维素膜购于上海碧云天生物科技公司,血管生成载玻片购于德国ibidi 公司,Matrigel 胶购于美国BD 公司,抗体CD105、CD90、CD73、CD45、CD34、CD9、HSP70、TSG101、VEGF、VEGFR2、PGF、GAPDH 及生物素标记的山羊抗兔IgG 抗体购于英国Abcam 公司。circSIPA1L1 过表达质粒载体交由上海生工生物工程有限公司设计与合成。
1.3 方法
1.3.1 hDPSC 分离与培养 使用眼科剪将牙髓组织剪成约1 mm × 1 mm × 1 mm 的组织块,移入无菌培养瓶底部,加入3% Ⅰ型胶原酶,置于37 ℃、5% CO2条件下消化培养1 h,每10 min 取出晃动1 次,加速消化过程。待组织彻底分散后,70 目过目筛,移入无菌离心管内,以1 000 r/min离心5 min,弃上清,在沉淀中加入含20%胎牛血清、100 U/mL青霉素-链霉素的DMEM 培养基,重悬细胞,转移至培养瓶内,放于37 ℃、5% CO2条件下培养。每隔1 d 更换1 次培养液,待细胞生长至融合度达到80%以上时,0.25%胰酶消化,常规传代培养,期间通过倒置相差显微镜观察细胞形态。
1.3.2 流式细胞术检测表面标记物表达 选取对数生长期的第3 代hDPSC,0.25%胰酶消化,PBS 洗涤,以4 000 r/min离心5 min,将沉淀重悬于PBS中,调整细胞浓度为6 × 106/mL,吸取100 μL 细胞悬液加到流式检测管内,接着在管内依次加入10 μL的干细胞表面标记物CD105、CD90、CD73、CD45、CD34 抗体,室温避光孵育30 min,再以4 000 r/min离心5 min,PBS 洗脱并重悬,上流式细胞仪检测细胞表面各标记蛋白表达情况。
1.3.3 细胞转染 将hDPSC 按照每孔5 × 103个接种到96 孔板内,置于37 ℃、5% CO2条件下培养过夜。将hDPSC 分为两组,一组细胞正常培养,另一组转染circSIPA1L1 过表达载体,具体根据Lipofectamine 2000 转染试剂说明书将circSIPA1L1 过表达质粒载体转染至hDPSC,转染48 h 后进行后续实验。
1.3.4 外泌体分离及表征鉴定 收集未转染的hDPSC 和转染circSIPA1L1 的hDPSC 于无菌离心管内,4 ℃下以4 500 r/min 离心15 min,吸取上清,将此上清通过4 ℃、12 000 r/min离心20 min,再吸取上清。将获得的上清与提取液A 混合,涡旋混匀,4 ℃下静置过夜。次日,再在4 ℃下以12 000 r/min离心60 min,弃上清,保留沉淀,即为Exo,吸取保存液B 吹打沉淀将其重悬,置于-20 ℃冰箱保存。吸取Exo 样品10 μL 加到铜网上,再加入磷钨酸,吸去多余浮液,干燥后在透射电镜下观察形态,通过纳米颗粒跟踪分析仪检测直径。
1.3.5 Western blot测定Exo标志蛋白CD9、HSP70、TSG101 及HUVEC 中VEGF、VEGFR2、PGF 蛋白表达水平 在Exo或HUVEC中加入适量RIPA裂解液提取总蛋白,BCA 蛋白定量法检测蛋白浓度。通过100 ℃金属浴煮沸蛋白进行变性处理,吸取等量20 μg 蛋白样品上样至凝胶孔内,10%SDS-PAGE凝胶电泳分离。结束后,160 mA 恒流将蛋白转移至硝酸纤维素膜上,浸入5%脱脂奶粉中室温封闭2 h,在Exo 标志蛋白检测中加入兔抗CD9、HSP70、TSG101 多克隆抗体,在HUVEC 蛋白样品中加入兔抗VEGF、VEGFR2、PGF 多克隆抗体,抗体均按1∶1 000 稀释,将膜与抗体共置于4 ℃条件下孵育过夜。次日,取膜复温,TBST 洗涤,加入对应标记的山羊抗兔IgG 抗体,按照1∶5 000 稀释,室温下共孵育2 h,TBST 再次清洗膜,滴加化学发光试剂液显色,曝光显影后,进行图像扫描与分析,观察Exo 各标志蛋白条带,并以GAPDH 作为内参蛋白,Image Analyst 软件分析各蛋白条带灰度值,以目的蛋白与内参蛋白的灰度值之比作为目的蛋白的相对表达量。
1.3.6 实时荧光定量PCR检测Exo中circSIPA1L1及HUVEC 中VEGF、VEGFR2、PGF mRNA 表达水平 在Exo 或HUVEC 中加入Trizol 试剂提取总RNA,通过核酸微量测定仪检测总RNA 浓度与纯度。按照反转录试剂盒说明书配置反应体系,合成底物cDNA。再通过qRT-PCR 法检测Exo 中circSIPA1L1表达或HUVEC中VEGF、VEGFR2、PGF mRNA 表达,参照SYBR Green 法qRT-PCR 测定试剂盒说明书进行检测,配制20 μL 的反应体系,在Bio-Rad CFX96 系统进行扩增,设置两步法PCR 反应程序:95 ℃预变性30 s;95 ℃变性5 s、60 ℃退火/延伸30 s,循环40 次。重复操作3 次,以GAPDH作为内参基因,采用2-△△Ct法分析各目的基因的相对表达量。
1.3.7 实验分组与处理 将冻存的HUVEC 经过37 ℃水浴复苏,添加含10%胎牛血清的DMEM 培养基培养,取对数生长期的细胞进行实验。实验分组与处理具体如下:(1)对照组,使用正常培养基培养HUVEC;(2)hDPSC Exo 组,在培养基中添加50 μL hDPSC 来源的Exo 培养HUVEC;(3)circ-SIPA1L1-hDPSC Exo 组,在培养基中添加50 μL 转染circSIPA1L1 的hDPSC 来源的Exo 培养HUVEC。置于37 ℃、5% CO2条件下培养48 h 后收集各处理组HUVEC,进行后续实验。
1.3.8 Matrigel 基质胶血管形成实验检测HUVEC血管形成能力 将Matrigel 胶放入4 ℃冰箱过夜融化,吸取10 μL 加到血管生成载玻片上,放入培养箱内待胶凝固。将各处理组HUVEC 浓度调整为2 × 105个/mL,吸取50 μL 细胞悬液接种于铺好Matrigel 胶的玻片孔内,置于37 ℃、5% CO2条件下培养。在倒置显微镜下观察成管情况,采集培养24 h 的图像,并对管样结构形成数目进行统计分析。
1.4 统计学方法 本实验数据分析均使用Graph-Pad Prism 7.0 软件进行,计量资料以均数±标准差表示。多组间统计分析采用单因素方差分析法,组间两两比较分析采用LSD-t检验。以P< 0.05 为差异有统计学意义。
2 结果
2.1 hDPSC 培养与鉴定结果 通过倒置相差显微镜观察到,培养3~5 d 后细胞从组织块周围边缘爬出,呈集落式生长,形态为长梭形或纺锤样。10 d 后细胞已经长满瓶底,似成纤维细胞样,细胞呈旋涡状排列。见图1。
流式细胞术检测细胞表面标志物表达,检测结果显示,CD105、CD90、CD73 呈阳性表达,CD45与CD34 呈阴性表达,见图2。以上结果均符合hDPSC 特征,说明成功分离培养到hDPSC。

图2 hDPSC 表面标志物表达水平Fig.2 Expression level of hDPSC surface markers
2.2 含circRNA SIPA1L1 修饰hDPSC 来源Exo鉴定结果 从未转染的hDPSC 与转染circSIPA1L1的hDPSC 中分离的颗粒物均为椭圆形,呈囊泡状,直径分布在45 ~ 135 nm,见图3A、3B。Western blot 检测结果显示,从未转染的hDPSC 与转染circ-SIPA1L1 的hDPSC 中分离的颗粒物中均检测到Exo 表面标志蛋白CD9、HSP70 及TSG101 蛋白明显表达,见图3C。以上结果表明,成功分离到hDPSC 来源的Exo 与转染circSIPA1L1 的hDPSC 来源的Exo。且qRT-PCR 检测结果显示,hDPSC Exo和circSIPA1L1-hDPSC Exo 中的circSIPA1L1相对表达量分别为1.00 ± 0.05、2.45 ± 0.26,circSIPA1L1-hDPSC Exo 中的circSIPA1L1 相对表达量显著上调(t= 27.478,P< 0.001)。

图3 Exo 鉴定结果Fig.3 Identification results of Exo
2.3 含circ SIPA1L1修饰hDPSC 来源Exo对HUVEC 血管生成的影响 镜检观察各组HUVEC 血管生成情况,3 组管样结构形成数目之间的差异有统计学意义(F= 157.846,P< 0.001)。hDPSC Exo 组HUVEC 的管样结构形成数目显著多于对照组(P< 0.05);circSIPA1L1-hDPSC Exo 组HUVEC的管样结构形成数目又显著多于hDPSC Exo 组(P< 0.05),见图4。
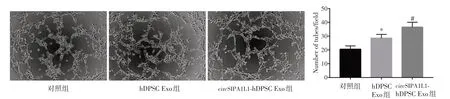
图4 各组HUVEC 管形成情况比较Fig.4 Comparison of HUVEC tube formation in each group
2.4 含circ SIPA1L1 修饰hDPSC 来源Exo 对HUVEC 中VEGF、VEGFR2 及PGF 表达水平的影响 qRT-PCR 检测结果显示,3 组HUVEC 中VEGF、VEGFR2、PGF 的mRNA 相对表达量之间的差异有统计学意义(F= 74.521、54.228、49.576,P< 0.001)。与对照组比较,hDPSC Exo 组HUVEC中VEGF、VEGFR2以及PGF mRNA相对表达量显著上调(P< 0.05);与hDPSC Exo组比较,circSIPA1L1-hDPSC Exo组HUVEC中VEGF、VEGFR2、PGF mRNA相对表达量进一步显著上调(P< 0.05),见图5。

图5 各组HUVEC 中VEGF、VEGFR2、PGF mRNA 表达水平比较Fig.5 Comparison of mRNA expression levels of VEGF, VEGFR2 and PGF in HUVEC in each groups
Western blot 检测结果显示,3 组HUVEC 中VEGF、VEGFR2、PGF 的蛋白相对表达量之间的差异有统计学意义(F= 42.157、39.442、32.058,P< 0.001)。hDPSC Exo组HUVEC中VEGF、VEGFR2、PGF蛋白相对表达量均显著高于对照组(P< 0.05);circSIPA1L1-hDPSC Exo 组HUVEC 中VEGF、VEGFR2、PGF 蛋白相对表达量进一步又显著高于hDPSC Exo 组(P< 0.05),见图6。
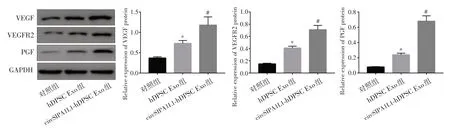
图6 各组HUVEC 中VEGF、VEGFR2、PGF 蛋白表达水平比较Fig.6 Comparison of protein expression levels of VEGF, VEGFR2 and PGF in HUVEC in each groups
3 讨论
牙髓疾病的传统治疗方法为根管治疗,该方法是基于受感染的牙髓切除和生物惰性材料进行根管填充,但会导致牙齿失活,更容易再次感染和发生牙折[14]。随着学者们对牙髓病学的深入研究,再生牙髓病学的出现被认为是牙齿保护和活化的前瞻性方法,该方法能够通过组织学技术产生或形成新组织代替坏死牙髓组织,以达到重建牙髓的目的,与传统根管治疗相比优势更为明显[15]。然而,由于根管结构的特殊性,血管网络再生成为牙髓再生中面临的一大难题。牙髓血管能够为牙髓组织输送氧气与营养物质,并清除代谢产物,对于维持正常的牙髓组织功能非常关键。因此,探究促进或提高牙髓血管再生的策略对于牙髓疾病治疗具有重大意义。
Exo 作为旁分泌机制中的关键元素,表现出良好的安全性和稳定性,其中所含的复杂货物可以反映亲本细胞的状态,以上这些特点均使其成为一种极具潜力的再生治疗工具。此外,已有大量研究报道指出,hDPSC 来源的Exo 在多种牙齿疾病中起到治疗效果,例如,SHEN 等[16]的研究表明了hDPSC 来源的Exo 掺入壳聚糖凝胶通过促进巨噬细胞从促炎表型转变为抗炎表型,从而抑制牙周炎症并调节免疫反应来改善小鼠牙周病变;GANESH 等[17]研究指出hDPSC 来源的Exo 促进了细胞增殖和迁移,增强了血管生成标志物的表达,对牙髓再生具有显著的治疗潜力;SHIMIZU等[18]研究发现hDPSC 来源的Exo 能够刺激hDPSC和小鼠成骨细胞的迁移,有效减轻牙周炎引起的骨质流失;ZENG 等[19]的研究还说明hDPSC 来源的Exo 能够逆转脂多糖诱导对人牙髓干细胞增殖的抑制作用,并抑制细胞凋亡与降低促炎细胞因子释放的能力。此外,在炎症环境下,hDPSC来源的Exo 具有较强的促血管生成作用[20]。这些结果均提示,hDPSC 来源的Exo 在生物组织工程牙髓治疗及血管再生中发挥积极作用。本研究成功从牙髓组织中分离出类成纤维细胞样细胞,且CD105、CD90、CD73 呈阳性表达,CD45、CD34 呈阴性表达,表明该细胞为hDPSC;并从未转染的hDPSC 与转染circSIPA1L1 的hDPSC 中分离出椭圆形的囊泡状颗粒物,检测到直径分布在45 ~ 135 nm,Exo 标志蛋白CD9、HSP70、TSG101均高表达,以上结果说明成功获得hDPSC 来源的Exo。
circRNA 参与各种生理和病理过程,也与血管生成密切相关。circRNA-001175 能够抑制高糖诱导下HUVEC 活性的降低,减少HUVEC 凋亡,并促进HUVEC 的管样结构形成能力[21];circGSE1 可以在体外促进衰老内皮细胞的增殖、迁移以及管形成,此外,在股动脉结扎和缺血的小鼠模型中,circGSE1 能够促进衰老小鼠缺血肢体的血流恢复和血管生成能力[22]。然而,关于circRNA 在牙髓再生中血管形成的作用研究报道却相对较少。由于血管系统重建是营养和氧气运输的先决条件,因此血管生成对于牙髓再生中至关重要。血管生成是一个复杂、动态的过程,涉及几个重要步骤,包括内皮细胞增殖、迁移、管形成,此外,该过程受到多种血管生成生长因子的调节[23]。其中,VEGF是最有效和特异性的血管生成因子,可促进血管舒张,增加血管通透性,并诱导毛细血管形成[24]。VEGF 的生物学功能主要通过其受体VEGFR2 所介导,VEGF 与VEGFR2 结合导致VEGFR2 酪氨酸磷酸化,随后招募关键蛋白和激活下游信号级联通路,以诱导多种血管生成相关基因的转录[25]。PGF 是VEGF 超家族的成员,通过与VEGFR1 的结合阻断了VEGFA 与该受体的结合,从而增强了VEGFA 与VEGFR2 的结合,产生更有效的促血管生成信号[26]。本研究结果显示,相较于hDPSC来源的Exo,经过circSIPA1L1 修饰hDPSC 来源的Exo 显著促进了HUVEC 的管样结构形成数目,并提高了VEGF、VEGFR2 及PGF 的表达水平。
综上所述,本研究成功分离到circSIPA1L1 修饰hDPSC 来源的Exo,并表明了circSIPA1L1 修饰hDPSC 来源的Exo 对于HUVEC 血管生成具有促进效应,该作用可能是通过上调VEGF、VEGFR2 及PGF 表达水平实现的,这为牙髓修复重建提供了新见解。然而,本实验只是从体外初步验证了circSIPA1L1 修饰hDPSC 来源的Exo 的促血管生成能力,其在体内牙髓再生中是否也发挥同样作用有待后续进行研究。
【Author contributions】LIU Jing designed this study and conducted experiments and wrote an article. LENG Chuntao and WANG Yan conducted experiments and made revisions to the article. All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
