铜离子激活MAPK-ERK通路调控鼻咽癌放射敏感性
2024-05-18黄秀婷林颉叶晓心蔡佳佐袁亚维
黄秀婷 林颉 叶晓心 蔡佳佐 袁亚维
广州医科大学附属肿瘤医院放疗科(广州 510095)
鼻咽癌(nasopharyngeal carcinoma, NPC)是一种在中国南方地区高发的恶性上皮性肿瘤,放射治疗是其最主要的治疗手段[1-2]。然而,放疗抵抗的存在导致约20%的患者治疗后出现肿瘤局部残留及复发[3],其治疗方式有限,预后不佳[4]。因此,需要探究NPC 的放疗抵抗机制,寻找有效的增敏策略。研究[5-7]表明,快速分裂的肿瘤细胞需要更高水平的Cu2+以满足其代谢需求,Cu2+能够参与致癌信号通路转导和肿瘤发生,促进肿瘤细胞生长增殖。包括NPC 在内的多种肿瘤患者血清及肿瘤组织内Cu2+含量显著升高[8-12]。此外,肝癌患者血清Cu2+水平与放疗反应呈负相关[13],应用铜螯合剂或阻断铜转运系统可以逆转多种肿瘤的放化疗抵抗性[13-16]。这些线索表明靶向Cu2+可能成为NPC 放射增敏的新方向。丝裂原活化蛋白激酶(MAPK-ERK)通路是调节多种细胞过程的关键信号通路,其过度活化在肿瘤的发生发展中起重要作用[17]。既往研究显示,Cu2+对肿瘤细胞中MAPKERK 通路的活化具有调控作用[18],MAPK-ERK 通路的激活又与淋巴细胞白血病的放射抗性相关[19]。但在NPC细胞中,关于Cu2+对MAPK-ERK通路的调控及其对放疗敏感性的影响,目前鲜见报道。为此,本研究以NPC 细胞内Cu2+含量为研究对象,旨在探究其对放射敏感性的潜在影响及其作用机制,现报告如下。
1 材料与方法
1.1 材料
1.1.1 细胞系 人鼻咽上皮细胞NP69 及人NPC细胞系CNE1、CNE2、5-8F、HONE1、SUNE1 由广州医科大学附属肿瘤医院放射生物学实验室保存。
1.1.2 主要材料与试剂 PBS 缓冲液、1640 培养基、DMEM 高糖培养基、胰蛋白酶及青霉素-链霉素双抗溶液购自美国Gibco 公司;胎牛血清购自以色列Biological Industries 公司;4%多聚甲醛溶液购自永津生物科技有限公司;2.5%结晶紫甲溶液购自北京雷根生物技术有限公司;铜离子检测试剂盒购自英国Cohesion BIOSCIENCES 公司;葡萄糖酸铜及四乙烯五胺(TEPA)购自上海麦克林生化科技股份有限公司;细胞计数试剂盒-8(CCK-8)试剂盒购自美国GlpBio 公司;RIPA 裂解液及BCA 蛋白定量试剂盒购自中国康为世纪生物科技股份有限公司;HRP 直标GAPDH 单克隆抗体购自中国Proteintech 公司;γH2AX 多克隆抗体、RAS 单克隆抗体、ERK1/2 多克隆抗体、Phospho-ERK1/2(PERK1/2)多克隆抗体购自美国Cell Signaling Technology 公司;Phospho-C-RAF(P-C-RAF)多克隆抗体、C-RAF 多克隆抗体购自美国Affinity 公司;MAPK-ERK 通路抑制剂SCH772984 购自美国Med-ChemExpress 公司。
1.2 实验方法
1.2.1 细胞培养 细胞培养于含10%胎牛血清和1%青霉素-链霉素双抗溶液的完全培养基中,置于CO2浓度5%、温度37 ℃的细胞培养箱中。
1.2.2 细胞Cu2+检测 收集细胞后加入细胞测定缓冲液,超声破碎细胞后离心收集上清液。将140 μL 标准品或待测样品分别加入酶标板中,每孔依次加入40 μL 反应缓冲液、10 μL 掩蔽剂及10 μL 染料试剂,37℃孵育15 min 后在酶标仪605 nm 处测定各孔OD值。
1.2.3 Cu2+溶液配制 精确称取453.84 mg 葡萄糖酸铜粉末,溶于10 mL 无菌PBS 缓冲液中。充分溶解后,经0.22 μm 微孔滤膜过滤器过滤得到浓度为0.1 mol/L 的Cu2+储存液,置于4 ℃冰箱保存。
1.2.4 细胞药物处理 取对数生长期的NPC 细胞进行传代铺板。首先分别加入0、5、10、20、50、100、200 μmol/L Cu2+溶液及0、0.05、0.1、0.2、0.5、1.0、2.0 mmol/L TEPA 溶液,通过CCK-8 实验确定药物的最佳作用浓度。在后续实验中,各组细胞分别接受了不同的药物处理:Cu2+组加入20 μmol/L Cu2+溶液;TEPA 组加入0.2 mmol/L TEPA 溶液;Cu2++ SCH772984 组同时加入20 μmol/L Cu2+溶液及300 nmol/L SCH772984;对照组不作任何处理。药物处理24 h 后进行后续实验,进一步探究这些处理对细胞的影响。
1.2.5 细胞辐照 使用广州医科大学附属肿瘤医院放疗中心直线性加速器(型号:Clinic iX, Varian,Pali Alto, CA, USA)产生的6 MV X 射线进行照射,源轴距(SAD)为1.5 cm,剂量率为200 cGy/min,照射野大小为10.0 cm × 15.0 cm。
1.2.6 CCK-8实验 收集处于对数生长期的细胞,在96 孔板加入5 000 细胞/孔。对各组细胞进行相应药物处理后在适宜环境培养24 h,进行射线辐照。辐照后24 h,洗净孔板中原有培基后每孔加入10 μL CCK-8 溶液和90 μL 完全培养基,37 ℃孵育1 h。利用酶标仪在450 nm波长处检测各孔OD值。
1.2.7 细胞克隆形成 将细胞消化成单细胞悬液,计数后接种于6 孔板中。0、2、4、6、8 Gy 的照射剂量对应的接种细胞个数分别为1 000、1 500、2 000、3 000、4 000 个,待细胞贴壁后按分组加入相应药物处理,24 h 后进行射线辐照处理。约14 d后终止培养,吸弃培养基并用PBS 清洗,用4%多聚甲醛充分固定后结晶紫染色30 min。流水洗净染料后晾干并拍摄图片。使用Image J 统计克隆数,利用单击多靶模型拟合细胞存活曲线,公式为:SF=1-(1-e-D/D0)N。
1.2.8 蛋白提取及蛋白质免疫印迹法(Western blot) 细胞辐照24 h 后,使用RIPA 裂解液提取细胞总蛋白,用BCA 法测定蛋白浓度并计算出相应的上样体积。电泳分离蛋白样品并转移到PVDF膜上,将膜在5% BSA 溶液中室温封闭1 h 后,置于相应一抗溶液4℃下孵育过夜。用TBST 充分洗涤后将膜与HRP 标记的相应种属的二抗于室温下孵育1 h。洗膜后用ECL 化学发光系统观察条带。
1.3 统计学方法 使用GraphPad Prism 8 软件对所有实验数据进行分析处理并制作统计图表,所得结果均以均数±标准差的形式表示。其中,两组均数比较采用t检验,多样本均数比较采用单因素方差分析。以P< 0.05 为差异有统计学意义。
2 结果
2.1 正常鼻咽上皮细胞及NPC 细胞中的Cu2+含量 与NP69 相比,各NPC 细胞株的Cu2+含量均明显升高。其中,高分化NPC 细胞系CNE1 的Cu2+含量最低,低分化NPC 细胞系SUNE1 中Cu2+含量最高(表1)。
表1 检测不同细胞株的Cu2+含量Tab.1 Detected the contents of the copper ions in different cell lines ±s

表1 检测不同细胞株的Cu2+含量Tab.1 Detected the contents of the copper ions in different cell lines ±s
注:取正常鼻咽上皮细胞NP69为参照
细胞NP69 CNE1 5-8F CNE2 HONE1 SUNE1 Cu2+含量1.07 ± 0.11 1.57 ± 0.14 1.77 ± 0.17 2.07 ± 0.16 2.78 ± 0.17 3.48 ± 0.24 P值0.016 0.001< 0.001< 0.001< 0.001
2.2 Cu2+含量引起NPC 细胞的放射敏感性改变CCK-8实验表明,当暴露于50 ~ 200 μmol/L铜水平时CNE1细胞发生了毒理学反应,添加外源性Cu2+浓度低于50 μmol/L 时细胞则出现了放疗抵抗(表2)。在SUNE1 细胞中,添加0.1 ~ 0.2 mmol/L TEPA 能提高其放射敏感性,添加0.50 mmol/L 以上TEPA 则会引起细胞毒性(表3)。克隆形成实验显示,与对照组相比,Cu2+组的CNE1 细胞对电离辐射的抵抗性增强,TEPA 组在SUNE1 细胞则产生了放疗增敏效果(图1A)。Western Blot 结果显示,相比未作处理的CNE1 细胞和SUNE1 细胞,接受同等剂量的电离辐射后Cu2+组细胞γH2AX 的蛋白表达量下降,TEPA 组γH2AX 表达升高(图1B)。

图1 NPC 细胞中Cu2+含量与放射敏感性的关系Fig.1 Relationship between copper ions and radiosensitivity in NPC cells
表2 添加Cu2+溶液后CNE1 的细胞存活率Tab.2 Cell viability of CNE1 after addition of copper ion solution ±s,%
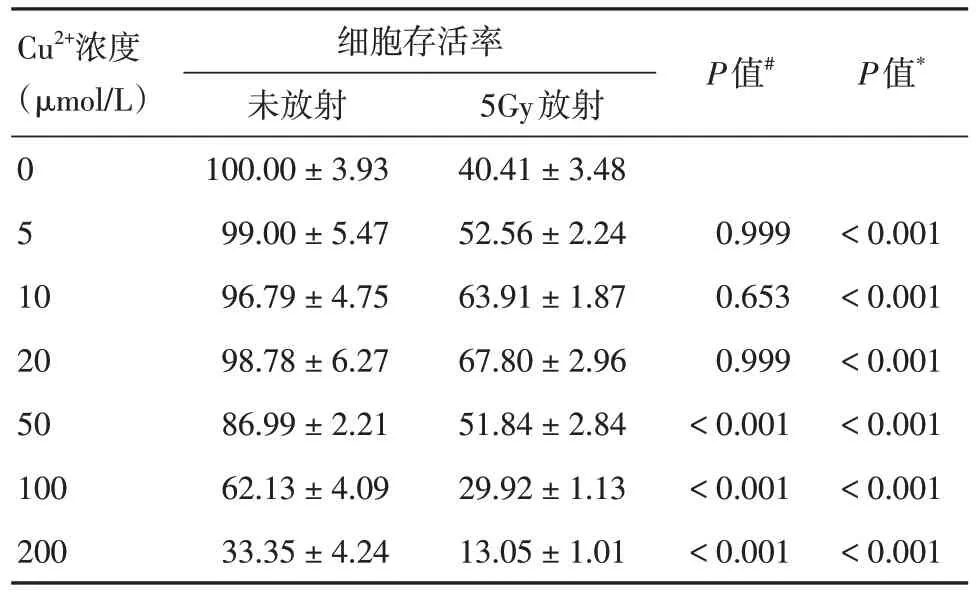
表2 添加Cu2+溶液后CNE1 的细胞存活率Tab.2 Cell viability of CNE1 after addition of copper ion solution ±s,%
注:取未添加Cu2+溶液组为参照,#表示未放射组间P 值;*表示5Gy放射组间P值
Cu2+浓度(μmol/L)0 5 10 20 50 100 200细胞存活率未放射100.00 ± 3.93 99.00 ± 5.47 96.79 ± 4.75 98.78 ± 6.27 86.99 ± 2.21 62.13 ± 4.09 33.35 ± 4.24 5Gy放射40.41 ± 3.48 52.56 ± 2.24 63.91 ± 1.87 67.80 ± 2.96 51.84 ± 2.84 29.92 ± 1.13 13.05 ± 1.01 P值#0.999 0.653 0.999< 0.001< 0.001< 0.001 P值*< 0.001< 0.001< 0.001< 0.001< 0.001< 0.001
表3 使用TEPA 后SUNE1 的细胞存活率Tab.3 Cell viability of SUNE1 after TEPA administration ±s,%

表3 使用TEPA 后SUNE1 的细胞存活率Tab.3 Cell viability of SUNE1 after TEPA administration ±s,%
注:取未添加TEPA 组为参照,#表示未放射组间P 值;*表示5Gy放射组间P值
TEPA浓度(mmol/L)0 0.05 0.10 0.20 0.50 1.00 2.00细胞存活率未放射100.00 ± 3.26 102.70 ± 3.72 101.80 ± 1.94 99.57 ± 4.73 82.37 ± 9.66 77.64 ± 3.52 66.12 ± 4.43 5Gy放射61.78 ± 4.40 58.20 ± 2.10 50.89 ± 2.96 41.57 ± 2.77 31.30 ± 3.48 26.09 ± 2.68 22.48 ± 2.08 P值#0.856 0.976 1.000< 0.001< 0.001< 0.001 P值*0.193< 0.001< 0.001< 0.001< 0.001< 0.001
2.3 添加外源性Cu2+后NPC 细胞MAPK-ERK 通路的活化情况 Western Blot 结果显示,无论放疗前后,与对照组相比,Cu2+组的CNE1 细胞内RAS蛋白、磷酸化的RAF 蛋白(P-RAF)和磷酸化的ERK1/2 蛋白(P-ERK1/2)蛋白表达上调,P-RAF/RAF 比值和P-ERK/ERK 比值升高(图2)。

图2 NPC 细胞内Cu2+引起MAPK-ERK 通路活化Fig.2 Copper ions activate MAPK-ERK pathway in NPC cells
2.4 MAPK-ERK 通路抑制剂逆转Cu2+介导的NPC放疗抵抗 CCK-8实验结果显示,使用MAPKERK 通路抑制剂SCH772984 可以逆转Cu2+引起的NPC 放疗抵抗性(表4)。克隆形成实验中,与Cu2+组相比,Cu2++ SCH772984 组在放疗后存活分数下降(图3A)。Western Blot 结果显示,与Cu2+组相比,联合使用Cu2+与SCH772984 能加剧放疗引起的NPC 细胞DNA 双链损伤(图3B)。

图3 抑制MAPK-ERK 通路逆转了Cu2+依赖性放疗抵抗Fig.3 Inhibition of MAPK-ERK pathway reverses copper ion-dependent radioresistance
表4 MAPK-ERK 通路抑制剂对CNE1 细胞存活率的影响Tab.4 Effect of MAPK-ERK pathway inhibitors on the cell viability of CNE1 ±s,%

表4 MAPK-ERK 通路抑制剂对CNE1 细胞存活率的影响Tab.4 Effect of MAPK-ERK pathway inhibitors on the cell viability of CNE1 ±s,%
组别Cu2+组Cu2++SCH772984组t值P值细胞存活率未放射100.00 ± 2.66 99.94 ± 3.78 0.03 0.977 5 Gy放射69.56 ± 2.47 45.12 ± 3.83 3.14< 0.001
3 讨论
放射治疗是NPC 最主要的治疗方式[2],探索NPC 放疗抵抗的机制不仅可以保证肿瘤局控率,还能够减少正常组织的放射损伤[20]。既往研究显示,Cu2+含量是调节肿瘤放射敏感性的重要因素。HSU 等[8]发现NPC 患者的血清铜水平明显高于正常人,在放疗期间和放疗后血清铜水平下降。TESSMER 等[21]发现患者血清Cu2+水平与霍奇金淋巴瘤的放射治疗效果密切相关,靶向Cu2+能有效降低肿瘤放射抵抗性。在肝细胞癌中,细胞内Cu2+通过促进铜相关蛋白的表达影响放射敏感性[13]。本研究发现,NPC 细胞内Cu2+水平较正常鼻咽上皮细胞显著升高,且Cu2+含量与NPC 的放疗抵抗性具有密切关系。然而,过量的Cu2+摄取也会导致细胞损伤和死亡。本研究发现NPC 细胞CNE1 在暴露于50 μmol/L 及以上的Cu2+时,会受到明显的毒性作用。之前的研究[22]也表明,当体内的Cu2+含量过高,可能通过引发活性氧(ROS)的产生或抑制蛋白酶体的功能导致细胞凋亡。除此之外,细胞内Cu2+的积累还可能诱导谷胱甘肽过氧化物酶4(GPX4)自噬降解,进而引发铁死亡[23]。这些发现不仅揭示了过量的Cu2+对细胞正常功能的影响,同时也为探索相关疾病的发生提供了新的视角。
此外,Cu2+水平的上升在促进肿瘤氧化磷酸化和生长、促进血管生成及抑制肿瘤细胞的凋亡中起着不可或缺的作用[24-26]。研究显示,铜与肿瘤细胞中的多个信号通路相关。HE 等[27]发现Cu2+可以直接结合并激活受体酪氨酸激酶(RTK),促进下游细胞外调节蛋白激酶(ERK)的磷酸化,导致细胞迁移。Cu2+还能通过作用于PI3K-AKT 信号通路的数个不同分子引起下游激活[28]。此外,MAPK 信号通路的激活依赖于Cu2+。BRADY 等[29]证实Cu2+通过直接结合激活MAPK 激酶,促进了下游ERK 的磷酸化,促进细胞增殖和血管生成,突变MEK1 的铜结合位点可以抑制ERK 的激活,这与较早前TURKISH 等[30]的研究结果一致。ZHANG等[31]发现抑制细胞对铜的摄取或使用特异性MAPK 抑制剂均可阻断铜诱导的细胞增殖。这些研究表明,Cu2+可以通过激活MAPK-ERK 信号通路发挥促肿瘤效应。在本研究中,一系列的实验证明Cu2+能够激活MAPK-ERK 通路,降低NPC 对放射线的敏感性。使用MAPK-ERK 通路抑制剂可以逆转Cu2+介导的放疗抵抗性。因此,降低NPC患者体内Cu2+水平可能是增强其放射敏感性、预防局部残留及复发的有效途径。
随着“铜死亡”这一新概念的提出及对其机制的深入研究,调节Cu2+水平已逐渐成为抗癌研究的新靶点[32]。体内应用铜螯合剂能够直接降低Cu2+水平,发挥抑制肿瘤的作用。CHAN等[33]对75例通过口服铜螯合剂四硫钼酸盐(TM)进行铜耗竭治疗的乳腺癌患者进行研究,结果显示铜耗竭治疗组患者的内皮祖细胞(EPCs)和赖氨酰氧化酶样蛋白2(LOXL-2)含量明显下降。在小鼠乳腺癌模型中,经TM 处理后的小鼠肺中的赖氨酸氧化酶(LOX)和胶原沉积均减少,肺转移发生率显著下降。当TM 用于联合治疗时,可显著增强激酶抑制剂药物对致癌信号通路的作用,尤其是MAPK 信号通路[29,34]。然而,目前大部分铜螯合剂均是采用全身给药,容易导致体内Cu2+浓度过低,产生不良反应。因此,使用靶向铜转运蛋白或铜伴侣蛋白的药物或许是更加安全的治疗手段[35],应成为未来研究的重点。
本研究发现Cu2+在正常鼻咽上皮细胞及NPC细胞中存在浓度差异,证实了在极量以内Cu2+能激活MAPK-ERK 信号转导通路,促进NPC 放疗抵抗,这些发现为NPC 放疗增敏治疗提供了新的观点。但本研究尚未在动物模型中验证Cu2+对NPC放射敏感性的影响,对MAPK-ERK 通路在NPC 细胞中调控放射敏感性的具体作用机制仍未完全阐明,后续仍需更深层次的探索。此外,MAPK-ERK通路的激活不仅与细胞的生长、侵袭、转移相关[17,36],还能调节机体的免疫反应[37-38]。因此,后续研究可以综合考量MAPK-ERK 通路的复杂调控作用,进一步探索Cu2+促进肿瘤发生、发展的机制,以期为临床治疗NPC 提供新的思路。
【Author contributions】HUANG Xiuting performed the experiments and wrote the initial draft of the paper. LIN Jie performed the experiments and data analysis. YE Xiaoxin and CAI Jiazuo performed the validation and revised the article. YUAN Yawei designed the study, interpreted the results and reviewed the article. All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
