血管生成素样蛋白8敲除减轻脂多糖诱导的肝脏脂质沉积
2024-05-18罗珊冯莹范丹丹郑雯鑫郭兴荣阮绪芝
罗珊 冯莹 范丹丹 郑雯鑫 郭兴荣 阮绪芝
1湖北医药学院基础医学院附属太和医院,胚胎干细胞研究湖北省重点实验室,脐带血造血干细胞治疗临床医学研究中心(湖北十堰 442000);2湖北省十堰市太和医院内分泌风湿免疫科(湖北十堰 442000);湖北医药学院3生物医学工程学院,4全科医学院(湖北十堰 442000)
脓毒症是由侵入机体的病原微生物引发的全身炎症反应,病原菌产生的内、外毒素及多种炎症介质可导致多器官功能障碍综合征,是住院患者病残和死亡的主要原因[1]。尽管近年来对脓毒症发病机制的认识不断加深、治疗手段逐步提高,但其病死率仍然居高不下[2]。由于肝脏是平衡宿主体内平衡和调节宿主防御作用的重要器官,因此成为脓毒症中关键“靶器官”[3]。研究[4]表明,机体发生感染时,脂肪组织释放的游离脂肪酸(FFAs)和甘油进入血液。正常情况下,FFAs主要被肝脏摄取进入β-氧化过程,产生能量和代谢中间化合物。但是脓毒症小鼠肝脏β-氧化过程受阻,进而引起脂质堆积和脂肪毒性[5]。因此,探究脓毒症中肝脏β-氧化过程等代谢的调节机制,进而开发针对性的干预治疗措施,既可以改善能量供应、也可以缓解脓毒症引起的肝脏毒性损伤,具有重要的临床意义。
血管生成素样蛋白8(ANGPTL8)是最新发现的ANGPTLs 家族成员,主要在肝脏和棕色脂肪组织表达[6]。研究[7-9]表明,ANGPTL8 在急性肝损伤、肝纤维化和肝癌中通过调节糖脂代谢和炎症反应发挥重要作用。但是ANGPTL8 在脓毒症脂代谢紊乱中的作用未见报道。本研究致力于探讨ANGPTL8 在脓毒症小鼠肝脏脂质沉积和过氧化中的作用及机制,为脓毒症相关性肝损伤的预防和治疗提供新的作用靶点。
1 材料与方法
1.1 材料
1.1.1 动物 6 ~ 8 周龄雄性C57BL/6J 小鼠,购自湖北医药学院实验动物中心,均饲养在SPF 级动物房中,可自由获取水和食物,温度维持在(23 ±1 )℃,湿度维持在50% ~ 60%,光/暗循环12 h。所有动物实验经湖北医药学院动物伦理委员会批准[批准号:SYXK(鄂)2023-085]。
1.1.2 材料与仪器 Trizol 总RNA 提取试剂(R1000)、反转录试剂盒(F0202)、2x Realab Green qPCR Fast mixture(R0202)、LPS(L2880)购于兰博利德公司。ANGPTL8 抗体(ab180915)、CAV1 抗体(K110092P)分别购于abcam、北京索莱宝公司。改良油红O 染色试剂盒(G1261)购于北京索莱宝公司。谷丙转氨酶(ALT/GPT)(C009-2-1)、谷草转氨酶(AST/GOP)(C010-2-1)、甘油三酯(TG)(A110-1-1)和丙二醛(MDA)(A003-1-2)测定试剂盒购于南京建成生物工程研究所。TUNEL 细胞凋亡检测试剂盒(C1089)、 Cy3 标记山羊抗兔IgG(H+L)(A0516)、辣根过氧化物酶标记山羊抗兔IgG(H+L)(A0208)、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(A0216)、4%多聚甲醛固定液(P0099)购于碧云天生物技术有限公司。ChemiDocTM、CFX ConnectTM、荧光定量PCR检测系统均购自BIORAD,NanoDrop 分光光度计、多功能酶标仪购自Thermo Scientific,DMi8 荧光显微镜、冰冻切片机CM1950 均购自Leica。
1.2 实验方法
1.2.1 模型构建 (1)脓毒症小鼠模型构建:取6 ~8 周龄野生型小鼠12 只,给予单次腹腔注射LPS(10 mg/kg)构建脓毒症小鼠模型,分别于造模后0、24、48 h(每个时间点3只)取外周血和肝脏组织,分离血清,-80 ℃保存备用。取6 ~ 8周龄ANGPTL8敲除小鼠和对照小鼠各8 只,构建脓毒症小鼠模型,分别于造模后0 h 和48 h(每个时间点4 只)取外周血和肝脏组织,分离血清,-80 ℃保存备用。(2)HepG2 细胞模型构建:HepG2 细胞传代贴壁后,给予LPS(4 μg/mL)刺激,分别于处理0、4、8、12、24 h 后检测ANGPTL8 的表达。
1.2.2 ALT、AST、TG 和MDA 检测 按照ALT、AST 测试盒说明书步骤,取5 μL 小鼠血清加入到96 孔板测定孔中,分别加入ALT、AST 基质液,酶标仪测定OD值后根据标准曲线计算ALT、AST 含量,评估小鼠肝功能。取小鼠肝组织100 mg 加生理盐水900 μL 制备肝组织匀浆液,按照TG、MDA测试盒说明书步骤进行加样孵育,酶标仪测定OD值后计算TG 和MDA 含量,评估小鼠肝脏脂肪含量及脂质过氧化指标。
1.2.3 肝组织HE、油红O 染色和肝脏细胞凋亡检测 取小鼠肝左侧叶,固定后石蜡包埋切片,厚度为4 μm,行HE 染色,显微镜下观察肝脏组织病理学改变;取小鼠肝右侧叶,经固定、脱水后,冰冻切片,厚度为5 μm,参照改良油红O 染色试剂盒步骤进行油红O 及苏木素染色,漂洗后显微镜下观察肝组织脂质沉积程度;将上述冰冻切片参照TUNEL 试剂盒步骤进行染色,光学显微镜观察阳性细胞数量,并进行统计评估肝细胞凋亡水平。
1.2.4 免疫荧光技术检测ANGPTL8 的表达 取LPS(4 μg/mL)处理24 h 的HepG2 细胞,免疫固定液固定15 min,漂洗后山羊血清室温封闭1 h,过夜孵育一抗(ANGPTL8),室温避光孵育二抗(Cy3标记山羊抗兔IgG(H + L)2 h,漂洗后光学显微镜观察分析ANGPTL8 的表达量。
1.2.5 RNA-seq测序筛选关键差异基因 取WT和ANGPTL8 KO 脓毒症小鼠的肝脏组织,送至华大基因进行RNA-seq 测序,将组织样品进行破碎裂解、抽提纯化后制备mRNA 文库,后续使用华大基因Dr. Tom 多组学数据挖掘系统进行数据分析、绘图及挖掘。使用DESeq2 (v1.4.5)进行差异基因检测,条件为P≤ 0.05,并使用pheatmap (v1.0.8)绘制基因在不同样本中的表达量聚类热图,条件为P≤ 0.05 且|logFC| > 1。
1.2.6 实时荧光定量PCR 检测ANGPTL8、CAV1的mRNA 水平 应用Primer Premier 5 设计引物,引物序列如下:actin(H)-F:5'CCTGGCACCCAGCACAAT 3',actin(H)-R:5'GGGCCGGACTCGTCATAC 3';actin(M)-F:5'GTGCTATGTTGCTCTAGACTTCG 3',actin(M)-R:5'ATGCCACAGGATTCCATACC 3';ANGPTL8(H)-F:5'GCACAATAGAACTCCTGGGGC 3',ANGPTL8(H)-R:5'CCTCCTCCATCTGAGTCTCCAAC 3';ANGPTL8(M)-F:5'CTGCCTCCTGTGGACCTTAG 3',ANGPTL8(M)-R:5' TCTGTACACGCCATTGAGGG 3';CAV1(M)-F:5' GAACCAGAAGGGACACACAG 3',CAV1(M)-R:5' GGAAAGAGAGAATGGCGAAG 3'。取上述LPS 处理过的小鼠肝组织和HepG2 细胞,提取总RNA,反转录为cDNA,染料法荧光定量PCR 检测,根据2-ΔΔCT法计算分析。
1.2.7 蛋白免疫印迹(Western blot)检测CAV1 水平 称取10 mg 小鼠肝组织,经含磷酸酶蛋白酶抑制剂的RIPA 裂解液500 μL 冰上裂解1 h,离心后取上清液,加入上样缓冲液后水浴(100 ℃)10 min制备蛋白样品。蛋白样品经电泳分离,半干转法将蛋白转印至PVDF 膜,封闭液室温封闭20 min 后依次孵育一抗和二抗,洗膜后进行曝光显影,进行分析统计。
1.3 统计学方法 本研究通过GraphPad Prism 8.3分析数据,计量资料均采用均数±标准差来表示。多组间比较采用单因素方差分析,以P< 0.05 为差异有统计学意义。
2 结果
2.1 LPS诱导的脓毒症小鼠肝脏脂质异常沉积 通过LPS(10 mg/kg)腹腔注射诱导脓毒症小鼠模型,分别收取对照组和模型组小鼠外周血和肝脏组织。肝脏HE 染色发现LPS 刺激24 h 出现细胞水肿,48 h 出现小泡性脂肪变;肝脏油红O染色结果显示24 h 和48 h 脂滴明显(图1A)。血清ALT 和AST 检测结果显示LPS 诱导后24 h、48 h ALT 和AST 均明显上调(图1B)。检测肝组织匀浆液TG 及MDA 含量可反映肝脏脂质沉积及脂质过氧化损伤程度,结果显示LPS处理后24 h和48 h 肝匀浆TG及MDA显著高于对照组(图1C)。以上结果表明,LPS诱导的脓毒症小鼠肝脏脂质代谢紊乱及肝功能异常。

图1 LPS 诱导的脓毒症肝脏脂质异常沉积Fig.1 LPS induced abnormal lipid deposition in septic liver
2.2 LPS上调ANGPTL8表达 为了明确ANGPTL8在LPS 诱导脓毒症小鼠肝脏中的表达水平,提取肝脏组织总RNA,利用qPCR 检测ANGPTL8的mRNA表达。结果显示,LPS 刺激后48 h ANGPTL8 的mRNA表达显著高于对照组(图2A)。随后利用LPS刺激HepG2 细胞体外构建急性炎症损伤细胞模型,通过qPCR 和免疫荧光检测LPS 刺激不同时间ANGPTL8的表达。结果显示,LPS刺激24 h,HepG2细胞ANGPTL8 表达显著高于对照组(图2B-C)。提示ANGPTL8 在LPS 刺激后表达明显上调,其可能在LPS 诱导的脓毒症肝损伤中发挥重要作用。抑制ANGPTL8 表达可能对肝脏具有保护作用。
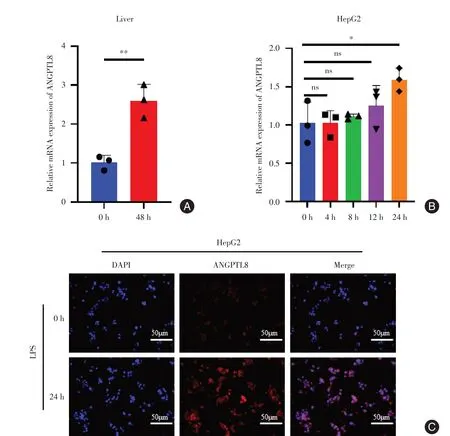
图2 LPS 上调ANGPTL8 的表达Fig.2 LPS upregulates the expression of ANGPTL8
2.3 ANGPTL8 缺失减轻LPS 对小鼠肝脏脂质沉积的作用 利用ANGPTL8 敲除小鼠和对照小鼠构建脓毒症小鼠模型,肝脏HE 染色和油红O 染色显示,LPS 刺激48 h,较WT 小鼠,ANGPTL8 敲除小鼠肝脏病变和脂质沉积明显减轻(图3A)。血清检测结果表明,LPS 刺激48 h,ANGPTL8 敲除小鼠肝功能指标ALT、AST水平显著低于WT小鼠(图3B)。此外我们还发现,LPS刺激48 h时ANGPTL8敲除小鼠肝匀浆TG及MDA含量显著低于WT小鼠(图3C)。以上结果表明抑制ANGPTL8 可减轻LPS 导致的肝功能异常及肝脏脂质异常沉积和过氧化。

图3 ANGPTL8 缺失减轻LPS 对肝脏脂质沉积的作用Fig. 3 ANGPTL8 knockout attenuates LPS- induced hepatic lipid deposition
2.4 ANGPTL8 的缺失抑制LPS 诱导的肝细胞凋亡 取上述脓毒症小鼠肝脏组织,行冰冻切片组织TUNEL 染色。在LPS 诱导48 h 后,对TUNEL阳性细胞进行统计分析,结果显示,ANGPTL8 敲除小鼠肝细胞阳性细胞数量明显低于对照小鼠(图4),提示ANGPTL8 的缺失抑制LPS 诱导的肝细胞凋亡。
2.5 脓毒症ANGPTL8 敲除小鼠和WT 小鼠肝脏组织RNA-seq 分析 为进一步明确ANGPTL8在脓毒症小鼠肝脏脂代谢紊乱中的作用机制,我们将LPS 刺激48 h 的ANGPTL8 敲除小鼠和对照小鼠肝脏组织进行RNA-seq 测序。分析发现差异基因大都与脂肪代谢相关。其中CAV1 基因在ANGPTL8敲除小鼠肝脏表达显著高于WT小鼠(图5A-B),而其编码的Caveolin-1 蛋白是细胞膜穴样凹陷的标志性结构蛋白,是脂肪细胞质膜上的主要脂肪酸结合蛋白,在游离脂肪酸和甘油三酯脂滴的运输或储存中[10]。利用qPCR 及Western blot 验证CAV1的表达,结果显示,LPS 刺激后,ANGPTL8 敲除小鼠肝脏CAV1 表达较WT 小鼠明显上调(图5C、D)。上述结果表明,ANGPTL8 缺失可能通过上调肝脏CAV1 的表达从而减轻LPS 诱导的肝脏脂质沉积和过氧化。

图5 ANGPTL8 抑制LPS 诱导脓毒症肝脏CAV1 的表达Fig. 5 ANGPTL8 inhibits CAV1 expression in LPS -induced septic liver
3 讨论
脓毒症可激活机体的免疫反应,引起全身异常免疫反应和炎症风暴,进一步诱导细胞功能障碍和凋亡和组织特异性破坏,导致多器官功能障碍和死亡[11]。肝脏作为机体重要的免疫应答器官,在调节内环境稳态、宿主防御激活及代谢等场所中发挥关键作用[12-13]。早期的研究[14]认为,肝损伤是脓毒症的终末期特征,主要表现为转氨酶升高和黄疸。但是越来越多的证据表明,在脓毒症早期,肝脏的生物转化和转运功能已经受损,导致肝细胞中胆红素、胆汁酸和外源性有害物质积累,胆汁酸结合能力和药物代谢受到干扰[15]。脓毒症相关性肝损伤短期死亡率高,预后差,治疗的挑战之一是目前临床缺乏脓毒症肝损伤的早期诊断标志物。因此,探索脓毒症肝损伤的发病机制,对于其早期预防和治疗进而改善患者预后至关重要。
脓毒症期间,免疫系统的强烈激活和许多患者的不理想喂养状态导致了一种能量剥夺状态,从而导致饥饿反应。一线能量供应分子,如糖原和葡萄糖在数小时内耗尽,并由脂肪组织释放的脂质补充[16]。多项研究[17-18]证实,脓毒症患者和动物模型的肌肉、肝脏和心脏ATP/ADP 比值大幅度下降,而活化能量代谢通路可以减轻脓毒症小鼠肾功能障碍、增加生存率。最新研究[7]表明,ANGPTL8 敲除可抑制高脂喂养引起的肝脏炎症、脂肪变性和肝纤维化。本研究结果表明LPS 可使肝脏ANGPTL8的表达增加,ANGPTL8 缺失可减轻脓毒症小鼠肝功能异常、肝组织细胞凋亡和脂肪变性。因此,ANGPTL8 可能介导脓毒症相关肝脏脂质代谢紊乱,抑制其表达可以改善肝脏脂肪代谢,进一步减轻脂质过氧化导致的肝脏毒性损伤。
CAV1 是质膜小窝的结构蛋白,能够从质膜转移到脂肪细胞脂滴,有助于调节脂质储存,与肝脏脂质积累、脂质和葡萄糖代谢、线粒体生物学和肝细胞增殖的调节密切相关[10,19-20]。有文献[21-23]报道,人类CAV1 纯合致病变异,可导致先天性全身性脂肪营养不良;小鼠CAV1 缺失可诱导进行性脂肪营养不良伴胰岛素抵抗和高甘油三酯血症;非酒精性脂肪肝病患者和高脂喂养的小鼠肝脏CAV1 的表达降低。本研究通过肝脏RNA-seq发现LPS刺激后,ANGPTL8 KO 小鼠肝脏组织CAV1 的mRNA 和蛋白表达均显著高于WT 小鼠。因此推测ANGPTL8 可能通过抑制CAV1 介导脓毒症小鼠肝脏脂质代谢紊乱。
综上所述,本研究表明,ANGPTL8 缺失通过上调CAV1 抑制肝脏脂质沉积、脂质过氧化和细胞凋亡,进而减轻肝脏损伤和功能障碍。因此,ANGPTL8 血清学检测及其抑制剂在脓毒症肝损伤的防治中具有重要应用价值。鉴于ANGPTL8 是一种分泌蛋白,而脓毒症属于全身炎症反应综合征,ANGPTL8 是否在脓毒症其他器官(肺脏、肾脏和心脏等)损伤中发挥作用还需要深入研究。
【Author contributions】LUO Shan performed the experiments and wrote the article. FENG Ying, FAN Dandan and ZHEN Wenxin performed the experiments. GUO Xingrong revised the article. RUAN Xuzhi designed the study and reviewed the article. All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
