探讨PD-1抑制剂联合艾坦在三阴性乳腺癌小鼠模型中的应答差异
2024-05-14徐忠玲
王 珏 王 睿 张 程 徐忠玲
齐齐哈尔医学院附属第三医院肿瘤一科,黑龙江齐齐哈尔 161000
乳腺癌位于女性恶性肿瘤之首,侵袭和转移是导致乳腺癌治疗失败或复发的主要原因[1]。三阴性乳腺癌(triple negative breast cancer,TNBC)作为乳腺癌的一个亚型,以雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人类表皮细胞生长因子受体2(human epidermal growth factor receptor 2,HER2)缺乏为主要特征[2],在各种亚型中具有最高的病死率和复发率。TNBC对激素和靶向治疗均不敏感,目前主要采取传统的化疗手段,但治疗效果较差。基因组不稳定性和高突变负荷使免疫浸润处于较高水平,从而使TNBC成为乳腺癌亚型中免疫原性最强的亚型[3]。TNBC相较于其他亚型,突出的特点是肿瘤浸润淋巴细胞(tumorinfiltrating lymphocyte,TILs)和程序性死亡受体1(programmed cell death 1,PD-1)高表达,有研究显示,程序性死亡-配体1(programmed cell deathligand 1,PD-L1)是TNBC患者预后的独立危险因素[4]。从TNBC的特点及PD-1抑制剂有效性出发,考虑采用PD-1抑制剂治疗TNBC,但PD-1抑制剂单药使用反应率一般不高,且不对所有的肿瘤类型有效,还存在继发耐药现象。本研究采用PD-1抑制剂联合艾坦,探讨其在TNBC小鼠模型中的应答差异。
1 材料与方法
1.1 实验材料
8周龄雌性BALB/c小鼠32只,体重18~22 g,由中国食品药品检定研究院提供,许可证号:SCXK(京)2019-0017;4T1小鼠乳腺癌细胞由上海弘顺生物科技有限公司提供;艾坦片(艾坦)购于江苏恒瑞医药股份有限公司,国药准字H20140103;PD-1抑制剂(拓益JS001)购于君实生物。本研究经过医院动物医学伦理委员会批准(伦理审批号:202215)。
1.2 TNBC荷瘤小鼠模型构建
取32只雌性 BALB/c小鼠,禁食饲养12 h后采用2%戊巴比妥腹腔注射麻醉(4 μl/g),将4T1细胞按3×106/ml浓度接种于腋下胸骨前缘乳腺脂肪垫,每只0.1 ml,观察接种部位,3 d后出现直径2~4 mm大小瘤结节,成瘤后7~10 d游标卡尺测量瘤体长径和短径计算瘤体体积=(瘤体长径×瘤体短径2)/2,肿瘤体积在100 mm3以上为造模成功。
1.3 实验分组及给药
将32只TNBC模型小鼠随机分为模型组、PD-1抑制剂组、艾坦组和联合组,每组各8只。PD-1抑制剂组给予PD-1抑制剂200 μg/只,经腹膜内注射,成瘤后2周和4周各给药1次。艾坦组给予艾坦片20 mg/kg灌胃,1次/d,成瘤后次日开始给药,连续28 d。联合组按照PD-1抑制剂组和艾坦组剂量同时给药。模型组给予等体积蒸馏水灌胃。
1.4 观察指标及评价标准
1.4.1 计算各组小鼠瘤体体积和抑瘤率 成瘤后7、14、21、28 d于体外采用游标卡尺测量瘤体长径和短径,计算瘤体体积和抑瘤率,抑瘤率=(模型组瘤体体积-干预组瘤体体积)/模型组瘤体体积×100%。
1.4.2 检测血清、肿瘤组织中PD-L1表达 末次给药后心脏采血,2500 r/min离心分离15 min后取上清液,采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)(美国Abcam公司,ab279408)检测血清PD-L1水平。次日脱颈椎处死小鼠,剥瘤称重后切取肿瘤组织标本,10%甲醛溶液固定,常规脱水,石蜡包埋及连续切片(厚度2 μm),EnVision 两步法染色步骤严格按照免疫组化试剂盒(美国DAKO公司,GK500705)说明书方法,PD-L1(美国Abcam公司,ab205921)均按1∶100稀释加入一抗工作液,以PBS缓冲液代替作为阴性对照组。一抗滴加后孵育1 h,PBS冲洗5 min×3次加入二抗,孵育30 min后再次冲洗加入二氨基联苯胺(diaminobenzidine,DAB)显色液,显微镜下观察显色情况。随机取3个高倍镜视野(400×),若染色的细胞数目占肿瘤细胞总数的百分比≥1%,则定义为阳性,否则为阴性[5]。
1.5 统计学方法
采用SPSS 23.0统计学软件进行数据分析,计量资料均符合正态分布,以均数±标准差()表示,两两比较采用LSD-t检验,P< 0.05为差异有统计学意义。
2 结果
2.1 各组小鼠瘤体体积和抑瘤率比较
造模后7 d,模型组小鼠瘤体生长较快,而PD-1抑制剂组、艾坦组和联合组小鼠瘤体生长较慢,与模型组比较差异有统计学意义(P< 0.05)。造模14 d,模型组小鼠瘤体迅速生长,而PD-1抑制剂组、艾坦组和联合组小鼠瘤体生长受到明显抑制,与模型组比较差异有统计学意义(P< 0.05);联合组小鼠瘤体明显小于PD-1抑制剂组、艾坦组(P< 0.05)。造模21、28 d,模型组小鼠瘤体生长速度放缓,PD-1抑制剂组、艾坦组和联合组小鼠瘤体生长速度受到抑制,与模型组比较差异有统计学意义(P< 0.05);联合组小鼠瘤体明显小于PD-1抑制剂组、艾坦组(P< 0.05)。造模后28 d,联合组抑瘤率明显高于PD-1抑制剂组、艾坦组,差异有统计学意义(P< 0.05)。见表1、图1。
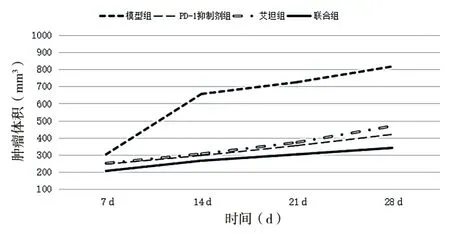
图1 肿瘤体积生长曲线
表1 造模后各组肿瘤体积和28 d抑瘤率比较()
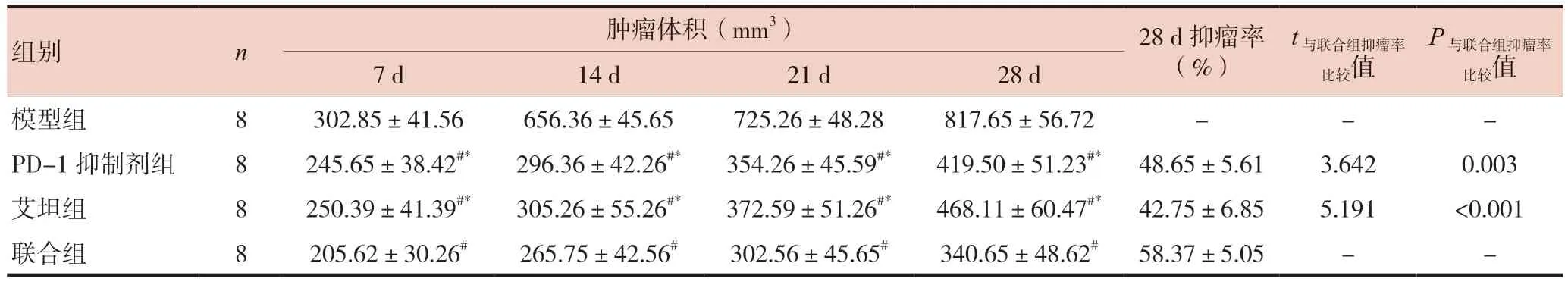
表1 造模后各组肿瘤体积和28 d抑瘤率比较()
注 与模型组比较,#P < 0.05;与联合组比较,*P < 0.05;“-”为无数据;PD-1:程序性死亡受体1;PD-L1:程序性死亡-配体1
组别n肿瘤体积(mm3)28 d抑瘤率(%)t与联合组抑瘤率P与联合组抑瘤率7 d14 d21 d28 d模型组8302.85±41.56656.36±45.65725.26±48.28817.65±56.72---PD-1抑制剂组8245.65±38.42#*296.36±42.26#*354.26±45.59#*419.50±51.23#*48.65±5.613.6420.003艾坦组8250.39±41.39#*305.26±55.26#*372.59±51.26#*468.11±60.47#*42.75±6.855.191<0.001联合组8205.62±30.26#265.75±42.56#302.56±45.65#340.65±48.62#58.37±5.05--比较值比较值
2.2 各组小鼠血清、瘤体组织中PD-L1表达比较
PD-1抑制剂组和联合组血清PD-L1和肿瘤PD-L1阳性率均明显高于模型组和艾坦组,差异有统计学意义(P< 0.05);PD-1抑制剂组和联合组血清PD-L1和肿瘤PD-L1阳性率比较差异无统计学意义(P> 0.05)。见表2、图2。
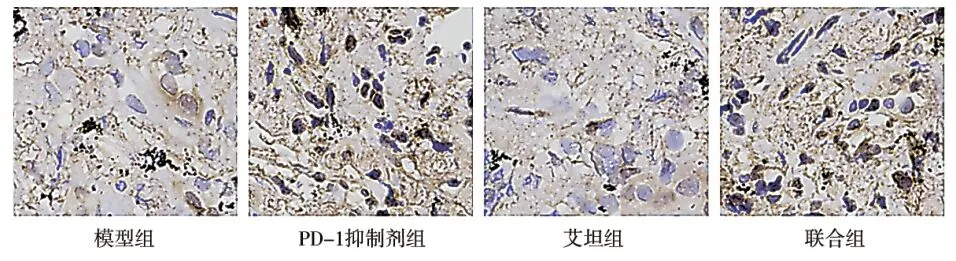
图2 PD-L1免疫组化结果(400×)
表2 各组小鼠血清、瘤体组织中PD-L1表达比较()
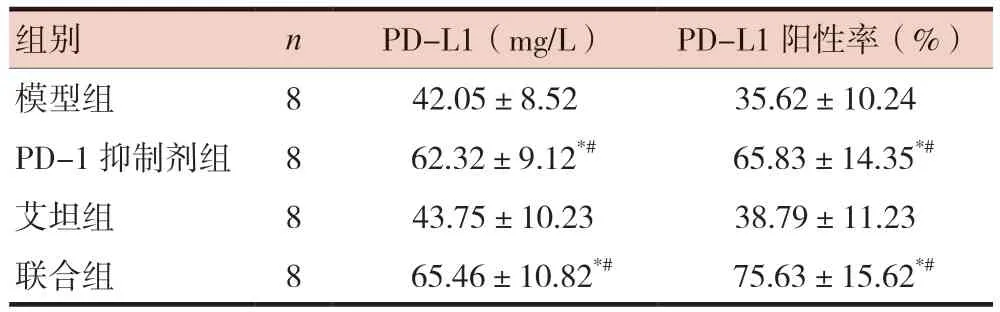
表2 各组小鼠血清、瘤体组织中PD-L1表达比较()
注 与模型组比较,*P < 0.05;与艾坦组比较,#P < 0.05;PD-1:程序性死亡受体1;PD-L1:程序性死亡-配体1
组别nPD-L1(mg/L)PD-L1阳性率(%)模型组842.05±8.5235.62±10.24 PD-1抑制剂组8 62.32±9.12*# 65.83±14.35*#艾坦组8 43.75±10.2338.79±11.23联合组8 65.46±10.82*# 75.63±15.62*#
3 讨论
PD-1抑制剂等免疫检验点抗体药物能够激活效应T淋巴细胞,阻断肿瘤免疫抑制机制,从而识别并杀死肿瘤细胞[6],是肿瘤免疫治疗的新方法,被批准用于肝癌、肾癌、肺癌等10余种恶性肿瘤的治疗,取得一定的效果。艾坦是一款我国自行研制的通过抑制肿瘤血管生成发挥抗癌效果的药物,目前已在晚期食管癌、胃癌等多种癌症中应用,Ⅱ期临床试验结果显示艾坦在晚期乳腺癌中取得效果[7-8]。
PD-L1是PD-1的配体,也是B7家族重要成员,而B7家族则是免疫反应中极为重要的协同刺激分子[9]。PD-L1主要在淋巴细胞、内皮细胞、树突状细胞(dendritic cell,DC)及其他重要脏器中表达。相关研究显示,PD-1/PD-L1通路对T细胞、Til、DC等均具有不同的调控作用[10]。PD-1/PD-L1在肺癌、黑色素瘤等多种恶性肿瘤中均有表达[11]。黄婉莹等[12]研究证实,TNBC患者肿瘤细胞中PD-1、PD-L1高表达,且与淋巴结转移、TILs表达呈正相关。肿瘤微环境及肿瘤细胞通过上调PD-L1表达与CD8+T细胞表面的PD-1结合限制免疫反应[13]。对于肿瘤细胞上调PD-L1表达的途径,主要有以下几个观点:①编码PD-L1的基因扩增;②PI3K-AKT通路、EGFR/MAPK通路、INFγ-JAK-STAT通路等激活,活化与PD-L1基因启动因子相关的转录因子[14];③EB病毒诱导;④表观遗传学机制。
祝梦姣等[15]研究显示,抗PD-1/PD-L1免疫检查点的双重阻滞可能是TNBC免疫治疗的突破口。钟恋君等[16]研究认为PD-L1可作为TNBC的治疗靶点及预后生物标志物。佟玲等[17]研究显示,阿帕替尼通过抑制乳腺细胞癌ERK1/2信号通路,抑制乳腺癌小鼠瘤体的生长。本研究从PD-1抑制剂和艾坦联合干预出发,探讨其抗肿瘤效果。对各组小鼠瘤体体积和抑瘤率的观察和比较发现,PD-1抑制剂、艾坦干预的TNBC小鼠模型瘤体生长受到明显抑制,联合组抑制效果更加明显,证实PD-1抑制剂联合艾坦在TNBC小鼠的抗肿瘤治疗中能够起到协同的作用。肿瘤细胞PD-L1表达水平越高,表示肿瘤通过PD-1/PD-L1信号通路发生免疫逃逸的可能性就越高[18],因此PD-L1可作为PD-1抑制剂治疗效果的预测因子。本研究中,PD-1抑制剂组和联合组血清PD-L1表达水平明显高于模型组和艾坦组,差异有统计学意义(P< 0.05),证实PD-1抑制剂在TNBC模型小鼠的干预中发挥良好的效果。而艾坦组血清PD-L1表达水平与模型组比较差异无统计学意义(P> 0.05),提示艾坦通过其他方面的机制进行抗肿瘤治疗,与PD-1抑制剂作用机制重合的可能性较低。
本研究不足之处在于并未对PD-1抑制剂可能的作用机制展开深入的研究,在今后的研究中着重于此展开研究。
综上所述,PD-1抑制剂联合艾坦在TNBC治疗中具有协同抗肿瘤作用,能有效抑制肿瘤生长,能为TNBC治疗提供新的思路。
