PET示踪剂在阿尔茨海默病早期诊断中的研究进展
2024-05-10刘文清刘明松杨莎马文杰朱华结徐志栋
刘文清 刘明松 杨莎 马文杰 朱华结 徐志栋
摘 要:阿尔茨海默病(Alzheimer′s disease,AD)是一种发病机理极其复杂的神经退行性疾病,以认知功能障碍和记忆丧失为特征,涉及多种生理、病理过程。早期诊断是AD预防和治疗的关键。正电子发射断层成像(PET)技术能够在分子层面准确检测神经元与脑组织中细微的生理变化,为AD早期诊断提供依据。从生物标志物的分类入手,介绍了脑中蛋白变性与神经元损伤的相关靶点,根据亲和力、半衰期、结合区域、药代动力学、分析方法以及结果相关性等几个重要参数,综述了各类PET示踪剂的研究现状,指出目前PET示踪剂开发面临的问题,认为未来研究应从以下几个方面展开:神经炎症相关PET示踪剂的开发;已有示踪剂的进一步评估和优化;示踪剂结果分析方法的规范化和标准化。
关键词:医学影像学;正电子发射断层成像技术;PET示踪剂;阿尔茨海默病;临床诊断
中图分类号:R811.3 文献标识码:A 文章编号:1008-1542(2024)02-0181-08
Research progress of PET tracer in early diagnosis of Alzheimer′s disease
LIU Wenqing1,2,LIU Mingsong1,2, YANG Sha1,2, MA Wenjie1,2, ZHU Huajie1,2, XU Zhidong1,2
(1.School of Chemical and Pharmaceutical Engineering, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018,China;2.Key Laboratory of Molecular Chemistry for Medicine of Hebei Province, Shijiazhuang, Hebei 050018, China)
Abstract:Alzheimer′s disease (AD) is a neurodegenerative disease with extremely complex pathogenesis, characterized by cognitive dysfunction and memory loss, involving in a variety of physiological and pathophysiological processes. Early diagnosis is a key factor for the prevention and treatment of AD. Positron emission tomography (PET) technology can accurately detect subtle physiological changes in neurons and brain tissues at the molecular level, providing evidence for early diagnosis of AD. Starting from the classification of biomarkers, the relevant targets of protein degeneration and neuronal damage in the brain were introduced, and the research status of various PET tracers was reviewed according to several important parameters such as affinity, half-life, binding region, pharmacokinetics, analysis method and correlation of results, etc. Additionally, the current problems faced by the development of PET tracers were pointed out, and it was believed that future research should be carried out from the following aspects: [JP2]The development of PET tracers related to neuroinflammation; Further evaluation and optimization of existing tracers; Normalization and standardization of methods for the analysis of tracer results.
Keywords:medical imaging science;positron emission tomography;PET tracer;Alzheimer′s disease(AD);clinical diagnosis
阿爾茨海默病(Alzheimer′s disease,AD)是一种常见的以不可逆神经元损伤为特征的慢性神经退行性疾病。AD的发生与患者年龄、周围环境、遗传等多种因素密切相关。AD患者临床表现为记忆力衰退、认知功能障碍等。据世界卫生组织报道,目前全世界约有5 000万AD患者,预计这一数字到2050年将增加至1.52亿[1]。
AD发病机理尚未明确,导致对AD的预防、诊断和治疗以及药物开发非常困难。经过长期研究,学术界形成了多种AD发病机理假说,如β-淀粉样蛋白假说(Aβ)、Tau蛋白假说(Tau)、胆碱能假说、神经炎症假说、自由基损伤假说等。研究发现,早在AD临床症状出现十几年前患者大脑就已经发生了生理性改变,医学界普遍认为早期诊断是AD预防和治疗的关键。然而,科学家在研究初期主要致力于患者认知功能和神经心理学方面,诊断结果的特异性和灵敏度都不理想,因此寻找更精准的靶向诊断方法至关重要。
正电子发射型计算机断层显像(positron emission computed tomography,PET)是一种无创的非侵入性分子影像学技术,通过使用正电子核素标记与疾病生理过程密切相关的、或能与生物体内特定生物靶分子进行特异性结合的化合物作为示踪剂,利用影像技术检测生物体内的代谢分布情况,最终由计算机成像技术模拟出生物体内疾病的发生和发展历程,以及某些部位的病变情况。PET示踪剂具有灵敏度高、准确度高、副作用小等特点,特别适用于疾病早期诊断和治疗药物的研究。
国际工作组(IWG)和美国国家衰老研究所-阿尔茨海默病协会(NIA-AA)在制定的AD活体诊断标准中指出了生物标志物评估在提高AD的3个阶段(AD临床前阶段、AD源性轻度认知损害阶段、AD痴呆阶段)诊断准确度上的重要性。长期以来,科学家开发了多种独特且可靠的生物标志物以及PET相关示踪剂用于AD早期诊断,为攻克AD提供了可能[2]。然而,由于部分靶标与AD相关性之间存在争议以及特定靶标示踪剂特异性不足等因素,导致许多PET示踪剂无法应用于临床。近年来,人们致力于AD相关发病机制的探索和特异性PET示踪剂的开发,对致病假说展开探讨并对PET示踪剂的亲和力和灵敏性进行优化,以提升AD早期诊断的准确率。
1 AD病理生物标志物PET示踪剂
NIA-AA提出了AD生物学的研究框架,并将Aβ和病理性Tau定义为AD特异性病理标志物。Aβ假说长期以来一直处于AD致病机理假说的主导地位,β-淀粉样蛋白的异常是AD发病机制中最早可检测到的脑部变化之一。以Aβ为靶标的PET相关研究起源于20世纪90年代中期,并于2002年首次在AD患者体内成像。[18F]Florbetapir是美国食品药品监督管理局(FDA)批准的首个支持AD临床诊断的PET示踪剂[3]。进一步研究发现,相较于Aβ,大脑中Tau蛋白沉积物的区域分布与AD疾病进展表现出更高的相关性[4]。过度磷酸化的Tau蛋白在神经元中的积聚被认为是AD等神经退行性疾病病变过程的关键。同时,新皮质Tau病理随临床症状的进展遵循固定的空间模式:BraakⅠ—Ⅱ期病理改变出现在横嗅和内嗅皮质,Ⅲ—Ⅳ期逐渐扩展到内侧和下颞叶,Ⅴ—Ⅵ期病理改变最终影响到广泛的皮质[5]。因此,以Tau蛋白为靶点的PET成像可能更有助于AD的準确分期。
尽管以Aβ和Tau蛋白为靶标的PET示踪剂已经取得较大成功,然而其在特异性和选择性方面一直存在争议。有研究发现,淀粉样蛋白负荷与痴呆的临床严重程度之间几乎没有关联,并且基于Aβ的PET成像技术只能满足对神经炎性斑块的评分,无法对内侧颞叶结构中的β-淀粉样变性进行组织病理学评估[6]。由于单胺氧化酶B(MAO-B)的存在,部分Tau探针会在中脑、基底节等区域存在非特异性摄取。Tauvid是最近被FDA正式批准作为AD诊断试剂的Tau蛋白PET示踪剂,但其在基底节、中脑黑质和脉络丛区域有明显的非特异性摄取,与神经黑色素和含黑色素的细胞也存在较强的脱靶结合现象[7]。尽管第2代Tau蛋白PET示踪剂如[18F]RO-948,[18F]MK-6240,[18F]Pl-2620,[18F]GTP1,[18F]PM-PBB3等大幅改善了第1代示踪剂的结合力、特异性以及药代动力学特性,但其在临床应用中的价值仍有待进一步证实。因此,目前以Aβ和Tau蛋白为靶标的PET成像技术尚不适合作为AD的独立诊断方法。
关于以β-淀粉样蛋白和Tau蛋白为靶标的 PET示踪剂研究进展已有详细的讨论[8-9],本文不再赘述。
2 神经元损伤标志物PET示踪剂
NIA-AA研究框架将神经元损伤和认知障碍定义为AD的非特异性改变,指出神经变性相关生物标志物的敏感度高但不是AD的特异性标志,仅用于AD诊断时严重程度的分期。
2.1 以葡萄糖代谢机理为基础的PET示踪剂
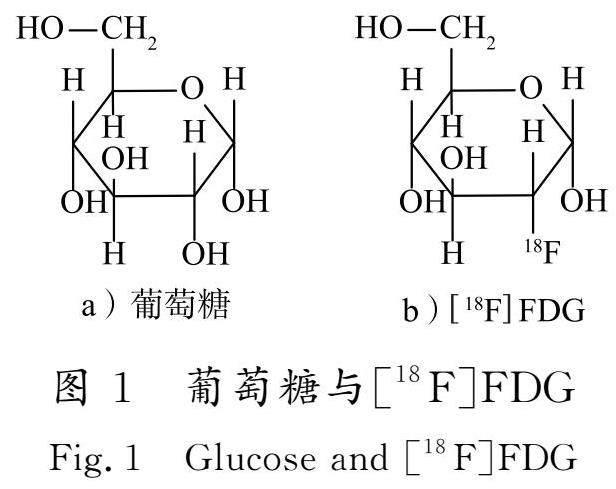
葡萄糖是人脑功能活动的主要能量来源。[18F]FDG是通过将正电子核素[18F]标记在葡萄糖2-位而得到的一种放射性PET示踪剂。[18F]FDG能够作为神经元的主要代谢底物,用于研究神经细胞糖酵解速率,通过定位和量化脑中的低代谢区域,反映神经元功能障碍和变性[10]。GORDON等[11]研究发现,在AD明显发病前的19年左右,AD患者大脑内就已存在葡萄糖代谢率降低的现象。葡萄糖和[18F]FDG的结构式见图1。
自问世以来,[18F]FDG作为能够反映葡萄糖代谢活动的示踪剂在临床上得到广泛使用。[18F]FDG PET图像中双侧颞叶信号降低也已成为AD临床诊断的标准之一。早期[18F]FDG显像研究将顶叶、颞叶、额叶单位面积放射性计数与小脑计数的比值作为半定量指标,这有助于对AD程度的评价。统计参数映射法(SPM)进行基于体素水平的分析显示,AD患者大脑葡萄糖代谢较对照组降低的脑区包括双侧颞-顶联合皮质区、额叶、楔前叶及后扣带回等部位,这表明[18F]FDG PET脑显像可为临床诊断神经变性痴呆提供依据[12]。目前,[18F]FDG PET的临床验证部分已接近完成,结果显示,该示踪剂能够大致区分AD受试者与健康受试者以及其他类型痴呆疾病,如路易体痴呆症(DLB)[13]。脑葡萄糖代谢受损诱导的多种致病级联反应可能导致AD患者神经元变性进而造成认知缺陷,因此,基于AD患者脑内相关信号传导以及代谢变化的研究,将有助于明确AD脑代谢减退的病因、发病机制和诊断生物标志物的开发。尽管[18F]FDG摄取减少能够作为神经元丢失的标志,但由于葡萄糖代谢下降的特定区域模式与许多病理相关,即[18F]FDG PET对AD并不是特异性的,因而常作为AD诊断的补充。另外,[18F]FDG在非典型AD中的诊断价值也尚未明确,在临床实用性等方面仍有待研究和验证。
2.2 基于神经炎症成像的PET示踪剂
AD的发生不仅存在着神经元蛋白的错误折叠和异常积累,还往往伴随着神经炎症的发生。中枢神经系统中的星形胶质细胞和小胶质细胞在调节神经元稳态方面发挥着主要作用,其信号传导和细胞行为的变化与多种神经退行性疾病有关[14]。在AD中,星形胶质细胞和小胶质细胞以活化形式存在于淀粉样斑块周围,其增生与神经原纤维缠结(NFTs)的积累相对应,并随AD的发展呈线性增加[15]。
2.2.1 转位蛋白
转位蛋白(TSPO)也称外周苯二氮受体,是神经炎症的重要生物标志物,与小胶质细胞和星形胶质细胞的激活成正相关。小胶质细胞激活后,TSPO聚合形成多个结合位点,在AD的发病过程中与神经元炎症密切相关。[11C]PK11195是第1个成功研制的以TSPO为靶标的高亲和力PET示踪剂,其结合分布与Aβ一致[16],但其结合特异性低,图像信噪比差,脑通透性较低,检测的灵敏度也并不理想。尽管如此,限制其临床应用的主要原因是其较短的半衰期。第2代TSPO示踪剂[18F]DPA-714是一种具有高特异性且成熟的吡唑并嘧啶配体,克服了[11C]PK11195半衰期较短的问题,已广泛用于临床研究。在AD的APP/PS1转基因小鼠模型中(12~13个月龄小鼠),小鼠皮质和海马体中小胶质细胞活化与TSPO表达水平均显著高于野生型对照组小鼠(示踪剂摄取皮层/肌肉:(2.77±0.13)vs.(1.93±0.32),p=0.001 4;海马/肌肉:(3.33±0.10)vs.(2.10±0.35),p=0.000 8),这表明[18F]DPA-714在监测小胶质细胞活化和神经炎症方面具有巨大潜力,有望用于AD的早期诊断并有助于发现AD抗炎治疗的最佳时间点[17]。然而,第2代示踪剂在人脑中的结合会受到TSPO基因rs6971多态性的影响,导致部分低亲和力的示踪剂难以准确测量。此外,因对rs6971基因多态性的敏感性不同,使得测量结果的解释变得复杂。第3代示踪剂[11C]ER176能够显示激活的小胶质细胞,成像特性得到优化,对rs6971的结合影像更灵敏,目前科研人员正在开发半衰期更长的18F标记的配体[18]。(R,S)-[18F]GE387同样是为了克服rs6971基因多态性而研发的示踪剂,实验表明,其可以顺利通过健康大鼠体内的血脑屏障,并可证实其对基因分型人脑组织TSPO多态性的低敏感性,但目前仅获得了(S)-[18F]GE387的初步PET影像数据,未来仍需进一步研究[19]。
2.2.2 嘌呤能受体
嘌呤能受体P2X7是一种钙渗透性阳离子通道,于免疫细胞和大脑中高度表达,在炎症过程中起关键作用。对AD动物模型的体外研究发现,P2X7表达上调和三磷酸腺苷(ATP)敏感性增加之间存在相关性,这表明P2X7是神经炎症的潜在靶标。另外,由于TSPO的基因多态性问题,P2X7被认为是TSPO的替代靶点。[11C]A740003是首个进入体内测试阶段的配体,但其在小鼠脑内摄取率低,不能够在脑内高效成像。[11C]JNJ-717可以实现P2X7成像,对大鼠和人类P2X7具有纳摩尔亲和力,还能够检测到影响不同结合亲和力的潜在基因型多态性(rs3751143),这表明[11C]JNJ-717在检测神经退行性疾病及炎症性疾病方面具有应用潜力[20]。
2.2.3 大麻素2型受体
大麻素2型受体(CB2R)是内源性大麻素系统的一部分,主要由免疫细胞表达,与中枢神经系统中的小胶质细胞激活有关。AD发病过程中出现CB2R上调,因此CB2R可作为AD相关生物标志物。尽管已开发了多种示踪剂,但目前仅获得[11C]NE40用于AD患者与健康受试者的数据,并且PET评估的结果表明AD患者(Aβ阳性)的CB2R准确度低于健康对照组。最近的研究未观察到[11C]NE40与脑Aβ负荷的关系,但过度表达人类APP695基因的小鼠模型(Aβ阳性)大脑中检测到CB2R免疫荧光强度的增加,且显示与Aβ沉积有关。上述结果可能是由示踪剂无法检测到AD动物模型中CB2R的细微变化所导致的,因此对相关示踪剂的结合特性仍需进一步研究与改进[21]。
2.2.4 单胺氧化酶
单胺氧化酶是一种分布在线粒体外膜上的核黄素蛋白,参与神经递质多巴胺和5-羟色胺(5-HT)等单胺类物质的降解。MAO-B是其中一种同工酶,主要分布于神经胶质细胞中,在神经炎症过程中表达上调。已有研究表明,[11C]DED已用作活體大脑中反应性星形胶质细胞增生的标志性示踪剂。在AD小鼠模型中,[11C]DED的增加先于Aβ沉积,表明AD中反应性星形胶质细胞增生与Aβ之间存在联系[22]。[18F]SMBT-1是由第1代Tau蛋白PET示踪剂[18F]THK5351的先导物优化所得,具有高亲和性、高血脑屏障通透性和高特异性结合的优点。[18F]SMBT-1在基底神经节和皮质区中的结合最为明显,在小脑和蛋白质中的检出率较低,符合MAO-B在人脑中的区域表达,并已经在AD患者中观察到反应性星形胶质细胞升高的现象[23]。
2.3 以胆碱能为靶点的PET示踪剂
胆碱能系统是由有组织的神经细胞结合2组主要胆碱能投射物形成的,包括大细胞基底前脑胆碱能系统和脑干胆碱能系统。胆碱能系统在记忆、注意力和情绪波动等认知功能中发挥着重要作用。目前已经在几种与认知衰退有关的人类疾病中观察到胆碱能缺陷[24]。
(S)(-)-[11C]Nicotine是以胆碱能系统烟碱型受体(N受体)为靶标的示踪剂。临床研究发现,AD患者颞叶皮质中(S)(-)-[11C]Nicotine摄取与其认知功能正相关。[11C]NMPB是以毒蕈碱型受体(M受体)为靶标的示踪剂,用[18F]FDG成像发现,轻至中度AD患者大脑皮质区域与示踪剂的结合显著降低,且M受体的丢失小于局部葡萄糖代谢的减少[25]。
乙酰胆碱酯酶(AChE)在早期和中期AD患者的大脑杏仁核和大脑皮质中的活性显著降低,而AChE的活性在基底核不变甚至有所增加,这表明杏仁核和新皮质中的胆碱能缺陷是AD的早期事件。[11C]CP-126,998是一种N-苄基哌啶苯并异恶唑,可与AChE选择性结合,并在PET图像中显示出预期的区域性差异(在基底神经节和小脑中最高,在大脑皮层、丘脑、杏仁核和海马体中最低),表明其可能有助于量化AChE分布,具有诊断AD的潜力[26]。[11C]MP4A可以反映体内AChE活性,实验结果显示AD患者的多个皮层区域AChE活性降低,且低于健康对照组。此外,几乎所有脑区域中的AChE活性均能很好地区分DLB和AD,这有望用于二者的鉴别诊断[27]。
α4β2型烟碱受体(nAChR)是一种配体门控离子通道,参与多种神经递质的调节和释放。2-[18F]A-85380是针对α4β2烟碱受体开发的第1代放射性标记的烟碱类似物。轻度认知功能障碍(MCI)和中晚期AD患者大脑中2-[18F]A-85380与作用靶点的结合显著减少,这种减少与认知障碍的严重程度相关[28]。早期AD患者表现出认知障碍,但α4β2受体密度未观察到任何下降,示踪剂摄取差异在AD中晚期才较为显著。这可能是由于2-[18F]A-85380灵敏度低而导致无法检测到早期AD患者脑内的受体丢失。
囊泡乙酰胆碱转运体(VAChT)是一种跨膜蛋白,位于突触囊泡中,负责囊泡中神经递质乙酰胆碱的运输和储存。VAChT仅由神经元表达,因而相关示踪剂可用于胆碱能改变的神经PET成像。[18F]FEOBV量化AD患者胆碱能变性的研究结果显示,受试者整体皮质示踪剂摄取与胆碱能基底前脑(BF)海马体和灰质体积呈正相关,这为定量评估区域特异性胆碱能末端的完整性提供了支持,有望用于检测早期AD胆碱能的功能障碍[29]。值得注意的是,该化合物在基底节的动力学代谢缓慢,导致PET扫描持续时间较长,从而影响其临床应用。此外,临床上尚未建立常规使用的以VAChT为靶标的PET成像方法,这也在一定程度上限制了该靶标的临床发展。
2.4 基于神经递质成像的PET示踪剂
已有的PET研究大部分集中在AD发病过程中的Aβ和Tau蛋白负荷上,而对神经递质系统功能的变化未给予足够的关注。研究表明,AD患者大脑中存在多种神经递质异常,如谷氨酸(Glu)、γ-氨基丁酸(GABA)、5-羟色胺等。
谷氨酸受体分为2类,一类为离子型受体,另一类属于代谢型受体。N-甲基-D-天冬氨酸受体(NMDAR)是离子型谷氨酸受体的一个亚型,构成异四聚体谷氨酸门控离子通道,在哺乳动物中枢神经系统中发挥重要作用。NMDAR功能障碍与包括AD在内的多种神经和精神疾病有关,在AD神经病变增加期间,海马亚区GluN2B亚基的蛋白质和mRNA表达水平显著降低。(R)-11C-Me-NB1是一种有前途的放射性配体,用于成像NMDAR的GluN2B亚基,在非人灵长类动物中表现出良好的药代动力学和体内结合特性。在扫描时间内,(R)-11C-Me-NB1在整个灰质中表现出可逆动力学的高异质放射性配体摄取,其中标准化摄取值(SUV)的绝对百分比差异范围为6.9%~8.5%,变异系数为4.9%~6.0%,这表明其重测的可靠性较高[30]。该放射性配体的出现有望加深对AD病理生理学的理解并改善AD治疗,但对于AD早期诊断的价值尚未明确。
代谢性谷氨酸受体5(mGluR5)在负责记忆和学习的大脑区域中普遍表达,并在调节神经元兴奋和突触传递中起着关键作用。異常的mGluR5信号传导和相关突触衰竭被认为是AD的新兴病理生理机制,并已成为AD发病机制的影像学靶标。在一项初步研究中,MCI患者大脑对[18F]FPEB摄取增加,大脑中放射性示踪剂的摄取反映了mGluR5密度的增加,这表明mGluR5可能与AD发病早期有关,具有发展为AD早期生物标志物的潜力。但AD患者脑中mGluR5改变的区域模式、时间过程以及与认知功能状态的关联,还需要做进一步的成像研究和生物学评估[31]。
GABA是一种非蛋白质氨基酸,为哺乳动物中枢神经系统中的主要抑制性神经递质。GABA系统可能是导致AD患者出现痴呆行为和心理症状(BPSD)的主要原因之一。[11C]Flumazenil是针对GABAA受体的PET示踪剂。在AD早期,[11C]Flumazenil在内侧颞叶皮层、脾后皮层的结合减少,而和海马的结合与患者记忆能力相关。研究显示,[11C]Flumazenil可与脑部最大程度神经元丢失的区域精准结合,并且摄取量降低,有望表征早期AD神经元丢失。该示踪剂的放射性代谢物只对PET数据的解释产生轻微影响,符合AD诊断的要求[32]。然而,该靶标可用的示踪剂较少,且敏感性不足,需要进一步优化与开发。
5-羟色胺也称血清素,是一种抑制性神经递质,在大脑皮层质及神经突触内含量较高。5-HT受体可分为7个亚科,目前已发现至少14种受体亚型。在众多受体中,5-HT1A受体在人类海马体中高度表达,并参与记忆过程的调节,与AD发病相关。[11C]WAY100635能够对脑中5-HT1A受体成像。研究结果显示,5-HT1A与轻度AD患者海马体、内嗅皮层和杏仁核的结合低于对照组,这表明早期神经退行性变化伴随着内侧颞叶的突触和神经元丢失[33]。5-HT1A受体具有识别轻度AD神经变性的潜力,对AD的早期变化更敏感,但能否用于AD早期诊断仍需要继续研究。
2.5 基于突触密度成像的PET示踪剂
突触在神经元-神经元相互作用中对神经传递至关重要,突触缺失会导致神经元功能障碍。突触囊泡蛋白2A(SV2A)是一种特异性表达于突触囊泡的膜蛋白,在脑内分布广泛,可调控脑内神经递质释放,参与神经元脉冲的传递。该蛋白对突触功能至关重要,虽然其确切的作用机制尚未明确,但SV2A功能障碍被认为与AD等神经疾病有关[34]。由于AD患者突触已被证明发生了结构和功能的改变,因此SV2A有望成为神经退行性疾病中衡量突触密度的生物标志物。
左乙拉西坦(LEV)是一种抗癫痫药物,能与中枢神经系统中的SV2A特异性结合。[11C]LEV是其放射性标记物,可用于PET成像,但对SV2A的亲和力(Ki=2.5 μmol)较低,并且脑渗透缓慢,阻碍了其应用发展[35]。[18F]UCB-H是一种新型配体,对人脑中的SV2A具有纳摩尔亲和力。与[11C]LEV成像原理不同,该示踪剂是基于阻断其与LEV结合而实现对SV2A成像的。研究发现,[18F]UCB-H在几个皮质区域(差异11%~18%)和丘脑(差异16%)中摄取显著降低,其中在海马体的差异最大(31%)[36]。[11C]UCB-J在非人灵长类动物和人类中均表现出比[18F]UCB-H更高的结合潜力和更大的动态范围。体内实验表明,[11C]UCB-J具有较高的脑摄取和区域分布,在AD患者和认知正常的受试者中都具有良好的重现性,但11C较短的半衰期可能会限制其临床应用[37]。[18F]SDM-16是基于UCB-A分子支架开发的一种新型示踪剂,在已发现的以SV2A为靶点的PET示踪剂中具有非常高的SV2A结合亲和力和代谢稳定性[38]。尽管[18F]SDM-16可对SV2A进行可靠和灵敏的定量分析,但能否应用于AD早期诊断还需进行深入研究。
突触密度变化是许多神经退行性疾病和精神疾病的病理特征,与大脑中灰质体积的丧失相比,突触密度更能预测出患者的认知表现能力。因此,以SV2A为靶点的PET示踪剂作为人脑中突触密度的体内生物标志物可能具有更大的潜力。然而,突触密度的改变并不是AD的特异性指标,这在一定程度上限制了其作为诊断试剂的发展。
3 问题与展望
3.1 PET示踪剂开发面临的问题
随着人口老龄化的加剧,AD发病率正逐年升高,给患者和社会带来极大负担。近年来,PET示踪剂的研究推动了PET技术在AD早期诊断中的应用,使其成为AD早期诊断中重要的辅助手段。但目前PET技术在示踪剂开发和临床应用方面仍存在许多问题。
1)经批准和有效支持体内研究的示踪剂数量较少,开发针对AD相关靶点的PET示踪剂仍非常具有挑战性。
2)已获批的示踪剂(如[18F]Florbetapir)在AD诊断中存在敏感性和特异性不足等问题。
3)神经变性的发生原因以及AD发病机制均未明确,各类假说与疾病的相关性仍存在争议。
4)对早期检测出的异常健康受试者需要进行长期随访调查,目前能够进行相关检查的医疗机构较少,获取患者体内生物标志物的信息较为困难。
3.2 PET示踪剂研究展望
AD预防和治疗的关键在于及时检测到临床症状出现前的神经变性。未来,PET示踪剂的相关研究应重视以下3个方面。
1)神经炎症相关PET示踪剂的开发
神经炎症在神经退行性病变过程中影响作用较大,如小胶质细胞和星形胶质细胞异常活化可能导致突触功能障碍和神经元丢失。二者增生已被证明与AD进展密切相关,因此针对神经炎症相关靶点的深入研究对于全面了解AD患者脑中蛋白异常堆积导致的神经退化过程具有重要意义。
2)已有示踪剂的进一步评估和优化
随着研究的不断深入,许多证据表明最初颇有潜力的PET示踪剂对于AD的诊断也具有一定局限性,这表明对已有示踪剂开展全面系统的评估十分必要。
3)示踪剂结果分析方法的规范化和标准化
许多示踪剂未建立标准的数据分析方法,一些方法存在效用、最佳数据库不明确等问题。数据分析会对检测结果产生影响,因此迫切需要对分析方法进行规范化和标准化方面的研究。
此外,针对各类靶点的新型PET示蹤剂研究可能会有助于在AD早期诊断时与其他神经退行性疾病进行区分,多示踪剂联用可以扩展AD分子靶标,提高对AD病理生理学的认识,这对推动AD早期诊断、监测以及治疗药物的开发同样具有广泛而深远的意义。
参考文献/References:
[1]MENG Xiangfei,SU Jianping,LI Huanhuan,et al.Effectiveness of caregiver non-pharmacological interventions for behavioural and psychological symptoms of dementia:An updated meta-analysis[J].Ageing Research Reviews,2021,71.DOI: 10.1016/j.arr.2021.101448.
[2] JACK C R J,BENNETT D A,BLENNOW K,et al.NIA-AA research framework: Toward a biological definition of Alzheimer′s disease[J].Alzheimer′s & Dementia,2018,14(4):535-562.
[3] PEMBERTON H G,COLLIJ L E,HEEMAN F,et al.Quantification of amyloid PET for future clinical use:A state-of-the-art review[J].European Journal of Nuclear Medicine and Molecular Imaging,2022,49(10):3508-3528.
[4] OSSENKOPPELE R,SMITH R,MATTSSON-CARLGREN N,et al.Accuracy of tau positron emission tomography as a prognostic marker in preclinical and prodromal Alzheimer disease:A Head-to-Head comparison against amyloid positron emission tomography and magnetic resonance imaging[J].JAMA Neurology,2021(8):961-971.
[5] MACEDO A C,TISSOT C,THERRIAULT J,et al.The use of tau PET to stage Alzheimer disease according to the braak staging framework[J].Journal of Nuclear Medicine,2023,64(8):1171-1178.
[6] OXFORD A E,STEWART E S,ROHN T T.Clinical trials in Alzheimer′s disease:A hurdle in the path of remedy[J].International Journal of Alzheimer′s Disease,2020.DOI: 10.1155/2020/5380346.
[7] TIAN Mei,CIVELEK A C,CARRIO I,et al.International consensus on the use of tau PET imaging agent 18F-flortaucipir in Alzheimer′s disease[J].European Journal of Nuclear Medicine and Molecular Imaging,2022,49(3):895-904.
[8] KRISHNADAS N,VILLEMAGNE V L,DOR V,et al.Advances in brain amyloid imaging[J].Seminars in Nuclear Medicine,2021,51(3):241-252.
[9] GROOT C,VILLENEUVE S,SMITH R,et al.Tau PET imaging in neurodegenerative disorders[J].Journal of Nuclear Medicine,2022,63(sup1):20S-26S.
[10]TRIPATHI S M,MURRAY A D.Alzheimer′s dementia:The emerging role of positron emission tomography[J].Neuroscientist,2022,28(5):507-519.
[11]GORDON B A,BLAZEY T M,SU Yi,et al.Spatial patterns of neuroimaging biomarker change in individuals from families with autosomal dominant Alzheimer′s disease:A longitudinal study[J].The Lancet Neurology,2018,17(3):241-250.
[12]SMITH N M,FORD J N,HAGHDEL A,et al.Statistical parametric mapping in amyloid positron emission tomography[J].Frontiers in Aging Neuroscience,2022,14.DOI: 10.3389/fnagi.2022.849932.
[13]PERINI G,RODRIGUEZ-VIEITEZ E,KADIR A,et al.Clinical impact of 18F-FDG-PET among memory clinic patients with uncertain diagnosis[J].European Journal of Nuclear Medicine and Molecular Imaging,2021,48(2):612-622.
[14][ZK(]蘇晓梅,张丹参.星形胶质细胞线粒体作为缺血性脑卒中治疗靶点的探讨[J].河北科技大学学报,2021,42(4):400-409.SU Xiaomei,ZHANG Danshen.Discussion of astrocytic mitochondria as a therapeutic target for ischemic stroke[J].Journal of Hebei University of Science and Technology,2021,42(4):400-409.[ZK)]
[15]PREETI K,SOOD A,FERNANDES V.Metabolic regulation of glia and their neuroinflammatory role in Alzheimer′s disease[J].Cellular and Molecular Neurobiology,2022,42(8):2527-2551.
[16]CHAUVEAU F,BECKER G,BOUTIN H.Have (R)-[11C]PK11195 challengers fulfilled the promise?A scoping review of clinical TSPO PET studies[J].European Journal of Nuclear Medicine and Molecular Imaging,2021,49(1):201-220.
[17]HU Wei,PAN Donghui,WANG Yalin,et al.PET imaging for dynamically monitoring neuroinflammation in APP/PS1 mouse model using [18F]DPA714[J].Frontiers in Neuroscience,2020,14.DOI: 10.3389/fnins.2020.00810.
[18]LEE J H,SIMON F G,LIOW J S,et al.Invivo evaluation of 6 analogs of 11C-ER176 as candidate 18F-Labeled radioligands for 18-kDa translocator protein[J].Journal of Nuclear Medicine,2022,63(8):1252-1258.
[19]RAMAKRISHNAN N K,HIRD M,THOMPSON S,et al.Preclinical evaluation of (S)-[18F]GE387,a novel 18-kDa translocator protein(TSPO)PET radioligand with low binding sensitivity to human polymorphism rs6971[J].European Journal of Nuclear Medicine and Molecular Imaging,2021,49(1):125-136.
[20]CRABB M,van der PERREN A,BOLLAERTS I,et al.Increased P2X7 receptor binding is associated with neuroinflammation in acute but not chronic rodent models for Parkinson′s disease[J].Frontiers in Neuroscience,2019,13.DOI: 10.3389/fnins.2019.00799.
[21]KECHELIEV V,SPINELLI F,HERDE A,et al.Evaluation of cannabinoid type 2 receptor expression and pyridine-based radiotracers in brains from a mouse model of Alzheimer′s disease[J].Frontiers in Aging Neuroscience,2022,14.DOI: 10.3389/fnagi.2022.1018610.
[22]CHOO I L H,CARTER S F,SCHLL M L,et al.Astrocytosis measured by 11C-deprenyl PET correlates with decrease in gray matter density in the parahippocampus of prodromal Alzheimer′s patients[J].European Journal of Nuclear Medicine and Molecular Imaging,2014,41(11):2120-2126.
[23]CHATTERJEE P,DOR V,PEDRINI S,et al.Plasma glial fibrillary acidic protein is associated with18F-SMBT-1 PET:Two putative astrocyte reactivity biomarkers for Alzheimer′s disease[J].Journal of Alzheimer′s Disease,2023,92(2):615-628.
[24]BUTLER T,HARVEY P,DESHPANDE A,et al.Basal forebrain septal nuclei are enlarged in healthy subjects prior to the development of Alzheimer′s disease[J].Neurobiology of Aging,2018,65:201-205.
[25][JP2]YOSHIDA T,KUWABARA Y,ICHIYA Y,et al.Cerebral muscarinic acetylcholinergic receptor measurement in Alzheimer′s disease patients on 11C-N-methyl-4-piperidyl benzilate-comparison with cerebral blood flow and cerebral glucose metabolism[J].Annals of Nuclear[JP] Medicine,1998,12(1):35-42.
[26]BENCHERIF B,ENDRES C J,MUSACHIO J L,et al.PET imaging of brain acetylcholinesterase using [11C]CP-126,998,a brain selective enzyme inhibitor[J].Synapse,2002,45(1):1-9.
[27]SHIMADA H,HIRANO S,SINOTOH H,et al.Dementia with Lewy bodies can be well-differentiated from Alzheimer′s disease by measurement of brain acetylcholinesterase activity-a [11C]MP4A PET study[J].International Journal of Geriatric Psychiatry,2015,30(11):1105-1113.
[28]GARIBOTTO V,WISSMEYER M,GIAVRI Z,et al. Nicotinic acetylcholine receptor density in the“Higher-Order”thalamus projecting to the prefrontal cortex in humans:A PET study[J].Molecular Imaging and Biology,2020,22:417-424.
[29]XIA Ying,EELES E,FRIPP J,et al.Reduced cortical cholinergic innervation measured using[18F]-FEOBV PET imaging correlates with cognitive decline in mild cognitive impairment[J].Neuro Image:Clinical,2022,34.DOI:10.1016/j.nicl.2022.102992.
[30][JP2]RISCHKA L,VRAKA C,PICHLER V,et al.First-in-humans brain PET imaging of the GluN2B-containing N-methyl-d-aspartate receptor with(R)-11C-Me-NB1[J].Journal of Nuclear Medicine,2022,63(6):936-941.[JP]
[31]MECCA A P,MCDONALD J W,MICHALAK H R,et al.PET imaging of mGluR5 in Alzheimer′s disease[J].Alzheimer′s Research & Therapy,2020,12(1).DOI: 10.1186/s13195-020-0582-0.
[32]GHOSH K K,PADMANABHAN P,YANG Changtong,et al.Dealing with PET radiometabolites[J].EJNMMI Research,2020,10(1):109-117.
[33]MATTSSON P,CSELNYI Z,ANDRE B,et al.Decreased 5-HT1A binding in mild Alzheimer′s disease:A positron emission tomography study[J].Synapse,2022.DOI:10.1002/syn.22235.
[34]CARSON R E,NAGANAWA M,TOYONAGA T,et al.Imaging of synaptic density in neurodegenerative disorders[J].Journal of Nuclear Medicine,2022,63(sup1):60S-67S.
[35]BECKER G,DAMMICCO S,BAHRI M A,et al.The rise of synaptic density PET imaging[J].Molecules,2020,25(10).DOI: 10.3390/molecules25102303.
[36]BASTIN C,BAHRI M A,MEYER F,et al.In vivo imaging of synaptic loss in Alzheimer′s disease with [18F]UCB-H positron emission tomography[J].European Journal of Nuclear Medicine and Molecular Imaging,2020,47(2):390-402.
[37]MECCA A P,O′DELL R S,SHARP E S,et al.Synaptic density and cognitive performance in Alzheimer′s disease:A PET imaging study with [11 C]UCB-J[J].Alzheimer′s & Dementia,2022,18(12):2527-2536.
[38]ZHENG Chao,HOLDEN D,ZHENG Mingqiang,et al.A metabolically stable PET tracer for imaging synaptic vesicle protein 2A:Synthesis and preclinical characterization of [18F]SDM-16[J].European Journal of Nuclear Medicine and Molecular Imaging,2022,49(5):1482-1496.
責任编辑:张士莹
基金项目:河北省科技计划项目(17392605D);国家自然科学基金(21877025)
第一作者简介:刘文清(1983—),女,河北邢台人,讲师,博士,主要从事天然产物化学合成与抗肿瘤活性方面的研究。
通信作者:徐志栋,教授。E-mail:zdxu@hebust.edu.cn刘文清,刘明松,杨莎,等.PET示踪剂在阿尔茨海默病早期诊断中的研究进展[J].河北科技大学学报,2024,45(2):181-188.LIU Wenqing,LIU Mingsong, YANG Sha,et al.Research progress of PET tracer in early diagnosis of Alzheimer′s disease[J].Journal of Hebei University of Science and Technology,2024,45(2):181-188.
