巨噬细胞M1/M2型极化对糖尿病视网膜病变进程的影响及相关性分析
2024-05-09王爱军周俊夏常杰
王爱军 周俊 夏常杰
作者简介:王爱军,大学本科,主管技师,研究方向:临床检验免疫学。
【摘要】目的 分析巨噬细胞(M?)M1/M2型极化对糖尿病视网膜病变(DR)进程的影响,为临床治疗提供参考。方法 选取2020年6月至2022年7月南华大学附属第二医院收治的97例DR患者(研究组)及同期105例单纯糖尿病(DM)患者(对照组)为研究对象,比较两组患者临床资料,分析M?表型检测的诊断价值,以及M1/M2型M?与炎症因子、血糖水平、氧化应激反应标志物、DR进程的关系。结果 研究组患者M1型、M1/M2型M?占比均大于对照组,M2型M?占比小于对照组(均P<0.05);M1/M2型M?>7.275时诊断DM患者发生DR的灵敏度为83.51%,特异度为77.14%,曲线下面积(AUC)为0.8655(P<0.05);研究组患者白细胞介素-4(IL-4)、转化生长因子-β(TGF-β)、超氧化物歧化酶(SOD)水平均低于对照组,肿瘤坏死因子-α(TNF-α)、诱导型一氧化氮合酶(iNOS)、丙二醛(MDA)水平均高于对照组(P<0.05);研究组患者M1/M2型M?与IL-4、TGF-β、SOD水平均呈负相关,与TNF-α、iNOS、空腹血糖(FBP)、餐后2 h血糖(2 hBP)、MDA水平呈正相关(均P<0.05)。结论 DR患者M?由M2型向M1型极化过程中炎性反应与氧化应激反应加重,升高血糖水平,加速DR的恶性病理发展。
【关键词】巨噬细胞M1/M2型极化;糖尿病视网膜病变;氧化应激反应
【中图分类号】R774.1 【文献标识码】A 【文章编号】2096-2665.2024.05.0083.04
DOI:10.3969/j.issn.2096-2665.2024.05.028
糖尿病(diabetes mellitus,DM)是目前全球范围内最常见的慢性疾病之一,据统计,2021年中国DM患者为1.409亿,居全球首位[1]。目前,临床无法治愈DM,需采用终身降糖治疗方法[2]。糖尿病视网膜病变(diabetic retinopathy,DR)发生率约占DM并发症的20%~30%,其早期通常无自觉症状,多被忽视或误诊,后期可能导致视力严重下降甚至失明[3]。巨噬细胞(Macrophages,M?)根据微环境改变表型,使自身发挥出多样功能的过程被称为M?极化,根据信号传导差异极化为M1/M2表型[4]。 研究表明,阻断M?中白细胞介素-17A(IL-17A)与内质网应激间的相互作用可抑制DR中新生血管的形成[5]。由此可见,M?极化过程可能与DR的病理变化相关。基于此,本研究分析M? M1/M2型极化对DR进程的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2020年6月至2022年7月南华大学附属第二医院收治的97例DR患者(研究组)及同期105例单纯DM患者(对照组)为研究对象。两组患者一般资料比较,差异无统计学意义(P>0.05),组间具有可比性,见表1。本研究经南华大学附属第二医院医学伦理委员会批准,患者均对本研究知情并签署知情同意书。纳入标准:⑴符合《中国2型糖尿病防治诊南(2020版)》[6]中DR的诊断标准;⑵年龄>18岁;⑶临床资料完整。排除標准:⑴入院前接受过抗生素类药物、手术治疗;⑵存在其他DM病变;⑶存在肝、肾功能障碍;
⑷凝血功能异常;⑸妊娠及哺乳期女性。
1.2 检测方法 ⑴单核细胞分离。入院时采集患者外周静脉血1 mL,采用血糖分析仪(青岛市三凯医学科技有限公司,鲁械注准20192220549,型号:SK-Ⅱ)检测空腹血糖(FBP)、餐后2 h血糖(2 hBP)、糖化血红蛋白(HbA1c)。同方法采集患者外周静脉血1 mL加入等体积磷酸盐缓冲液稀释后滴加至淋巴细胞分离液中,以
3 000 r/min转速、10 cm半径,离心10 min后吸取下层细胞并将其置于培养皿中,37 ℃、5%CO2环境下恒温培养24 h,细胞贴壁后吸除悬浮细胞,获得外周血中的单核细胞。⑵M?检测。预冷的PBS洗涤单核细胞3次,后分装至两个离心管中,一管加入PE抗人CD68抗体检测M1型M?,一管加入APC抗人CD206抗体检测M2型M?。检测仪器为流式细胞仪[美国贝克曼库尔特,国食药监械(进)字2012第2402288号,型号:CyFlow(r) Counter]。⑶酶联免疫吸附(ELISA)法实验。入院时采集患者外周静脉血于促凝管中,室温下静置30~50 min,以3 000 r/min转速、10 cm半径,离心10 min后分离血清。ELISA检测血清中白细胞介素-4(IL-4)、转化生长因子-β(TGF-β)、肿瘤坏死因子-α(TNF-α)、诱导型一氧化氮合酶(iNOS)、超氧化物歧化酶(SOD)及丙二醛(MDA)水平,试剂盒均购自江西艾博因生物科技有限公司。
1.3 观察指标 ⑴绘制受试者工作特征(ROC)曲线分析M?表型检测的诊断价值。⑵使用Pearson相关系数分析两组患者M1/M2型M?与血糖、炎症因子、氧化应激反应标志物的关系。⑶M?与DR进程的关系。
1.4 统计学分析 使用SPSS 22.0统计学软件进行数据分析,计数资料以[例(%)]表示,组间比较使用χ2检验;计量资料以(x)表示,组间比较使用t检验,多组间比较采用方差分析及最小显著差异法(LSD)组内检验;诊断价值使用ROC曲线分析;相关性使用Pearson相关系数分析。 P<0.05为差异有统计学意义。
2 结果
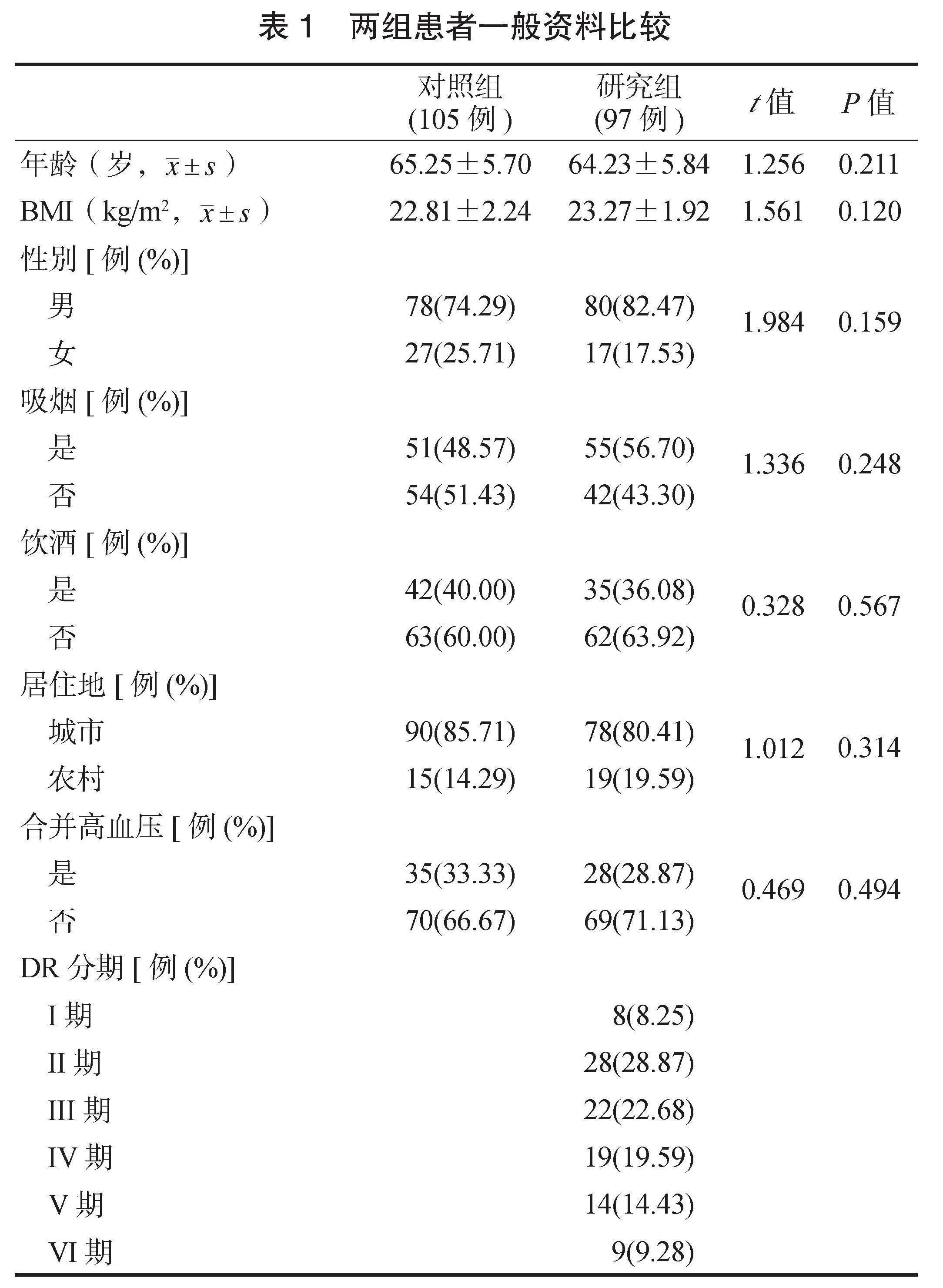
2.1 M?表型检测诊断效能 研究组患者中M1型M?、M1/M2型M?占比均高于对照组,M2型M?占比低于对照组,差异均有统计学意义(均P<0.05),见表2。ROC曲线分析结果显示,当M1/M2型M?>7.265时,诊断DM患者发生DR的灵敏度为83.51%,特异度为77.14%,曲线下面积(AUC)为0.8655,见图1。
图1 M1/M2型M?诊断DR的ROC曲线
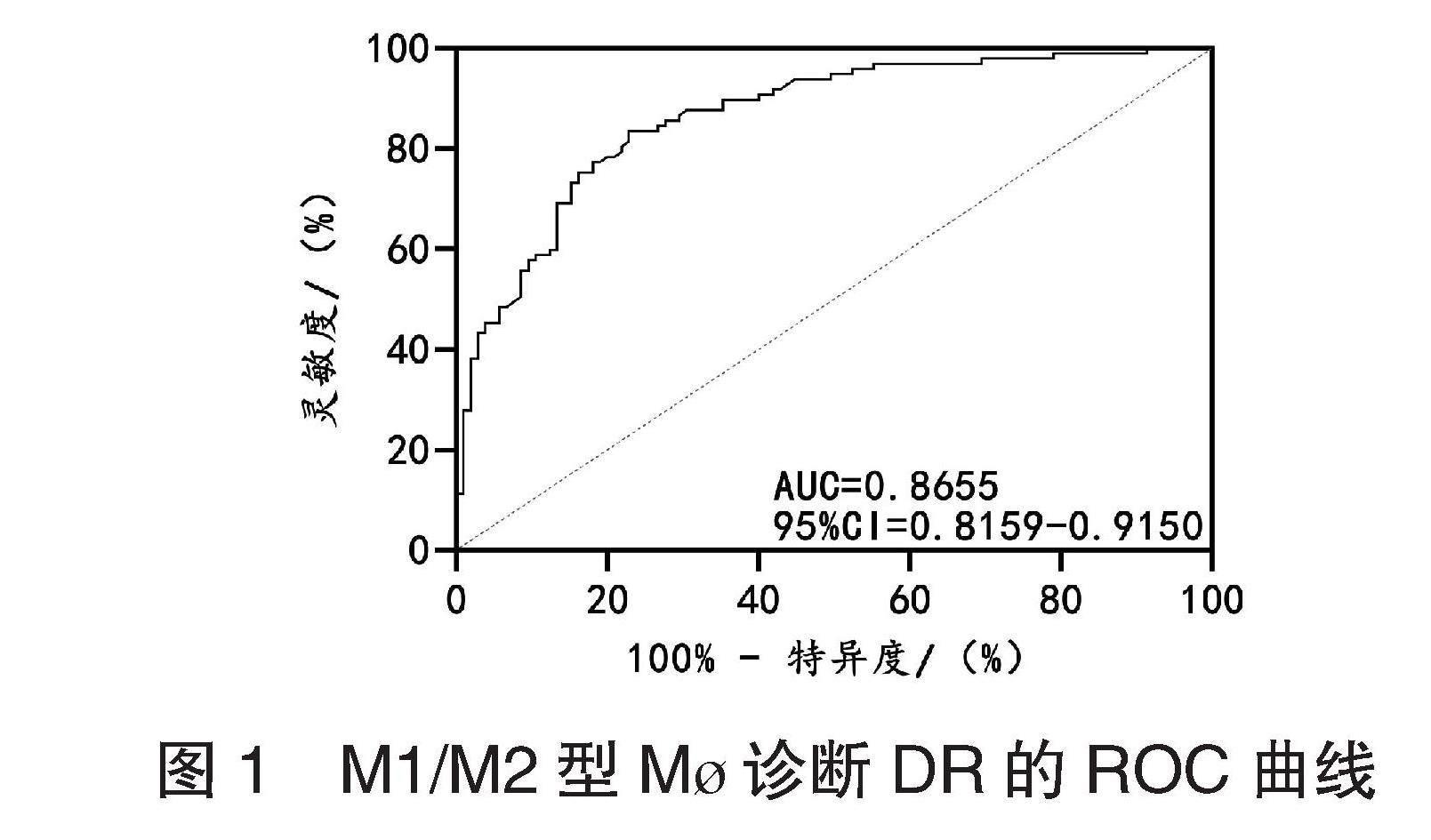
2.2 两组患者M1/M2型M?与炎症因子的关系 研究组患者中IL-4、TGF-β水平均低于对照组,TNF-α、iNOS均高于对照组,差异均有统计学意义(均P<0.05),见表3。Pearson相关系数分析结果显示:研究组患者M1/M2型M?与IL-4、TGF-β水平均呈负相关,与TNF-α、iNOS水平呈正相关(均P<0.05),见图2。
图2 DR患者M1/M2型M?与炎症因子的关系
注:IL-4:白细胞介素-4;TGF-β:转化生长因子-β;TNF-α:肿瘤坏死因子-α;iNOS:诱导型一氧化氮合酶。
表2 M?表型检测结果比较(%,x)
例数 M1型M? M2型M? M1/M2型M?
研究组 97 38.24±5.94 4.32±0.73 9.12±2.13
对照组 105 32.48±6.36 5.34±0.76 6.23±1.63
t值 6.638 9.712 10.880
P值 <0.001 <0.001 <0.001
表3 两组患者炎症因子检测结果比较(x)
例数 IL-4(ng/L) TGF-β(ng/L) TNF-α(ng/L) iNOS(U/mL)
研究组 97 30.42±6.01 604.88±84.35 1.50±0.32 4.11±0.64
对照组 105 36.76±3.83 664.97±91.47 1.07±0.24 2.99±0.52
t值 8.044 4.842 10.860 13.700
P值 <0.001 <0.001 <0.001 <0.001
注:IL-4:白细胞介素-4;TGF-β:转化生长因子-β;TNF-α:肿瘤坏死因子-α;iNOS:诱导型一氧化氮合酶。
2.3 两组患者M1/M2型M?与血糖的关系 Pearson相关系数分析结果显示:研究组患者M1/M2型M?与FBP、2 hBP均呈正相关(均P<0.05),见图3。
图3 DR患者M1/M2型M?与血糖的关系
注:FBP:空腹血糖;2 hBP:餐后2 h血糖。
2.4 两组患者M1/M2型M?与氧化应激反应标志物的关系 研究组患者SOD水平低于对照组,MDA水平高于对照组,差异均有统计学意义(均P<0.05),见表4。研究组患者M1/M2型M?与SOD水平呈负相关,与MDA水平呈正相关(均P<0.05),见图4。
表4 氧化应激反应标志物检测结果(x)
例数 SOD(μg/L) MDA(μmol/L)
研究组 97 141.94±35.37 8.67±2.11
对照组 105 161.52±28.59 6.21±1.42
t值 4.342 2.721
P值 <0.001 0.007
注:SOP:超氧化物歧化酶;MDA:丙二醛。
圖4 DR患者M1/M2型M?与氧化应激反应的关系
注:SOP:超氧化物歧化酶;MDA:丙二醛。
2.5 M?与DR进程的关系 研究组患者中Ⅰ期患者M1/M2型M?占比最低,并随着病理进程逐渐升高,Ⅵ期患者M1/M2型M?占比最高(P<0.05),表5。
表5 M?与DR进程的关系
分期 例数 M1/M2型M?
Ⅰ期 8 5.90±0.83
Ⅱ期 28 7.62±0.91a
Ⅲ期 22 8.62±0.72ab
Ⅳ期 16 9.75±0.52abc
Ⅴ期 14 11.28±1.04abcd
Ⅵ期 9 13.00±1.57abcde
F值 88.170
P值 <0.001
注:与Ⅰ期患者比较,aP<0.05,;与Ⅱ期患者比较,bP<0.05;与Ⅲ期患者比较,cP<0.05;与Ⅳ期患者比较,dP<0.05;与Ⅴ期患者比较,eP<0.05;MQ:巨噬细胞;DR:糖尿病视网膜病变。
3 讨论
DM作为目前全球范围内发病率较高的慢性疾病,已严重威胁患者的生活质量[7]。DR作为DM中的并发症,其发病率随DM患者的增多不断升高[8]。炎症反应在DR的病理过程中具有重要意义,且现代临床治疗中抗炎药物是DR治疗的关键之一。
M?不仅是人体免疫细胞,还对炎症反应调控有重要影响。现代临床研究中指出,M?向M2方向极化可促进视神经功能恢复,调节M?极化可促进实验性脉络膜新生血管的形成[9]。本研究结果显示,DR患者中M1型M?增加,而M2型M?减少,M1/M2型M?比例升高,提示DR患者中M?由M2型向M1型极化,与既往研究结果一致[10]。本研究结果还显示,当M1/M2型MQ>7.265时,诊断DM患者发生DR的灵敏度为83.51%,特异度为77.14%,AOC为0.8655,提示M1/M2型M?占比同作为DR潜在病情评估指标。研究组患者IL-4、TGF-β水平均降低,而TNF-α、iNOS水平升高,提示患者存在明显的炎性反应,与既往DR的病理研究结果相符[11]。研究组患者中M1/M2型M?与 IL-4、TGF-β水平呈负相关,而与TNF-α、iNOS水平呈正相关,这也验证了M?极化与炎症反应的关系。同时,研究组患者血糖水平更高,且与M1/M2型M?成正比,证明M?极化与DR进展密切相关。
此外,M1型M?可通过介导活性氧的生成加速组织再生的氧化应激损伤并延缓创伤的愈合[7]。M2型M?则具有清除碎片、凋亡细胞的能力,可促进机体内过氧化物的分解,促进组织损伤修复 [12]。可见,M?极化对于细胞与组织中的氧化应激反应也有极为重要的影响。DR病变的过程中,氧化应激反应加剧所致的视网膜微血管基底膜增厚、缺血性损伤等,这已是临床公认的病理机制[13]。本研究结果显示,研究组患者SOD水平降低,MDA水平升高,提示M?极化过程存在明显氧化应激损伤,而M1/M2型M?与SOD呈负相关、与MDA呈正相关也提示M?极化对DR患者氧化应激损伤的影响。研究发现随着DR分期的增加,M1/M2型M?占比呈现升高的趋势,可见随着M?由M2向M1的极化程度的增加,DR的病情发展也会不断加重。
综上所述,DR患者中M?由M2型向M1型极化过程中炎性反应与氧化应激反应加重,血糖水平升高,加速DR的恶性病理发展。
参考文献
高嘉良, 杨庭, 王洪武. 巨噬细胞极化与2型糖尿病關系的研究进展[J].中国糖尿病杂志, 2024, 32(1): 65-69.
VUJOSEVIC S, ALDINGTON S J, SILVA P, et al. Screening for diabetic retinopathy: new perspectives and challenges[J]. Lancet Diabetes Endocrinol, 2020, 8(4): 337-347.
LIN K Y, HSIH W H, LIN Y B, et al. Update in the epidemiology, risk factors, screening, and treatment of diabetic retinopathy[J]. J Diabetes Investig, 2021, 12(8): 1322-1325.
KANG Q, YANG C. Oxidative stress and diabetic retinopathy: Molecular mechanisms, pathogenetic role and therapeutic implications[J]. Redox Biol, 2020, 37: 101799.
ANDERSON N R, MINUTOLO N G, GILL S, et al. Macrophage-based approaches for cancer immunotherapy [J]. Cancer Res, 2021, 81(5): 1201-1208.
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 中华糖尿病杂志, 2021, 13(4): 315-409.
WANG Y, GAO S, GAO S, et al. Blocking the interaction between interleukin-17A and endoplasmic reticulum stress in macrophage attenuates retinal neovascularization in oxygen-induced retinopathy [J]. Cell Biosci, 2021, 11(1): 82.
SIM?-SERVAT O, HERN?NDEZ C, SIM? R. Diabetic retinopathy in the context of patients with diabetes [J]. Ophthalmic Res, 2019, 62(4): 211-217.
张顺立, 白倩, 张倩, 等. 醛糖还原酶基因敲除促进视神经损伤后巨噬细胞向M2方向极化并促进视神经功能恢复[J]. 细胞与分子免疫学杂志, 2014, (5): 505-508.
SABANAYAGAM C, BANU R, CHEE M L, et al. Incidence and progression of diabetic retinopathy: A systematic review [J]. Lancet Diabetes Endocrinol, 2019, 7(2): 140-149.
YIN L, ZHANG D, REN Q, et al. Prevalence and risk factors of diabetic retinopathy in diabetic patients: A community based cross-sectional study [J]. Medicine (Baltimore), 2020, 99(9): e19236.
YUNNA C, MENGRU H, LEI W, et al. Macrophage M1/M2 polarization [J]. Eur J Pharmacol, 2020, 877: 173090.
ZHANG J, MURI J, FITZGERALD G, et al. Endothelial lactate controls muscle regeneration from ischemia by inducing M2-like macrophage polarization [J]. Cell Metab, 2020, 31(6): 1136-1153. e7.
