CH25H 调控细胞自噬和凋亡对喉鳞状细胞癌进展影响
2024-05-07熊华才许雨欣邬振华胡丹飞李群项振飞
熊华才 许雨欣 邬振华 胡丹飞 李群 项振飞
喉癌是常见的头颈部恶性肿瘤,喉鳞状细胞癌(laryngeal squamous cell carcinoma,LSCC)是最常见的类型,约占90%[1]。喉部主要生理功能是吞咽、呼吸和发音,喉癌主要通过手术切除、联合术前或术后化疗、放疗等综合治疗方式治疗。虽然目前临床已对喉癌的治疗做了大量研究,但喉癌发病率和死亡率依旧较高。在癌症发展过程中癌细胞存在自噬和凋亡现象[2]。细胞凋亡是一种阻止癌细胞存活的程序性细胞死亡途径,而自噬通过清除受损的细胞器、蛋白质以及限制细胞生长,从而抑制恶性肿瘤发展,凋亡和自噬是常见的肿瘤抑制机制[3]。
胆固醇25-羟化酶(cholesterol 25-hydroxylase,CH25H)是一种催化胆固醇氧化形成可溶性产物25-羟基胆固醇(25-hydroxycholesterol,25-HC)的酶,参与脂质代谢。也有研究表明,CH25H 在炎症和免疫应答中发挥多种功能[4]。CH25H 在黑色素细胞瘤、乳腺癌、前列腺癌、结肠癌和胆管癌等恶性肿瘤中发挥重要作用。在黑色素细胞瘤患者的外周血WBC 中观察到CH25H 丢失,这与转移和低生存率相关[5]。但CH25H 在LSCC 中的表达模式、肿瘤相关作用及分子机制目前尚不清楚。本研究旨在探讨CH25H 在LSCC中的生物学作用和调控机制。
1 材料和方法
1.1 材料 SPF 级4 周龄的BALB/c 雄性裸鼠24 只,体重20~25 g,购自杭州医学院实验动物中心[动物许可证号:SYXK(浙)2019-0011],普通饲料喂养。本动物实验方案经浙江省实验动物中心实验动物福利伦理委员会审查通过(批准文号:ZJCLA-IACUC-20040153)。人口腔角质形成细胞(HOK)以及人LSCC 细胞系TU-177、AMC-HN-8 购自上海雅吉生物科技公司,FDLSC-1 购自南京万木春生物科技公司,过表达慢病毒购自上海吉玛基因生物科技公司,Dulbecco 改良的Eagle 培养基(Dulbecco's modified eagle medium,DMEM)(批号:C11995500BT,规格:500 mL)和FBS(批号:10091148,规格:500 mL)均购自美国Gibco 公司,RIPA裂解液(批号:20-188,规格:100 mL)、聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)(批号:C3117,规格:0.45 μm)购自美国Millipore 公司,二辛可宁酸(bicinchonininc acid,BCA)试剂盒(批号:P0010S,规格:200次)、Trizol 试剂盒(批号:R0016,规格:100 mL)购自上海碧云天生物技术有限公司,聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)预制胶(批号:PG42015-S,规格:10块)购自北京索莱宝生物科技公司,实时荧光定量PCR 试剂盒(批号:RR820A,规格:200 次)购自日本TaKaRa 公司,蛋白抗体CH25H(批号:sc-293256,规格:100 μL)购自上海玉博生物科技有限公司,B 淋巴细胞瘤-2(B cell lymphoma 2,Bcl-2)(批号:3498T,规格:20 μL)、Bcl-2 关联X 蛋白(Bax)(批号:2772T,规格:20 μL)、半胱氨酸蛋白酶-3(caspase-3)(批号:9662S,规格:100 μL)、裂解的caspase-3(C-caspase-3)(批号:9664T,规格:20 μL)、β 肌动蛋白(β-actin)(批号:4970T,规格:20 μL)、微管相关蛋白1A/1B-轻链3(LC3)Ⅰ、LC3Ⅱ(批号:3868T,规格:20 μL),Beclin-1(批号:3738S,规格:100 μL)、p62(批号:5114T,规格:20 μL)、蛋白激酶B(protein kinase B,Akt)(批号:9271T,规格:20 μL)、磷酸化Akt(p-Akt)(批号:4060T,规格:20 μL)、磷脂酰肌醇-3-激酶(phosphoinositide-3-kinase,PI3K)(批号:4292S,规格:100 μL)和磷酸化PI3K(p-PI3K)(批号:4228T,规格:20 μL)均购自美国CST 公司,聚凝胺(批号:BL628A,规格:500 μL)购自中国兰杰柯科技有限公司;自动细胞计数仪(型号:TC10)购自美国Bio-Rad 公司。
1.2 细胞培养和转染 在含10%FBS 的DMEM 培养基中培养HOK、FD-LSC-1、TU177、AMC-HN-8 细胞,细胞均在37 ℃、5%CO2条件下培养。通过5 μg/mL 聚凝胺介导慢病毒转染LSCC 细胞株并用嘌呤霉素筛选出稳定表达CH25H 的转染细胞株AMC-HN-8/CH25H。慢病毒空白载体AMC-HN-8/Mock 作为对照,未做转染处理为AMC-HN-8。使用自动细胞计数仪进行细胞计数。
1.3 LSCC 移植瘤动物模型的构建和观察 采用随机数字表法将裸鼠分为AMC-HN-8 组、AMC-HN-8/Mock 组、AMC-HN-8/CH25H 组,每组8 只。取AMCHN-8、AMC-HN-8/Mock 和AMC-HN-8/CH25H 组对数生长期细胞,经胰酶消化,重新细胞计数,使细胞悬浮液浓度调整至2.0×107个/mL,各取0.5 mL 细胞悬浮液依次接种于3 组裸鼠右侧腋下,每天检查裸鼠瘤体生长情况,瘤体长出为造模成功。每隔1 周用游标卡尺测量裸鼠右侧腋下原位肿瘤的长径(L)与短径(W),计算原位肿瘤的近似体积(V),V=0.5×(L×W2)。接种5 周后,断颈处死裸鼠切取原位肿瘤,测定重量并切取部分肿瘤用于后续实验。
1.4 CH25H mRNA 表达水平检测 采用Trizol 法提取细胞总RNA,经反转录试剂盒将RNA 反转录为cDNA。反应参数:95 ℃预变性5 min,96 ℃变性30 s,55 ℃退火30 s,72 ℃延伸20 s,35 个循环。引物序列如下,CH25H-F:5'- GGCATACCAAGTGTC-CTTCTAAGC-3';CH25H-R: 5'-AACACCCTACACCCAGATTCCTC-3';βactin-F:5'-CAGATGTGGATCAGCAAGCAGGAG-3';βactin- R:5'- CGCAACTAAGTCATAGTCCGCCTAG- 3'。以β-actin 为内参,使用2-ΔΔCt法计算CH25H mRNA 相对表达水平。
1.5 CH25H、Bax、Bcl-2、C-caspase-3、caspase-3、LC3Ⅱ、Beclin-1、p62、PI3K、p-PI3K、Akt、p-Akt 蛋白表达的检测 采用Western blot 法。RIPA 裂解液提取AMC-HN-8、AMC-HN-8/Mock 和AMC-HN-8/CH25H组LSCC 细胞和裸鼠瘤体组织总蛋白,采用BCA 法测定蛋白浓度。取40 μg 蛋白样品进行SDS-PAGE。采用湿转法转膜,5%脱脂牛奶(TBST 溶解)37 ℃封闭1 h。将PVDF 膜置于CH25H、Bax、Bcl-2、C-caspase-3、caspase-3、LC3Ⅱ、Beclin-1、p62、p-PI3K、PI3K、p-Akt、Akt 和β-actin 一抗溶液(1∶2 000)4 ℃过夜,PBST 洗膜(6×5 min);将膜置于辣根过氧化物酶结合的二抗溶液(1∶5 000)中37 ℃孵育1.5 h,PBST 洗膜(6×5 min)后,化学发光显色剂显色,凝胶成像系统曝光成像,结果以相对灰度值表示。
1.6 细胞凋亡率检测 采用流式细胞术检测。收集AMC-HN-8、AMC-HN-8/Mock 和AMC-HN-8/CH25H组转染24、48、72 h 后的LSCC 细胞,根据试剂盒说明书使用Annexin V-FITC/碘化丙啶(propidium iodide,PI)凋亡试剂盒分析细胞凋亡,1 000×g 离心后弃上清液,加入195 μL 结合缓冲液重悬细胞,加入5 μL Annexin V-FITC 和10 μL PI 染色液,避光孵育15 min后上机检测细胞凋亡率。
1.7 细胞自噬检测 采用免疫荧光法。将AMC-HN-8、AMC-HN-8/Mock 和AMC-HN-8/CH25H 组LSCC 细胞用4%多聚甲醛室温固定30 min,然后用0.1%Triton X-100 4 ℃渗透细胞10 min。用含有2%FBS 白蛋白的PBS 在室温下饱和1 h 后,用LC3Ⅱ一抗抗体进行免疫荧光处理,然后用Alexa Fluor 488 偶联免疫球蛋白和DAPI 进行免疫荧光处理。采用Olympus Fluoview 1000共聚焦显微镜观察自噬蛋白LC3Ⅱ荧光染色情况。
1.8 统计学处理 采用GraphPad Prism 9.0 统计软件。计量资料以表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 HOK 与LSCC 细胞CH25H mRNA 的相对表达水平比较 相较HOK 正常细胞,FD-LSC-1、TU177、AMC-HN-8 3 种LSCC 细胞中CH25H 相对表达水平均明显下调(均P<0.05),其中AMC-HN-8 水平最低,见图1,选取其进行后续实验。
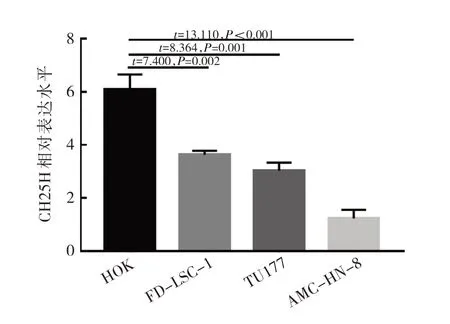
图1 HOK 和LSCC 细胞系(FD-LSC-1、TU177、AMC-HN-8)中CH25H 表达水平的比较
2.2 CH25H 对喉鳞癌AMC-HN-8 细胞凋亡率和凋亡蛋白的影响 AMC-HN-8 和AMC-HN-8/Mock 组CH25H表达水平差异无统计学意义(P>0.05),AMC-HN-8/CH25H组CH25H表达水平明显上调(P<0.05),见图2A、B。AMC-HN-8 和AMC-HN-8/Mock 组细胞凋亡率比较差异无统计学意义(P>0.05)。AMC-HN-8/CH25H组24、48、72 h 的细胞凋亡率均明显高于AMC-HN-8/Mock 组(P<0.05),见图2C。AMC-HN-8 和AMC-HN-8/Mock组Bax、Bcl-2 和C-caspase-3 蛋白表达差异均无统计学意义(均P>0.05);与AMC-HN-8/Mock 组比较,AMC-HN-8/CH25H组Bax、C-caspase-3蛋白表达均明显上调(均P<0.05),Bcl-2 蛋白明显下调(P<0.05),见图2D、2E。
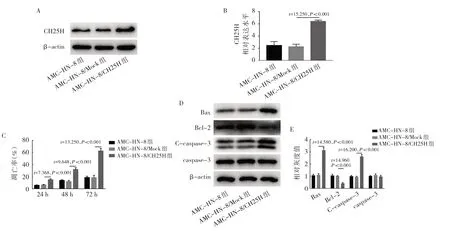
图2 CH25H 促进喉鳞癌AMC-HN-8 细胞凋亡(A:CH25H 表达的电泳图;B:3 组细胞CH25H 的表达水平;C:3 组细胞不同时点凋亡率的比较;D:Bax、Bcl-2、C-caspase-3、caspase-3 蛋白表达的电泳图;E:Bax、Bcl-2、C-caspase-3、caspase-3 蛋白表达水平比较)
2.3 CH25H 对AMC-HN-8 细胞自噬蛋白的影响AMC-HN-8 和AMC-HN-8/Mock 组LC3Ⅱ、Beclin-1 和p62 蛋白表达差异均无统计学意义(均P>0.05)。相较AMC-HN-8/Mock 组,AMC-HN-8/CH25H 组LC3Ⅱ和Beclin-1 表达水平明显上调(P<0.05),p62 明显下调(P<0.05),见图3A(插页)。免疫荧光结果显示,与AMC-HN-8/Mock 组比较,AMC-HN-8/CH25H 组LC3Ⅱ标记的自噬小体数量增加,见图3B(插页)。

图3 过表达CH25H 促进喉鳞癌AMC-HN-8 细胞自噬(A:CH25H 对LSCC 细胞自噬蛋白影响的电泳图及表达水平比较;B:3 组细胞LC3Ⅱ表达的染色结果,免疫荧光染色×400)
2.4 CH25H 对AMC-HN-8 细胞PI3K/Akt 信号通路蛋白的影响 Western blot 检测p-PI3K、PI3K、p-Akt 和Akt 信号通路蛋白表达水平发现,AMC-HN-8 和AMC-HN-8/Mock 组p-PI3K 和p-Akt 蛋白表达水平差异均无统计学意义(均P>0.05)。与AMC-HN-8/Mock组比较,AMC-HN-8/CH25H 组p-PI3K 和p-Akt 蛋白表达水平下调,见图4。

图4 3 组细胞PI3K、p-PI3K、Akt、p-Akt 蛋白表达的电泳图及表达水平比较
2.5 CH25H 对裸鼠移植瘤体积和重量的影响 接种AMC-HN-8、AMC-HN-8/Mock 和AMC-HN-8/CH25H细胞后第5 周处死裸鼠切取的移植瘤见图5A(插页)。AMC-HN-8 和AMC-HN-8/Mock 组裸鼠移植瘤CH25H 表达水平差异无统计学意义,AMC-HN-8/CH25H 组CH25H 表达水平明显上调(P<0.05),见图5B(插页)。AMC-HN-8 和AMC-HN-8/Mock 裸鼠瘤体体积、重量差异均无统计学意义,而与AMC-HN-8/Mock 组比较,AMC-HN-8/CH25H 组裸鼠瘤体体积和重量显著减小(均P<0.05),过表达CH25H 裸鼠移植瘤生长速度显著减缓(P<0.05),见图5C、D(插页)。
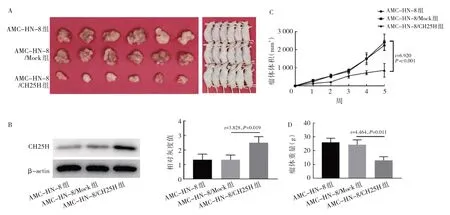
图5 CH25H 影响喉鳞癌细胞体内生长(A:第5 周移植瘤裸鼠及移植瘤裸鼠右侧腋下原位移植瘤;B:CH25H 在AMC-HN-8、AMC-HN-8/Mock 和AMC-HN-8/CH25H 移植瘤中的表达水平;C:裸鼠移植瘤体积的变化;D:第5 周裸鼠移植瘤重量的比较)
2.6 CH25H 对裸鼠移植瘤细胞自噬蛋白、凋亡蛋白和PI3K/Akt 信号通路蛋白的影响 AMC-HN-8 和AMCHN-8/Mock 组Bax、Bcl-2、C-caspase-3、LC3Ⅱ、Beclin-1、p62 蛋白表达水平的差异均无统计学意义(均P>0.05)。与AMC-HN-8/CH25H 组比较,AMC-HN-8/Mock 组Bax、C-caspase-3、LC3Ⅱ、Beclin-1 表达上调,Bcl-2、p62 表达下调,见图6A、B、D、E。同时检测PI3K/Akt 信号通路相关蛋白发现,AMC-HN-8 和AMC-HN-8/Mock 组p-PI3K 和p-Akt蛋白表达水平差异无统计学意义(均P>0.05)。与AMC-HN-8/Mock组比较,AMC-HN-8/CH25H 组p-PI3K 和p-Akt 表达水平下调,见图6C、F。
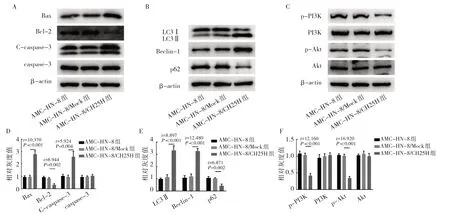
图6 CH25H 通过抑制PI3K/Akt 信号通路调控喉鳞癌细胞自噬和凋亡(A、D:凋亡蛋白表达的电泳图及表达水平比较;B、E:自噬蛋白表达的电泳图及表达水平比较;C、F:PI3K/Akt 信号通路蛋白表达的电泳图及表达水平比较)
3 讨论
研究报道CH25H 通过25-HC 可在不同的生物过程中发挥重要作用,对25-HC 的相关研究已确定25-HC 具有抗病毒和抗炎作用[4]。此外,CH25H 可以抑制细胞毒性T 淋巴细胞的胞吞作用,促进细胞毒性T 淋巴细胞活性,即促进抗肿瘤免疫反应,进而抑制肿瘤生长[6]。CH25H 可以作为乳腺癌患者预测因子[7]。甲基化异常基因CH25H 和其他3 个基因可以作为肺鳞癌预后风险模型预测患者的预后[8]。而本研究发现CH25H 可以平衡肿瘤细胞自噬和凋亡。
细胞凋亡通过清除病变细胞来维持组织稳态,促进细胞凋亡可以抑制肿瘤细胞的生长,从而抑制肿瘤的发生和发展,诱导肿瘤细胞凋亡是抗肿瘤的重要手段。癌细胞表现出对凋亡的抵抗,以维持其不受控制的增殖。具有调节凋亡活性的分子都有可能成为一种潜在的抗癌靶标[9]。Bcl-2 具有抗凋亡作用,Bax 诱导凋亡,C-caspase-3 的激活则被视为凋亡细胞死亡的标志[10-11]。本研究中CH25H 上调后抑制了LSCC 细胞中Bcl-2 表达,同时促进了Bax 和C-caspase-3 表达,促进了肿瘤细胞凋亡。
自噬是真核细胞中一种保守的细胞内反应,其生理功能是清除衰老细胞和细胞内受损蛋白,维持饥饿时氨基酸库的稳定。近年来研究发现,自噬与肿瘤的发生、发展密切相关,自噬激活有助于清除肿瘤细胞[12]。然而,有研究表明自噬也会维持肿瘤细胞的生存,说明自噬在肿瘤的发生、发展中起着抑制和促进的双重作用,但本研究中CH25H 的表达在清除LSCC细胞中发挥着促进自噬的作用。自噬的特征包括诱导、成核、延伸、成熟和破坏等多个动态过程。其中,延伸对于完全自噬体的形成至关重要,而从LC3Ⅰ到LC3Ⅱ是延伸过程中的重要转变,LC3Ⅱ和Beclin-1 是自噬通量的标志,分别参与自噬囊泡的起始和关闭。此外,当自噬被激活时,自噬底物p62 会被下调[13]。本研究中CH25H 上调后抑制了LSCC 细胞中p62 表达,同时促进了LC3Ⅱ和Beclin-1 表达。
PI3K/Akt 通路是一种主要的细胞内信号转导通路,参与调节细胞周期、细胞增殖、自噬、凋亡、代谢和血管生成[14-15]。PI3K/Akt/mTOR 信号通路在自噬和凋亡过程中起着至关重要的作用,抑制mTOR 通路可增强自噬体的产生,调节细胞存活和死亡。一些抗癌药物通过抑制PI3K/Akt 通路诱导细胞凋亡和自噬。还有证据表明,自噬和凋亡之间的相互作用是通过PI3K/Akt 信号通路[16]。在肿瘤发生过程中PI3K/Akt 通路经常过度激活[17],这与本研究结果一致,在LSCC 细胞中PI3K/Akt 通路被过渡激活,CH25H 通过抑制PI3K/Akt 信号通路进而影响细胞自噬和凋亡。
综上所述,本研究探讨了CH25H 在LSCC 细胞自噬和凋亡发挥的作用,发现CH25H 可通过PI3K/Akt通路调控LSCC 细胞凋亡和自噬进而影响LSCC 进展,这可能为LSCC 相关治疗提供极有前景的分子靶点。
