UCA1/miR-122-5p/CPEB1轴促进肺腺癌的顺铂耐药发生机制研究
2024-05-07吴玲玲陈姝慧胡天奇周辰康仇鲁男王瑜敏
吴玲玲 陈姝慧 胡天奇 周辰康 仇鲁男 王瑜敏
在全球,肺癌的发病率和死亡率居各种癌症之首[1]。2016 年中国恶性肿瘤流行数据显示,恶性肿瘤死亡第1 位是肺癌,发病率和死亡率分别位列男性肿瘤首位,女性肿瘤第2 位和第1 位[2]。非小细胞肺癌(non-small-cell carcinoma,NSCLC)在肺癌中最为多见,肺腺癌是NSCLC 中最常见的类型,占肺癌的40%,占NSCLC 的50%。目前肺腺癌的发病率在全球范围呈不断上升趋势,由于肺腺癌具有早期出现远处转移的生物学特点,多数患者确诊时已属晚期。以顺铂为基础的联合化疗在肺腺癌的综合治疗方案中占有重要地位[3]。但随着顺铂的应用,不可避免会引起肿瘤细胞对其产生耐药性,使化疗效果明显降低[4]。据美国癌症协会调查显示,90%以上肿瘤患者的死亡在不同程度上与肿瘤耐药性产生有关,癌细胞一旦对顺铂产生耐药,会对阿霉素、长春碱、氟尿嘧啶、丝裂霉素等众多一线化疗药物形成多药耐药,其危害尤为严重[5]。本研究团队前期已采用高通量长链非编码RNA(long non-coding RNA,lncRNA)芯片技术比较肺腺癌顺铂耐药株A549/DDP 细胞与顺铂敏感株A549 细胞,获得了肺腺癌顺铂耐药株差异性lncRNA 表达谱,筛选并初步鉴定出一些与肺腺癌顺铂耐药相关的lncRNA 分子,其中通过lncRNA 芯片及实时荧光反转录定量PCR(real-time fluorescence reverse transcription quantitative PCR,RT-qPCR)检测结果均证实了尿路上皮癌胚抗原1(urothelial carcinoembryonic antigen 1,UCA1)为这些候选基因中明显上调的lncRNA 分子。UCA1 首先被证实在膀胱癌组织呈高表达[6],在其他癌症也显示为高表达。UCA1 经常与miRNA 进行互作[7],而是否通过与相关miRNA 分子进行竞争性内源RNA(competing endogenouse RNA,ceRNA)调控肺腺癌对顺铂耐药的机制?本研究拟在前期工作的基础上,根据miRNA 预测网站预测的交集,获得UCA1 调控相关miRNA 分子,重点针对UCA1 相关miR-122-5p 分子进行研究,旨在探讨UCA1 通过miR-122-5p 参与调控肺腺癌顺铂耐药的机制,现将结果报道如下。
1 材料和方法
1.1 材料 RPMI 1640 培养基(批号:C11875500BT)、DMEM 培养基(批号:12800017)、opti-MEM 培养基(批号:31985-070)购自美国Gibco公司(规格:500 mL/瓶)。顺铂注射液购自江苏豪森药业集团有限公司(批号:SL2138596,规格:6 mL∶30mg×5 支)。FBS 购自美国Gibco 公司(批号:16000-044)。miR-122-5p 模拟物、miR-122-5p 模拟物阴性对照(NC)、miR-122-5p 抑制剂、miR-122-5p 抑制剂NC、质粒pcDNA-胞质多聚腺苷酸元件结合蛋白1(cytosolic polyadenyl element binding protein 1,CPEB1)、对照载体pcDNA-3.1 均购自广州锐博生物科技有限公司(规格:50 μg/支)。Lipofectamine 3000 购自赛默飞世尔科技(中国)有限公司(批号:16000-044)。miDETECT A TrackTMmiRNA qPCR试剂盒购自锐博生物科技有限公司(批号:C10710)。双荧光素酶报告分析系统试剂盒购自美国Promega 公司(批号:ZY130595)。RrimeScriptTMRT Master Mix、TB GreenTMPremix Ex TaqTMⅡ试剂盒购自日本Takara 公司(批号:RR036A、RR420A)。Trizol 试剂盒购自美国Thermo Fisher Scientific 公司(批号:ALH005,规格:200 mL/瓶);氯仿、异丙醇购自天津大茂化学试剂厂(批号:S19382、N32930,规格:10 mg/瓶)。CCK-8 试剂盒购自日本同仁公司(批号:C0038,规格:2 mL/瓶)。pmiRGLO-UCA1-野生型(WT)/突变型(Mut)载体、pmiRGLO- CPEB1-3'UTR-WT/Mut 载体均购自锐博生物科技有限公司。 311 型CO2培养箱购自美国赛默飞公司;ABI 7500 PCR 仪器购自美国ABI 公司;Nanodrop 2000 仪器购自美国Thermo Fisher Scientific 公司。
1.2 细胞培养 肺腺癌细胞(HCC827、A549、H1299)和正常人支气管上皮细胞(BEAS-2B)系购自中国科学院细胞库。其中A549(顺铂敏感细胞株)、H1299 和HCC827 细胞保存在含有10%FBS 的RPMI 1640 培养基中,BEAS-2B 细胞保存在含有10%FBS 的DMEM 培养基中,并在37 ℃、5%CO2条件下培养。所有培养物均经过常规检测,未发现支原体或真菌污染。A549/DDP细胞(顺铂耐药细胞株)购自中国科学院细胞库,在培养基加入1 μg/mL 顺铂,以保持其抗药性。A549 过表达UCA1 及A549 过表达NC 细胞系前期已经构建完毕,可用于直接培养。所有细胞系均按照建议在含10%FBS 的RPMI 1640 培养基中培养,并置于37 ℃、5%CO2的311型CO2培养箱中。
1.3 转染 准备miR-122-5p 模拟物、miR-122-5p 模拟物NC、miR-122-5p 抑制剂、miR-122-5p 抑制剂NC、pcDNA-CPEB1、对照载体pcDNA-3.1 等质粒。转染前1 天,以50%的细胞密度分别将A549、A549/DDP细胞株接种到12 孔板中,待细胞数量增加达到实验要求后待用。转染前2 h,将含有10%FBS 的RPMI 1640 完全培养基换为opti-MEM 培养基;制备聚乙烯亚胺(polyethylenimine,PEI)和上述质粒的转染复合物,上述质粒的瞬时转染浓度为50 nmol/L;分别用50 μL opti-MEM 培养基稀释2 μL PEI 和1.25 μL 上述质粒,随后将稀释好的PEI 和上述质粒混匀,置于室温孵育15 min。将100 μL 上述质粒转染复合物加入细胞株培养基中,十字混匀摇匀,转染8 h 后更换为500 μL 含有10%FBS 的RPMI 1640 完全培养基。获得构建A549 miR-122-5p 模拟物NC 细胞株、A549 miR-122-5p 模拟物细胞株、A549/DDP miR-122-5p 抑制物NC 细胞株、A549/DDP miR-122-5p 抑制物细胞株、A549 CPEB1 过表达NC 细胞株、A549 CPEB1 过表达细胞株;通过RTqPCR 验证转染效率。
1.4 总RNA提取和qPCR检测UCA1相关miRNA分子
1.4.1 细胞总RNA 提取 收集A549 和A549/DDP 的各处理组细胞沉淀于1.5 mL 的EP 管中,加入1 mL的Trizol,混匀后置于冰上充分裂解细胞10 min。向每个EP 管加入200 μL 氯仿于冰上静置10 min 后离心15 min。吸取上层水相溶液400 μL 至新的EP 管,按同等体积比加入预冷的异丙醇,颠倒混匀后冰上静置15 min 后离心15 min。吸去上清液,留RNA 沉淀,加入1 mL 75% 乙醇轻柔吹洗,离心5 min。吸干乙醇,开盖5 min 使乙醇充分挥发,加入15 μL RNase-free 水使其溶解。
1.4.2 RNA 浓度检测 使用Nano drop 2000 仪器,开机选择RNA 浓度测定程序,用2 μL DEPC 水调零后进行检测;取1 μL RNA 样品进行测定,A260/A280值位于1.8~2.0表示RNA 提取合格,保存于-20 ℃用于后续实验。
1.4.3 RNA 反转录为cDNA 按RrimeScriptTMRT Master Mix 试剂盒说明书,配制反转录体系。PCR 仪设定以下程序:反转录37 ℃,15 min;RNA 酶失活85 ℃,5 s;反应终止4 ℃,30 min;将样本置于PCR 仪中进行反转录反应得到cDNA,保存于-20 ℃待用。用于检测miRNA 的RNA 样本反转录采用miDETECT A TrackTMmiRNA qPCR Kit,操作步骤按miDETECT A TrackTMmiRNA qPCR 试剂盒说明书,配制Poly(A) Tailing 体系,混匀后于37 ℃反应1 h,4 ℃保存备用。
1.4.4 RT-qPCR 稀释引物前先进行瞬时离心使其沉于管底,按照管身的说明加入相应体积×10 的去离子水,得到10 μmol/L 的工作引物浓度,并置于-20 ℃冰箱保存;按TB GreenTMPremix Ex TaqTMⅡ试剂盒说明书制备10 μL 荧光定量PCR 体系;采用PCR 仪为ABI Q5 PCR 仪,设定PCR 反应程序:95 ℃预变性30 s;40 个循环包括:95 ℃变性5 s,55 ℃退火和延伸34 s。以β-肌动蛋白(β-actin)和U6 作为内部参考,结果分析采用2-ΔΔCt法,引物序列见表1。

表1 引物序列
1.5 双荧光素酶报告实验 构建含有miR-122-5p 结合位点的WT 和Mut 序列UCA1 和CPEB1 的质粒,并克隆到含有pmiRGLO 启动子的双荧光素酶报告质粒中,得到pmiRGLO-UCA1-WT/Mut 和pmiRGLO-CPEB1-3'UTR-WT/Mut双荧光素酶报告载体。具体实验分组为:miR-122-5p模拟物NC,miR-122-5p 模拟物,UCA1 WT+miR-122-5p 模拟物NC,UCA1 WT+miR-122-5p模拟物,UCA1 Mut+miR-122-5p模拟物NC,UCA1 Mut+miR-122-5p 模拟物;CPEB1 WT+miR-122-5p 模拟物NC,CPEB1 WT+miR-122-5p 模拟物,CPEB1 Mut+miR-122-5p 模拟物NC,CPEB1 Mut +miR-122-5p 模拟物。将A549 细胞接种到24 孔板中,置于37 ℃、5%CO2的311 型CO2培养箱中培养24 h,将miR-122-5p 模拟物或模拟物NC 与构建的报告载体pmiRGLOUCA1-WT/Mut 或pmiRGLO- CPEB1-3'UTR-WT/Mut 共转染48 h,最后用双荧光素酶报告分析系统试剂盒评价相对荧光素酶活性。
1.6 顺铂敏感性试验 将A549 和A549/DDP 细胞接种在96 孔板中(2×103个/孔),并培养至细胞贴满。随后,用不同浓度顺铂(0、1、2、4、8、10 μg/mL)培养基代替RPMI 1640 培养基培养细胞48 h,用10%CCK-8替换每个孔中的培养液并培养1 h。用微孔板阅读器在450 nm 处测量吸光度(A),并计算细胞活力,细胞活力(%)=(A加-A空白)/(A0加药-A空白)×100%,其中A 加是指不同顺铂浓度(1、2、4、8、10 μg/mL)后细胞株的吸光度值,A 空白是指没加细胞株,没加药物的培养基吸光度值,A0 加药是指加入顺铂马上检测的吸光值。使用GraphPad Prism 8.0 软件计算顺铂的半抑制浓度(half maximal inhibitory concentration,IC50)。
1.7 公共数据库进行生物信息学分析 从肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)公共数据库中下载肺腺癌及正常肺样本的基因组数据,其中肺腺癌535例,匹配的正常肺样本59个;肺腺癌组与正常组之间CPEB1 基因表达水平差异比较采用两独立样本t检验。绘制ROC曲线评价CPEB1基因诊断肺腺癌的效能,并计算AUC。采用Kaplan-Meier法绘制低表达组和高表达组患者的生存曲线,总生存期比较采用log-rank 检验。选择与CPEB1 基因表达相关的免疫细胞,以CPEB1基因表达高低来分组,比较免疫细胞浸润的差异。
1.8 统计学处理 采用GraphPad Prism 8.0 和SPSS 22.0 统计软件。计量资料以表示,组间比较采用两独立样本t检验,配对样本比较采用配对样本t检验;计数资料组间比较采用χ2检验和Fisher 确切概率法。P<0.05 为差异有统计学意义。
2 结果
2.1 UCA1 与多个miRNA 发生互作关系 根据miRNA预测网站http://www.microrna.org/microrna/home.do 和http://www.mircode.org/预测的交集,获得UCA1调控相关miRNA(包括miR-143、miR-18a、miR-18b、miR-96-3p、miR-1271、miR-135a、miR-135b、miR-122-5p、miR-193a、miR-193b、miR-203a)。进一步通过RT-qPCR 检测获得miR-122-5p、miR-203a、miR-143、miR-135a、miR-135b 作为UCA1 互作miRNA 分子参与肺腺癌的顺铂耐药发生,见图1。
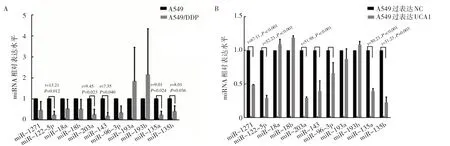
图1 UCA1 互作miRNA 分子表达水平比较结果(A:A549/DDP 和A549 细胞株的差异miRNA 表达情况;B:UCA1 过表达后差异miRNA 的表达情况)
2.2 检测肺腺癌细胞及BEAS-2B 细胞中miR-122-5p的表达水平 双荧光素酶报告实验结果表明,miR-122-5p 在肺腺癌细胞中的表达水平明显升高,见图2A。与miR-122-5p 模拟物NC、miR-122-5p 模拟物、UCA1 WT+miR-122-5p 模拟物NC、UCA1 Mut+miR-122-5p 模拟物NC、UCA1 Mut miR-122-5p 模拟物相比较,UCA1 WT+miR-122-5p 模拟物共转染组的相对荧光素酶活性明显下降,见图2B,表明miR-122-5p 和UCA1 具有结合位点。
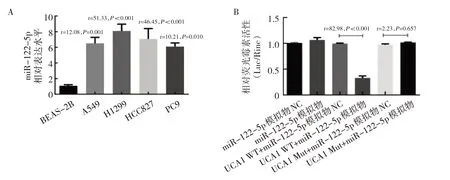
图2 肺癌细胞及BEAS-2B 细胞中miR-122-5p 表达水平的比较(A:miR-122-5p 在肺腺癌细胞株的表达情况;B:miR-122-5p 模拟物或模拟物NC 与构建的报告载体pmiRGLO-UCA1-WT/Mut 共转染后荧光素酶活性比较)
2.3 miR-122-5p 对肺癌细胞株顺铂敏感性的影响RT-qPCR 结果显示成功构建了miR-122-5p 抑制物转染的细胞株,见图3A;miR-122-5p 抑制后,顺铂IC50浓度从5.1 μg/mL 下降到2.3 μg/mL,提示miR-122-5p敲低后能提高顺铂的药物敏感性,见图3B。成功构建了miR-122-5p 模拟物转染的细胞株,见图3C;miR-122-5p 过表达后,顺铂IC50浓度从2.3 μg/mL 升高到4.8 μg/mL,提示miR-122-5p 过表达能减低顺铂的药物敏感性,促进顺铂耐药,见图3D。

图3 miR-122-5p 对肺癌细胞株顺铂敏感性的影响(A:miR-122-5p 抑制物转染A549/DDP 细胞株后miR-122-5p 表达水平的比较;B:miR-122-5p 抑制物转染A549/DDP 细胞株后顺铂IC50的变化;C:miR-122-5p 模拟物转染A549 细胞株后miR-122-5p 表达水平的比较;D:miR-122-5p 模拟物转染A549 细胞株后顺铂IC50的变化)
2.4 miRNA 荧光素酶发现miR-122-5p 与CPEB1 存在结合 进一步通过https://www.targetscan.org/vert_71/和https://www.mirbase.org/网站预测,发现miR-122-5p 与CPEB1 可能存在结合。随后检测肺腺癌细胞及BEAS-2B 细胞中CPEB1 的表达水平,发现CPEB1 在肺腺癌细胞中的表达水平明显降低,见图4A。双荧光素酶报告实验结果表明,与miR-122-5p 模拟物NC、miR-122-5p 模拟物、CPEB1 WT+miR-122-5p 模拟物NC、CPEB1 Mut+miR-122-5p 模拟物NC、CPEB1 Mut miR-122-5p 模拟物组比较,CPEB1 WT +miR-122-5p 模拟物组的相对荧光素酶活性明显下降,见图4B,表明miR-122-5p 和CPEB1 具有结合位点。
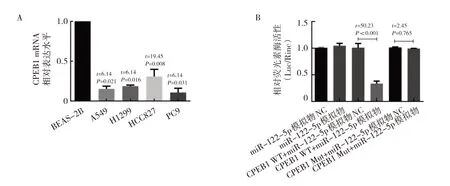
图4 miR-122-5p 与CPEB1 的双荧光素酶活性实验(A:CPEB1 在肺腺癌细胞株的表达情况;B:miR-122-5p 模拟物或NC 与构建的报告载体CPEB1 WT 及CPEB1 Mut 共转染后相对荧光素酶活性的比较)
2.5 CPEB1 对肺腺癌细胞株顺铂敏感性的影响 RTqPCR 结果显示成功构建了CPEB1 过表达细胞株,见图5A;CPEB1 过表达后,顺铂IC50浓度从5.2 μg/mL 下降到2.5 μg/mL,见图5B,提示CPEB1 过表达能提高顺铂的药物敏感性,降低顺铂耐药。

图5 CPEB1 对肺腺癌细胞株顺铂敏感性的影响(A:CPEB1 过表达质粒转染A549/DDP 细胞株后CPEB1 表达水平的比较;B:CPEB1 过表达后A549/DDP 细胞株后顺铂IC50的变化)
2.6 CPEB1 在肺腺癌表达及与免疫细胞功能的相关性 TCGA 公共数据库分析显示肺腺癌组织CPEB1 mRNA 明显低于癌旁组织,见图6A、B;ROC 曲线分析显示CPEB1 表达水平能较好地用于诊断肺腺癌(AUC=0.849,95%CI:0.810~0.888),见图6C,高CPEB1水平与低CPEB1 水平患者的生存预后差异无统计学意义,见图6D;CPEB1 表达水平与肺腺癌患者的细胞功能如T 细胞、B 细胞、CD8+T 细胞、自然杀伤细胞、巨噬细胞、中性粒细胞、树突状细胞、肥大细胞存在密切关联,见图6E。
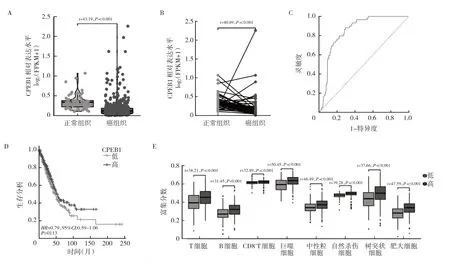
图6 数据库CPEB1 mRNA 表达情况(A:CPEB1 在肺腺癌组织的表达情况;B:CPEB1 在肺腺癌组织的表达情况;C:ROC 曲线分析CPEB1 用于肺腺癌的诊断效能;D:高CPEB1 水平与低CPEB1 水平患者生存预后的比较;E:CPEB1 表达水平与肺腺癌患者的细胞功能相关性)
3 讨论
近年来国内外研究表明,顺铂主要通过抑制肿瘤细胞DNA 合成[8]、诱导凋亡[9]而发挥作用。顺铂化疗抵抗制极其复杂,是一个多基因参与的复杂事件,目前认为主要通过如下几种机制[10]来实现:(1)改变细胞内药物转运;(2)降低药物活性干扰药物作用机制;(3)影响DNA 损伤修复,目前相关基因如乳腺癌相关基因1、切除修复交叉互补基因等;(4)主要信号通路(PDK/Akt、MAPK/Erk、Wnt 等)的遗传和表观遗传学改变,使药物作用凋亡受阻。然而,令人遗憾的是,尽管以往包括基因组学和蛋白质组学研究取得了不少进展,但顺铂化疗抵抗机制仍尚未阐明。
有研究发现,UCA1 可通过与miRNA 进行互作,参与顺铂耐药机制[11]。目前文献报道UCA1 通过CREB调节膀胱癌细胞中的miR-196a-5p 促进顺铂/吉西他滨耐药[12]。UCA1 表达失调可能通过调节microRNA-495/NRF2 信号通路参与顺铂治疗NSCLC 化疗耐药的发生[13]。本研究通过筛选到UCA1 的多个相关miRNA,表明UCA1 可与miRNA 互作参与肺腺癌的顺铂耐药机制;结合相关文献[14],笔者初步选定miR-122-5p作为后续的研究对象,发现miR-122-5p 在肺腺癌细胞中的表达水平明显升高,并通过双荧光素酶报告实验以验证UCA1 与miR-122-5p 结合,构建miR-122-5p 抑制物和模拟物转染肺腺癌细胞株,发现miR-122-5p 抑制后,顺铂IC50浓度下降,而miR-122-5p 过表达后,顺铂IC50浓度升高,提示miR-122-5p 能降低顺铂的药物敏感性,促进肺腺癌顺铂耐药。
本研究通过https://www.targetscan.org/vert_71/和https://www.mirbase.org/网站预测,发现miR-122-5p 与靶基因CPEB1 可能存在结合。CPEB1 是指一种序列特异性的RNA 结合蛋白,可以调节mRNA 多聚腺苷酸化和翻译以及肿瘤的发生[15]。进一步发现CPEB1 在肺腺癌细胞中的表达水平明显降低,双荧光素酶报告实验证实CPEB1 是与miR-122-5p 结合;构建CPEB1 过表达质粒染肺腺癌细胞株,CPEB1 过表达后,顺铂IC50浓度减低,提示CPEB1 过表达能提高顺铂的药物敏感性,减低顺铂耐药,表明CPEB1 参与肺腺癌顺铂耐药机制。有报道显示,CPEB1 降低会导致体内乳腺癌细胞肺转移[16]。本研究对公共数据库分析显示肺腺癌组织CPEB1 mRNA 明显低于癌旁组织,ROC 曲线分析显示CPEB1 表达水平能较好地用于诊断肺腺癌(AUC=0.849),分析显示CPEB1 表达水平与肺腺癌患者的细胞功能如T 细胞、B 细胞、CD8+T 细胞、自然杀伤细胞、巨噬细胞、中性粒细胞、树突状细胞、肥大细胞存在密切关联。
综上所述,UCA1 与miR-122-5p 存在结合位点,后者可影响肺腺癌的顺铂耐药,并与靶基因CPEB1 结合;肺腺癌中CPEB1 呈低表达,降低肺腺癌顺铂药物的敏感性。UCA1/miR-122-5p/CPEB1 轴有望为干预肺腺癌顺铂耐药的靶点。
