超声靶向微泡破坏联合溶瘤腺病毒治疗胰腺癌的实验研究
2024-05-07张婷婷杨陈胡巧洪王世兵范小明
张婷婷 杨陈 胡巧洪 王世兵 范小明
胰腺癌患者通常发现时已处于晚期,手术是目前最有效的治疗方法,然而大多数患者确诊时已不具备手术条件[1]。对于无法切除且化疗不敏感的患者,溶瘤病毒的免疫激活和肿瘤内选择性复制等特点为临床提供了新的诊疗思路。重组人5 型腺病毒药物在2005 年时已被我国批准用于鼻咽癌治疗[2]。溶瘤病毒通过增强抗原释放、识别和免疫激活来增强肿瘤组织周围促炎环境形成,以抵消肿瘤细胞的免疫逃避[3-4]。然而,胰腺肿瘤周围结缔组织增生和免疫抑制性微环境(tumor micro-environment,TME)限制了病毒与肿瘤细胞接触以及免疫细胞在肿瘤周围浸润,使溶瘤病毒抑制肿瘤的效果大打折扣[5]。在低频超声条件下,诱导微泡破裂引起的空化效应能改变细胞膜通透性,从而提高药物或基因传送,该技术被称为超声靶向微泡破坏(ultrasound targeted microbubble destruction,UTMD)[6]。超声和微泡因具有安全、无毒、廉价等优点,使UTMD 产生的空化作用在药物运输、血管破坏等领域被广泛关注[7]。本研究通过将UTMD 与溶瘤腺病毒(oncolytic adenovirus, oAd)联合使用,探索UTMD 是否能促进oAd 对胰腺肿瘤的抑制作用,及其相关作用机制。
1 材料和方法
1.1 材料 C57BL/6 SPF 级雌性小鼠55 只(6~8 周,体重18~20 g)购自上海斯莱克实验动物有限责任公司,均饲养在浙江省人民医院动物实验研究中心,温度20~26 ℃,空气湿度40%~70%,12 h 昼夜光照交替。鼠源胰腺癌细胞(Panc-02 细胞)、人胚胎肾细胞293(HEK293 细胞)和oAd 均由浙江省人民医院临床科研所提供。DMEM 培养基(批号:C11995500BT)、FBS(批号:C0235)均购自美国Gibco公司,PBS(批号:PB180327)购自武汉普诺赛生命科技有限公司,无水乙醇(批号:10009228)、氯化铯(批号:20014213)、柠檬酸(批号:10007108)、二甲苯(批号:10023418)、中性树胶(批号:10004160)购自国药集团化学试剂有限公司,聚乙二醇8000(批号:60304ES76)购自上海翌圣生物科技有限公司。青/链霉素双抗溶液(批号:C0222)、Annexin V-FITC 细胞凋亡检测试剂盒(批号:C1062S)、过氧化物酶显色试剂(propidium iodide,DAPI;批号:C1002)、HE 染色试剂盒(批号:C0105S)、辣根过氧化物酶标记的山羊抗鼠二抗(批号:A0216)、透析袋(批号:FDM303-5m)、多聚甲醛(批号:P0099)均购自上海碧云天生物技术股份有限公司,oAd-5 E1A 单克隆抗体(sc-58658)购自美国Santa Cruz Biotechnology 公司,CD3 抗体(ab16669)抗体购自美国Abcam 公司,Tunel染色试剂盒(批号:11684817910)购自瑞士Roche 公司,抗荧光淬灭封片剂(批号:0100-01)购自美国SouthernBiotech 公司,胶原酶Ⅱ(批号:C8150)购自北京索莱宝科技有限公司。小鼠血清(批号:SBJ-SEM004)购自南京森贝伽生物科技有限公司。超声治疗仪(型号:VINNO M86)购自中国飞依诺科技股份有限公司。微泡为医用Sono Vue 对比剂,购自意大利Brocco 公司。超声医用耦合垫购自深圳市全立好实业有限公司,倒置显微镜(型号:DM750P)购自德国Leica 公司,高速低温离心机(型号:Optima XPN-10)购自美国Beckman 公司,流式细胞仪(型号:NovoCyteAdanteon V6B5R3)购自美国Agilent Technologies 公司。本研究经浙江省人民医院实验动物福利伦理委员会审查通过(批准文号:20231016192616359566)。
1.2 微泡oAd 混合液制备 oAd 病毒扩增:将HEK293细胞放在含有10%FBS、1%青/链霉素双抗(100 U/mL)的DMEM 培养基中培养至40 皿。待HEK293 细胞长满至80%~90%时将培养基换成含有5%FBS、1%青/链霉素双抗(100 U/mL)的DMEM 培养基,加入50 μL浓度为106PFU/mL病毒感染HEK293 细胞。观察培养皿,当全部布满病毒空斑时收集所有培养液和细胞,将培养液和细胞反复冻融3 次以上,放置在-80 ℃冰箱保存。
氯化铯梯度超速离心法病毒提纯:将冻融后的培养液和细胞在4 ℃高速离心机12 000 r/min离心10 min,收集上清液。将上清液和聚乙二醇8 000 溶液以2∶1 的比例混匀,置4 ℃冰箱内过夜。次日将溶液放在4 ℃高速离心机12 000 r/min 离心20 min,弃上清液,收集沉淀。在沉淀中加2 mL 密度为1.1 g/mL 的氯化铯溶液并重悬沉淀,移至4 ℃高速离心机12 000 r/min 离心10 min,收集上清液。先在离心管加入2 mL 密度为1.4 g/mL 的氯化铯溶液,再用滴管加入3 mL 密度为1.3 g/mL 的氯化铯溶液,最上层加入5 mL 含病毒的上清液,置4 ℃高速离心机20 000 r/min 离心2 h。离心结束后用移液枪收集密度在1.3~1.4 g/mL 氯化铯溶液之间的病毒条带,转移至透析袋中封存。将透析袋放在透析缓冲液中,置4 ℃冰箱内过夜,8 h 换1 次透析缓冲液。收集透析袋内的病毒溶液,置-80 ℃冰箱保存。通过TCID50 法测定病毒的滴度。
将微泡按产品说明书注入0.9%氯化钠溶液5 mL用力振荡30 s 形成微泡悬液,用刚配制的微泡悬液将1010PFU/mL oAd 稀释至108PFU/mL,冰上孵育30 min,制成微泡oAd 混合液[8]。
1.3 小鼠体内肿瘤模型建立和分组 在C57BL/6 小鼠右前肢皮下注射Panc-02 细胞2×106个/只,选择肿瘤体积在100~150 mm3的小鼠55只。将小鼠随机分为NC组(注射PBS 溶液100 μL)、UTMD 组(注射微泡溶液100 μL,并行超声微泡破坏处理5 min)、oAd 组(注射108PFU/mL oAd 溶液100 μL)、oAd+微泡组(注射108PFU/mL 微泡oAd混合液100 μL)、oAd+UTMD组(注射108PFU/mL微泡oAd混合液100 μL,并行超声微泡破坏处理5 min),每组11 只。2 d 给予1 次瘤内注射治疗及超声微泡破坏处理,共处理5 次。2 d 记录1 次小鼠肿瘤体积。当有小鼠肿瘤体积超过2 000 mm3时终止实验,所有小鼠均在实验第14 天采用颈椎脱臼法处死,所有数据记录终止在第12 天。第3 次给药结束后24 h 每组随机取6 只小鼠处死,剥离小鼠皮下肿瘤组织,随后PBS 冲洗干净置于冰上,其中3 只用于流式分析,3 只用于切片染色分析。肿瘤体积计算公式:肿瘤体积=长度(mm)×宽度(mm)×宽度(mm)×0.5。
1.4 UTMD 处理及超声仪器参数设置 UTMD 组和oAd+UTMD 组小鼠在瘤内注射微泡溶液或微泡oAd混合液后,立即给予持续异氟烷吸入麻醉(气体流量为300 mL/min,浓度为1.5%),随后在小鼠皮下肿瘤处涂满灭菌耦合剂,放置超声医用耦合垫(厚约5 mm),探头紧贴耦合垫垂直于皮下瘤照射。超声选用X4-12L探头下CBI 造影模式,设置发射频率4 MHz,脉冲重复频率为1 000 Hz,脉冲长度18.0 cycle,声功率40%,脉冲时间1 s,间隔时间1 s,持续时间300 s,占空比0.2%[9]。
1.5 肿瘤组织坏死区域的观察 采用HE 染色。将每组3 只小鼠的肿瘤组织放至多聚甲醛中固定、石蜡包埋,切片厚约5 μm,二甲苯溶液浸泡,然后用无水乙醇冲洗脱蜡,再进行HE 染色,中性树胶封片。倒置显微镜观察切片并拍照,采用Image J 软件圈取切片中粉色坏死区域计算坏死面积,比较各组小鼠坏死面积(以与NC 组比值表示)的差异。
1.6 肿瘤组织E1A 蛋白/CD3+T 细胞的检测 制作切片步骤同HE 染色步骤,切片脱蜡后,用1×柠檬酸(pH 6.0)修复液进行抗原修复。将切片放于3%H2O2溶液中,室温孵育20 min 进行内源性酶阻断。然后在切片组织上滴加小鼠血清,室温孵育30 min 进行血清封闭。加入一抗(E1A抗体、CD3抗体)室温孵育30 min,PBS 洗涤后加入辣根过氧化物酶标记的山羊抗鼠二抗孵育30 min。将DAPI 染液滴加到组织上,玻片放在倒置显微镜下观察,待出现E1A 抗体/CD3 抗体棕色染色后清水冲洗干净,风干并用中性树胶封片,倒置显微镜对切片拍照。E1A 抗体表达为细胞内蛋白染色,观察各组切片上E1A 蛋白棕色染色分布及染色深浅情况。CD3 抗体表达为细胞膜染色,采用Image J 软件计数切片中棕色CD3+T 细胞数。
1.7 观察肿瘤组织凋亡染色情况 采用Tunel 染色。血清封闭之前的步骤同E1A 蛋白染色,按产品说明书配置Tunel 反应液,血清封闭后在切片组织上滴加Tunel 反应液,4 ℃孵育过夜。PBS 洗涤,甩干后在切片组织内滴加DAPI 染液,避光室温孵育10 min。PBS 洗涤,甩干后用抗荧光淬灭封片剂封片。使用荧光显微镜对切片拍照(委托武汉市皮诺飞生物有限公司拍摄),观察各组小鼠切片中荧光情况。
1.8 肿瘤细胞总凋亡率的检测 采用流式细胞术。每组3 只小鼠的肿瘤组织用剪刀剪碎,加入300 μL Ⅱ型胶原酶(200 U/mL),37 ℃持续振荡培养箱中孵育6 h 后,PBS 洗涤,用滤网过滤去大块细胞团,留下细胞悬液。细胞悬液加入Annexin V-FITC 细胞凋亡检测试剂,室温避光孵育30 min,PBS 洗去多余染料,流式细胞仪检测细胞发光情况,NovoExpress 软件分析流式图,流式图右下象限表示早期凋亡,右上象限表示晚期凋亡,两象限值相加即为总凋亡率。
1.9 统计学处理 采用SPSS 26.0 统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 第12 天各组小鼠肿瘤组织体积的比较 在第12天时oAd 组、oAd+微泡组和oAd+UTMD 组肿瘤体积比NC 组均明显降低(均P<0.05),其中oAd+UTMD 组肿瘤增长减缓效果最强。oAd+UTMD 组的肿瘤组织体积小于oAd 组(P<0.05),oAd 组和oAd+微泡组肿瘤体积差异无统计学意义(P>0.05),UTMD 与NC 组肿瘤体积比较差异无统计学意义(P>0.05),见表1。
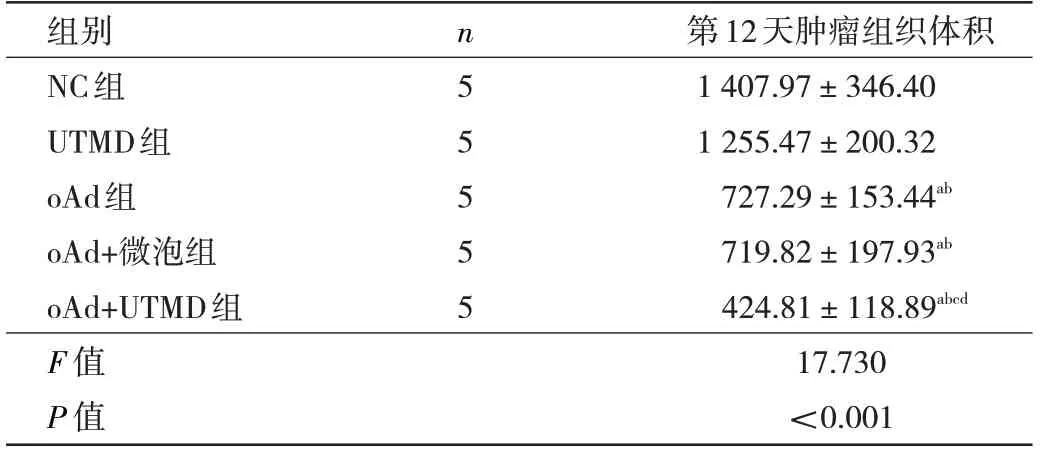
表1 第12 天各组小鼠肿瘤组织体积比较(mm3)
2.2 各组小鼠肿瘤组织E1A 蛋白表达情况 NC 组和UTMD 组切片中未见E1A 蛋白表达,oAd 组、oAd+微泡组和oAd+UTMD 组均见到E1A 蛋白表达,oAd+UTMD组细胞质内E1A 蛋白染色最深,oAd 组染色最浅,见图1(插页)。

图1 各组小鼠肿瘤组织E1A 蛋白表达情况
2.3 各组小鼠肿瘤组织切片坏死面积的比较 含oAd的3 组小鼠肿瘤坏死面积均大于UTMD 组(均P<0.05),其中oAd+UTMD 组坏死最大。oAd+UTMD 组坏死面积又较oAd 组明显增加(P<0.05),oAd 组和而oAd+微泡组之间的比较差异无统计学意义(P>0.05),见图2(插页)、表2。

图2 各组小鼠肿瘤组织切片病理检查所见

表2 各组小鼠肿瘤组织切片坏死面积的比较
2.4 各组小鼠肿瘤组织CD3+T 细胞数比较 相比于NC 组和UTMD 组,含oAd 的3 组小鼠肿瘤组织内CD3+T细胞数均增加(均P<0.05)。oAd+UTMD 组肿瘤组织中CD3+T 细胞数较oAd 组和oAd+微泡组均增多(均P<0.05),UTMD 组与NC 组比较差异无统计学意义(P>0.05),见图3(插页)、表3。

图3 各组小鼠肿瘤组织CD3+T 细胞分布

表3 各组小鼠肿瘤组织CD3+T 细胞数比较(个)
2.5 各组小鼠肿瘤组织凋亡情况比较 oAd 组、oAd+微泡组和oAd+UTMD 组的总凋亡率均高于NC 组(均P<0.05),oAd+UTMD 组比oAd 明显增多(P<0.05)。oAd 组和oAd+微泡组比较差异无统计学意义(P>0.05),UTMD 组和NC 组之间差异无统计学意义(P>0.05),见图4(插页)、表4。同样的趋势,在肿瘤组织Tunel 染色中也观察到,oAd+UTMD 组绿色荧光分布最多,见图4(插页)。
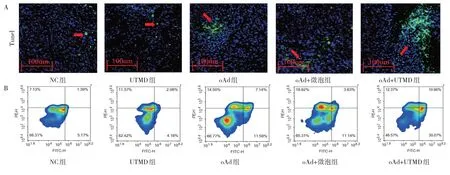
图4 各组小鼠肿瘤组织凋亡分析(A:凋亡的肿瘤组织染色结果,Tunel 染色,×20;B:肿瘤细胞凋亡流式分析图)

表4 各组小鼠肿瘤总凋亡率比较(%)
3 讨论
肿瘤细胞与正常细胞相比,胞内抑制病毒的细胞信号转导通路表达异常,使溶瘤病毒可以选择性的在肿瘤细胞内转染[10]。Zhang 等[11]研究发现单纯疱疹病毒通过下调肿瘤相关巨噬细胞,增加肿瘤浸润淋巴细胞百分比来减缓胰腺肿瘤细胞增长。Koujima 等[12]发现胰腺癌细胞的侵袭性与磷酸化细胞外信号调节激酶1 和2 的表达有关,端粒酶特异性oAd 可以破坏细胞外调节蛋白激酶信号传导,抑制胰腺癌细胞迁移和侵袭。本研究建立小鼠胰腺癌肿瘤模型中,给予包含oAd 的3 组小鼠肿瘤体积增长都有所减缓,符合oAd 对肿瘤有杀伤作用。胰腺肿瘤结缔组织增生和肿瘤TME 限制病毒的进入复制以及效应T 细胞和自然杀伤细胞等免疫细胞的肿瘤浸润[13]。将药物溶解在微泡壳内的脂质中,或附着在微泡壳表面[14-15],当载药的微泡到达目标位置后,用低强度超声刺激微泡破裂,产生的液体流动增加了细胞的剪切应力,使细胞膜通透性增加,促进分子、纳米颗粒等治疗剂在细胞内递送而不造成不可逆的细胞损伤[16-17]。为了探寻UTMD 是否能增强oAd 对胰腺癌的溶瘤作用,笔者对小鼠瘤体进行测量并进一步行肿瘤组织HE 染色和Tunel 染色及肿瘤细胞凋亡分析,结果显示oAd+UTMD 组小鼠肿瘤体积增长比oAd 组显著减缓,肿瘤组织肿瘤坏死和凋亡均为最多。为进一步研究UTMD 是否提高oAd 在肿瘤内转染,对肿瘤组织进行oAd 独特表达的E1A 染色,结果显示在给予相同病毒量的情况下oAd+UTMD组E1A 蛋白染色最深,这提示UTMD 通过提高oAd 在体内利用率来增强其抗肿瘤作用。oAd 组和oAd+微泡组无论是在抑制肿瘤生长还是富集CD3+T 细胞等方面差异均无统计学意义,这提示单纯的微泡对oAd溶瘤效果帮助不大,微泡破裂产生的空化作用才是溶瘤的关键因素。
实体肿瘤内促血管生成因子过表达,使肿瘤内血管生成畸形和血液灌注少,血液内抗肿瘤因子无法进入[18]。有相关研究表明,UTMD 可以促进前列腺素和一氧化氮的产生,使肿瘤血管正常化,增加肿瘤局部的血流灌注[19]。Lin 等[20]研究发现UTMD 的空化将肿瘤相关巨噬细胞从M2 巨噬细胞重新定向到抑制肿瘤的M1 巨噬细胞,使肿瘤内血管正常化,促进药物向肿瘤内渗透。这也解释了在实验中UTMD 组的肿瘤体积增长比NC 组略缓,UTMD 组在富集CD3+T 细胞和诱导肿瘤凋亡等方面比NC 组略强。Zhang 等[21]在探寻如何以低成本的方式将核酸转染进乳腺癌细胞中时,发现UTMD 处理后细胞立即出现孔隙,并在30 min 内细胞形态恢复正常。UTMD 不仅使细胞产生空隙增加药物运输,同时刺激细胞内吞作用增加。Jin 等[22]用微泡运输腺相关病毒,对Hela 细胞超声照射后发现病毒不完全通过超声形成的空隙运输,由网格蛋白介导的肿瘤细胞内吞作用增加,细胞通过内吞来摄取溶瘤病毒,同时恢复细胞膜结构。
溶瘤病毒将肿瘤细胞溶解后释放的肿瘤相关抗原和肿瘤新抗原可被树突状细胞呈现在细胞表面,刺激免疫细胞启动先天性和适应性免疫反应[23]。溶瘤病毒介导的免疫治疗在实体肿瘤治疗中疗效差的原因主要考虑:一是肿瘤细胞外基质中纤维增生多,使病毒无法渗透进肿瘤内部;二是肿瘤周围有免疫抑制微环境,其中调节性T 细胞和骨髓源性抑制细胞增多,而免疫细胞处于耗竭状态,进而无法响应溶瘤病毒引发的抗肿瘤免疫[24]。本研究中注射oAd 的3 组小鼠肿瘤切片中CD3+T 细胞均有所增加,其中以oAd+UTMD 组增加最明显且与oAd 组比较差异有统计学意义。这提示UTMD 和oAd 联合使用可以提升oAd 引的抗肿瘤免疫能力。
综上所述,UTMD 和oAd 联合使用时,UTMD 可以促进oAd 在肿瘤内的转染,协助oAd 在肿瘤内富集更多的免疫细胞,增加肿瘤内坏死和凋亡从而抑制肿瘤增长。
