前交通动脉瘤破裂的血管和动脉瘤形态学危险因素分析
2024-05-06晁晓峰汤宏杰
蒋 中 晁晓峰 张 桐 汤宏杰 冯 力
颅内绝大多数动脉瘤位于前循环,尤其是在Willis 环的交界处或分叉处频发,前交通动脉瘤(anterior communicating artery aneurysm,ACoA)破裂率较高[1]。杨明贵等[2]研究指出,ACoA可作为预测动脉瘤破裂风险指标。Jin等[3]研究结果显示,在281例有脑卒中家族史人群中发现有121例存在Willis前环变异,其中以单侧大脑前动脉(anterior cerebral artery,ACA)A1段发育不良最常见。Zimelewicz等[4]研究表明,A1段变异与ACoA破裂有关。也有研究发现,A1与A2之间的夹角与ACoA破裂具有一定的相关性[5]。然而上述研究并未考虑ACoA瘤颈所生长的位置,因此这种类似的血管角度对ACoA破裂的影响并不完全明确。为此,本研究通过选取瘤颈位于A2与前交通动脉(anterior communicating artery,Acom)分叉处出的ACoA,排除瘤颈位置的影响,进一步探讨Acom复合体形态学与ACoA破裂的相关性,为研究ACoA破裂危险因素提供另一种思路。
对象与方法
1.一般资料:对徐州医科大学附属医院2016年6月~2022年12月211例ACoA动脉瘤患者进行回顾性分析,根据其是否破裂分为破裂组与未破裂组,其中破裂组149例,未破裂组62例。本研究经笔者医院医学伦理学委员会审批通过(伦理学审批号:XYFY2023-KL001)。
2.纳入标准:①经笔者医院CTA或DSA检查证实为ACoA,并且其瘤颈位于A2与Acom分叉处;②多次住院治疗只纳入1次。
3.排除标准:①ACoA同侧A1段变异;②病历资料或头颅CTA或DSA图像缺乏、不完整或不清晰;③动脉瘤术后复发;④ACoA多发;⑤因外伤和烟雾病、动静脉畸形等血流相关疾病导致的动脉瘤;⑥因动脉瘤破裂引起的血管痉挛;⑦Acom未开放。
4.资料收集:所有患者均经笔者医院CTA或DSA检查,通过三维重建合成Willis血管环立体图像,其中破裂组患者通过术后复查CTA图像与术前发病24h内CTA或DSA图像对比,患者双侧A1段由两位高级职称的放射科医师利用工作站进行观察和测量,意见不一致时,则由第3位神经外科高年资医师共同讨论完成,排除动脉瘤破裂后发生血管痉挛的影响。本研究参考依据,双侧A1段可根据其解剖形态学分为对称(正常)与不对称(变异),其中不对称有2种组成,a单侧A1段纤细或发育不良,即优势侧A1段管径大于对侧2倍及以上;b单侧A1段缺如,即一侧A1段在CTA/DSA图像上不显影,而另一侧显影正常(图1)[6]。测量血管角度及方法:A1段与Acom之间(A1/Acom)、A2段与Acom之间(A2/Acom)、A1与A2段之间(A1/A2)以及ACoA动脉瘤长径与A1段之间的夹角(入射角);当A1段发生变异时,测量优势侧MCA始段、A1始段和颈内动脉(internal carotid artery, ICA)末端的直径及A1/ICA之间的夹角[7, 8]。A2/ACoA分叉角测量是根据A1远侧分叉端中心点分别连至A2段和ACoA中心轴所构成的夹角(A1/ACoA),A1/ACoA角、A1/A2角和A1/ICA角以类似方式测量(图2)。
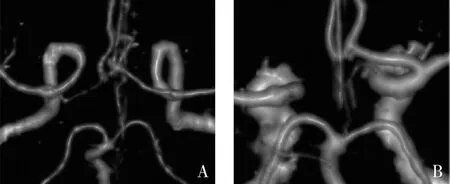
图1 Willis环A1段形态学变异类型
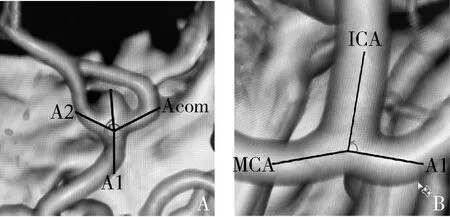
图2 血管角度测量

结 果
1.单因素分析结果:两组性别、糖尿病、吸烟史、饮酒史、动脉瘤数量方面比较,差异无统计学意义(P>0.05);而在年龄、高血压、AR值、瘤体形态、瘤体指向、A1段变异、A1/Acom角、A2/Acom角、A1/A2角、入射角方面比较,差异有统计学意义(P<0.05),详见表1。

表1 影响ACoA破裂的单因素分析结果
2.多因素分析结果:根据单因素分析结果,将年龄、高血压、AR值、瘤体形态、瘤体指向、A1段变异、A1/Acom角、A2/Acom角、A1/A2角、入射角纳入多因素Logistic回归分析,结果显示年龄、高血压、AR值、瘤体不规则、A1段变异、A2/Acom角、入射角是ACoA破裂的独立危险因素(P<0.05,表2)。

表2 影响ACoA破裂的多因素分析结果
3.A1段变异组中优势侧A1起始段、MCA、ICA末端的直径及A1/ICA角与ACoA破裂的相关分析:211例患者中,有148例患者A1段发生变异,A1/ICA角(r=0.237,P=0.004,95% CI:-0.388~0.074)与ACoA破裂存在正相关性,而MCA始段直径(r=-0.245,P=0.003,95% CI:-0.395~-0.082)与ACoA破裂存在负相关性;A1始段直径(r=0.064,P=0.440,95% CI:-0.103~0.228)、ICA末端直径 (r=0.024,P=0.769,95% CI:-0.142~0.190) 与ACoA破裂相关性不大。
讨 论
ACoA位于Willis环前半部分,与相邻的双侧ACA A1段及穿支动脉共同构成Acom复合体,研究发现ACoA生长方式多样,形态特征也各异,并且由于ACoA瘤颈所在位置的不同,其破裂率也存在差异[9]。因此单纯研究ACoA形态学特征不足以明确其破裂的危险因素。本研究的创新性通过选取特定部位的ACoA,排除瘤颈位置对本研究的影响,进一步探讨Acom复合体形态学与ACoA的相关性。
IAs是蛛网膜下腔出血常见病因,IAs一旦发生破裂,无论介入栓塞还开颅夹闭,早期病死率高达30%~40%,且再次破裂的概率极高,再次破裂出血病死率高达60%以上,即使存活其预后仍较差,通常留有不可逆的神经功能损害,严重危害人类的健康[10, 11]。
本研究发现高血压与ACoA破裂具有相关性,但高血压与动脉瘤破裂之间尚无明确定论,大多数研究表明,高血压的动脉瘤破裂的危险因素[1, 12,13]。笔者推测原因可能是,长期的高血压导致血管壁的损伤,改变血管壁的脆性和顺应性,促使动脉瘤发生破裂[14]。
本研究发现,双侧A1段不对称是ACoA破裂的独立危险因素,结果与Zimelewicz等[4]研究相似。笔者推测原因之一可能是,当双侧ICA、ACA和MCA对称时,流经A1段血流量相等,进入ACoA内血流较少[15]。因此对动脉瘤生长和破裂影响较少,而不对称的血流通常继发于上述血管解剖变异,当双侧A1段管径大小差异超过50%时,并且这种差异越大,血流速度越大[6]。由此产生的流动应力促使动脉瘤快速生长,最终破裂。另一个原因可能是,由于一侧A1段纤细或缺如,导致来对侧A1段的血流量增加,通过Acom的血流量会代偿性增加,Acom复合体处的血管壁压力增加,从而启动血管重塑,这可能是ACoA相对其他部位动脉瘤更易发生破裂的原因[16]。
与大多数研究结果一致,动脉瘤形态特征是影响其破裂出血的重要因素[17,18]。本研究发现,AR值越大,动脉瘤越容易发生破裂。有研究发现高的剪应力常促使动脉瘤形成与生长,AR值越大,血流进入细长的瘤体内流速越慢,将产生局部低剪应力的血流动力学环境,高剪应力和低剪应力是两种异常的血流动力学条件,可引起管壁病理重构途径,驱动动脉瘤生长和破裂[19]。动脉瘤是否规则同样是评价动脉瘤形态特征的指标,众多研究表明形态越不规则的动脉瘤,将产生更不稳定和更复杂的血流,引起动脉瘤壁损伤,从而导致动脉瘤破裂[20]。
除了动脉瘤形态特征之外,本研究还发现,ACA末端血管分叉角、入射角是与ACoA破裂相关,其中A2/Acom角和入射角是ACoA破裂独立危险因素。但有研究指出ACA末端血管分叉角不能预测ACoA破裂,与本研究的结果不一致,分析其原因可能是未考虑ACoA所处具体位置,忽略了瘤颈位置与瘤体内血流动力学的关系[21]。有研究显示,血管分叉角与血流动力学改变显著相关[22]。本研究的 ACoA瘤颈在A2与Acom夹角之间,与A2/Acom关系极为密切,A2/Acom角越大,ACoA破裂越容易破裂。笔者推测原因之一可能是,血管分叉部的血流动力学随着夹角变大而改变,造成血管壁局部压力失衡,当此处形成动脉瘤后,更大血流将进一步冲击受损的瘤壁,加快动脉瘤进展[23]。另一个原因可能是,当A2/Acom角变大,有助于涡流形成,进一步损伤血管壁,导致动脉瘤发生破裂[7,24]。多项研究发现,入射角与动脉瘤破裂密切相关,入射角越大,动脉瘤破裂的可能性越大[25]。当入射角增加时,会引发不利的血流动力学环境产生,血流方式更加复杂,动脉瘤壁面剪应力会相对增大,容易导致动脉瘤破裂。
此外,本研究还发现优势侧A1/ICA角与ACoA破裂呈正相关,MCA始段直径与ACoA破裂呈负相关。当一侧A1段纤细或缺如时,通过ACoA的血流主要由优势侧A1段供应,此时A1/ICA角越大,MCA始段直径越小,ACoA越容易发生破裂。笔者推测原因可能是,当A1/ICA角增大,流入A1段的血流速度越大,更快的血流对分叉末端的冲击压力也就更大,从而促使动脉瘤生长;当MCA始段直径越小,更多的血液流入A1段,从而引起大量血液涌入瘤体,其内的血流动力学也将更为复杂,最终导致动脉瘤发生破裂。
本研究不足之处在于属于单中心回顾性研究,涉及的患者数量有限,可能导致一定的偏倚,其次动脉瘤破裂后可能影响其形态学特征。
综上所述,年龄、高血压、AR值、瘤体不规则、A1段变异、A2/Acom角、入射角是影响ACoA破裂的危险因素,并且当一侧A1段发生变异时,优势侧A1/ICA角越大,MCA始段直径越小,ACoA越容易破裂。因此,建议对有以上危险因素的患者给于积极治疗,降低ACoA自发破裂率,提高患者预后。
利益冲突声明:所有作者均声明不存在利益冲突。
