汉防己乙素衍生物LYY-47对三阴性乳腺癌细胞及其多倍体巨瘤细胞增殖、凋亡的作用和机制*
2024-04-22余晓静张望明贺天辉刘小花艾海锋安丽君杨留启潘卫东刘杰麟
余晓静, 张望明, 贺天辉, 刘小花,艾海锋, 安丽君, 杨留启, 潘卫东, 刘杰麟,5***
(1.贵州医科大学 基础医学院 免疫学教研室, 贵州 贵阳 550025; 2.九江学院附属医院 检验科, 江西 九江 332000; 3.德江县民族中医院 检验科, 贵州 铜仁 565200; 4.贵州大学 药学院, 贵州 贵阳 550025; 5.贵州医科大学 省部共建药用植物功效与利用国家重点实验室, 贵州 贵阳 550014)
乳腺癌是女性最常见的恶性肿瘤之一,其发病率居女性恶性肿瘤之首,呈逐年上升的趋势,并且趋于年轻化[1]。其中不表达雌激素受体、孕激素受体及人表皮生长因子受体-2(human epidermal growth factor receptor 2,HER-2)的乳腺癌称为三阴性乳腺癌(triple negative breast cancer,TNBC),占所有乳腺癌的 15%~20%,对内分泌治疗及 HER-2 的靶向治疗往往不敏感,积极研制新型靶向治疗药物是临床科研中亟待解决的问题。多倍体巨瘤细胞(polyploid giant cancer cells, PGCCs)是导致实体瘤异质性的一类特殊的癌细胞亚群,在多种癌症细胞中已经发现了PGCCs 的存在,显示出与肿瘤直接的相关性[2],且PGCCs及其子代细胞参与了上皮-间充质转化(epithelial-mesenchymal transition,EMT)相关癌症侵袭和转移的发生,与乳腺癌的发生发展、转移及治疗耐药相关[3]。有研究表明,PGCCs具有肿瘤干细胞的特性,能够表达肿瘤干细胞标志物白细胞分化抗原44(cluster of differentiation 44,CD44)和白细胞分化抗原133(cluster of differentiation 133,CD133)[4],并可在体外形成球型体,导致免疫缺陷小鼠体内产生肿瘤[5]。在耐药性方面,已有研究表明PGCCs对包括阿霉素、长春花碱及紫杉醇(paclitaxel,PTX)在内的常规化疗药物具有抵抗能力,PGCCs可以在这些药物的极端剂量中存活,半抑制浓度(half maximal inhibitory concentration,IC50)值是其亲本细胞的10倍以上[6]。为了治疗肿瘤的复发和转移,必须消除促转移、耐药及肿瘤生长的PGCCs,所以寻找PGCCs的治疗靶标就显得尤为关键。Bloom(BLM) DNA 解旋酶作为人类RecQ家族解旋酶中的重要成员,参与了DNA的修复、复制及重组等过程,在维持端粒和染色体的稳定性中发挥着重要作用[7],且与乳腺癌、前列腺癌、结肠癌及卵巢癌等发生发展有着重要的关系[8]。此外,亦有研究显示,小分子ML216 可抑制高表达BLM DNA解旋酶的癌细胞增殖[9]。汉防己乙素是从防己科植物粉防己的根中提取的单体化合物,具有抗炎镇痛、降血压等药理作用[10]。有研究表明,汉防己乙素可通过调节肿瘤细胞周期、促进凋亡相关基因的表达,对肝癌、胰腺癌等多种肿瘤细胞具有明显的抑制作用[11]。PGCCs是以有丝分裂失败导致内复制或者细胞间的融合形成的单个巨核或者多核的细胞, BLM DNA解旋酶参与了DNA代谢的各个过程,但是目前尚无其与PGCCs相互关联的报道。本研究拟探讨BLM DNA解旋酶是否能够成为抑制PGCCs及其子代细胞的有效靶点,寻找有效的小分子化合药物,从而为临床治疗TNBC提供新的思路及线索。
1 材料与方法
1.1 实验材料
1.1.1细胞及动物来源 TNBC MDA-MB-231细胞和MDA-MB-436细胞购自中国科学院细胞库;6周龄雌性无特定病原体(specific pathogen free, SPF)级无胸腺BALB/c裸鼠12只,体质量18~20 g,购自北京斯贝福生物技术有限公司。本研究获学校动物实验伦理委员会批准[2200073,动物许可证号为SCXK(京)2019-0010]。
1.1.2主要试剂 汉防己乙素衍生物LYY-47由贵州省中国科学院天然产物化学重点实验室提供[纯度>95%,配制溶剂为二甲基亚砜(dimethyl sulfoxide,DMSO)],PTX(大连美仑公司),BLM特异性抑制剂ML216(美国APExBIO公司),L15培养基(上海中乔新舟公司),胎牛血清(以色列BI公司),1%青霉素链霉素双抗、胰蛋白酶(美国Gibco公司),胰岛素(武汉普诺赛公司),苏木素-伊红(hematoxylin-eosin,H&E)染色试剂盒、噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)试剂、蛋白Marker、抗荧光衰减封片剂含4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)、中性树胶、0.1%结晶紫染液、3,3-二氨基联苯胺盐酸盐(3,3-N-diaminobenzidine tertrahydrochloride,DAB)显色试剂盒(北京索莱宝公司),细胞周期检测试剂盒、Annexin V-FITC/碘化丙啶(propidium iodide,PI)凋亡试剂盒(杭州联科公司),二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(江苏碧云天公司),细胞周期蛋白依赖性激酶1(cyclin dependent kinase 1,CDK1)抗体、细胞周期蛋白B1(cell cycle protein B1 ,cyclin B1)抗体、Rad51抗体、BCL2-相关X蛋白(Bcl-2-associated X protein,Bax)抗体、B淋巴细胞瘤蛋白-2 (B-cell lymphoma protein2,Bcl-2)抗体、裂解凋亡蛋白酶-3(cleaved Caspase-3)抗体、裂解凋亡蛋白酶-8(cleaved Caspase-8)抗体(成都正能生物公司),CD44抗体、细胞周期调节蛋白-67(cell cycle regulatory proteins-67,Ki-67)抗体(北京博奥森公司),乙醛脱氢酶1A1(acetaldehyde dehydrogenase1A1,ALDH1A1)抗体、乳腺癌易感基因1(breast cancer susceptibility gene 1,BRCA1)抗体(美国Proteintech公司),CD133抗体、磷酸化组蛋白2AX(phosphorylation of histone 2AX,γ-H2AX)抗体(武汉博士德生物公司),BLM抗体(美国Santa公司),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔抗体和抗鼠抗体、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的山羊抗鼠抗体(武汉塞维尔公司)。
1.1.3主要仪器 正置荧光显微镜、倒置荧光显微镜(日本Nikon公司),凝胶成像系统(上海天能公司),超微量微孔板分光光度计(美国biotek 公司),水平电泳仪(北京六一仪器厂),流式细胞仪(安捷伦生物公司)。
1.2 研究方法
1.2.1细胞培养 MDA-MB-231细胞使用L15培养基培养,添加10%胎牛血清和1%青霉素链霉素双抗;MDA-MB-436细胞使用L15培养基培养,添加20%胎牛血清和1%青霉素链霉素双抗以及20 U/100 mL胰岛素完全培养基。
1.2.2PGCCs的形成 取“1.2.1”项下2种细胞融合度达到80%~90%时,加500 nmol/L PTX培养18 h,更换为不含PTX的完全培养基继续培养,每3 天换液1次。
1.2.3H&E染色和PGCCs的计数 取“1.2.1”项下2种细胞以8×104个/孔接种于预先放入细胞爬片的24孔板中,诱导其形成PGCCs,每隔1天取出对应培养时间的细胞爬片;4%多聚甲醛固定细胞10 min,加苏木素染液染色5 min,水洗;加伊红染液染色1 min,稍稍水洗;自然晾干,中性树胶封片;高倍镜下(400×)选择5个视野进行PGCCs计数,计算PGCCs平均数量并绘制PGCCs的形成曲线。
1.2.4流式细胞术检测细胞周期 收集“1.2.1”项下MDA-MB-231细胞和“1.2.2”项下PGCCs子代细胞,以3×105个/孔均匀铺于6孔板;设置对照组(0.00 μmol/L或DMSO)、LYY-47(6.50 μmol/L)给药组,ML216(25 μmol/L、50 μmol/L及100 μmol/L)给药组,处理48 h; 收集各组细胞,1 000 r/min 离心 5 min,弃上清液,PBS洗涤;加 DNA Staining solution 1 mL和Permeabilization solution 10 μL ,混匀;室温避光孵育 30 min,通过流式细胞仪检测分析。
1.2.5Western blot检测周期相关蛋白(CDK1、CyclinB1)、干性相关蛋白(ALDH1A1、CD44、CD133)、DNA损伤修复相关蛋白(BLM、Rad51、BRCA1)及凋亡相关蛋白(Bax、Bcl-2、cleaved Caspase-3、cleaved Caspase-8)的表达 收集“1.2.1”项下对数生长期的MDA-MB-231细胞和“1.2.2”项下PGCCs子代细胞 ,以3×105个/孔均匀铺于6孔板;设置对照组(0.00 μmol/L)、LYY-47(5.00 μmol/L)给药组,加入含蛋白酶抑制剂的RIPA裂解液(RIPA Lysis Buffer)裂解细胞,4 ℃低温12 000 r/min离心15 min,取上清移至新的EP管;BCA法测定蛋白的浓度后将剩余蛋白与5×上样缓冲液按4∶1的比例加样混匀,100 ℃水浴加热10 min;所得蛋白样品经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDS-PAGE)分离,电转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜;5%脱脂奶粉封闭2 h,分别加入对应的 CDK1、CyclinB1、ALDH1A1、CD44、CD133、BLM、Rad51、BRCA1、Bax、Bcl-2、cleaved Caspase-3、cleaved Caspase-8抗体,4 ℃冰箱孵育过夜;三乙醇胺缓冲盐水溶液/吐温(tris buffered saline/ Tween,TBS/T)洗膜后根据一抗的来源分别加入对应的山羊抗鼠或者山羊抗兔二抗,室温摇床孵育2 h;TBST洗膜,使用增强型化学发光(enhanced chemiluminescence,ECL)显影。
1.2.6MTT法检测细胞活力 收集“1.2.1”项下对数生长期的MDA-MB-231细胞和“1.2.2”项下PGCCs子代细胞,按照1.0×104/孔的密度接种于96孔板;设置对照组(0.00 μmol/L)、LYY-47(1.25 μmol/L、2.50 μmol/L、5.00 μmol/L、10.00 μmol/L、20.00 μmol/L及30.00 μmol/L)给药组、ML216(6.25 μmol/L、12.50 μmol/L、25.00 μmol/L、50.00 μmol/L及100.00 μmol/L)给药组;培养特定时间后取出培养板,每孔加培养基100 μL 和MTT试剂10 μL ,避光孵育 4 h,每孔加入二甲基亚砜(dimethyl sulfoxide,DMSO)150 μL,37 ℃摇床上充分溶解结晶10 min,酶标仪于490 nm 波长处检测各孔的光密度(optical density,OD)值。
1.2.7克隆形成实验 收集“1.2.1”项下对数生长期的MDA-MB-231细胞和“1.2.2”项下PGCCs子代细胞,计数后以800个/孔接种于6孔板;设置对照组(0.00 μmol/L)、LYY-47(0.25 μmol/L、0.50 μmol/L及0.75 μmol/L)给药组、ML216(0.625 μmol/L、1.250 μmol/L及2.500 μmol/L)给药组。继续培养12 d,终止培养,期间每2~3 天换液1次;弃原有培养液,PBS洗涤细胞2次;4%多聚甲醛室温固定细胞20 min,PBS洗涤2次;0.1%结晶紫染液染色20 min,自来水冲洗;空气干燥,拍照,使用Image J软件计数细胞集落数。
1.2.8细胞免疫荧光实验检测γ-H2AX的表达 收集“1.2.1”项下对数生长期的的MDA-MB-231细胞和“1.2.2”项下PGCCs子代细胞,以8×104个/孔接种于预先放入细胞爬片的24孔板中,待细胞长至合适的融合度后,4%多聚甲醛室温固定细胞20 min,0.3% Triton X-100室温透化细胞20 min;5%山羊血清室温封闭20 min;洗涤后加鼠抗γ-H2AX抗体(1∶400稀释),放入湿盒,4 ℃冰箱孵育过夜;洗涤,加FITC标记的山羊抗鼠IgG(1∶100稀释),37 ℃温箱避光孵育30 min;洗涤,滴加适量含DAPI的封片剂于载玻片上,盖上爬片,让细胞接触封片液,使用正置荧光显微镜观察拍照。
1.2.9荧光偏振实验检测汉防己乙素衍生物对BLM DNA 解旋酶酶活性的影响 反应缓冲液(20 mmol/L Tris、25 mmol/L NaCl、3 mmol/L MgCl2、0.1 mmol/L DTT及pH 7.9)中加2 nmol/L荧光标记DNA [dsDNA或ssDNA (21 nt)],检测荧光各向异性值,直至稳定;加不同浓度(0.00~6.67 μ mol/L)汉防己乙素衍生物,检测荧光各向异性值,直至其稳定;加500 nmol/L BLM642-1290DNA解旋酶,使DNA底物浸泡后检测荧光各向异性值,直至其稳定;记录荧光各向异性值。汉防己乙素衍生物对BLM642-1290DNA解旋酶解链的影响采用相同的方法,汉防己乙素衍生物终浓度调整为0.00~33.34 μmol/L,最后加终浓度为0.2 mmol/L的腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)。
1.2.10ML216对MDA-MB-231细胞形成PGCCs的影响 收集“1.2.1”项下对数生长期的MDA-MB-231细胞,以3×105个/孔均匀铺于6孔板,隔天细胞贴壁后,将细胞分为对照组、PTX组、ML216组及ML216+PTX组, ML216组和ML216+PTX组分别加3 μmol/L 的ML216,对照组和 PTX 组分别加入同等体积的完全培养基;各组细胞继续培养48 h至细胞融合度达80%~90%后,PTX组加500 nmol/L PTX、ML216组加3 μmol/L ML216及ML216+PTX组分别加PTX和ML216至PTX药物终浓度为500 nmol/L ,ML216药物终浓度为3 μmol/L,对照组加入同等体积的完全培养基;置于培养箱培养18 h,无菌PBS轻轻洗涤2次, ML216组和ML216+PTX组加3 μmol/L ML216、对照组和PTX组加同等体积的完全培养基;继续培养9 d,期间每2~3 天进行换液;到达培养时间后, PBS洗涤细胞2次,4%多聚甲醛室温固定细胞20 min,0.1%结晶紫染液染色20 min,自来水冲洗,使用Image J软件计数细胞数。
1.2.11流式细胞术检测细胞凋亡 收集“1.2.1”项下MDA-MB-231细胞和“1.2.2”项下PGCCs子代细胞,以3×105个/孔均匀铺于6孔板;设置对照组(0.00 μmol/L)、LYY-47(2.50 μmol/L、5.00 μmol/L及6.50 μmol/L)给药组,处理48 h;不含EDTA的0.25%胰蛋白酶消化收集细胞(包括培养上清中的细胞),预冷 PBS 离心洗涤2次;双蒸水稀释 5×Binding Buffer 为 1×工作液,取1×Binding Buffer 500 μL重悬各组细胞;每管加Annexin V-FITC 5 μL 和 PI 10 μL,吸头吹吸混匀,室温避光孵育 5 min,流式细胞仪检测细胞凋亡情况。
1.2.12皮下成瘤动物实验 裸鼠皮下分别注射5×106个“1.2.1”项下的MDA-MB-231细胞和“1.2.2”项下诱导形成的PGCCs子代细胞,每隔3天测量1次肿瘤体积,测量29 d,颈椎脱臼处死裸鼠,剥离肿瘤,称重并拍照;剥离的肿瘤组织浸泡于4%多聚甲醛制作石蜡切片,H&E染色和免疫组织化学染色观察细胞形态并检测BLM与Ki-67的表达。
1.3 统计学分析
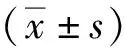
2 结果
2.1 PTX诱导人乳腺癌细胞形成PGCCs及其子代细胞
人乳腺癌MDA-MB-231细胞和MDA-MB-436细胞经500 nmol/L PTX处理18 h,更换不含PTX的完全培养基继续培养细胞,镜下发现单个巨核或者多核的PGCCs;MDA-MB-231细胞继续培养20~25 d时观察到细胞通过出芽的方式产出了子代细胞,至27~35 d时产生了更多的子代细胞群体。诱导MDA-MB-436细胞形成PGCCs后,继续培养9 d时,PGCCs同样通过出芽的方式产出了子代细胞,至15~35 d时,子代细胞群体明显,H&E染色计数了PTX处理后35 d内PGCCs百分比的变化情况,并绘制了MDA-MB-231 PGCCs的形成曲线,可以看到PTX处理后的20 d内, PGCCs的百分比逐渐增加,比例达100%后保持稳定;产生子代细胞后,PGCCs的百分比开始下降,直至趋于0%。见图1。

注:A为MDA-MB-231细胞、MDA-MB-436细胞与各自 PGCCs及其子代细胞的形态(H&E,×400),B为500 nmol/L PTX处理MDA-MB-231细胞后产生PGCCs的定量结果。
2.2 细胞周期和细胞周期相关蛋白的表达
与未经诱导的细胞相比,MDA-MB-231细胞来源的PGCCs S期(P<0.01)和G2/M期细胞增加(P<0.05),其子代细胞则S期细胞增加(P<0.01),但G2/M期细胞减少(P<0.01);PGCCs 中G2/M期周期蛋白CDK1和CyclinB1表达均下调(P<0.05),子代细胞中的表达则上调(P<0.05)。见图2。

注:A为细胞周期图,B为细胞周期分布的定量结果,C、D为MDA-MB-231细胞和PGCCs及其子代细胞中CDK1、CyclinB1蛋白的表达及定量结果;与MDA-MB-231细胞组比较,(1)P<0.01,(2)P<0.05。
2.3 干性相关蛋白的表达和增殖能力
与MDA-MB-231细胞比较,PGCCs及其子代细胞中干性相关蛋白ALDH1A1、CD44及CD133表达上调(P<0.05),PGCCs子代细胞的增殖和克隆形成能力增强(P<0.05),PGCCs子代细胞中DNA损伤标志物γ-H2AX的表达上调(P<0.01)。见图3。

注:A为MDA-MB-231细胞和PGCCs及其子代细胞中CD44、ALDH1A1、CD133的表达,B为干性相关蛋白定量结果,C为细胞克隆形成图,D为MDA-MB-231细胞与PGCCs子代细胞生长曲线,E为细胞克隆形成数统计结果,F为MDA-MB-231细胞与PGCCs子代细胞中DNA损伤标志物γ-H2AX的表达(免疫荧光染色,×400),G为γ-H2AX荧光强度的定量结果;与MDA-MB-231细胞组比较,(1)P<0.01, (2)P<0.05。
2.4 BLM DNA解旋酶对PGCCs形成的影响
检测MDA-MB-231细胞和PGCCs子代细胞中DNA损伤修复相关蛋白的表达,结果显示,PGCCs子代细胞中DNA损伤修复相关蛋白BLM、Rad51、BRCA1的表达均上调(P<0.05);进一步研究了药物抑制BLM DNA解旋酶对PGCCs形成的影响,在用PTX诱导MDA-MB-231细胞形成PGCCs的过程中加入BLM DNA解旋酶抑制剂ML216,结果显示,与PTX组相比,PTX+ML216组PGCCs的形成数目明显减少(P<0.01)。见图4。
注:A、B为Western blot检测MDA-MB-231细胞与PGCCs子代细胞中BLM、Rad51及BRCA1蛋白的表达及定量结果,C为PGCCs形成数目的结晶紫染色图(40×),D为PGCCs形成数目的统计结果;(1) 与MDA-MB-231细胞组比较,P<0.05;(2)与500 nmol/L PTX组比较,P<0.01。
2.5 MDA-MB-231细胞和PGCCs子代细胞的裸鼠成瘤能力
检测MDA-MB-231细胞和PGCCs子代细胞的裸鼠成瘤能力,结果显示,PGCCs子代细胞组瘤体的体积和重量均极明显高于MDA-MB-231细胞组(P<0.001),PGCCs子代细胞组的肿瘤生长速度也明显快于MDA-MB-231细胞组(P<0.01);PGCCs子代细胞组中BLM、增殖相关蛋白Ki-67均呈高表达(P<0.01)。见图5。

注:A为MDA-MB-231细胞与PGCCs子代细胞小鼠移植瘤模型示意图,B为裸鼠瘤体照片,C为肿瘤最终瘤体重量统计结果, D为肿瘤体积生长曲线,E为H&E染色和免疫组织化学染色检测图(红色箭头所指为Ki-67阳性细胞,DAB显色,200×),F为Ki-67阳性细胞统计结果;与MDA-MB-231细胞组比较,(1)P<0.001,(2)P<0.01。
2.6 汉防己乙素衍生物LYY-47对BLM642-1290DNA解旋酶的酶活性及蛋白表达的影响
检测LYY-47对 BLM642-1290DNA解旋酶酶活性的影响,结果显示,LYY-47能够使得BLM642-1290DNA解旋酶的DNA结合活性、ATPase活性及解链活性下调;且LYY-47作用于MDA-MB-231细胞和PGCCs子代细胞后,细胞中DNA损伤修复相关蛋白BLM、Rad51、BRCA1的表达均下调(P<0.05)。见图6。

注:A为LYY-47 对 dsDNA 的影响及BLM DNA解旋酶与 dsDNA 复合物的荧光各向异性值, B为 LYY-47 与 dsDNA 结合后对其与BLM DNA解旋酶 结合活性的影响,C 为 LYY-47对 ssDNA的影响及BLM DNA解旋酶与 ssDNA复合物的荧光各向异性值,D为LYY-47与 ssDNA结合后对其与 BLM DNA解旋酶结合活性的影响,E为LYY-47对BLM DNA解旋酶ATPase活性的影响,F为 LYY-47对BLM DNA解旋酶解链活性的影响,G为LYY-47对 BLM DNA解旋酶解链时间曲线的影响, H、I为LYY-47药物处理后,MDA-MB-231细胞和PGCCs子代细胞中BLM、Rad51、 BRCA1蛋白的表达及定量结果; A0 为 LYY-47 -DNA 复合物的荧光各向异性值,A1为BLM-LYY-47-DNA 复合物的荧光各向异性值,A2为加入终浓度0.2 mmol/L ATP 后反应体系的荧光各向异性值;与对照组比较,(1)P<0.001,(2)P<0.01,(3)P<0.05。
2.7 LYY-47和ML216对MDA-MB-231细胞和其PGCCs子代细胞增殖和克隆形成的影响
检测LYY-47和ML216对正常乳腺上皮MCF-10A细胞、MDA-MB-231细胞和PGCCs子代细胞增殖和克隆形成能力的影响,结果显示,不同浓度的LYY-47和ML216作用于MCF-10A细胞、MDA-MB-231细胞和PGCCs子代细胞后,细胞的增殖和克隆形成能力下调(P<0.05)。见图7。

注:A、B、C为LYY-47处理后MCF-10A细胞、MDA-MB-231细胞及PGCCs子代细胞的OD值,D为LYY-47对MCF-10A细胞、MDA-MB-231细胞及PGCCs子代细胞增殖抑制的IC50, E、F为ML216处理后对MDA-MB-231细胞和PGCCs子代细胞的OD值, G、H、I 为LYY-47对MDA-MB-231细胞、PGCCs子代细胞克隆形成能力的检测结果和定量结果(结晶紫染色),J、K及L为ML216对MDA-MB-231细胞、PGCCs子代细胞克隆形成能力的检测结果和定量结果(结晶紫染色);与对照组比较,(1)P<0.05,(2)P<0.01,(3)P<0.001;(4) 与MCF-10A细胞比较,P<0.001。
2.8 LYY-47对MDA-MB-231细胞和PGCCs子代细胞周期的影响
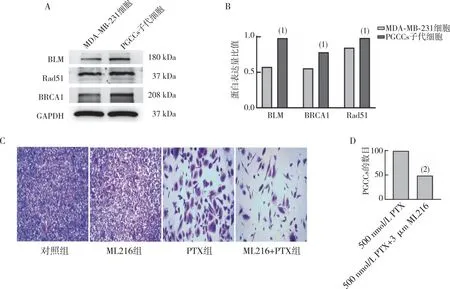
检测LYY-47对MDA-MB-231细胞和其PGCCs子代细胞周期的影响,结果显示,LYY-47能够使得MDA-MB-231细胞和PGCCs子代细胞G2 /M 期细胞数量增多(P<0.05),S 期细胞数量减少(P<0.05),将细胞阻滞于 G2/M期;与对照组相比,LYY-47给药组CDK1 与 CyclinB1 的表达水平均被明显抑制了(P<0.05)。见图8。

注:A、B为LYY-47处理后MDA-MB-231细胞和PGCCs子代细胞周期的检测结果和定量结果,C、D为MDA-MB-231细胞和PGCCs子代细胞中细胞周期相关蛋白CDK1、CyclinB1的表达和定量结果;与对照组比较, (1)P<0.05,(2)P<0.01。
2.9 ML216对MDA-MB-231细胞和PGCCs子代细胞周期的影响
检测ML216对MDA-MB-231细胞和其PGCCs子代细胞周期的影响,结果显示,不同浓度ML216能够引起MDA-MB-231细胞和PGCCs子代细胞G1期细胞数量的增加(P<0.05),使得细胞难以进入S期,S期细胞数量减少(P<0.05)。见图9。
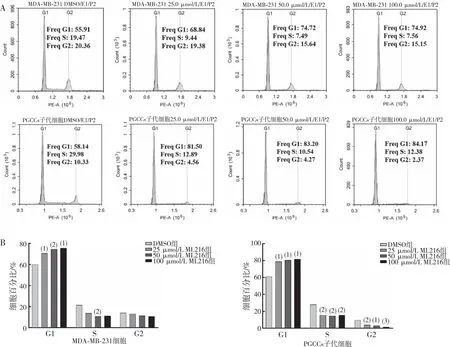
注:A、B为ML216处理后MDA-MB-231细胞和PGCCs子代细胞周期的检测结果和定量结果;与DMSO组比较,(1)P<0.01,(2)P<0.05,(3)P<0.001。
2.10 LYY-47对MDA-MB-231细胞和PGCCs子代细胞凋亡及凋亡相关蛋白表达的影响
检测LYY-47对MDA-MB-231细胞和其PGCCs子代细胞凋亡的影响。结果显示,与对照组相比,LYY-47给药组的细胞总凋亡比例(总凋亡率=晚期细胞凋亡率+早期细胞凋亡率)增加(P<0.05);实验组细胞经5 μmol/L LYY-47处理48 h后,检测各组凋亡相关蛋白的表达;结果显示,与对照组相比,LYY-47给药组细胞中Bax、cleaved Caspase-3、cleaved Caspase-8的表达均上调(P<0.05),Bcl-2的表达则下调(P<0.05)。见图10。
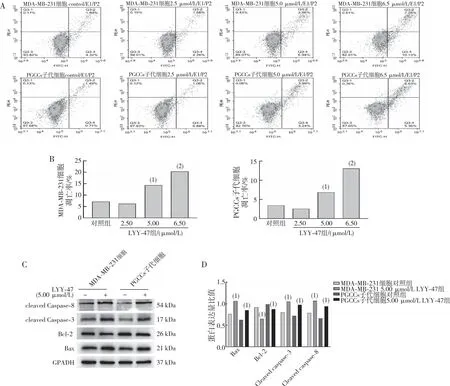
注:A、B为MDA-MB-231细胞和PGCCs子代细胞的流式细胞术检测结果和定量结果,C、D为MDA-MB-231细胞和PGCCs子代细胞中凋亡相关蛋白Bax、Bcl-2、cleaved Caspase-3 及cleaved Caspase-8的表达和定量结果;与对照组比较, (1)P<0.05,(2)P<0.001。
2.11 BLM DNA解旋酶对PGCCs及其子代细胞的影响
通过PTX诱导人乳腺癌MDA-MB-231/436细胞形成的PGCCs及其子代细胞的性状以及LYY-47对MDA-MB-231细胞及其PGCCs子代细胞的影响总结如图11所示。

注:↑表示上调,↓表示下调。
3 讨论
以往研究表明,癌症复发往往是耐药亚群在初始治疗后重新产生肿瘤的结果,而PGCCs就是这样一个耐药亚群,最近研究已证实其在癌症进展中的相关性和重要性,它是导致实体瘤异质性的一类特殊的癌细胞亚群,治疗压力会诱导形成PGCCs,且PGCCs可通过不对称分裂产生具有治疗抗性的子代细胞[2,12-13]。本研究中,通过500 nmol/L PTX诱导TNBC MDA-MB-231和MDA-MB-436细胞产生PGCCs,并观察到了PGCCs子代细胞的产生;采用H&E染色对PGCCs进行染色,根据Zhang等[14]对PGCCs的定义对PGCCs进行计数,并计算百分比,绘制了PGCCs的形成曲线;与MDA-MB-231细胞相比,PTX诱导MDA-MB-436细胞形成的PGCCs 数量较少,因此,目前没有展开深入的研究。通过流式细胞术对MDA-MB-231细胞、PGCCs以及 PGCCs子代细胞进行细胞周期分析,进一步证实了PGCCs表现为多倍体和非整倍体以及经历了G2/M期阻滞,PGCCs产生的子代细胞又回归了二倍体属性。CyclinB1 与 CDK1 是调控细胞周期 G2/M 期的核心蛋白,在DNA合成的后期细胞由S期向G2/M期过渡过程中依赖于CyclinB1 与 CDK1形成的复合物的调控,驱动G2期到M期的转换[15]。结果显示,与MDA-MB-231细胞相比,PGCCs 中CyclinB1 与 CDK1表达下调,PGCCs子代细胞中CyclinB1 与 CDK1表达则上调,这与流式细胞术结果相符合。
PGCCs的形成会发生去分化和向胚胎阶段的逆转[16]。PGCCs符合癌症干细胞的定义,在调节人实体瘤细胞之间的异质性、干性和化学抗性中起着基本作用[17]。结果显示,PGCCs及其子代细胞中肿瘤干细胞标志物CD44、ALDH1A1及CD133表达均上调。有研究应用流式细胞术分选出CD44+CD24-/low细胞亚群,并通过NOD/SCID小鼠成瘤实验,确定了CD44/CD24是乳腺癌肿瘤干细胞表面标志物[18],但也有文献报道CD24在乳腺癌MDA-MB-231细胞中不表达[19],因此在本研究中未进行CD24的相关实验。应激压力使细胞发生内复制或者细胞间的融合产生PGCCs,PGCCs在经历G2/M周期阻滞后能够产生具有治疗抗性、恶性程度更高的子代细胞[20]。研究结果显示,PGCCs子代细胞较MDA-MB-231细胞增殖、克隆形成能力均明显增强。γ-H2AX是DNA双链断裂(double-strand break,DSB) 的早期标志物,在无明显DSB的情况下,γ-H2AX也与肿瘤的发生发展关系密切[21]。结果显示,PGCCs子代细胞中γ-H2AX的表达较MDA-MB-231细胞上调。综上结果表明,通过细胞内复制或者细胞间融合形成的PGCCs具有肿瘤干细胞特性,能够通过不对称分裂产生恶性程度更高的子代细胞,且PGCCs及其子代细胞与癌症的发生发展密切相关。
目前研究认为,有丝分裂失败是PGCCs形成的一个重要的原因[22],因此本研究探讨了PGCCs及其子代细胞与BLM DNA解旋酶之间可能存在的关联。本研究检测了MDA-MB-231细胞和PGCCs子代细胞中BLM、BRCA1及Rad51蛋白表达,结果显示,PGCCs子代细胞较MDA-MB-231细胞BLM、BRCA1及Rad51蛋白表达均上调;随后检测了BLM DNA解旋酶特异性抑制剂ML216对PGCCs形成的影响,在PTX诱导MDA-MB-231细胞形成PGCCs的过程中加入ML216,结果显示,ML216能够抑制PGCCs的形成,使得PGCCs形成的数量明显减少;体内实验表明,PGCCs子代细胞的裸鼠成瘤能力较MDA-MB-231细胞明显增强,肿瘤组织中BLM和Ki-67均呈高表达;本课题组前期研究表明,汉防己甲素衍生物HL-42和HL-49能够抑制TNBC MDA-MB-231细胞增殖及诱导其凋亡[23]。在本研究中,以抑制BLM DNA解旋酶的酶活性为靶点对汉防己乙素衍生物进行筛选,通过荧光偏振实验筛选出汉防己乙素衍生物LYY-47对BLM DNA 解旋酶的酶活性具有显著的抑制作用,且 LYY-47能够抑制MDA-MB-231细胞和PGCCs子代细胞中BLM、Rad51及BRCA1蛋白的表达。
大量研究表明,细胞周期失调是恶性肿瘤细胞的重要特征之一,使得细胞具有无限增殖的能力,最终导致肿瘤的形成[24]。已有文献报道,BLM DNA解旋酶与细胞周期具有重要关系,抑制BLM DNA解旋酶能够有效提高PC3细胞在G0/G1期的细胞数量[8]。本研究检测了LYY-47和ML216对MDA-MB-231和PGCCs子代细胞增殖和细胞周期的影响,设置了不同药物浓度梯度作用于MDA-MB-231和PGCCs子代细胞,结果显示LYY-47和ML216能够浓度依赖地抑制MDA-MB-231和PGCCs子代细胞的增殖以及克隆形成;在此基础上,采用流式细胞仪检测了LYY-47和ML216对MDA-MB-231和PGCCs子代细胞周期的影响,结果显示不同浓度的ML216能够有效提高MDA-MB-231和PGCCs子代细胞G1期的细胞数量,G1期细胞数目增多,细胞难以进入S期,S期细胞减少,提示在ML216的干扰下,能够抑制MDA-MB-231和PGCCs子代细胞的增殖;LYY-47可导致MDA-MB-231和PGCCs子代细胞S期细胞减少,G2/M期细胞明显增加,细胞被阻滞于G2/M期,因此LYY-47可引起MDA-MB-231细胞和PGCCs子代细胞G2/M期的阻滞,从而抑制细胞的增殖。进一步通过蛋白质印迹实验检测LYY-47对细胞周期G2/M期相关蛋白CDK1、CyclinB1表达的影响,结果显示,LYY-47药物处理组MDA-MB-231细胞和PGCCs子代细胞中CDK1、CyclinB1的表达均被显著抑制了。同时也发现,相同浓度的情况下,LYY-47和ML216对MDA-MB-231细胞的增殖抑制以及克隆形成抑制要强于对PGCCs子代细胞,而对PGCCs子代细胞的周期影响则强于对MDA-MB-231细胞。
已有文献报道,BLM DNA 解旋酶在DNA 损伤修复中起着重要作用[25]。本课题组前期研究表明,沉默BLM DNA解旋酶能够导致DNA损伤增加,从而促进细胞的凋亡[26]。本研究中,使用不同浓度LYY-47处理MDA-MB-231和PGCCs子代细胞后,细胞凋亡率增加,Bax、cleaved Caspase-3及cleaved Caspase-8表达上调, Bcl-2表达下调,提示LYY-47能够浓度依赖的诱导MDA-MB-231和PGCCs子代细胞发生凋亡。相同浓度的情况下,LYY-47对MDA-MB-231细胞的促凋亡作用要强于对PGCCs子代细胞,表明PGCCs子代细胞可能更具有药物治疗抗性。
综上所述,本研究表明,BLM DNA 解旋酶可能参与了PGCCs的形成过程,LYY-47可通过抑制BLM DNA解旋酶诱导细胞凋亡和阻滞细胞周期,从而影响PGCCs子代细胞的增殖。
