LMR/LDH对弥漫大B细胞淋巴瘤合并乙型病毒性肝炎患者预后的价值*
2024-04-22胡里花石倩筠聂微何水梁俊秋严芝强杨芳
胡里花, 石倩筠, 聂微, 何水, 梁俊秋, 严芝强, 杨芳,**
(1.贵州医科大学 医学检验学院 临床检验学教研室, 贵州 贵阳 550004; 2.贵州医科大学附属医院 临床检验中心, 贵州 贵阳 550004; 3.贵州医科大学附属医院 胃肠外科, 贵州 贵阳 550004)
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL) 是淋巴瘤中最常见的一种亚型,据估计,全世界每年新增患者15万例,占所有非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)病例的30%[1];近年来国内外有研究提示DLBCL 患者更易感染乙型肝炎病毒 (hepatitis B virus,HBV),感染率为15.6%~30.2%[2]。HBV感染除造成肝脏功能及器质性病变外,还与淋巴瘤的发生密切相关,如:HBV的感染是淋巴瘤患者总生存期(overall survival,OS)与无进展生存期(progression-free survival,PFS)的独立预后不良指标[3];DLBCL感染HBV的风险高于普通人群[4];HBV感染对B细胞NHL(B cell NHL,B-NHL)的治疗在多方面存在影响,例如:由于HBV存在肝功能损伤的潜在危害,因此这类阳性DLBCL 患者在化疗后可能会出现更为严重的肝功能损伤等[3]。由此,NHL合并HBV患者的预后与单纯NHL相比也存在差异。所以,迄今为止,DLBCL 预后评分系统是目前国际上常用的欧美地区国际预后指数(international prog nostic index,IPI),而IPI只是一种辅助工具,不能完全准确地预测患者的预后,于是在IPI的基础上,结合年龄、乳酸脱氢酶(lactic dehydrogenase,LDH)等因素构建一个更精确的国家综合癌症网络-国际预后指数(National Comprehensive Cancer Network-international prognostic index,NCCN-IPI)预后体系,且NCCN-IPI评分优于IPI预后指数[5-6]。NCCN-IPI为原发性胃DLBCL患者生存的独立预测因子,其可改善患者的危险分层,并有助于患者的个性化治疗。但未见关于针对合并HBV感染对DLBCL患者预后评估系统。近年来研究显示,外周血淋巴细胞与单核细胞比值(lymphocyte to monocyte quotient,LMR)与乳酸脱氢酶(lactate dehydrogenase quotient,LDH)的比值(LMR/LDH)可作为DLBCL等多种恶性肿瘤的重要预后指标[6-8]。LDH是淋巴瘤负荷的标志,与细胞增殖相关,LMR能准确反映宿主的免疫状态,对宿主免疫和肿瘤微环境作出系统联合评价,利用LMR/LDH的比值评估疾病的预后是较为经济、便捷的血液指标[9-11]。因此,本研究采用回顾性分析方法,探究DLBCL合并乙型病毒性肝炎患者中治疗前 LMR/LDH与各项临床特征之间的关系,以及它们对患者OS与PFS的影响,进一步分析LMR/LDH对DLBCL合并乙型病毒性肝炎患者预后的价值。
1 对象与方法
1.1 研究对象
选取2013年4月—2019年4月病理组织学检查确诊为 DLBCL且合并乙型病毒性肝炎的患者。纳入标准为:(1)符合2016年更新版《WHO造血与淋巴组织肿瘤分类》的诊断标准[12];(2)年龄≥18岁;(3)初诊患者,既往未接受过其他方案化疗;(4)有慢性乙型病毒性肝炎病史。排除标准为:(1)其他病理类型淋巴瘤转化而来的DLBCL;(2)伴其他恶性肿瘤或其他疾病患者;(3)既往接受过化疗或者放疗;(4)既往无酒精性肝病、自身免疫性肝病、药物及遗传代谢性肝病病史。最终纳入DLBCL合并乙型病毒性肝炎患者77例,且患者知情同意。
1.2 研究方法
1.2.1收集临床资料 收集患者的性别、年龄、临床分期、B症状(不明原因发热≥38 ℃、盗汗及6个月内体质量下降>10%)、美国东部肿瘤协作组(eastern cooperative oncology group,ECOG)评分、淋巴结外受累数量、IPI分级(0~2分为低危,3~5分为高危)等临床资料。
1.2.2血生化指标检测 采集患者治疗前空腹外周静脉乙二胺四乙酸二钾(ethylenediaminetetraacetic acid dipotassium salt dihydrate,EDTA-2K+)抗凝全血及空腹静脉血,抗凝全血用于血细胞分析,采用电阻抗、高频电导及激光散射联合检测法检测淋巴细胞绝对值及单核细胞绝对值,计算LMR,试剂购于Sysmex有限公司;静脉血3 mL,3 500 r/min 离心10 min,取血清采用紫外分光光度法检测血清LDH,免疫比浊法检测β2-微球蛋白(Beta-2-microglobulin,β2-MG),试剂购于Roche有限公司。
1.2.3治疗方法 所有患者接受2~8个疗程的化疗,使用利妥昔单抗(rituximab,R)、环磷酰胺(cyclophosphamide,C)、多柔比星(doxorubicin,H)、长春新碱(vincristine,O)及泼尼松(prednisone,P)方案,即R-CHOP方案进行治疗。
1.2.4随访及疗效评价 采用电话和查阅病例的方式随访36个月,随访1次/年,末次随访日期为2022年4月1日,随访期间根据化疗后患者疾病的进展情况,收集患者的存活时间,统计患者的OS及PFS,并进行恶性淋巴瘤的疗效评价[13],将疗效分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)及疾病进展(progression disease,PD),并采用OS(从确诊之日起到患者死亡或末次随访日期[14])和PFS(开始接受治疗至患者出现疾病进展或末次随访日期[14])评估患者生存情况。
1.3 统计学分析
使用SPSS 25.0软件对数据进行统计分析,采用ROC曲线来确定LMR/LDH的最佳临界值。计数资料采用频数和构成比表示,使用卡方检验比较组间差异,针对单因素分析的生存率的比较采用Log-rank检验进行分析,使用Kaplan-Meier法绘制患者生存函数图;多因素分析使用Cox回归模型,以P<0.05为差异有统计学意义。
2 结果
2.1 LMR/LDH临界值的确定
ROC曲线(图1)分析结果显示,最具差异性的LMR/LDH临界值为0.008, 曲线下面积(aera under curve,AUC)为0.705 4,敏感度0.660 7,特异度0.761 9, 95%CI为0.549 1~0.893 7(P=0.005 7)。

图1 DLBCL合并乙型病毒性肝炎患者LMR/LDH临界值的确定Fig.1 ROC curves of low LRM/LDH group and high LRM/LDH group in patients with DLBCL combined with HBV
2.2 LMR/LDH水平与患者临床特征的相关性
据LMR/LDH临界值将患者分为低LMR/LDH组 (LMR/LDH≤0.008,n=35)和高LMR/LDH组 (LMR/LDH>0.008,n=42),与高LMR/LDH组比较,低LMR/LDH组患者在性别、年龄和B症状方面进行比较,差异均无统计学意义(P>0.05);低LMR/LDH组患者的临床分期(Ⅲ~Ⅳ期)、ECOG评分(≥2分)、结外受累(≥2个)、IPI(3~5分)、LDH(>245 U/L)、β2-MG (>3 mg/L)中所占比例均较高LMR/LDH组升高,差异均有统计学意义(P<0.05)。见表1。
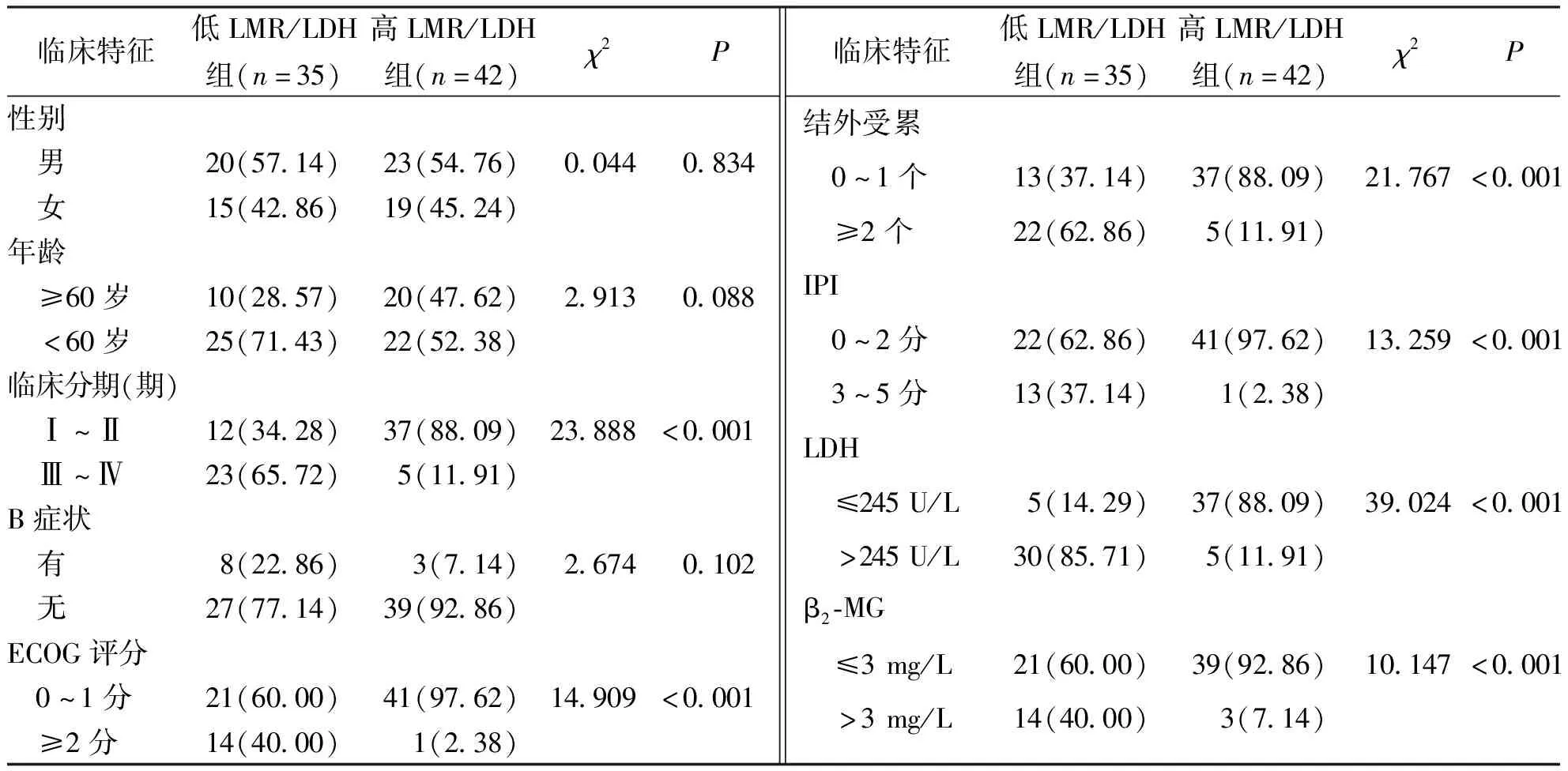
表1 高LMR/LDH组和低LMR/LDH组DLBCL合并乙型病毒性肝炎患者的临床特征[n(%)]Tab.1 The clinical characteristics of patients with DLBCL combined with HBV in high LMR/LDH group and low LMR/LDH group[n(%)]
2.3 LMR/LDH与生存期的关系
高LMR/LDH组患者的3年OS率及PFS率都高于低LMR/LDH组,且差异均有统计学意义(P=0.000 7,0.000 2),见图2。
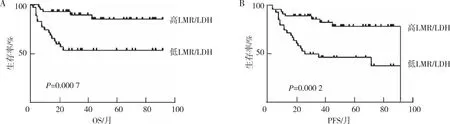
注:A为OS,B为PFS。
2.4 预后危险因素分析
单因素方差分析结果表明,LMR/LDH、临床分期、IPI评分、结外病变≥2个、ECOG评分≥2分、LDH及β2-MG水平是对所有DLBCL合并乙型病毒性肝炎患者3年PFS率及OS率产生影响的危险因素,差异显著且均有统计学意义(P<0.05);将单因素方差分析中影响OS及PFS的危险因素纳入到多因素分析中,结果显示LMR/LDH是影响DLBCL合并乙型病毒性肝炎的患者3年 PFS及 OS的独立危险因素。见表2。
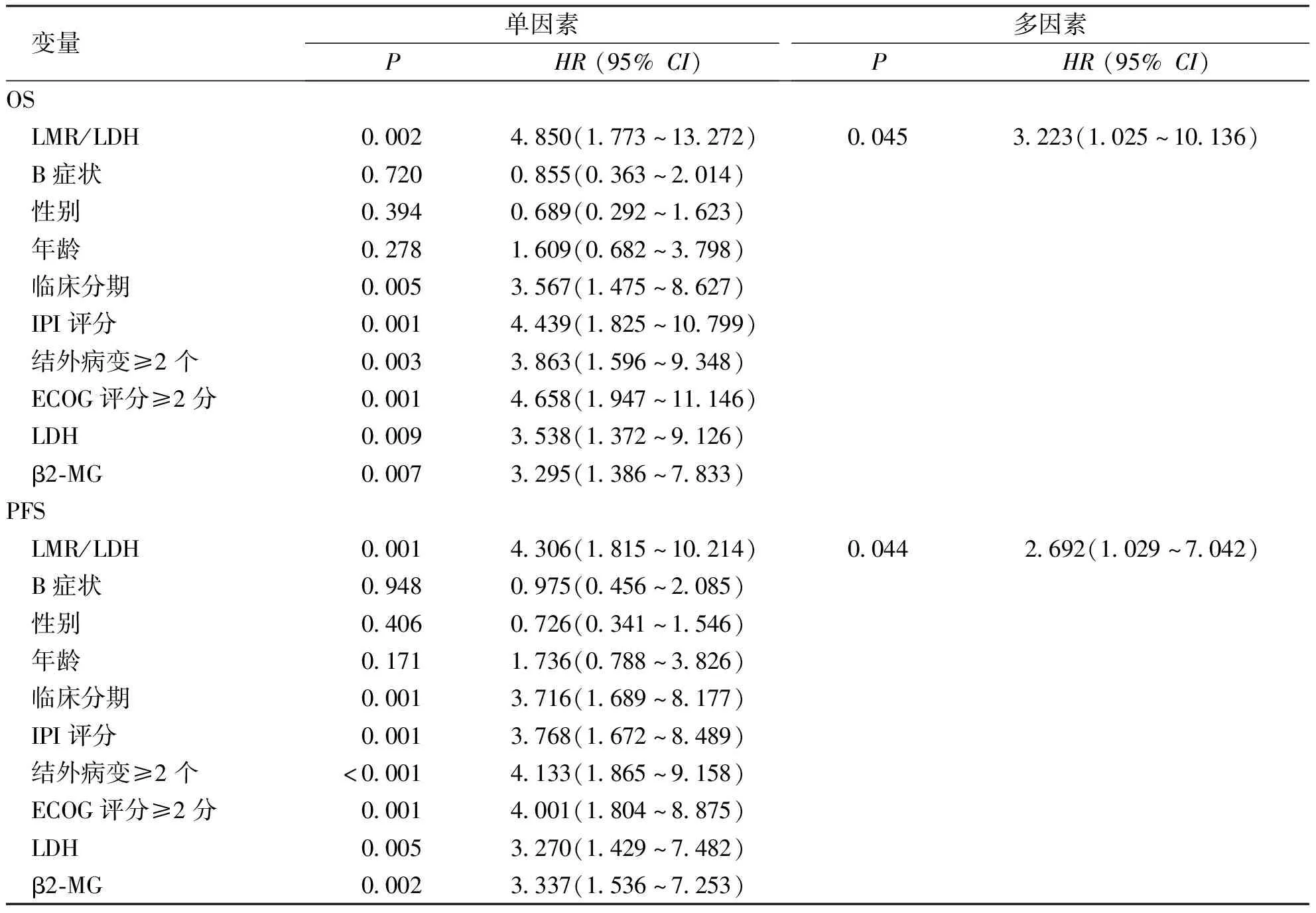
表2 DLBCL合并乙型病毒性肝炎患者OS及PFS的单因素和多因素分析Tab.2 Univariate and multivariate analysis of OS and PFS in patients with DLBCL combined with HBV
3 讨论
DLBCL的发生发展与机体的免疫反应密不可分,预后也同时受到机体对肿瘤细胞的免疫反应、肿瘤固有特征以及肿瘤生长的微环境等因素的影响[15]。因此,通过调节机体对肿瘤细胞的免疫反应和肿瘤细胞自身的肿瘤负荷以及微环境,可以有效地改善DLBCL患者的预后[15]。肿瘤相关炎性细胞在肿瘤生长和进展中起到至关重要的作用[17]。有研究指出,淋巴细胞计数与机体免疫状态有关,而单核细胞计数与机体炎性反应相关[18];T淋巴细胞介导的特异性免疫反应,是一种与肿瘤细胞增殖、凋亡功能密切相关的抗肿瘤细胞免疫系统[19];而单核细胞作用与T淋巴细胞的作用相反,可抑制体内抗肿瘤免疫反应,也可通过浸润肿瘤组织并分化为肿瘤相关巨噬细胞,创造了可诱导突变、促进肿瘤增殖的炎性微环境,肿瘤相关巨噬细胞在肿瘤进展过程中可促进血管生成、增强肿瘤细胞的迁移和侵袭,并通过抑制抗肿瘤免疫反应来影响DLBCL的预后[20-21]。有研究表明,中间型单核细胞增多与DLBCL患者疾病进展有关[22]。肿瘤患者的生存既受宿主体内免疫反应的影响,也受肿瘤本身固有特征的影响(如肿瘤负荷等因素),这些因素共同作用于肿瘤生长环境,可影响肿瘤细胞的增殖、扩散及侵袭等特征,最终影响患者的预后[16,23]。许多研究表明,在实体瘤中,例如肺癌、黑色素瘤和乳腺癌,常使用CT扫描评估肿瘤大小以确定肿瘤负荷[24-26]。由于DLBCL是一种全身性疾病,通常涉及全身淋巴结和结外组织,因此,认为正电子发射计算机断层显像-电子计算机X射线断层扫描技术(positron emission tomography-computed tomography,PET-CT)成像是确定DLBCL患者肿瘤负荷最敏感和特异性的方法[27],但因费用昂贵在临床的应用中经常受限。因此,寻找便捷经济的指标更为实际可行,LDH在调控肿瘤细胞见得能量代谢中发挥着关键关作用,它可以介导丙酮酸与乳酸之间的相互转化,许多肿瘤患者的血液或肿瘤分泌物中,都伴随有LDH水平不同程度的升高[10]。有研究显示,LDH是DLBCL患者肿瘤负荷的极好替代标志物,LMR与LDH的比率是能够预测DLBCL患者生存的独立预后生物标志物[8];杨迪等[28]研究结果与之相似,且进一步表明初诊时高LMR/LDH提示DLBCL患者具有更好的预后。目前,LMR/LDH对仅患有DLBCL的研究比较多,LMR/LDH对的研究较少,在我国DLBCL合并乙型病毒性肝炎的患者并不少见。因此,在DLBCL合并HBV的疾病中寻找一种新的预后指标是新的出发点,而LMR/LDH对DLBCL合并乙型病毒性肝炎患者的预后是否有预测作用的研究尚比较缺乏,本研究旨在探索现有的指标是否可用来预测DLBCL合并乙型病毒性肝炎患者生存预后及价值。
本研究显示,LMR/LDH是预测DLBCL合并乙型病毒性肝炎的患者OS和 PFS的独立预后因素,LMR/LDH降低提示预后不良。刘琦等[29]研究结果显示,低LMR/LDH对原发韦氏环DLBCL预后不良;杨迪等[28]研究结果也提示,低LMR/LDH对DLBCL患者预后不良。本研究中,与高LMR/LDH组患者相比,低LMR/LDH组患者临床分期更晚、更高的EOCG及IPI评分、更多的结外受累数、LDH及β2-MG水平也更明显升高,这些结果均提示低LMR/LDH预后不良。可见,本研究跟上述研究者所做的结果一样,虽然研究对象不同,但都提示低LMR/LDH对患者是一种预后不良的指标。
综上所述,在DLBCL合并乙型病毒性肝炎的患者中,治疗前LMR/LDH≤0.008是OS和 PFS的独立危险因素,LMR/LDH水平降低提示患者预后不佳,同时由于LMR/LDH可通过检测外周血的血常规及LDH酶活性获得,因此,LMR/LDH可作为一种经济便捷的指标,用于评估合并乙型病毒性肝炎的DLBCL患者预后,也可以作为IPI评分系统的重要补充;但由于个体差异的存在,LMR/LDH值会因研究主体不同的临界值而有所变化。由于本研究患者样本量小、单中心研究以及随访时间较短等原因,仍有许多不足之处,故仍需开展多中心前瞻性研究,扩大样本量,并进行长期随访,以进一步揭示LMR/LDH对DLBCL合并乙型病毒性肝炎患者预后的临床意义。
