吡非尼酮对肾纤维化大鼠的治疗作用及分子机制*
2024-04-22晏青程芝梅张帅周石
晏青, 程芝梅, 张帅, 周石 *
(贵州医科大学 医学影像学院, 贵州 贵阳 550004)
近年来,慢性肾脏病(chronic kidney disease, CKD)患病率逐年递增,患者年龄也越来越年轻化,因其极易进展到终末期肾病(end-stagere-nal disease,ESRD)导致患者只能依靠透析治疗或肾移植维持生命,因此已成为全球性公共健康问题之一[1-2]。肾纤维化是各种原因所致肾脏疾病发展到ESRD的共同途径,也是贯穿CKD发展全过程的病理改变[3]。目前肾纤维化已经成为治疗CKD的关键节点,故而探索安全有效的抗肾纤维化药物是当前临床的迫切需求及研究热点[4]。吡非尼酮(pirfenidone,PFD)是一种口服的小分子吡啶酮类化合物[5],因有广谱的抗纤维化、抗氧化及抗炎作用,因此被广泛认识及深入研究[6]。已有研究显示,PFD能够有效减轻肺纤维化、肝纤维化程度以及延缓青光眼术后瘢痕形成的进展[7-8],因此PFD已被临床用于多种脏器纤维化疾病的治疗,但是关于PFD在肾纤维化中的作用研究较少且大多数都处于初级阶段,且其肾纤维化防治作用的机制通路也尚未完全明确。有研究认为,PFD可保留受损肾细胞中线粒体嵴结构,减少线粒体肿胀,保留其部分抗氧化功能,从而达到保护肾脏的作用[9]。沉默信息调节因子3(Silence information regulator 3,SIRT3)是Sirtuin蛋白家族中位于线粒体内的重要成员之一,可以调节线粒体结构和功能[10-11]。目前SIRT3因抗氧化作用而被广泛认识[12]。大量研究表明,SIRT3广泛分布于肾小管细胞中且对肾脏具有保护作用,可能与该分子可以促进线粒体融合、维持肾小管细胞内稳态等功能有关,但具体机制尚不明确[13-14]。因此,本研究旨在探究PFD对肾纤维化大鼠肾脏的治疗作用及可能的分子机制, 从而为临床靶向治疗肾纤维化提供新的方向。
1 材料与方法
1.1 实验材料
1.1.1实验动物 Sprague-Dawley(SD) 雄性大鼠30只,体质量180~200 g,由学校实验动物中心提供,本研究已获学校实验室动物伦理委员会的批准(1702161)。
1.1.2主要试剂和仪器 PFD(北京康蒂尼药业有限公司)、98%四氯化碳(CCL4,上海麦克林生化科技有限公司)、橄榄油(大连美仑生物技术有限公司),尿素测定试剂盒、肌酐测定试剂盒、尿酸测定试剂盒(深圳雷杜生命科学有限公司),二喹啉甲酸(bicinchoninic acid,BCA) 蛋白定量试剂盒、苏木素-伊红(hematoxylin-eosin,HE)染色试剂盒(上海碧云天生物技术公司),Masson三色染色液(珠海贝索生物技术有限公司),鼠抗人α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、鼠抗人金属蛋白酶组织抑制因子1(tissue inhibitors of metalloproteinase 1,TIMP1)及鼠抗人基质金属蛋白酶2(matrix metalloproteinases 2,MMP2)单克隆抗体(美国Novus Biologicals公司),兔抗人Ⅰ型胶原(collagen Ⅰ, ColⅠ)单克隆抗体(武汉博士德生物工程有限公司),兔抗人Ⅲ型胶原(collagen Ⅲ, Col Ⅲ)单克隆抗体、兔抗人缺氧诱导因子-1α(hypoxia-inducible factor-1α ,HIF-1α)单克隆抗体(上海爱必信生物科技有限公司),兔抗人β-肌动蛋白(beta-actin ,β-actin)和鼠抗人转化生长因子-β1(transforming growth factor-β1,TGF-β1)单克隆抗体(美国Affinity公司),兔抗人SIRT3单克隆抗体(美国Proteintech公司),小型垂直电泳转印仪器、快速蛋白转印仪器、凝胶成像仪器(美国Bio-Rad 公司)。
1.2 研究方法
1.2.1造模 30只SD大鼠随机均分为对照组、模型组及治疗组,模型组和治疗组大鼠按1 mL/kg剂量腹腔注射50%浓度CCl4油溶液,对照组大鼠按1 mL/kg剂量腹腔注射橄榄油,均为2次/周、连续5周;处理结束,随机抽取各组大鼠2只处死,取右肾行病理检查作为金标准判定造模是否成功,造模成功标准为HE染色后于光学显微镜下观察到大鼠正常肾组织结构破坏,肾小球肥大或硬化,肾小球系膜细胞增生,肾小管上皮细胞脱落,肾小管扩张、肿胀或塌陷,肾间质纤维化等改变[15]。造模成功后,治疗组大鼠采用PFD以200 mg/(kg·d)剂量连续4周灌胃给药,模型组和对照组大鼠按相同体积生理盐水灌胃,其中模型组大鼠于造模成功后4周内继续予CCl4油溶液腹腔注射(1次/周),对照组大鼠则腹腔注射橄榄油,剂量计算同前。
1.2.2一般情况观察 观察各组大鼠处理过程中的一般情况,包括进食饮水量、精神状态及活动量、毛发及大小便颜色变化等情况,每周末以及处死大鼠前称体质量并记录。
1.2.3取材和标本收集 取“1.2.1”项下第9周给药24 h后的各组大鼠8只,麻醉处死,取心脏血,游离右肾周脂肪和被膜后取右肾,去除包膜和结缔组织,洗净并沥干;所采集样本妥善处置并保存以待后续检测。
1.2.4血清肾功能指标检测 取“1.2.3”项下各组大鼠血样本,室温静置1 h,2~8 ℃下3 000 r/min离心机中离心15 min,取上层血清,通过全自动生化分析仪检测血清中尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,Scr)以及尿酸(uric acid, UA)含量。
1.2.5HE和Masson染色 取“1.2.3”项下各组大鼠右肾组织,常规脱水、透明、浸蜡包埋及切片;根据HE和Masson染色试剂盒说明书进行染色操作,中性树胶封片;200倍光学显微镜下观察肾脏组织学改变并采集图像。
1.2.6Western blot检测蛋白表达 取“1.2.3”项下各组大鼠肾组织检测SIRT3、HIF-1α、TGF-β1、α-SMA、ColⅠ、Col Ⅲ、TIMP1及MMP2蛋白水平。具体方法如下:取肾组织50~100 mg,裂解研磨,12 000 r/min离心15 min,取上清,按BCA试剂盒测定蛋白浓度后变性蛋白;制胶、上样、电泳、转膜、封闭、一抗及二抗(辣根过氧化物酶标记的羊抗鼠、羊抗兔IgG)、曝光;Image J软件分析目的蛋白条带灰度。
1.3 统计学分析
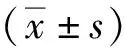
2 结果
2.1 一般情况
开始造模后,模型组和治疗组大鼠的进食、活动量较造模前逐渐减少,且明显少于对照组大鼠,毛色由白色逐渐变黄,精神开始萎靡,大小便发黄,大便稀软易散开;经过PFD治疗后,治疗组大鼠进食及活动量较前增多,毛色发黄及精神状态较前改善、小便略黄,大便正常;模型组大鼠第2、5、7、9周体质量较对应时点对照组大鼠体质量减少(P<0.05),治疗组大鼠第7、9周时体质量较对应时点模型组大鼠体质量增多(P<0.05)。见表1。
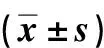
表1 各组大鼠干预过程中体质量的变化Tab.1 Changes in body mass of rats in each group during the experimental
2.2 血清BUN、Scr及UA
与对照组比较,模型组大鼠血清BUN、Scr及UA含量增高(P<0.05);PFD治疗4周后,治疗组大鼠血清BUN、Scr及UA含量较模型组降低(P<0.05)。见表2。
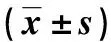
表2 各组大鼠血清BUN、Scr及UA含量Tab.2 Serum BUN, Scr, and UA contents of
2.3 肾脏组织学特征
HE染色结果显示(图1),对照组大鼠肾脏组织结构正常,无明显破坏;模型组大鼠肾脏组织结构明显破坏,肾小管扩张、肿胀,上皮细胞脱落;治疗组大鼠肾脏组织结构破坏介于对照组和模型组之间,肾小球系膜增生、肾小管上皮细胞脱落减少以及肾小管扩张程度均较模型组程度减低。Masson染色显示(图1),对照组大鼠仅见大血管周围少许纤维,模型组肾间质及血管周围见大量蓝染胶原纤维沉积,治疗组大鼠蓝染胶原纤维沉积较模型组减少且纤维化程度有明显减轻。
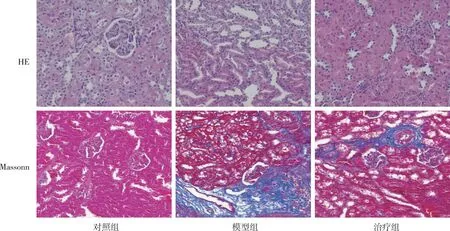
图1 各组大鼠肾脏的组织学特征(200×)Fig.1 Histological characteristics of kidneys of rats in each group(200×)
2.4 MMP2和TIMP1蛋白的表达
Western blot结果表明(图2),模型组大鼠肾组织MMP2表达较对照组降低(P<0.05),治疗组MMP2表达较模型组增高(P<0.05);模型组大鼠肾组织TIMP1表达较对照组增高(P<0.05),治疗组TIMP1表达较模型组降低(P<0.05)。
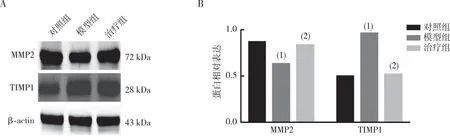
注:A为MMP2、TIMP1蛋白的检测结果,B为MMP2、TIMP1蛋白表达的定量结果;(1)与对照组比较,P<0.05;(2)与模型组比较,P<0.05。
2.5 Col Ⅰ、Col Ⅲ和α-SMA蛋白的表达
Western blot结果表明(图3),模型组大鼠肾组织ColⅠ、Col Ⅲ和α-SMA表达较对照组增高(P<0.05),PFD治疗4周后,治疗组大鼠肾脏组织中ColⅠ、Col Ⅲ和α-SMA表达较模型组降低(P<0.05)。
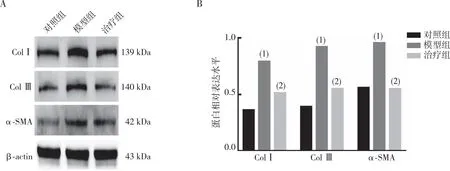
注:A为ColⅠ、ColⅢ及α-SMA蛋白的检测结果,B为ColⅠ、Col Ⅲ及α-SMA蛋白的定量表达;(1)与对照组比较,P<0.05;(2)与模型组比较,P<0.05。
2.6 SIRT3、HIF-1α及TGF-β1蛋白的表达
结果表明(图4),模型组大鼠肾脏组织中SIRT3表达较对照组降低(P<0.05),PFD治疗4周后的治疗组SIRT3表达较模型组增高(P<0.05);模型组大鼠肾脏组织中HIF-1α、TGF-β1表达较对照组增高(P<0.05),PFD治疗4周后的治疗组大鼠肾脏组织中HIF-1α、TGF-β1表达较模型组降低(P<0.05)。
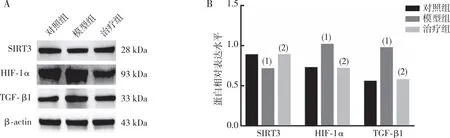
注:A为SIRT3、HIF-1α及TGF-β1蛋白的检测结果,B为SIRT3、HIF-1α及TGF-β1蛋白的定量结果;(1)与对照组比较,P<0.05;(2)与模型组比较,P<0.05。
3 讨论
肾脏纤维化可以作为CKD的标志,肾纤维化程度越严重CKD也就越严重,两者严重程度呈正相关[16],所以延缓甚至逆转肾脏的纤维化是目前治疗CKD的切入点。PFD能阻止甚至逆转细胞外基质(extracellular matrix,ECM)的积聚,已被大量研究证实在多种器官纤维化中均有良好的抗纤维化作用[17]。目前PFD对肾纤维化防治作用的信号通路尚未完全探究清楚。肾纤维化形成主要是由于ECM的异常增多与过度累积,ECM异常沉积主要与其生成和降解失衡相关[18]。研究显示,肌成纤维细胞是导致ECM异常大量生成的重要细胞[19],成纤维细胞分泌基质金属蛋白酶(matrix metalloproteinases,MMPs)可促使ECM降解,也可以分泌MMPs组织抑制因子(tissue inhibitors of metalloproteinase,TIMPs)抑制MMPs的活性,促使ECM合成,这两类蛋白分子可以调节肾脏ECM的合成和降解,维持其相对平衡状态[20-21]。肾小管上皮-间充质转分化(endothelial-mesenchymal transition,EMT)也是肌成纤维细胞的主要来源之一[22]。TIMP1、MMP2能反映肾脏ECM情况[23];ColⅠ、Col Ⅲ是ECM的主要成分,能反映肾间质纤维化的情况[24];α-SMA、TGF-β1是EMT的间质形成标志物,尤其是TGF-β1作为生物体内一种重要的促纤维化生长因子,可以独立启动和完成EMT的整个过程[25-26]。已有很多临床结果表明,在患病肾脏标本及尿液中TGF-β1的含量明显增高,且肾纤维化程度越高,TGF-β1含量越高,两者关系呈正相关[27]。目前许多研究显示,EMT过程与组织缺氧有非常紧密的联系,HIF-1α在EMT过程中处于重要地位,正常肾组织中HIF-1α无活性,而缺氧条件下HIF-1α可被激活且积聚在肾间质内,激活的HIF-1α可以促进多种促纤维化因子介导脏器纤维化的发生[28]。亦有研究显示,HIF-1α可直接结合TGF-β1启动子的缺氧反应元件,从而驱动TGF-β1表达上调,加剧肾纤维化程度[29]。本研究造模5周后,模型组和治疗组大鼠出现肾脏损伤,肾组织结构破坏,血清肾功能指标BUN、Scr及UA含量较对照组增高,与病理HE染色结果一致;Masson染色证实大鼠肾脏组织胶原纤维沉积、纤维化发生;Western blot检测肾组织TIMP1、ColⅠ、ColⅢ、α-SMA、TGF-β1及HIF-1α表达增高,MMP2表达降低,以上结果说明大鼠肾纤维化模型建立成功。PFD持续治疗4周后,治疗组大鼠肾脏损伤及纤维化程度较模型组明显减轻,上述血清肾功能指标含量以及肾纤维化相关蛋白TIMP1、ColⅠ、Col Ⅲ、α-SMA、TGF-β1及HIF-1α表达均较模型组降低,MMP2表达增高,说明PFD可以有效减轻CCL4诱导的肾损伤及纤维化程度。
已有研究表明,SIRT3蛋白可通过抑制HIF-1α/TGF-β1通路的激活发挥抗纤维化的作用[30]。本研究成功建立大鼠肾纤维化模型后,与对照组比较,模型组大鼠肾组织中SIRT3蛋白表达降低,HIF-1α和TGF-β1表达增高;PFD治疗4周后,治疗组SIRT3蛋白表达较模型组明显增高,HIF-1α和TGF-β1表达降低,提示SIRT3蛋白可通过抑制HIF-1α/TGF-β1信号通路的激活发挥抗肾纤维化作用,与上述文献结果一致。
综上所述,本研究表明PFD可减轻大鼠肾纤维化程度,恢复部分受损肾功能,提示对大鼠肾纤维化具有较好的防治作用,其机制可能与上调SIRT3蛋白表达,从而抑制HIF-1α/TGF-β1信号通路的激活有关。这为PFD治疗肾纤维化提供了新思路和实验依据,但信号通路还需进一步的细胞或基因层面实验来验证。
