多不饱和脂肪酸对Δ15 Des转基因小鼠睾丸结构和功能的影响及机制*
2024-04-22赵瑄郑红梅王雨虹巨佳曦朱贵明
赵瑄, 郑红梅, 王雨虹, 巨佳曦, 朱贵明*
(贵州医科大学 生物与工程学院&健康医药现代产业学院, 贵州 贵阳 550025)
游离脂肪酸(free fatty acids,FFAs)是机体内重要的能量来源,根据碳链的长度可以分为短链脂肪酸(short-chain fatty acids,SCFAs)、中链脂肪酸(medium-chain fatty acids,MCFAs)及长链脂肪酸(long-chain fatty acids,LCFAs)[1-2]。FFAs在各种生理条件下表现出信号传导、基因表达及调节机体能量稳态等关键功能[3]。FFAs受体(FFAs receptors,FFARs)也称为G蛋白偶联受体(G protein-coupled receptor,GPCRs),FFARs根据激活的FFAs的碳链长度进行分类,游离脂肪酸受体2(free fatty acid receptor 2,FFAR2)与FFAR3可被SCFAs激活,MCFAs和LCFAs作为配体可激活膜受体FFAR1与FFAR4[4-6]。FFAR4可被天然配体以及非内源性激动剂激活,天然配体主要为多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs),它是一类含有2个或2个以上的双键且含碳原子个数>18的直链脂肪酸,通常分为欧米伽-6PUFAs(omega-6,ω-6或n-6)系和n-3系,其中n-3 PUFAs对高血压、动脉粥样硬化及心肌梗死等心血管疾病产生积极的影响[7-9]。研究发现,n-3 PUFAs激活FFAR4后在脂肪因子与细胞因子产生过程中发挥重要作用,过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)和核因子-κB(nuclear factor kappa-B,NF-κB)也参与了该途径[10-12];在糖尿病小鼠(db/db)模型中,FFAR4激动剂可使脂肪组织胰岛素增敏,达到抗糖尿病的效果[13];静脉注射鱼油脂乳剂(fish oil fat emulsion,FOLE)可预防小鼠肠外营养(parenteral nutrition,PN)诱导的肝损伤,逆转PN诱导的小儿胆汁淤积;Fell等[14]研究显示,FOLE能够保护小鼠肝脏,部分是通过激活FFAR4、PPARγ及血小板反应蛋白受体(thrombospondin receptor,CD36)。因此,本研究利用能够将n-6 PUFAs转化为n-3 PUFAs的Δ15脂肪酸去饱和酶(Δ15 fatty acid desaturase,Δ15 Des)转基因小鼠,探究PUFAs对小鼠睾丸结构和功能的影响及其机制,为后续研究PUFAs与雄性小鼠生殖功能的联系提供实验及理论基础。
1 材料与方法
1.1 实验材料
1.1.1动物来源 4周龄SPF级C57BL/6野生型(wild type,WT)雄性小鼠5只,实验室前期使用PiggyBac转座子系统构建表达Δ15 Des活性的转基因4周龄雄性小鼠(即Δ15 Des转基因小鼠)5只,体质量为18~22 g,饲养于学校实验动物中心[SYXK(黔)2018-0001];饲养环境为日平均温度22~26 ℃、湿度60%~80%、光照周期为12 h光照及12 h黑暗。
1.1.2主要仪器及试剂 HP5890气相色谱仪(昆山塞特科学仪器有限公司),石蜡包埋机(武汉俊杰电子有限公司),病理切片机(上海徕卡仪器有限公司);定制小鼠饲料[6%花生四烯酸(arachidonic acid,ARA)]、动物组织总RNA提取试剂盒[天根生化科技(北京)有限公司]。
1.2 研究方法
1.2.1实验分组及取样 取C57BL/6 WT小鼠和Δ15 Des转基因小鼠分别作为对照组(WT组)和实验组(TG组),含6% ARA饲料饲喂8周,麻醉处死,于冰上迅速分离小鼠完整的睾丸组织及附睾组织,用于后续实验。
1.2.2气相色谱(gas chromatography,GC)检测睾丸组织总脂肪酸的组成及含量 取“1.2.1”项下2组小鼠睾丸组织,采用三氟化硼/甲醇(boron trifluoride/methyl alcohol,CH3OH/BF3)法提取睾丸组织的总脂肪酸,GC检测睾丸组织总脂肪酸的组成,标准品对照法对比待测样品中的PUFAs组成,N2000色谱数据离线工作站计算脂肪酸的含量。
1.2.3小鼠精子运动活力检测及精子超微结构分析 精子获能液200 μL于胚胎培养皿中,37 ℃恒温台上预热5 min;取“1.2.1”项下2组小鼠附睾组织的附睾尾快速放入精子获能液中,刺破附睾尾,使精子充分游出;迅速把胚胎培养皿放于37 ℃培养箱内孵育10 min;取精子获能液的上层悬液20 μL于载玻片上,置盖玻片,载玻片置于显微镜载物台处;计算机辅助精子分析(computer-aided sperm analysis,CASA)系统检测小鼠的精子活力指标,包括精子总活力、直线运动精子活力、精子平均路径速度(average path velocity,VAP)、精子曲线速度(curvilinear velocity,VCL)及精子直线速度(straight-line velocity,VSL),并截取精子3个不同视野的超微结构。
1.2.4苏木精-伊红(hematoxylin-eosin,HE)染色观察睾丸组织的形态学特征 取“1.2.1”项下2组小鼠睾丸组织,置于4%多聚甲醛固定24 h,乙醇梯度脱水,二甲苯透明处理,石蜡包埋、切片、脱水、染色,显微镜下观察腓肠肌组织结构变化。
1.2.5实时荧光定量PCR(real time fluorescence quantitative PCR,RT-qPCR)检测睾丸组织中膜受体FFARs(FFAR1、FFAR2、FFAR3及FFAR4)、核受体PPARs(PPARα、PPARβ及PPARγ) 信使RNA(messenger RNA,mRNA)的表达 取“1.2.1”项下2组小鼠睾丸组织20 mg,利用Trizol法提取小鼠总RNA,定量为1 μg,将总RNA反转录成互补DNA(complementary DNA,cDNA)。RT-qPCR检测在睾丸组织中膜受体FFARs(FFAR1、FFAR2、FFAR3、FFAR4)及核受体PPARs(PPARα、PPARβ、PPARγ)mRNA表达;反应体系为cDNA样品1 μL、上下游引物各0.4 μL、TB Green 5 μL及超纯(diethyl pyrocarbonate,DEPC)水3.2 μL;反应条件为预变性95 ℃ 30 s,变性95 ℃ 5 s、退火60 ℃ 30 s、延伸72 ℃ 30 s、40个循环;仪器上测出各个样品的循环阈值(cycle threshold,Ct)后,根据2-ΔΔCt计算目的基因的相对表达量。
1.2.6蛋白质印迹法(Western blot)检测睾丸组织中FFAR4与PPARγ的表达 取“1.2.1”项下2组小鼠睾丸组织提取总蛋白,利用二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒以及酶标仪测定蛋白浓度。将蛋白置于100 ℃水浴5 min变性,-20 ℃冰箱保存备用;制备12%分离胶于5%浓缩胶进行电泳,于聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上蛋白转移,5%脱脂牛奶室温封闭2 h,洗膜后一抗孵育(β-tubulin、FFAR4、PPARγ)4 ℃过夜,β-tubulin、FFAR4以及PPARγ抗体的稀释倍数均为1∶1 000,加1∶5 000比例配置的辣根过氧化物酶(horse radish peroxidase,HRP)二抗,室温孵育40~60 min,进行凝胶成像分析。
1.3 统计学分析
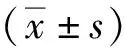
2 结果
2.1 睾丸组织中脂肪酸的GC检测
GC检测结果显示(图1),与WT组相比,TG组小鼠睾丸组织中ARA(20∶4n-6)与二十二碳四烯酸(docosatetraenoic acid,DTA;22∶4n-6)含量降低(P<0.05或P<0.01),亚油酸(linoleic acid,LA;18∶2n-6)、二十碳五烯酸(eicosapentaenoic acid,EPA;20∶5n-3)、二十二碳六烯酸(docosahexaenoic acid,DHA;22∶6n-3)含量升高(P<0.05或P<0.01)。

注:A为WT组,B为TG组,C为脂肪酸的定量结果;与WT组比较,(1)P<0.01,(2)P<0.05。
2.2 精子形态
探究转化的n-3 PUFAs与转入小鼠体内的Δ15 Des基因是否对小鼠的精子形态及运动活力产生影响,通过显微镜观察,选取同鼠附睾组织在3个不同视野下的精子形态,结果显示2组小鼠的精子形态及数量无明显差异(图2)。

图2 WT组和TG组小鼠精子的形态观察(40×)Fig.2 Morphological observation of sperm in WT and TG groups(40×)
2.3 精子运动活力
CASA系统分析小鼠精子的运动活力,结果显示(图3),与WT组相比,TG组小鼠精子的直线运动精子活力、VSL升高,差异有统计学意义(P<0.05);精子总活力、VAP、VCL比较,差异无统计学意义(P>0.05)。

注:A为精子总活力、直线运动精子活力的定量结果,B为VAP、VCL及VSL的定量结果;(1)与WT组相比,P<0.05。
2.4 睾丸结构
睾丸组织的HE染色结果显示(图4),与WT组相比,TG组小鼠睾丸管腔内精子发生密集,靠近管腔的圆形精子及管腔内的长形精子数量增加;WT组小鼠可见生精小管排列松弛,管腔较大,间质松散,精原细胞和精母细胞较TG组有所减少,管腔内的长形精子数量有所减少。
图4 WT组和TG组小鼠睾丸组织的HE染色(40×)Fig.4 HE staining of testicular tissue in WT and TG groups(40×)
2.5 睾丸组织FFAR2、FFAR3、FFAR4及PPARα、PPARβ、PPARγ mRNA的表达
RT-qPCR结果显示(图5),与WT组相比,TG组小鼠睾丸组织中FFAR4、PPARα mRNA表达上调(P<0.01或P<0.05),PPARβ mRNA表达下调(P<0.05),FFAR1、FFAR2、FFAR3及PPARγ mRNA表达无差异(P>0.05)。

注:A为FFAR2、FFAR3、FFAR4 mRNA定量结果,B为 PPARα、PPARβ及PPARγ mRNA定量结果;与WT组相比,(1)P<0.001,(2)P<0.05。
2.6 睾丸组织中FFAR4与PPARγ蛋白的表达
采用Western blot分析小鼠睾丸组织中FFAR4、PPARγ蛋白的水平,结果表明(图6),与WT组相比,TG组小鼠睾丸组织中FFAR4蛋白水平增加(P<0.05),PPARγ蛋白水平无变化(P>0.05)。
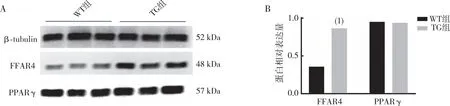
注:A为Western blot检测结果,B为定量结果;(1)与WT组相比,P<0.01。
3 讨论
作为n-3FFAs的受体,在人体与许多哺乳动物中FFAR4发挥着重要的生理作用,研究表明,2型糖尿病、肥胖、急性肝损伤及其他免疫疾病时,FFAR4是一个重要的治疗靶点[15-18]。然而,FFAR4影响小鼠睾丸组织结构和功能的相关报道尚比较缺乏。本研究利用精子质量分析仪与CASA系统分析小鼠精子的运动活力,从精子的形态以及运动指标可看出,转化的n-3PUFAs能使转基因小鼠在不影响小鼠精子总动能的前提下,提高小鼠的直线运动精子活力及VSL,说明转化的n-3PUFAs以及转入的Δ15 Des基因的并不会影响精子的形态及总运动水平;通过HE染色分析发现,与WT组小鼠相比,TG组小鼠睾丸组织内的曲细精管排布规整,曲细精管内空泡较少,在曲细精管管腔处形成的成熟精子较多。根据上述现象可以认为,PUFAs影响小鼠睾丸组织内精子发生的途径可能为FFAR4通路。有研究表明,n-3PUFAs或FFAR4激动剂激活FFAR4后,会刺激纤毛产生环磷酸腺苷(cyclic adenosine monophosphate,cAMP)直接激活交换蛋白(exchange proteins directly activated,EPAC),从而促进脂肪生成[19-21];Miyamoto等[22]研究显示,MCFAs和LCFAs可同时激活FFAR1与FFAR4,SCFAs可以激活FFAR2与FFAR3;此外,FFAR1结合n-3 PUFAs配体的亲和力和FFAR4相差不大[23-25]。本研究采取n-6系的ARA饲喂小鼠,TG组小鼠将其转化为n-3系的EPA以及碳链更长的DHA后,可能通过激活FFAR4,影响下游基因的表达;与WT组小鼠相比,TG组小鼠睾丸组织中FFAR4 mRNA和蛋白的表达上升,PPARγmRNA和蛋白的表达无差异,表明在睾丸组织中n-3PUFAs不能以配体的形式结合PPARγ。
综上所述,n-3PUFAs可能以配体-受体的方式结合FFAR4,激活下游信号分子,从而改善小鼠睾丸组织结构和功能,但FFAR4是否将胞外信号传递给cAMP,进而对睾丸组织产生影响,仍需进一步的研究。
