circRAF1调节人卵巢颗粒细胞的增殖与凋亡
2024-04-15李文昕卢敏君林莉刘月琴朱小兰
李文昕 卢敏君 林莉 刘月琴 朱小兰
江苏大学第四附属医院(镇江市妇幼保健院)生殖医学中心,中心实验室(江苏镇江 212001)
女性在40 岁之前出现卵巢功能障碍,引起闭经及相关伴随症状,称为早发性卵巢功能不全(primary ovarian insufficiency, POI)[1]。据统计,POI 在一般人群中的发病率约为1%[2]。在社会层面上,一直存在着推迟生育的趋势,但女性的卵巢储备功能却随年龄增长而逐步下降[3]。通过经典的序贯激素替代疗法很难恢复卵巢功能,且伴有副作用[4]。因此,挖掘POI 发病(或发生)的相关因素,发现POI 的潜在生物标志物,对高危人群进行早期预防与干预显得尤为重要。
卵巢储备功能减退和卵母细胞质量下降是POI 患者低妊娠率最重要的原因[5],卵巢颗粒细胞(GCs)可以为卵母细胞成熟提供必要的营养支持和微环境[6]。在哺乳动物卵巢中,不到1%的卵泡排卵,其余99%的卵泡在排卵前会发生闭锁[7],而GCs 凋亡在卵泡闭锁中起主要作用[8]。最近的研究表明,GCs 的功能障碍主要表现为细胞增殖减少、凋亡增加[9],找到GCs 增殖及凋亡的关键调节因子可能为POI 的防治提供新的策略。
随着RNA 测序的发展,越来越多的环状RNA(circRNAs)被发现和鉴定。与以5'帽端和3'尾端终止的线性RNA 不同,circRNAs 既没有5'至3'极性,也没有聚腺苷酸化尾巴[10],不易被RNase R 降解[11]且拥有更长的半衰期[12]。此外,因circRNAs具有组织特异性且高度保守,往往被认为是各种疾病的潜在生物标志物[13-14]。circRNAs 已被证实参与调节包括细胞增殖、凋亡、迁移、侵袭等各种生物过程[15]。近年来对于circRNAs的研究日益增多,但circRNAs 与POI 的相关性及其调节POI 的机制还鲜见报道。因此,寻找与POI 相关的circRNAs并阐明其在POI 中的作用,有助于POI 的早期预防与干预。
本研究在POI 患者的GCs 及血清中发现了共同下调的circRAF1 并探究其生物来源。此外,本研究结果表明,circRAF1 的表达与临床卵巢功能指标的血清水平相关,并通过干扰KGN 细胞中circRAF1 的表达证实了其在GCs 增殖和凋亡中的调节作用,为寻找POI 的新型生物学标记物提供理论基础。
1 资料与方法
1.1 资料来源选取2022 年6 月至2023 年7 月于江苏大学附属第四人民医院生殖医学中心行体外受精和(或)卵母细胞胞浆内单精子显微注射-胚胎移植(in vitrofertilization or intracytoplasmic sperm injection and embryo transfer,IVF/ICSI-ET)的POI 患者(POI 组)50 例;同期选取因男方和(或)输卵管因素在本中心行IVF/ICSI-ET 的卵巢储备功能正常的患者(NC 组)50 例作为对照,2 组年龄及BMI相比较,差异无统计学意义(P> 0.05),具有可比性。本研究中所有POI 患者均由主治及以上医师明确诊断。收集患者的GCs 和血清样本(月经期第2~3 天清晨空腹抽取)。经江苏大学附属第四人民医院伦理委员会批准,符合伦理学要求,所有受试者均自愿参加并签署书面知情同意书。患者基本信息见表1。
表1 本研究的患者信息Tab.1 Patients information for this study ±s

表1 本研究的患者信息Tab.1 Patients information for this study ±s
注:BMI,体质量指数;AMH,抗苗勒管激素;E2,雌二醇;FSH,卵泡刺激素;LH,促黄体生成素;AFC,窦卵泡计数
P值0.458 0.513 0.001 0.001 0.001 0.001 0.001项目年龄(岁)BMI(kg/m2)AMH(ng/mL)E2(pmol/L)FSH(IU/L)LH(IU/L)AFC(个)NC组(n = 50)31.50±5.50 21.10±2.84 4.94±3.90 181.00±91.00 6.26±3.68 6.58±4.33 12.50±5.50 POI组(n = 50)33.00±5.00 21.53±2.57 0.50±0.49 80.50±67.50 32.19±7.11 22.55±11.52 5.00±4.00
纳入标准:(1)符合POI 诊断标准[16]:女性在40 岁之前出现月经稀发/闭经> 4 个月,间隔1 个月以上检测两次FSH 水平> 25 U/L;(2)临床资料保存完整者;(3)未伴有其他任何疾病。
排除标准:(1)伴有其他内分泌和(或)免疫疾病者;(2)伴有严重的心血管、肾脏等疾病者;(3)既往3 个月服用激素者。
1.2 方法
1.2.1 GCs 的提取在取卵期间收集直径为16~20 mm的卵泡进行进一步分析。将样品4 000 r/min离心4 min,去除大部分上清以获取GCs沉淀。加入透明质酸酶(80 IU/mL)后在37 ℃、5% CO2的湿润培养箱中孵育30 min。1 500 r/min 离心10 min 弃上清,使用含有10%胎牛血清(美国Gibco 公司)和1%青霉素-链霉素(美国Hyclone 公司)的DMEM/F12(美国Gibco 公司)培养基重悬GCs,并在37 ℃、5% CO2的培养箱中培养。
1.2.2 细胞的培养与转染本研究涉及的KGN 细胞系购自中国科学院细胞库。使用含有10%胎牛血清和1%青霉素-链霉素的DMEM/F12培养基,在37 ℃、5% CO2的培养箱中培养。Si-circRAF1(sense:5'-GCAGGAUGAUUGAGAUUGUTT-3',antisense:5'-ACAAUCUCAAUCAUCCUGCTT-3')和相应的对照(si-NC)均购自中国苏州吉玛基因股份有限公司。按照制造商的说明,使用lipofectamine2000 试剂(美国Invitrogen 公司)进行转染。
1.2.3 RNA提取、RNase R处理和RT-qPCR根据说明书,使用TRIzol 试剂(美国Invitrogen 公司)裂解细胞提取总RNA。在1 μg 总RNA 中加入4 U RNase R(美国Lucigen 公司),37 ℃中孵育30 min,70 ℃ 10 min 终止反应。使用HiScript II Q RT SuperMix(南京诺唯赞生物科技股份有限公司)对加入或没加入RNase R 的总RNA 进行逆转录得到cDNA。使用ChamQ Universal SYBR qPCR Master Mix(南京诺唯赞生物科技股份有限公司)进行RT-qPCR。GAPDH 或U6 被用来作为内源性参考。所有引物均由上海生工生物技术有限公司设计和合成。相关基因RT-qPCR 扩增引物见表2。

表2 引物名称及序列Tab.2 Primers names and sequences
1.2.4 普通PCR 及产物鉴定根据说明书,使用基因组DNA 提取试剂盒[天根生化科技(北京)有限公司]提取细胞gDNA。分别以cDNA 及gDNA为模板,设计circRAF1 的聚合引物和发散引物(引物见表2)进行PCR 扩增(反应体系50 μL)。使用1 × TAE 缓冲液(北京索莱宝科技有限公司)配制2%琼脂糖凝胶,扩增产物在120 V 恒压条件下电泳30 min。在凝胶成像系统下拍照,并判断扩增片段的位置。
1.2.5 放线菌素D(act-Dactinomycin, ACTD)处理将KGN 细胞接种于6 孔板中,培养箱中孵育24 h 后加入ACTD(美国sigma 公司),分别在培养0、6、12 和24 h 后使用TRIzol 试剂提取总RNA。
1.2.6 核质分离使用细胞核与细胞浆蛋白抽提试剂盒(上海碧云天生物技术有限公司)分离细胞核与细胞质。收集细胞,加入200 μL 预先混入5 μL RNase Inhibitor 的试剂A,冰浴10~15 min。加入10 μL试剂B,冰浴3~5 min。4 ℃ 12 000g/min离心5 min 后,立即吸取上清至一预冷的离心管中,加入TRIzol 试剂抽提胞浆RNA。对于沉淀,吸尽上清后加入TRIzol 试剂抽提胞核RNA。
1.2.7 蛋白质提取和免疫印记(WB)使用含有1%蛋白酶抑制剂(北京索莱宝科技有限公司)的RIPA 缓冲液(北京索莱宝科技有限公司)裂解细胞,提取蛋白。测定样品蛋白浓度,加入5 ×Lodding 缓冲液(上海碧云天生物技术有限公司),水浴煮沸5 min。蛋白裂解物用10% SDS-PAGE 凝胶分离,然后转移到PVDF 膜(美国Millipore 公司)上。PVDF 膜在5%脱脂牛奶中室温封闭2 h 后分别与FSHR 抗体(美国Proteintech 公司,1∶1 000)、PCNA 抗体(沈阳万类生物科技有限公司,1∶500)、Bcl-2 抗体(沈阳万类生物科技有限公司,1∶500)、Casp-3 抗体(沈阳万类生物科技有限公司,1∶500)和Bax 抗体(沈阳万类生物科技有限公司,1∶500)在4 ℃下孵育过夜,GAPDH 抗体(美国Proteintech公司,1∶10 000)作为内参。IgG 抗体(合肥白鲨生物科技有限公司,1∶10 000)在室温下孵育2 h,用增强化学发光试剂盒(ECL;南京诺唯赞生物科技股份有限公司)曝光。
1.2.8 EdU 细胞增殖实验使用EdU 细胞增殖检测试剂盒(广州市锐博生物科技有限公司)检测细胞增殖。将KGN 细胞接种于24 孔板中,按照试剂盒的说明,对EdU进行标记(红色);每孔加入250 μL 5 μg/mL 1× Hoechst 33342 反应液,进行细胞核染色(蓝色),制片后立即用荧光显微镜(德国Leica公司)拍摄图片。
1.2.9 CCK-8 细胞活力检测使用CCK-8 试剂盒(南京诺唯赞生物科技股份有限公司)检测细胞活力。将KGN细胞接种于96孔板中,每孔加入100 μL细胞培养液;24 h 后进行转染,分别在转染24、48、72和96 h时检测细胞增殖。每孔加入10 μL CCK-8溶液,空白对照组(不包含细胞)添加相同体积的细胞培养液和CCK-8 溶液;培养箱内孵育1 h 后使用酶标仪测定OD450,并计算细胞存活百分比,计算公式如下:细胞存活百分比=[(实验组OD450-空白对照组OD450)/(对照组OD450-空白对照组OD450)]×100%
1.2.10 JC-1 线粒体凋亡检测使用JC-1 线粒体膜电位检测试剂盒(上海碧云天生物技术有限公司)检测线粒体凋亡。将KGN 细胞接种于24 孔板中,根据说明书配制染色工作液(10 μg/mL)和染色缓冲液。每孔加入250 μL 染色工作液,在培养箱中孵育20 min,用染色缓冲液清洗细胞2 次后制片,立即用荧光显微镜拍摄照片。
1.2.11 TUNEL细胞凋亡检测使用一步法TUNEL细胞凋亡检测试剂盒(上海碧云天生物技术有限公司)检测细胞凋亡。将KGN 细胞接种于24 孔板中,用4%多聚甲醛室温固定30 min,PBS洗涤1次。用含0.3% Triton X-100 的PBS 室温孵育5 min,PBS洗涤2 次。根据说明书配制适量的TUNEL 检测液,每孔加入25 μL TUNEL 检测液,37 ℃避光孵育60 min。PBS 洗涤3 次后制片,立即用荧光显微镜拍摄图片。
1.3 统计学方法实验数据代表3 个独立实验,所有统计分析均使用GraphPad Prism 软件(9.0 版)进行计算并生成统计图。两组之间的差异使用双侧t检验进行分析。有统计学意义的表达如下:ns 差异无统计学意义;*P< 0.05;**P< 0.01;***P< 0.001;****P< 0.000 1。
2 结果
2.1 circRAF1 在POI 患者GCs 与血清中表达下调为了寻找与卵巢储备功能相关的circRNAs,对GEO 数据集(GSE97193)进行了再分析,该数据包括3 例高龄(AA, ≥ 38 岁)IVF 患者和3 例年轻(≤ 30 岁)IVF 患者GCs 中circRNAs 的RNA-seq 数据。共有179 个circRNAs(包括61 个下调和117 个上调的circRNAs)在卵巢GCs 中存在差异表达(图1A-B)。在这些下调的circRNAs 中,分析了其宿主基因的功能,发现circ_0064365 的宿主基因RAF1 参与细胞增殖与凋亡的调控。由于circ_0064365来源于RAF1,将其命名为circRAF1。随后,提取了正常卵巢储备患者和POI患者的GCs,并用FSHR免疫荧光染色进行鉴定(图1C)。RT-qPCR结果显示,circRAF1 在POI 患者的GCs 及血清中明显下调(P< 0.000 1),见图1D-E。

注:A,聚类图;B,火山图;C,通过FSHR 免疫荧光鉴定GCs;D-E,通过RT-qPCR 检测NC 组(n = 50)和POI 组(n = 50)GCs 和血清中circRAF1 的表达;F,circRAF1 环化示意图;G,琼脂糖凝胶电泳验证了KGN 细胞中circRAF1 的存在;H-I,ACTD 和RNase R 处理后,通过RT-qPCR 测定circRAF1 和RAF1 的表达;J-K,核质分离法和FISH 实验检测circRAF1 在KGN 细胞中的亚细胞定位。ns 差异无统计学意义;**P < 0.01;****P < 0.000 1图1 circRAF1 在POI 患者GCs 与血清中下调Fig.1 CircRAF1 is down-regulated in GCs and serum of POI patients
2.2 circRAF1 在KGN 细胞中的鉴定与特征长达253 bp 的circRAF1 由RAF1 的6-7 号外显子环化而成(图1F)。为了验证circRAF1的特征,使用发散引物和聚合引物进行PCR扩增,PCR产物进行琼脂糖凝胶电泳。结果表明,circRAF1 在KGN 细胞中表达,且只有在cDNA 中以发散引物才能扩增出circRAF1(图1G)。ACTD实验显示,circRAF1比线性RAF1拥有更长的半衰期(P< 0.01),见图1H。RAF1在RNase R 消化后表达量明显降低(P< 0.000 1),而circRAF1 表达量无明显变化(P> 0.05),这表明circRAF1相比于RAF1具有更强的耐RNase R 消化的特征(图1I)。核质分离实验(图1J)和FISH 实验(图1K)表明大部分circRAF1 位于细胞质中。
2.3 circRAF1 与卵巢储备功能相关为了验证circRAF1 与卵巢储备功能的相关性,首先分析50 例POI患者中,circRAF1的表达与临床卵巢储备功能指标(E2、 AMH、 FSH、 LH、 AFC)的相关性,结果显示:circRAF1 的表达与血清中基础E2和AMH水平呈正相关(P< 0.001),见图2A-B,而与血清中基础FSH、LH 水平呈负相关(P< 0.001),图2C-D。同样地,所有血清样本(n= 100)的相关分析显示,circRAF1 的表达与血清中基础E2和AMH 水平呈正相关(P< 0.001),见图2E-F,而与血清中基础FSH、LH 水平呈负相关(P< 0.001),图2G-H,同时,circRAF1 的表达与AFC 呈正相关(P< 0.001),见图3I。这表明circRAF1 与卵巢储备功能相关,有望成为POI 的新型生物学标记。
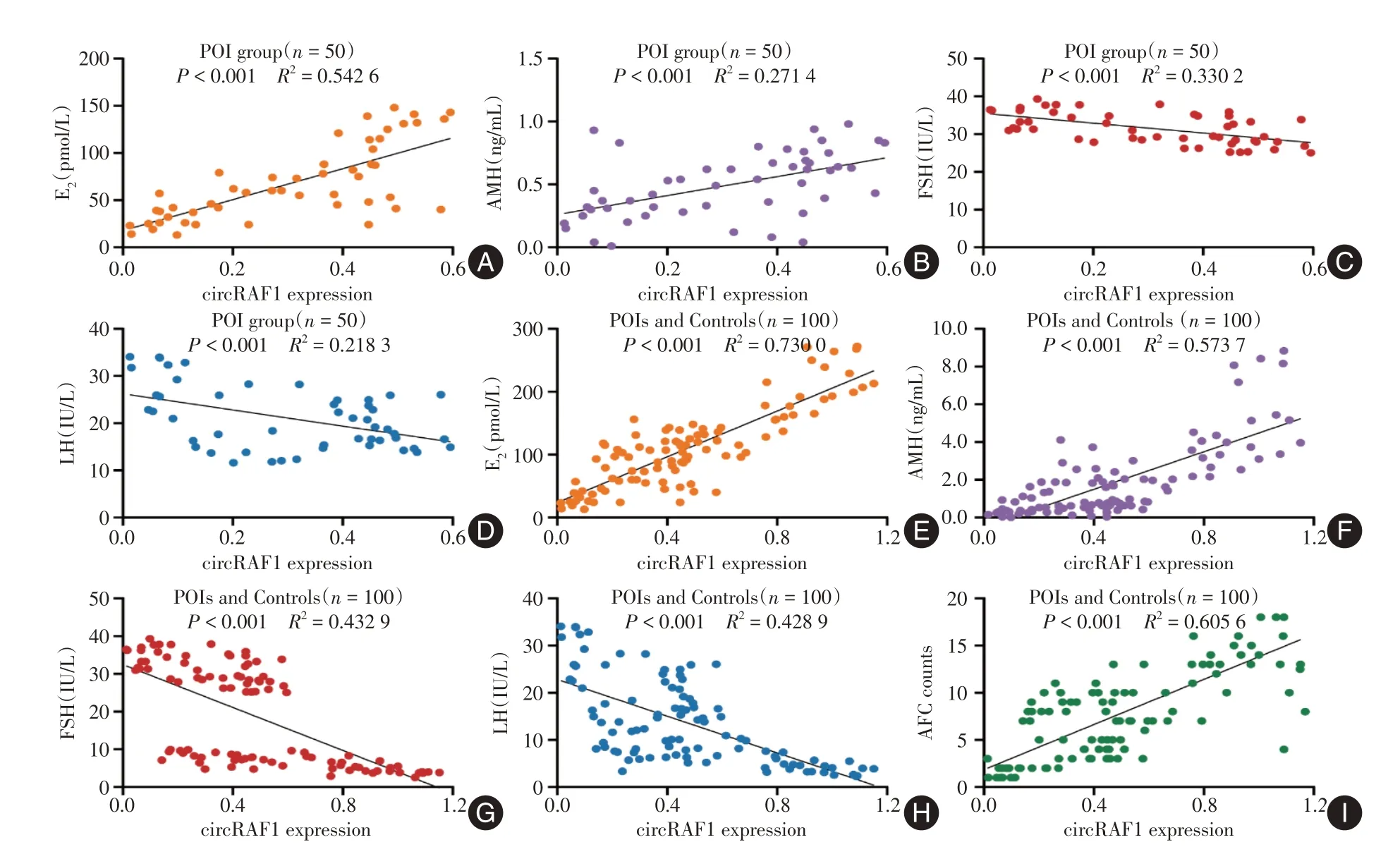
注:A-D,采用Pearson 相关分析法分析血清中circRAF1 的表达与POI 患者(n = 50)血清E2、AMH、FSH、LH 浓度的相关性;E-H,采用Pearson 相关分析方法分析血清中circRAF1 的表达与所有受试者(n = 100)血清E2、AMH、FSH、LH 浓度的相关性;I,采用Pearson 相关分析方法分析血清中circRAF1 的表达与所有受试者(n = 100)AFC 的相关性图2 circRAF1 与卵巢储备功能相关Fig.2 Correlation between circRAF1 and ovarian reserve function
2.4 干扰circRAF1 抑制KGN 细胞的增殖为了进一步探究circRAF1 的功能,设计了针对circRAF1 的小干扰RNA(si-circRAF1),并在KGN 细胞中对circRAF1 进行干扰。与对照组相比,干扰circRAF1 后,circRAF1 的表达下调(P< 0.05),见图3A,细胞增殖能力下降(P< 0.05),见图3B,细胞活力降低(P< 0.01),见图3C。此外,增殖相关基因FSHR、PCNA 和Bcl-2 mRNA 及其对应蛋白表达水平也显著降低(P< 0.05),见图3D-G。综上所述,干扰circRAF1 抑制了KGN 细胞的增殖能力。

注:A,RT-qPCR 检测si-circRAF1 的干扰效率;B,EdU 检测细胞增殖能力;C,CCK-8 检测细胞活力;D-F,RT-qPCR 检测FSHR、PCNA 和Bcl-2 mRNA 的表达;G,WB 检测FSHR、PCNA 和Bcl-2 蛋白的表达。*P < 0.05;**P < 0.01图3 干扰circRAF1 抑制KGN 细胞的增殖Fig.3 Silencing circRAF1 inhibits the proliferation of KGN cells
2.5 干扰circRAF1 促进KGN 细胞凋亡线粒体膜电位的破坏是细胞凋亡早期发生的一个标志性事件,检测了干扰circRAF1 对细胞凋亡的影响,结果显示,干扰circRAF1 后,KGN 细胞线粒体膜电位下降(P< 0.05,图5A-B),凋亡细胞数量显著增加(P< 0.05,图5C-D)。此外,凋亡相关基因Casp-3、Bax mRNA 及其对应蛋白的表达水平显著升高(P< 0.05,图5E-H),Bcl-2/Bax 下降(P< 0.05,图5I)。这些结果表明,干扰circRAF1 促进KGN细胞凋亡。

注:A-B,JC-1 检测细胞线粒体凋亡;C-D,TUNEL 检测细胞凋亡;E-F,RT-qPCR 检测Casp-3 和Bax mRNA 的表达;G-H,WB 检测Casp-3 和Bax 蛋白的表达;I,Bcl-2 与Bax 表达水平的比值。*P < 0.05;**P < 0.01;***P < 0.001图4 干扰circRAF1 促进KGN 细胞凋亡Fig.4 Silencing circRAF1 promotes apoptosis in KGN cells
3 讨论
由于卵泡闭锁和周期性排卵,原始卵泡数量在女性整个生命过程中逐步下降,并随年龄的增长而加速[17]。异常的卵泡闭锁会导致原始卵泡过早耗竭,继而发生卵巢功能不全[18]。卵巢GCs凋亡是卵泡闭锁的重要机制[19]。这表明促进GCs增殖,抑制GCs 凋亡可以挽救受损的卵巢结构和功能。
由于circRNAs 独特的稳定性、多样性和特异性,具有作为候选诊断、预后和治疗靶点的潜力[20]。近年来,肾癌[21]、胃癌[22]、肝癌[23-24]、甲状腺癌[25]等都已找出高灵敏度的circRNAs 指标作为生物标志物来辅助临床诊断。最近的证据显示,circRNAs 与多种卵巢疾病相关,包括多囊卵巢综合征[26-27]、卵巢早衰[28]和上皮性卵巢癌[29]等。本研究在POI 患者GCs 及血清中发现了共同下调的circRAF1。随后证实了circRAF1具有较长的半衰期和较高的稳定性。同时,发现circRAF1 与临床卵巢功能指标血清水平和AFC 高度相关,这都说明circRAF1 有望成为提示POI 的新型生物标志物。
此前的研究表明,RAF1 可以介导FSH 的信号传导,以刺激GCs 中E2的合成和分泌[30]。另有研究表明,RAF1 可以通过调节LAGE1 调控下咽癌细胞增殖与凋亡[31]。来源于RAF1 的circRAF1 可能行使着与其宿主基因相似的生物学功能。此前,已有多项研究证实circRNAs 参与卵巢功能的调节,例如:circLDLR 通过miR-1294/CYP19A1 轴调节E2的分泌[32];circ_0118530 缺失抑制KGN 细胞增殖、迁移、氧化应激和炎性细胞因子释放[33];circ_0023942 通过调节CDK-4 抑制GCs 增殖[34];敲低circ-FURIN 通过miR-195-5p/BCL2 轴抑制GCs 的增殖并诱导凋亡[35]。然而,circRAF1是否参与卵巢功能的调节目前尚未知晓,本研究对此进行了验证。本研究将KGN 细胞作为研究对象,通过瞬时转染si-circRAF1 构建circRAF1 低表达KGN 细胞模型。实验发现,干扰circRAF1 抑制了KGN 细胞增殖,促进了凋亡,这表明circRAF1 在卵巢功能中发挥着重要的调节作用。
然而,本研究仍存在一定的局限性。首先,纳入研究的样本量较小,还需要更多的大规模的临床试验来证明circRAF1 作为未来POI 生物标志物的有效性。此外,由于时间有限,本研究未能深入探究circRAF1 下游通路及其下游因子在POI 中的作用。不过众所周知,circRNAs 往往通过作为miRNA 的分子海绵[36]和RNA 结合蛋白[37]来执行多种功能,一些circRNAs 甚至在多种病理生理过程中充当翻译模板[38]。后续的研究也将从以上几个方面为切入点,进一步探究circRAF1 调节卵巢功能的可能机制。
综上所述,本研究通过生物信息学分析和临床验证发现:POI 患者GCs 及血清中的circRAF1 表达水平下调,且与卵巢储备功能下降有关。同时,体外实验发现:干扰circRAF1 可以抑制KGN 细胞增殖,促进其凋亡。这都表明circRAF1 可能通过调控GCs 的功能影响POI 的发生发展。在后续的研究中,可以在细胞和动物水平进一步探讨circRAF1 调控GCs 功能的具体分子机制,为POI 防治研究提供新的视角和思路。
【Author contributions】LI Wenxin was responsible for experimental operation, data collection and analysis, statistical analysis and paper writing; LU Minjun was responsible for data collection and analysis; LIN Li and LIU Yueqin were responsible for sample collection;ZHU Xiaolan was responsible for experimental design, research guidance, paper revision and financial support.All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
