培养时间对小鼠树突状细胞及其外泌体免疫相关膜蛋白的影响
2024-04-15肖俐罗淑敏徐芳路鹏鹏邢恩鸿李伟华
肖俐 罗淑敏 徐芳 路鹏鹏 邢恩鸿 李伟华
1承德医学院附属医院,河北省泛血管疾病重点实验室 (河北承德 067000);2首都医科大学附属北京佑安医院肝病研究所 (北京 100069)
树突状细胞(dendritic cell, DC)是机体内功能最强的专职抗原提呈细胞(antigen-presenting cell,APC),其可通过MHC 分子呈递抗原肽诱导初始T 细胞激活和分化,在机体免疫过程中发挥着重要作用[1-3]。近些年研究[4-5]表明,树突状细胞来源的外泌体(dendritic cell-derived exosomes, DEX)因其携带有亲代DC 大量特征性蛋白,被证实也具有抗原提呈的作用。目前关于此方面的研究有很多,但是体外培养时间对DC 及其DEX 免疫相关膜蛋白的影响,以及DC 与DEX 两者表达免疫相关膜蛋白水平是否具有相关性,至今未见相关报道。因此本文就不同培养时间,对小鼠DC 及其DEX 表达CD80、CD11c、MHC-Ⅰ和MHC-Ⅱ水平进行研究,旨在明确不同培养时间点DC 及其DEX功能变化情况,为今后相关研究提供科学依据。
1 材料与方法
1.1 小鼠C57BL/6 雄性小鼠(H-2b)(6~8 周),购于北京斯贝福生物技术有限公司。所有动物实验均在首都医科大学附属北京佑安医院肝病研究所动物研究室,按照机构伦理委员会授权和特别批准的程序(许可证号AEEI-2023-151)进行。
1.2 试剂与仪器细胞因子:重组粒细胞-巨噬细胞集落刺激因子 GM-CSF(Cat:AF-315-03-20UG,Lot:0413AF055,PEPROTECH,美国),肿瘤坏死因子α TNF-α(Cat:AF-315-01A-20UG,Lot:0913AFC5 4,PEPROTECH,美国),白介素4 IL-4(Cat:AF-214-14-20UG,Lot:1118AFC49,PEPROTECH,美国);流式抗体:APC Human Anti-Mouse CD11c antibody(Cat:550261,Lot:1209238,BD,美国),PE Human Anti-Mouse CD80 antibody(Cat:553769,Lot:2040971,BD,美国), BV510 Human Anti-Mouse MHC-Ⅰ antibody(Cat:116523,Lot:B388327,Biolegend),APC Human Anti-Mouse MHC-Ⅱ antibody(Cat:FAB6118A,Lot:ABJY0120111,RD,美国),488 Human Anti-Mouse CD81 antibody (Cat:FAB4865G,Lot:1609468,RD,美国);BCA 试剂盒(Cat:P1511,北京普利莱生物有限公司)。超速离心机(型号:Optima XPN-100,Bcekman Coulter,美国);Amnis 量化成像分析流式细胞仪(型号:ImageStream Mk Ⅱ,Luminex,美国);全电动倒置荧光显微镜(型号:Ti-E,Nikon,日本)。
1.3 方法
1.3.1 小鼠骨髓细胞的提取取6~8 周龄C57 BL/6 雄性小鼠,将小鼠脱颈处死后,酒精浸泡消毒3~5 min。剪掉小鼠腿部皮毛层,沿着小鼠股骨根部将大腿剪下。刮刀将小鼠腿部肌肉剥离,取出股骨和胫骨置于装有1640 培养基的6 孔板中,剪刀剪掉股骨和胫骨两端,暴露出骨髓腔。1 mL注射器吸取1640 培养基,针头穿进骨髓腔中,对骨髓腔进行反复冲洗直到骨髓腔变白。将带有骨髓细胞的培养液转至15 mL 离心管中,室温下500g,离心5 min。得到细胞沉淀后加入1 mL 红细胞裂解液,混匀后,静置30 s,随后加入10 mL 培养液终止裂解,再于500g离心5 min。弃上清,加入3 mL培养液,充分混匀后,静置10~20 s,吸取上清液至另一新的15 mL 离心管中,500g离心5 min,得到小鼠DC 前体细胞即小鼠骨髓前体-单核细胞。
1.3.2 小鼠树突状细胞的培养将上述骨髓前体-单核细胞按密度(每孔1 × 106~3 × 106cells)均匀铺于6孔板中,每孔加入2 mL 1640完全培养基以及20 μg/mL GM-CSF,20 μg/mL IL-4 诱导分化。于第2 天和第5 天半量换液,同时补足细胞因子GM-CSF、IL-4 各1 μL;第6 天加入20 μg/mL TNF-α刺激为成熟DC。刺激成熟后,每周加2-3 次细胞因子GM-CSF,维持细胞生长。
1.3.3 小鼠树突状细胞表面免疫膜蛋白的检测收集培养第5、8、13、20、25、30 天的小鼠DC,500g,离心5 min,洗涤两遍,然后转至1.5 mL EP管。加入Anti-mouse CD11c-APC、Anti-mouse CD80-PE、Antimouse MHC-Ⅰ-BV510、Anti-mouse MHC-Ⅱ-APC 抗体各2.5 μL,冰上避光孵育30 min。洗去未结合抗体,Amnis 量化流式细胞仪检测,Amnis 分析系统IDEAS 软件6.2 版本进行分析。
1.3.4 小鼠树突状细胞外泌体的提取收集第5、8、13、20、25、30 天小鼠DC 培养上清,500g离心5 min,去除细胞。取上清,2 000g离心10 min,去除死细胞。取上清,10 000g离心30 min,去除细胞碎片及大囊泡。取上清,转至超速离心管中,加入PBS,110 000g离心70 min,得到小鼠DEX。
1.3.5 Western blot(WB)法鉴定小鼠树突状细胞外泌体DEX 裂解后,BCA 法检测蛋白浓度。12%SDS-聚丙烯酰胺凝胶进行蛋白电泳,待两端条带明显分离时,停止电泳。电压100 V,1 h,将蛋白转移到PVDF 膜上。5%脱脂牛奶封闭PVDF 膜,加入20 μL 小鼠单克隆抗体CD9、CD63、CD81(1∶500稀释)于4 ℃过夜孵育。一抗孵育结束后,洗膜3次。加入50 μL山羊抗鼠IgG二抗(1∶2 000稀释)37 ℃孵育1 h,再次洗膜3 次后,加入显影剂显影。
1.3.6 小鼠树突状细胞外泌体表面蛋白的检测100 μL DEX 回流液中加入Anti-mouse CD81-488、Anti-mouse CD11c-APC、Anti-mouse CD80-PE、Antimouse MHC-Ⅰ-BV510、Anti-mouse MHC-Ⅱ-APC 各2.5 μL,冰上避光孵育30 min。孵育结束后转至超速离心管中,加入PBS,110 000g离心70 min,洗去未结合抗体。Amnis 量化成像流式细胞仪检测,Amnis 分析系统IDEAS 软件6.2 版本进行分析。
1.4 统计学方法所有数据均符合正态性分布,均以均数±标准差表示。SPSS 25.0 统计学软件对数据进行统计分析。多组间数据采用单因素方差分析,LSD-t检验进行两两比较。以P< 0.05 为差异有统计学意义。
2 结果
2.1 倒置显微镜观察小鼠骨髓来源树突状细胞(bone marrow-derived dendritic cell, BMDC)体外培养生长情况前体-单核细胞即小鼠骨髓前体细胞,细胞胞体较小,细胞形态近似圆形或椭圆形,处于悬浮状态(图1A)。加入GM-CSF 和IL-4细胞因子后,细胞胞体变大,细胞开始出现聚团生长现象,一部分细胞由悬浮转为贴壁状态(图1B)。第6 天,加入TNF-α 后,细胞开始长出伪足样小突触,其形态多呈现出边缘不规则的类圆形,此时60%~70%细胞贴壁(图1C);第13 天,细胞突触数量和长度增加,呈网络状生长,细胞处于完全贴壁状态(图1D);第20 天,细胞突触略缩短,一部分细胞由贴壁转为悬浮状态(图1E);第25 天,细胞聚团生长现象明显,胞质、胞核清晰可见且体积明显增大(图1F);第30 天,细胞长势依旧良好,核质分明,细胞大小不一(图1G)。

注:A-G 分别为第0、5、8、13、20、25、30 天时镜下观察BMDC 形态图(20 ×)图1 BMDC 体外培养不同时间点细胞形态图Fig.1 The morphology of BMDC cultured in vitro at different time points
2.2 不同培养时间点小鼠树突状细胞免疫膜蛋白表达情况Amnis 量化成像流式细胞仪检测到小鼠DC 表面免疫膜蛋白CD80、CD11c、MHC-Ⅰ和MHC-Ⅱ表达情况(图2)。结果显示:细胞培养第5 天即可检测出CD80、CD11c、MHC-Ⅰ和MHC-Ⅱ的表达。其中CD80 阳性率为(55.48±4.83)%,CD11c 阳性率为(53.28±9.53)%,MHC-Ⅰ阳性率为(73.13±13.04)%,MHC-Ⅱ阳性率为(55.11 ±13.14)% 。第13 天表达水平达高峰,CD80 阳性率为(97.29±0.63)%,CD11c 阳性率为(92.31 ±1.18)%,MHC-Ⅰ阳性率为(97.91±0.49)%,MHC-Ⅱ阳性率为(97.91±0.49)%,与其他各组比较差异有统计学意义(P< 0.01,图3A、B、C)。13 d后CD80、CD11c、MHC-Ⅰ和MHC-Ⅱ表达水平略有降低,但仍保持在较高水平。第30 天,CD80 阳性率为(78.86±2.72)%,CD11c阳性率为(77.67±2.58)%,MHC-Ⅰ阳性率为(85.56±1.31)%,MHC-Ⅱ阳性率为(81.35±2.05)%(表1)。
表1 不同培养时间点对小鼠DC 表面免疫蛋白阳性表达率的影响Tab.1 The effects of different culture time points on the positive expression rate of immunoprotein of BMDC ±s,%

表1 不同培养时间点对小鼠DC 表面免疫蛋白阳性表达率的影响Tab.1 The effects of different culture time points on the positive expression rate of immunoprotein of BMDC ±s,%
脂蛋白CD80 CD11c MHC-ⅠMHC-Ⅱ数量6666 5 d 55.48±4.83 53.28±9.53 73.13±13.04 55.11±13.14 8 d 92.66±2.70 76.05±4.50 93.68±2.43 84.29±1.49 13 d 97.29 ± 0.63 92.31±1.18 97.91±0.49 97.91±0.49 20 d 91.80 ± 0.48 91.19±2.03 94.14±1.77 94.06±1.78 25 d 90.42±1.58 88.64±1.74 90.10±0.93 86.55±1.82 30 d 78.86±2.72 77.67±2.58 85.56±1.31 81.35±2.05 F值208.89 61.93 15.53 44.13 P值0.000 1 0.000 1 0.000 1 0.000 1
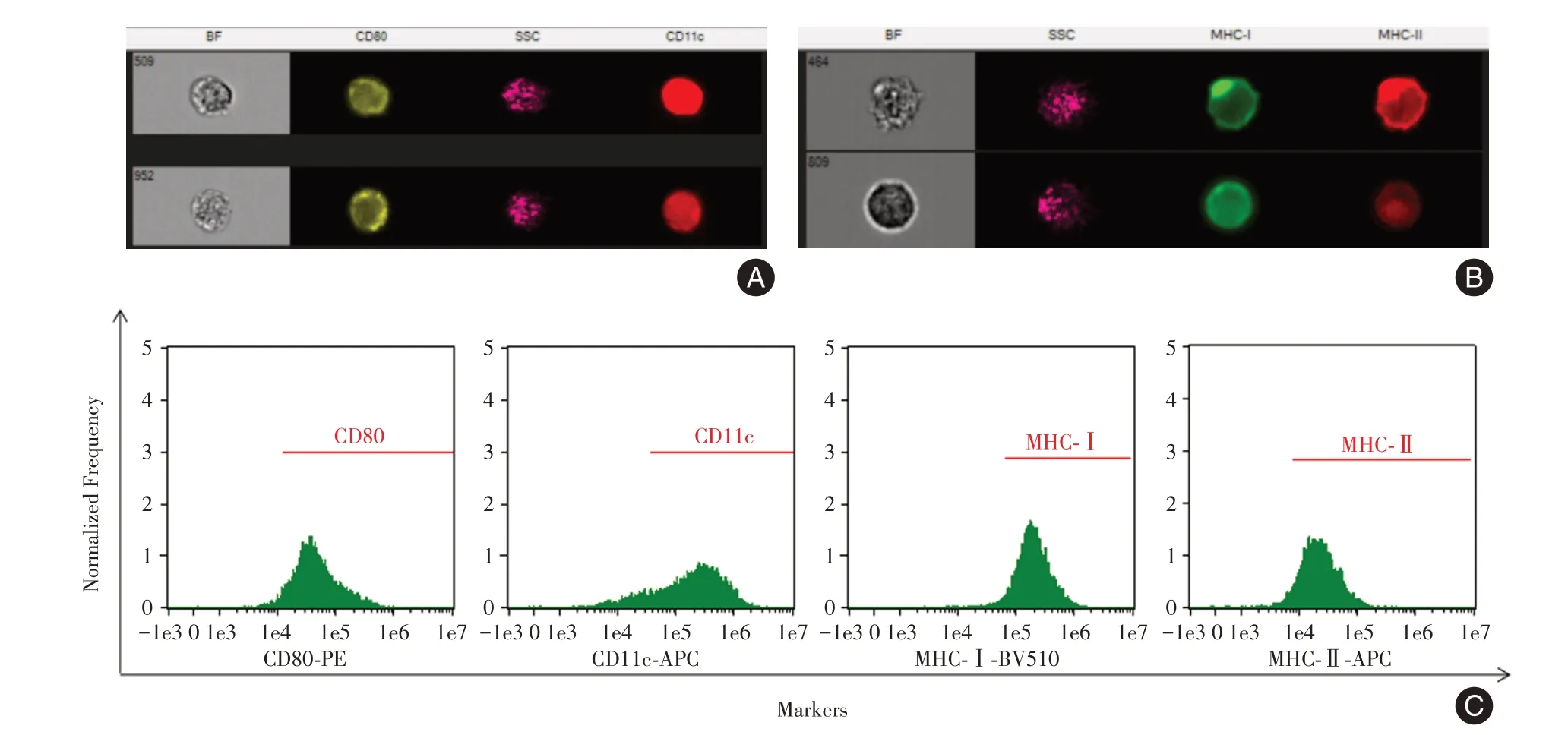
注:A,Amnis 量化成像流式细胞仪检测DC 表达CD80、CD11c 荧光图;B,Amnis 量化成像流式细胞仪检测DC 表达MHC-Ⅰ、MHC-Ⅱ荧光图;C,DC 表达CD80、CD11c、MHC-Ⅰ和MHC-Ⅱ直方图(BF:明场)图2 Amnis 量化成像流式细胞仪检测小鼠DC 表面免疫蛋白图Fig.2 Amnis image flow cytometey detected the immunoprotein on the surface of BMDC
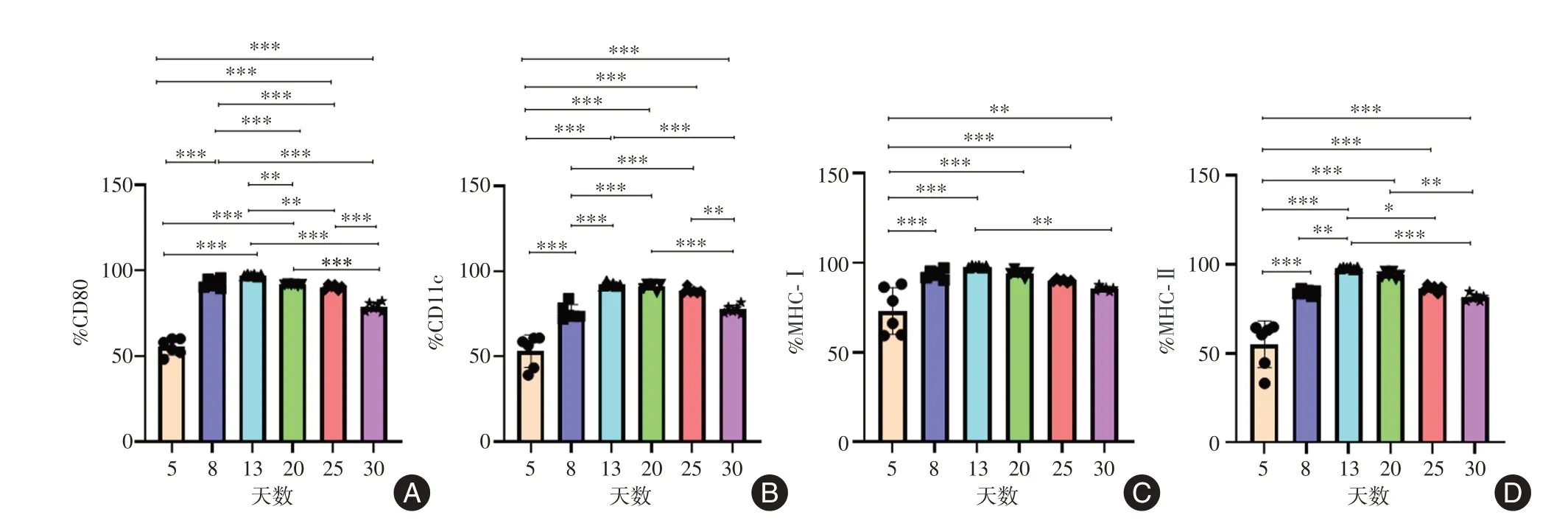
注:A,不同培养时间点DC 表达CD80 情况;B,不同培养时间点DC 表达CD11c 情况;C,不同培养时间点DC 表达MHC-Ⅰ情况;D,不同培养时间点DC 表达MHC-Ⅱ情况。*P < 0.05,**P < 0.01,***P < 0.001图3 不同培养时间点小鼠DC 表面免疫蛋白Fig.3 The immunoprotein of BMDC surface at different culture time points
2.3 小鼠树突状细胞外泌体鉴定蛋白印迹(Western blot)检测到DEX 表面特征性蛋白CD9、CD63和CD81,分别为25、50、22 kDa(图4A);Amnis量化成像流式细胞仪检测到CD9-APC、CD63-405和CD81-488 标记的DEX(图4B)。

注:A,蛋白质印迹法检测DEX 上CD9、CD63 和CD81 蛋白表达;B,Amnis 量化成像流式细胞仪检测外泌表面特异性标志物(BF:明场)图4 Western blot 和Amnis 量化成像流式细胞仪检测DEX 特异性标志物Fig.4 Western blot and Amnis image flow cytometey detection the markers of exosomes
2.4 不同培养时间点DEX免疫膜蛋白表达情况Amnis 量化成像流式细胞仪检测到CD81 阳性DEX免疫相关膜蛋白CD80、CD11c、MHC-Ⅰ和MHC-Ⅱ表达情况(图5A、B、C)。结果显示:CD81阳性DEX表达CD80、CD11c、和MHC-Ⅱ水平以第5 天表达最高,其中CD80 阳性表达率为(37.96±5.67)%,CD11c 阳性表达率为(49.59±9.22)%,MHC-Ⅱ阳性表达率为(57.67±16.53)%,组间差异有统计学意义(图6A、B、D,P< 0.01);CD81 阳性DEX 表达MHC-Ⅰ水平以第13天表达最高(图7C),阳性表达率为(81.30±5.41)%。见表2。
表2 不同培养时间点对小鼠DEX 免疫相关膜蛋白阳性表达率的影响Tab.2 The effect of different culture time points on the positive expression rate of immune-related membrane proteins in mouse dendritic cell exosomes ±s,%

表2 不同培养时间点对小鼠DEX 免疫相关膜蛋白阳性表达率的影响Tab.2 The effect of different culture time points on the positive expression rate of immune-related membrane proteins in mouse dendritic cell exosomes ±s,%
脂蛋白CD80 CD11c MHC-ⅠMHC-Ⅱ数量6666 5 d 37.96±5.67 49.59±9.22 60.83±10.10 57.67±16.53 8 d 26.57±6.71 35.98±8.94 73.46±6.17 55.19±6.12 13 d 20.56±7.39 35.41±10.47 81.30±5.41 28.94±1.76 20 d 10.46±8.26 24.90±8.81 63.32±8.23 22.00±6.70 25 d 18.34±10.97 22.55±21.61 56.85±13.31 16.20±3.31 30 d 15.04±6.10 22.74±10.20 71.84±13.47 16.84±4.09 F值9.49 4.38 5.07 33.20 P值0.000 1 0.004 0.002 0.000 1

注:A,CD81 阳性DEX 表达CD80 和CD11c 荧光图;B,CD81 阳性DEX 表达MHC-Ⅰ和MHC-Ⅱ荧光图;C,CD81 阳性DEX 表达CD80、CD11c、MHC-Ⅰ和MHC-Ⅱ直方图(BF:明场)图5 Amnis 量化成像流式细胞仪检测CD81 阳性DEX 表达CD80、CD11c、MHC-Ⅰ、MHC-Ⅱ情况Fig.5 Amnis image flow cytometry detected the expression of CD80,CD11c, MHC-Ⅰ and MHC-Ⅱ in CD81 positive exosomes.

注:A,不同培养时间点CD81 阳性DEX 表达CD80 情况;B,不同培养时间点CD81 阳性DEX 表达CD11c 情况;C,不同培养时间点CD81阳性DEX 表达MHC-Ⅰ情况;D,不同培养时间点CD81 阳性DEX 表达MHC-Ⅱ情况。*P < 0.05,**P < 0.01,***P < 0.001图6 不同培养时间点CD81 阳性DEX 表达CD80、CD11c、MHC-Ⅰ、MHC-Ⅱ情况Fig.6 The expression of CD80, CD11c, MHC-Ⅰ and MHC-Ⅱ in CD81 positive exosomes at different culture time points
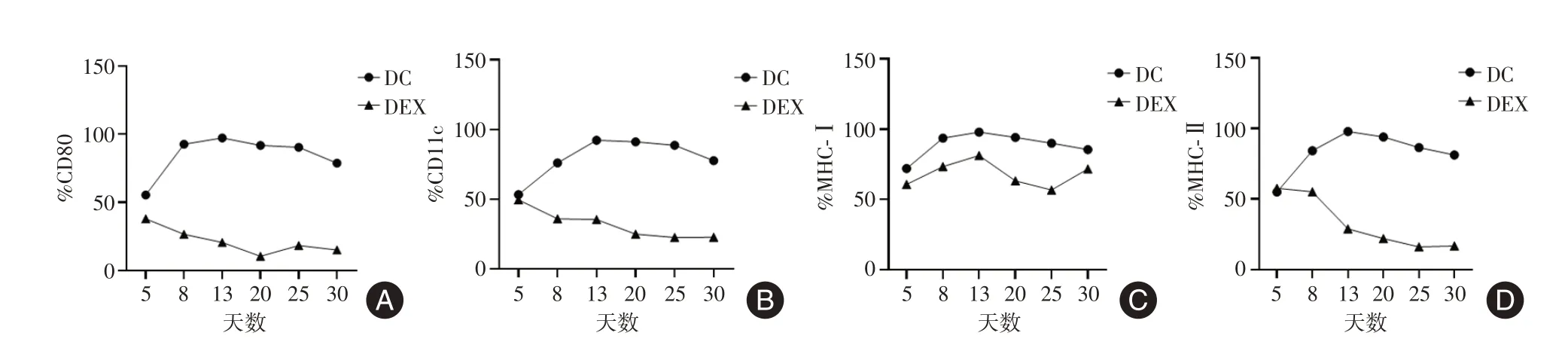
注:A,不同培养时间点DC 和DEX 表达CD80 的变化趋势;B,不同培养时间点DC 和DEX 表达CD11c 的变化趋势;C,不同培养时间点DC 和DEX 表达MHC-Ⅰ的变化趋势;D,不同培养时间点DC 和DEX 表达MHC-Ⅱ的变化趋势图7 小鼠DC 及DEX 表达CD80、CD11c、MHC-Ⅰ和MHC-Ⅱ的变化趋势Fig.7 Amnis image flow cytometry detected the expression of CD80, CD11c, MHC-Ⅰand MHC-Ⅱ in BMDC and DEX at different culture time points
2.5 小鼠树突状细胞与其分泌外泌体免疫膜蛋白相关性小鼠DC 培养第13 天CD80、CD11c、MHC-Ⅰ、MHC-Ⅱ表达水平最高,随着培养时间增加,表现出先递增后下降趋势;DEX 膜上CD80、CD11c、和MHC-Ⅱ表达水平以第5 天最高,随培养时间增加,总体呈下降趋势,MHC-Ⅰ以第13 天表达水平最高(图7)。结果提示,DC 与DEX 表达免疫相关膜蛋白水平趋势不同,无明显相关性。
3 讨论
DC 是机体免疫应答的关键细胞,主要参与抗原提呈与加工处理,在许多免疫系统疾病的发生、发展中起着重要作用[6-7],而其表面的免疫膜蛋白是发挥功能的关键。本研究结果显示,小鼠DC 培养至第5 天,约50%以上细胞上表达CD80、CD11c、MHC-Ⅰ和MHC-Ⅱ免疫分子,此时为未成熟树突状细胞(immature dendritic cells, imDCs)。imDCs 主要存在于外周组织中,当机体识别到病原微生物入侵时,其直接摄入抗原,抗原吞噬能力较强[8]。加入TNF-α 刺激分化至第13 天,DC 表面免疫膜蛋白表达水平随着细胞成熟度逐渐增加达到峰值。DC 表面MHC 类分子的表达增加,从而使DC 发挥强大的抗原呈递能力[9]。随着培养时间增加,镜下观察成熟DC 数量逐渐减少,但是DC培养第30 天,Amnis 量化成像流式细胞仪检测到MHC-Ⅰ和MHC-Ⅱ阳性表达率均达80%以上,抗原提呈能力依旧较强。
近年来,DC 来源外泌体已成为肿瘤疫苗领域的新星[10]。本研究显示,DEX 携带大量与免疫激活相关的组织相容性复合体MHC-Ⅰ、MHC-Ⅱ、共刺激分子CD80 和黏附因子等,与文献报道[11-12]一致。其中CD80、CD11c、和MHC-Ⅱ表达水平以第5 天最高,然后随培养时间增加,总体呈下降趋势。体外培养第5 天时,为DC 未成熟状态,有研究报道[13],DC 未成熟时分泌的DEX 蛋白量平均比成熟时高0~0.5 倍,提示DC 未成熟时DEX 上免疫膜蛋白可能比成熟状态时高。同时,DC 早期分泌的DEX 膜上一些免疫蛋白表达高,提示在DEX的疫苗或免疫治疗实验中使用DC 早期DEX 可能更有利于抗原提呈,更能激发机体的免疫反应。
外泌体是由细胞分泌的,它可携带分泌细胞的一些生物学分子,为了进一步明确DC 及其分泌的DEX 表面免疫膜蛋白的相关性,我们分析了DC表面CD80、CD11c、MHC-Ⅰ和MHC-Ⅱ表达水平与DEX 上CD80、CD11c、MHC-Ⅰ和MHC-Ⅱ的表达水平,结果显示,两者表达水平未发现明显相关性。原因可能是外泌体虽然由细胞分泌,但其携带的生物学分子需要经过细胞内的分选机制进行分选,然后包装到外泌体分泌出细胞外,因此,外泌体膜上携带的蛋白不一定与分泌细胞上的膜蛋白保持一致。
以DC 和DEX 为主的免疫治疗在未来有着广阔的应用前景,提高体外培养DC 以及DEX 的质量,保持其较强的抗原提呈能力,对当前研究和应用具有重要意义。本研究发现,体外培养的小鼠DC 高表达免疫相关的膜蛋白,在一定时间内可稳定维持。其分泌的DEX 也携带有丰富的免疫相关膜蛋白,但DC 与DEX 表面的免疫相关蛋白未发现明显相关性。
【Author contributions】XIAO Li performed the experiments and wrote the article.LUO Shumin analyzed the data.XU Fang and LU Pengpeng collected information and helped the experiments.XING Enhong revised the article.LI Weihua designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
