心脏传导系统
2024-04-13苏冠菲喜林强周贤惠
苏冠菲 喜林强 周贤惠
正常情况下,心脏以一定范围的频率发生有规律的搏动,搏动起源于窦房结发起的冲动,沿心脏传导系统依次激动心房、心室,从而达到心脏协调统一的收缩。心律失常的发生机制包括冲动形成异常和(或)冲动传导异常。无论是冲动形成异常或冲动传导异常,都与心脏传导系统密切相关,了解心脏传导系统对心律失常相关机制及心电生理介入诊疗至关重要。
1 窦房结
1.1 窦房结的解剖及血液供应 窦房结是心脏正常起搏点,其特殊的心肌细胞呈纤维网状,其外无纤维鞘包裹,主要由起搏(P)细胞与移行(T)细胞组成。窦房结位于上腔静脉与右房交界处界沟上1/3心外膜深面。在成人心脏其长度平均为13.5 mm,形态呈不规则形,分为头、体、尾三部分,头部位于心外膜下,接近嵴间沟上缘,尾部向下穿入界嵴心肌,靠近心内膜下,尾部远端密度降低,分散成丛状的特殊细胞群[1]。Sánchez-Quintana等[2]选取47例成年人心脏标本切片染色(图1),将窦房结分为头、体、尾三部分,分别测量不同部分长度、高度、宽度(表1)以及窦房结距离心内膜和心外膜的距离(表2),将窦房结形态具体化有助于理解窦房结的毗邻解剖。窦房结内有丰富的交感神经及副交感神经,交感神经主要支配特殊分化的心肌细胞,副交感神经主要分布于窦房结周围。窦房结区的神经纤维分布密度明显高于周围心肌区域。通常有一条明显的窦房结动脉穿入窦房结,窦房结血液供应大部分来自于一侧冠状动脉,右冠状动脉或左冠状动脉,少部分来自双侧冠状动脉(图2[4])。
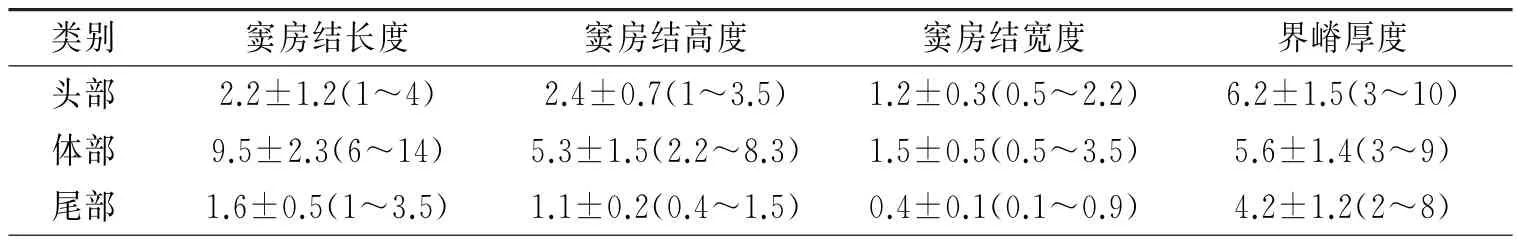
表1 窦房结和终末嵴测量/mm

表2 窦房结不同部分与心外膜及心内膜的距离/mm
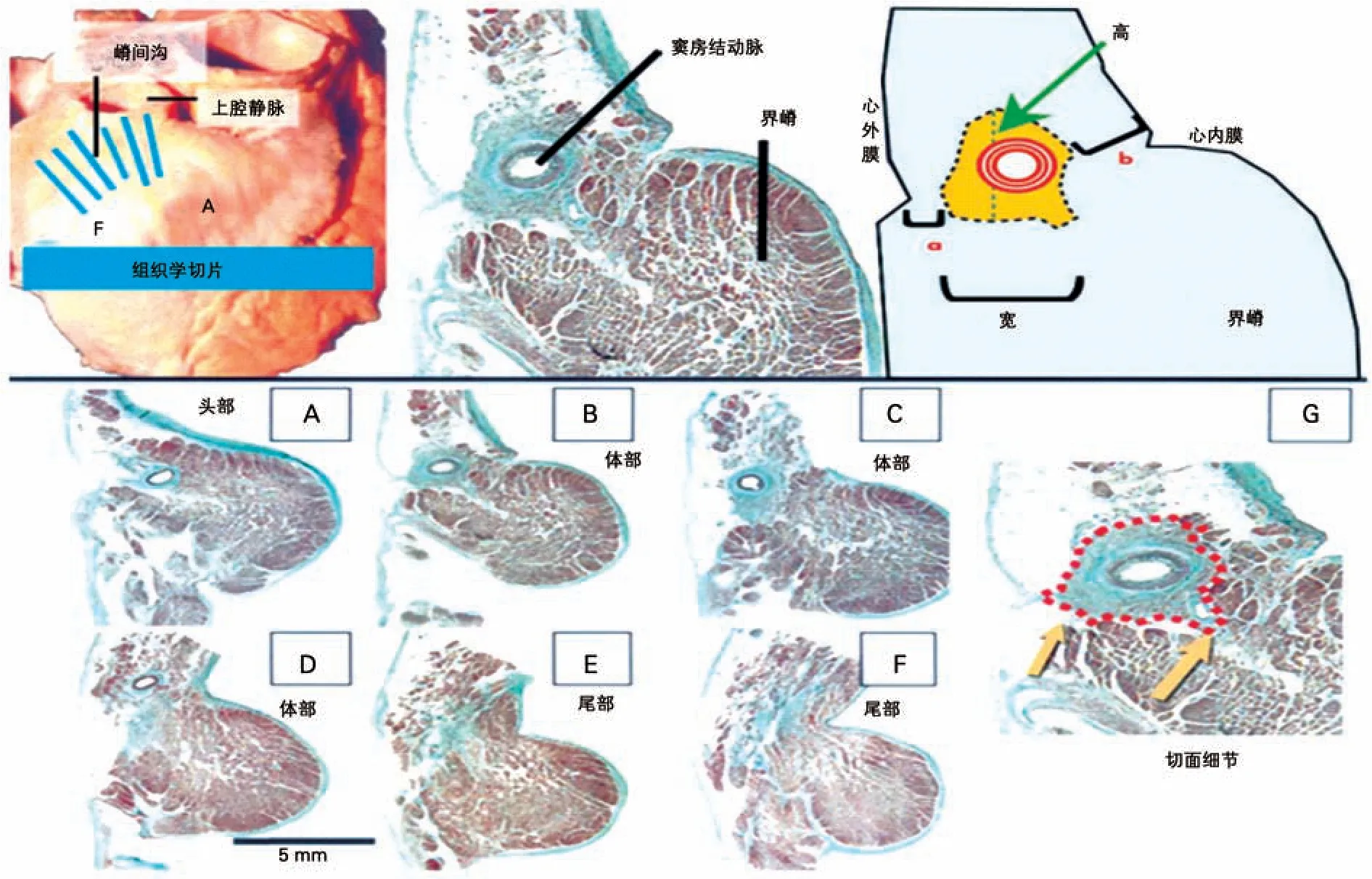
图1 窦房结区域心脏大体标本及组织切片(解释测量指示的图示及表1和表2)[2]
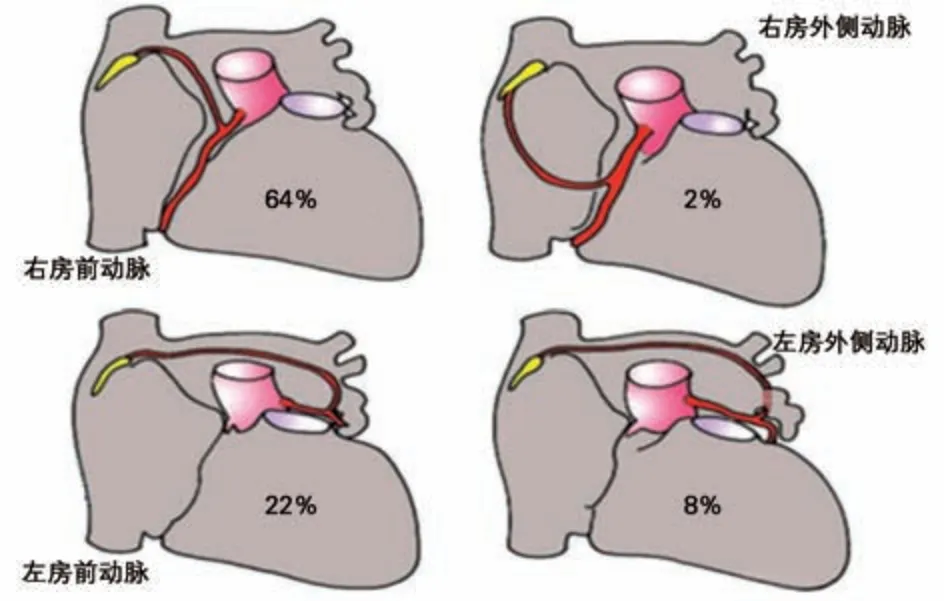
图2 窦房结血液供应[4]
1.2 窦房结冲动起始 窦房结作为心脏正常起搏点,冲动形成后沿着心脏传导系统传导激动完成一次心动周期。Stephenson等[3]通过增强微计算机断层扫描得到高分辨解剖数据整合到心脏电去极化数学模型中,强有力证明了心脏电激动从窦房结发出,分别向左房和房室结传播。
2 房室交界区
房室交界区又称房室结区,其范围大概基本与Koch三角一致,如图3所示[5]。Koch三角下缘位于右房冠状窦口前内缘,两侧缘分别为三尖瓣隔侧尖附着缘和Todaro键,前部心内膜深面为房室结。尽管大部分人普遍认为房室结位于Koch 三角区内,但有人对此存疑。Sánchez-Quintana等[6]对41例心脏(24例尸体解剖,17例组织学)进行研究发现,房室结动脉与Koch三角相邻的位置是可变的,可以是冠状动脉窦的固有部、右房的心内膜面、心脏的静脉、心脏传导系统组织,如对Koch三角部位进行射频消融,极有可能损伤房室结动脉和心脏传导组织。
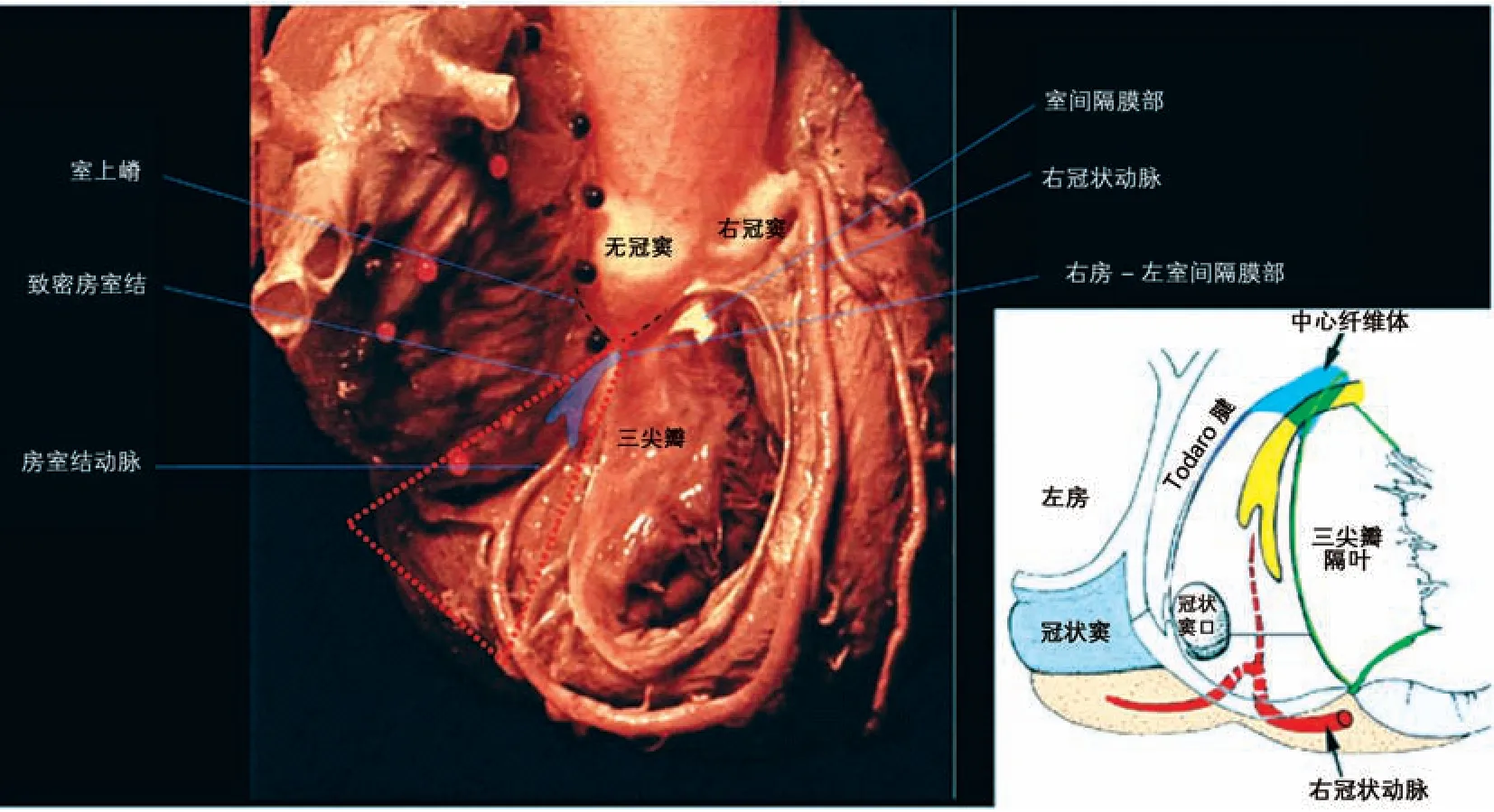
图3 房室交界区与Koch三角[5]
房室交界区由三部分构成:房室结、房室结的心房延伸部和房室束近侧部,各部之间无明显的分界。Tawara等[7]建议使用中央纤维体作为His束和房室结之间的界限。房室结是房室交界区的中央部分,有数条纤维束延伸至房间隔和冠状窦口周围,即心房延伸部;前端变细插入中心纤维体,形成房室束。①房室结收集来源于窦房结下传的兴奋。窦房结产生的冲动信号通过3个结间束到达房室结边缘。后结间束穿过窦房结,向下穿过界嵴,经下腔静脉瓣到达房室结的后缘。前、中结间束在通过房间隔时很快合并,共同通过卵圆窝前缘下降,到达房室结顶部[8]。②房室结保证心脏冲动传导的方向性。来自于窦房结的冲动一旦传导至房室结边缘,传导将沿His束方向传导。这种功能需要相互连接的T 细胞组成的心肌纤维,T 细胞不仅分支相互连接,而且在一些部位聚集一个或多个P细胞,起到类似于窦房结起搏功能。③房室结有延迟传导和减慢心脏频率的作用。P 细胞之间存在缝隙连接进而引起传导延迟,尽管这种缝隙小于其他心肌细胞间的缝隙连接[8]。房室结延迟传导和减慢频率的作用,不仅使心室收缩前充分充盈[8]而且能很好保护心室肌细胞,如心房颤动期间,房室结过滤心房高频兴奋进而保护心室心肌[9]。④房室结起搏功能。生理条件下,窦房控结制心脏的节律与频率。一般来说,当窦房结出现功能障碍时,房室结作为“次级起搏点”替代窦房结产生心脏自律性[5,10]。Marger等[11]通过构建小鼠模型发现房室结细胞的起搏作用低于窦房结起搏细胞,原因可能是心肌细胞离子电流(如钠通道电流、钙通道电流)在两者中的分布密度不同。
3 His束和左、右束支
3.1 His束 房室束又称His束,起自房室结前端,穿过中心纤维体,继而行走在室间隔肌性部分与中心纤维体之间,向前下行走于室间隔膜部后下缘,同时左束支(LBB)的纤维陆续从His束主干发出,最后分为右束支(RBB)和LBB(图4)。1893年,Wilhel m His Jr第一次提出了“束”的概念,遗憾的是他没有对此进行深一步的探究[12]。1906年,Tawara发现了连接心房与心室的心肌轴,并将轴上被纤维组织覆盖的部分称为房室结穿透束或His束[13],他认为房室结与His束存在解剖学差异,但不存在组织学差异。直到1971年,Ja mes和Sherf[14]发现房室结与His束存在组织学差异,认为His束中的细胞主要是Purkinje细胞,细胞间被胶原分隔,呈纵向走形,这与Kauf man 和Rothber ger在1919年提出的纵向理论一致[15]。Sugrue等[16]发现,对于束支传导阻滞患者,通过刺激不同部位的His束可以使异常QRS波形恢复正常,这一观察结果被认为是由于His束纤维存在纵向分离(图5)。这是His束纵向分离临床意义的首次展现,也进一步证明了His束纵向走形的解剖结构。
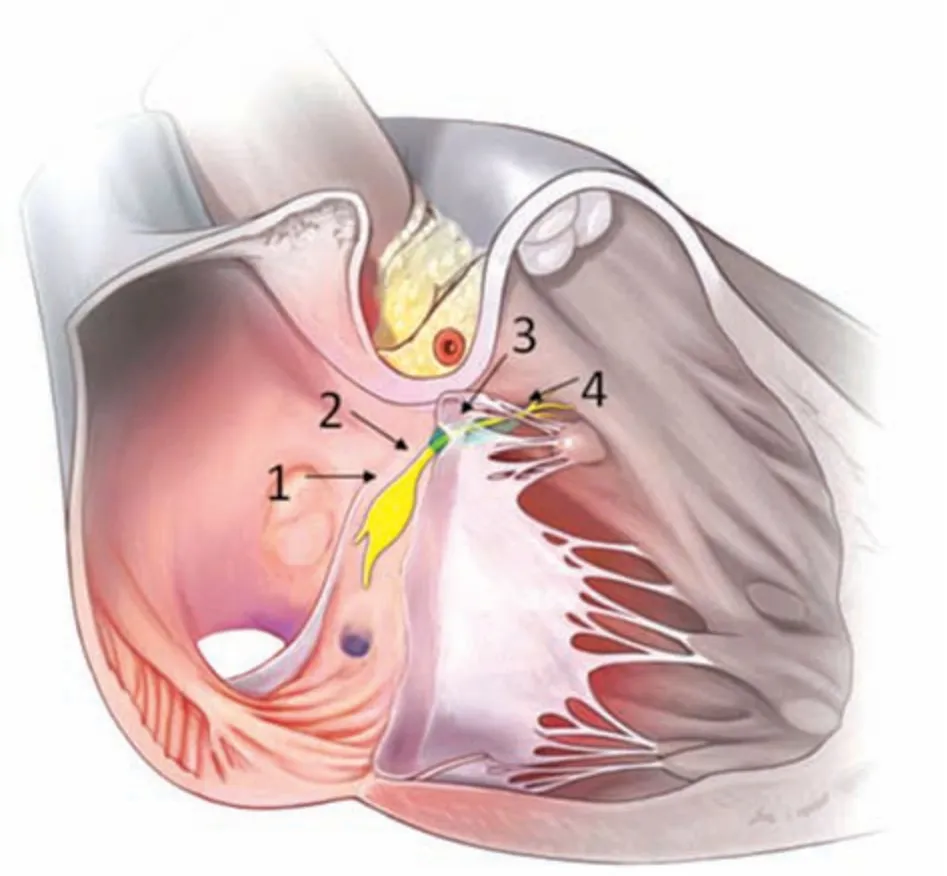
图4 His束的解剖学[16]
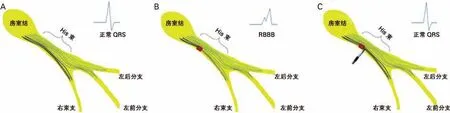
图5 His束纵向分离解剖示意图[16]
随着传统起搏位点弊端不断显露,寻找新的起搏位点势在必行。His束区域被认为是迄今为止最生理的起搏位点,使用固有传导系统激动心室。His起搏最初于20 世纪80年代提出,直到2000年Desh mukh等[17]开创性进行了直接His起搏术,证实His起搏的可行性。Kawashi ma等[18]对105例成人心脏传导系统进行了宏观解剖研究(图6),将His束分为三型(Ⅰ~Ⅲ型),同时认为His束的解剖变异可能与His束起源部位位于房室环与球室环的交界处有关。

图6 His束的宏观解剖及分型[18]
3.2 LBB和RBB LBB、RBB均来源于His束,LBB来源于His束分叉,而RBB则作为His束分出LBB后的延续(图7)。
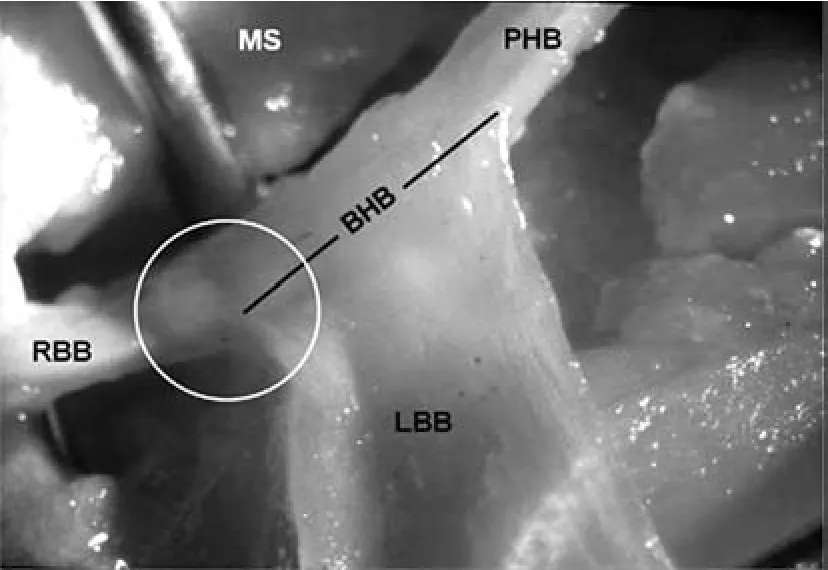
图7 LBB和RBB[19]
LBB发自房室束分叉部,在室间隔左侧心内膜下走行于肌性室间隔上、中1/3交界水平,继而分为前组、后组和间隔组3组,其分支在心内膜深面互相吻合形成Pur kinje纤维网。其在不同心脏中形态各异,通过对一系列心脏标本左室间隔心肌部分组织学切片分析,总结了不同形态LBB 的解剖特征(图8)。Elizari等[19]的研究中,所有形成LBB 的纤维都位于同一平面,走行于室间隔左侧心内膜下呈带状分布(图9),大多可分为前束和后束,分别延伸至前组乳头肌和后组乳头肌并与之相连,这也是临床上难以区分乳头肌起源与传导束起源室性早搏的原因;有时后束经过一段走形后再次分为两部分,一条延伸走向后组乳头肌,另一条走向左室间隔中部的后1/3。

图8 LBB不同形态[19]

图9 LBB不同分型[19]
RBB起于房室束分叉部的末端,像由特殊细胞形成的条索(图10 A),其外由纤维鞘包裹,向下穿过右侧室间隔肌部,到达内侧乳头肌基底部的心内膜下,然后于间隔边缘部肌小梁部心内膜下浅层延伸。在RBB 下降过程中,有一个重要的分支携带在导管束内,横跨于壁面(图10 B)。
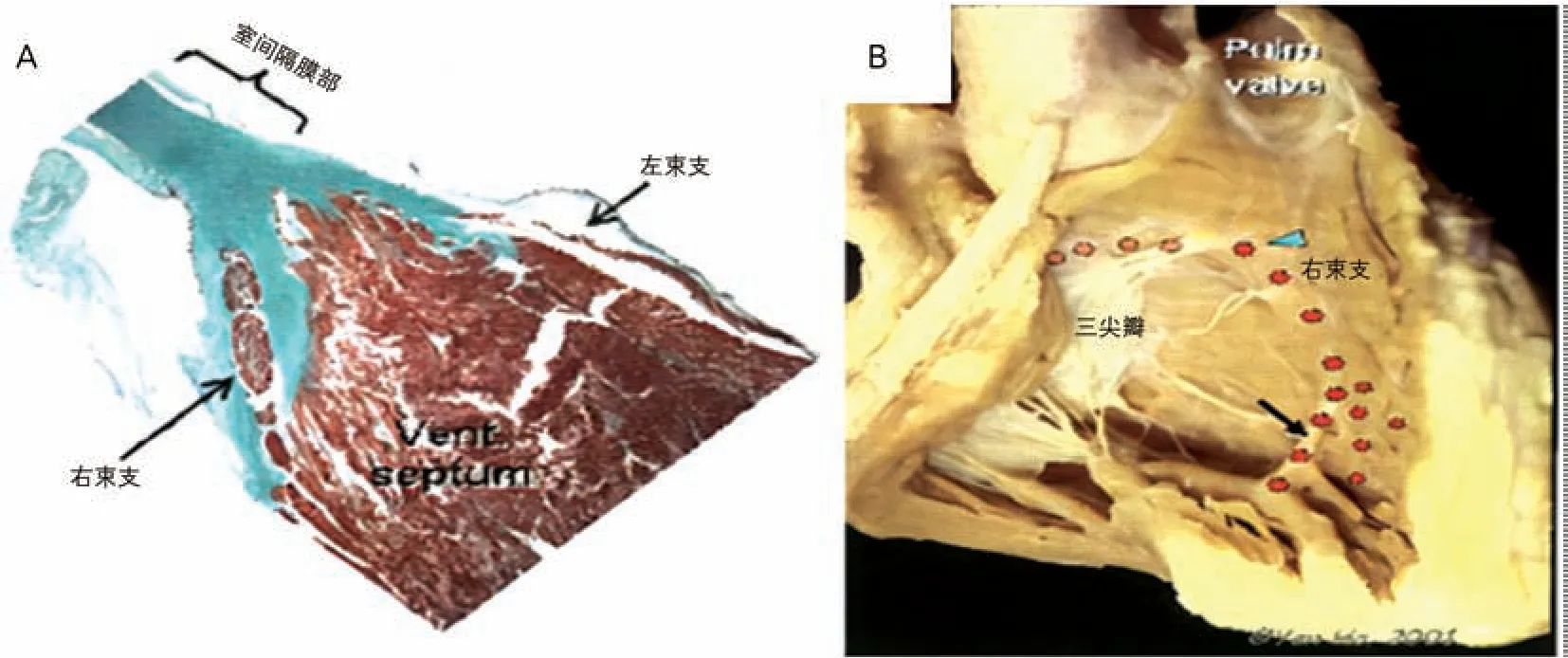
图10 RBB形态[1]
4 Pur kinje纤维网
Pur kinje纤维是在1837年被发现的,后来Tawara对其解剖特征加以研究。左、右束支的分支在心内膜下交织成心内膜下Purkinje纤维网,Purkinje纤维网并不是平面结构,而是一个立体三维结构,主要分布于室间隔中下部至心尖处,乳头肌的下部和心室游离室壁的下部,而室间隔上部、动脉口和房室口附近则分布稀少或没有。心内膜下Pur kinje纤维网发出纤维分支以直角或钝角进入心室壁内则构成心肌内Pur kinje纤维网,最后与收缩心肌相连,使心脏产生收缩和舒张。Pur kinje纤维网是心脏传导系统最后一个环节,冲动在纤维网上的快速传导保证了心室的协调收缩。
At kinson等[20]为进一步研究Pur kinje纤维网的特点,利用实验兔进行心脏Purkinje纤维网免疫酶组化研究,通过构建His-Pur kinje纤维网的三维计算机模型,进一步揭示了Pur kinje纤维网的结构特点。LBB 由许多独立的心肌束组成,它们在室间隔表面平行朝向心尖走行,分为三束,走行于间隔心内膜,随后从室间隔内膜上分离出来,穿越心室腔,达到左室游离壁心内膜表面,形成Pur kinje纤维网(图11)。RBB沿室间隔右侧面走形到达乳头肌底部后,通过调节束到达右室顶室壁,后形成自由走行Pur kinje纤维与终末端Purkinje纤维相连接,最后终末端Purkinje纤维分裂融合形成一个比左室更复杂的Pur kinje纤维网,该网络覆盖了大部分右室游离壁并向三尖瓣延伸(图12)。Azarov等[21]对实验兔心室激活顺序研究表明心室存在两个心外膜兴奋突破点,兴奋从两个突破点开始,首先激动左室表面和右室基底部,最后激动左室基底部(图13 下图)。Atkinson 等[20]通过His-Pur kinje纤维网三维模型与左、右室几何结构的叠加,形象地揭示了心室外膜的激动(图13 上图)。Tusscher等[22]通过电激动标测,进一步形象化His-Pur kinje纤维网的激动顺序,激动从His束传到Pur kinje系统的左、右束支,LBB传播速度因其分支的存在较RBB 更快,起初兴奋只在Pur kinje系统传播,50 ms左右出现第一次Pur kinje插入点或连接点的激动并开始通过心肌细胞传导激动,Pur kinje系统的激动在90 ms完成,而心室的激动则在150 ms完成(图14);此外作者还建立了束支传导阻滞的模型,验证了Purkinje系统在束支传导阻滞等一系列复杂心律失常中发挥重要作用,但相关作用机制有待进一步研究。
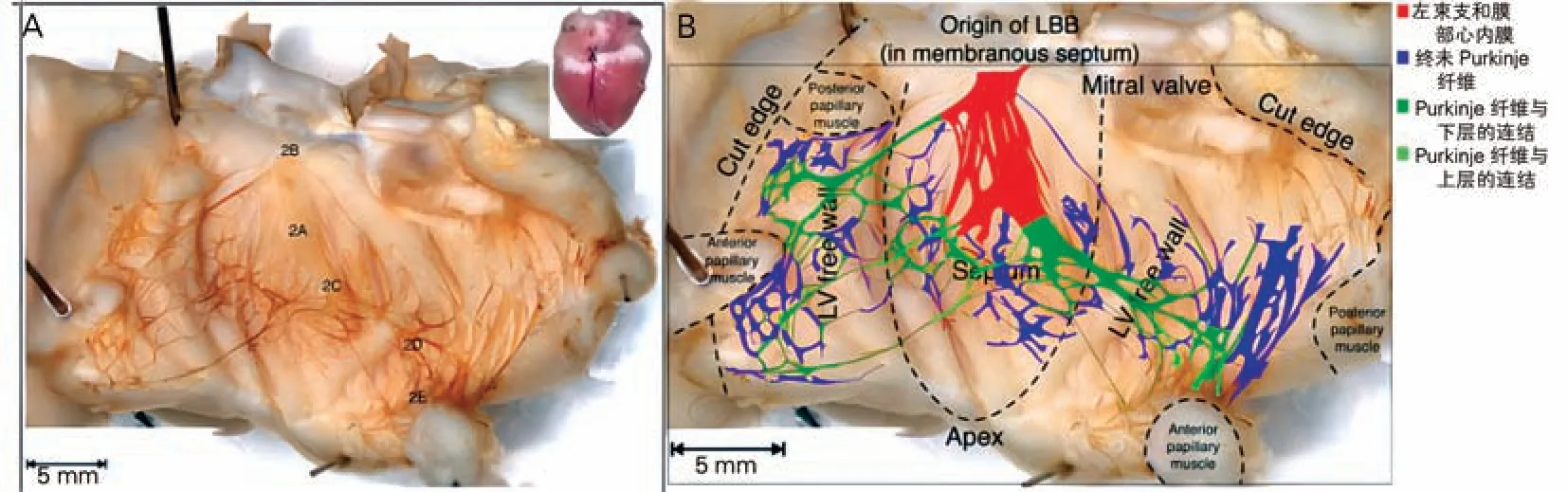
图11 兔左室His-Pur kinje纤维网[20]

图12 兔右室His-Purkinje纤维网[20]

图13 His-Pur kinje纤维网三维激动模型[20]
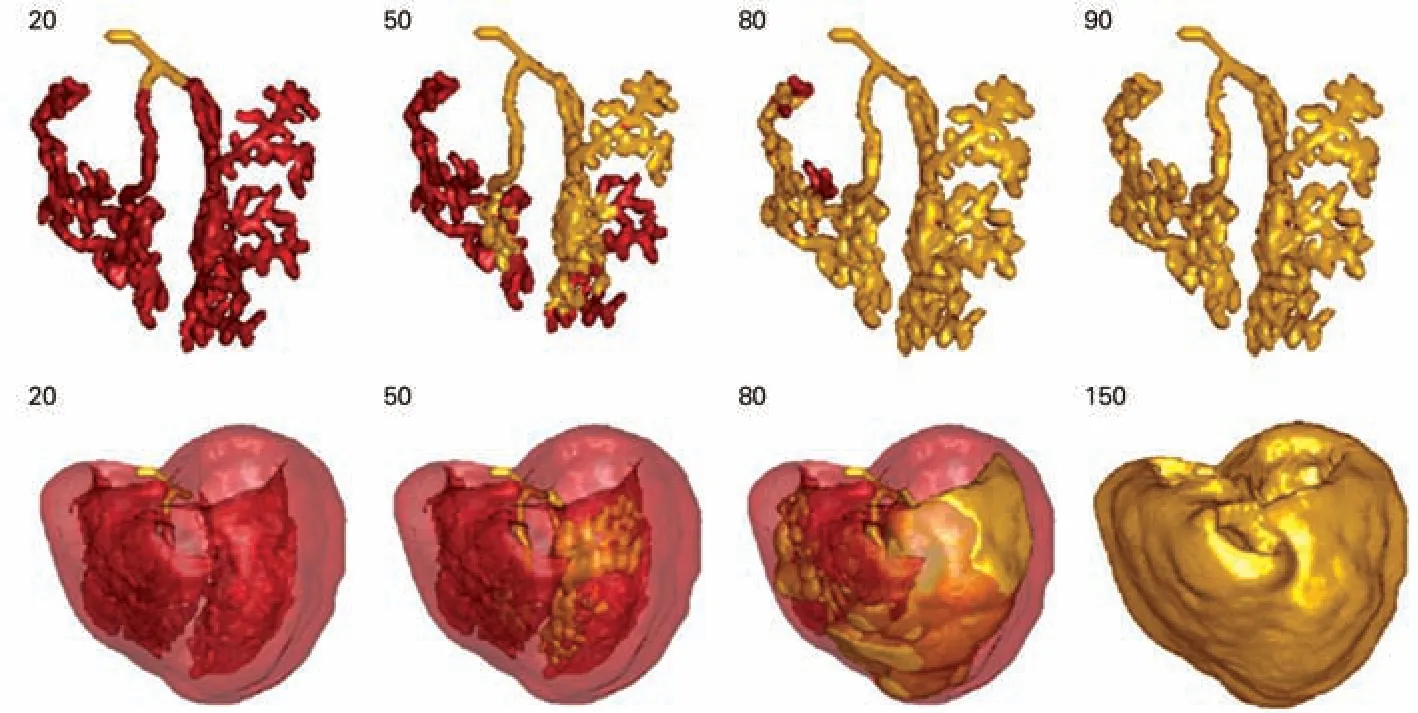
图14 正常Purkinje纤维网系统及心室激动序列[22]
5 传导系统单细胞的功能
心脏传导系统每部分都是由特殊的心肌细胞构成,具有独特的电生理特性[23],比如窦房结起搏功能、房室结延迟传导。更重要的是心脏传导系统具有显著的细胞异质性[24]。目前这种异质性与临床联系最紧密的是T 细胞的发现,它与窦房结功能障碍、心脏传导阻滞甚至心室颤动相关。T 细胞存在于传导系统并为周围工作的心肌细胞提供连接的桥梁。T 细胞除连接作用外,还可促进去极化扩散、将电流传递至周围心肌前放大电流等作用[25]。之前研究T 细胞的分离、分子表征等十分困难,关于T 细胞的功能还都只是假设。单细胞转录组测序的出现极有可能解决这一难题。
目前关于心脏传导系统的研究大多是在个体和组织水平上进行研究,很少针对单细胞研究,这与心脏传导细胞总数较少、复杂的传导结构以及不易从周围工作心肌细胞中分离出传导细胞等有关[26]。
Goodyer等[26]通过显微解剖结合单细胞分离测序等技术,克服了既往技术障碍,成功分离心脏传导细胞的所有细胞类型,包括之前从未捕捉到的T 细胞。他们从细胞、分子、基因等水平对心脏传导系统进行了研究分析。①窦房结区:新的窦房结基因被发现,包括Igfbp5、Cpne5、Rgs6、Ntm、Smoc2。尤其是Smoc2,仅在紧凑型窦房结、过渡型窦房结及节间细胞群中富集,其他传导组织中未见富集。既往研究表明它与非心脏组织中内皮细胞增殖和迁移以及和血管生成有关。特别提到的是富集在窦房结的新基因同样存在于T 细胞中,这就为以后捕捉研究这一神秘细胞提供很大帮助[26]。陈义汉院士与薛志刚教授团队,通过单细胞转录测序结合生物信息学分析及体外验证,解释了窦房结的新标志物Vsnl1,并验证了该基因很有可能参与窦房结自主节律的调控[27]。②房室结-His束区:最显著富集基因之一是Cpne5,一种依赖于钙离子的磷脂结合蛋白质家族成员,可在膜运输中起作用。尽管其功能未知,但它的同源物Cpne8已经被认为与人心率变异性相关[26]。③His-Purkinje纤维网区:新的基因包括Igfbp5、Cpne5、Ntm。尤其是从未与心脏传导系统联系的免疫球蛋白细胞粘附分子的成员Ntm,被发现存在于心脏传导系统的各个部分[26]。
心脏传导系统单细胞测序的结果,有助于我们从分子层面更深入的理解心脏传导系统不同细胞特征以及传导系统不同细胞激动传导特性,这一领域的开拓性进展,将帮助我们更好的理解心脏传导系统的病理生理,必将提高我们对心脏传导系统疾病的诊治水平。
6 结语
尽管数学建模、三维标测、单细胞测序等新技术的出现有助于我们对心脏传导系统有更进一步的认识,然而心脏传导系统还存在着许多悬而未决的问题,比如结间传导的结间束是否真实存在,心房颤动产生的病理生理机制,传导系统T 细胞的功能等,这也正体现了心脏传导系统的复杂性。而通过不断发展的新技术深入研究心脏传导系统是学科发展的必然趋势。
