RRM2在结直肠癌的放射增敏中的作用及研究
2024-04-13王俊李亮李建刚
王俊 李亮 李建刚


收稿日期:2023-05-06;修回日期:2023-06-27。
基金项目:新疆维吾尔自治区自然科学基金项目(2021D01C377)。
作者简介:王俊,主治医师,主要从事胃肠道肿瘤方面的研究工作。
* 通信作者:李建刚,主治医师,主要从事胃肠道肿瘤方面的研究工作。E-mail: lijiangang810311@163.com。
摘 要:大多数结直肠癌患者治疗失败的原因是对放射治疗的抵抗。本研究采用生物信息学方法,筛选放疗处理后癌组织中的差异基因(DEGs),寻找与放射敏感性相关的治疗靶点。通过细胞周期调节基因核糖核苷酸还原酶调节亚基M2(RRM2)的表达筛选后,分别采用Lipofectamine 2000和3 Gy放射剂量对细胞进行转染及放疗处理,应用实时荧光定量PCR和蛋白质印迹检测RRM2蛋白在结直肠癌中的表达,采用噻唑兰(MTT)方法测量细胞活力,用流式细胞术测定细胞周期和细胞凋亡。本研究共鉴定出4 269个DEGs,其中RRM2基因差异最显著。与肠上皮细胞FHC比较,RRM2在肿瘤细胞中的表达显著升高(P<0.05)。与对照(NC)组比较,过表达RRM2可促进细胞活力。与3 Gy组比较,过表达RRM2能够延缓放疗对细胞的杀伤作用。与NC组比较,过表达RRM2会导致细胞凋亡率降低,而抑制RRM2表达则导致细胞凋亡率升高。与单独使用si-RRM2或辐照相比,si-RRM2和辐照的组合显示出了更好的效果。在细胞周期的分析中,RRM2的過表达导致S期细胞聚集,而RRM2的敲低导致G1期细胞聚集。此外,辐照可导致显著的G1相停滞,而RRM2的敲低与辐照一起可导致更显著的G1相停滞。这表明,RRM2介导了结直肠癌细胞的细胞周期调节,并通过细胞周期影响结直肠癌的放射敏感性。本研究为结直肠癌联合疗法的开展提供了重要的数据支持。
关键词:RRM2;结直肠癌;细胞周期;放射敏感性;治疗靶点
中图分类号:R735.3 文献标志码:ADOI:10.3969/j.issn.1007-7146.2024.01.008
Mechanism of RRM2 in Radiosensitization of Colorectal Cancer
WANG Jun, LI Liang, LI Jiangang*
(Department of General Surgery, the Second Affiliated Hospital of Xinjiang Medical University, Urumqi 830063, China)
Abstract: Resistance to radiotherapy is the reason for treatment failure in most patients with colorectal cancer. In this study, bioinformatics methods were used to screen differential genes (DEGs) in cancer tissues after radiotherapy, and to find therapeutic targets related to radiosensitivity. After screening the cells by cell cycle mediator ribonucleotide reductase regulatory subunit M2 (RRM2) expression, the cells were transfected with lipofectamine 2000 and irradiated with 3 Gy. Real-time fluorescence quantitative PCR and Western blot were used to detect the expression of RRM2 in colorectal cancer. Cell viability was measured by MTT assay. Flow cytometry was used to determine cell cycle and apoptosis. A total of 4 269 DEGs were identified, and RRM2 was found to be the most significant difference. Compared with intestinal epithelial FHC cells, RRM2 expression level significantly increased in tumor cells (P<0.05). Compared with NC group, RRM2 overexpression promoted cell viability. Compared with the 3 Gy group, RRM2 overexpression could delay the killing effect of radiotherapy on the cells. Compared with NC group, overexpression of RRM2 reduced the apoptosis rate, while inhibition of RRM2 increased the apoptosis rate. The combination of si-RRM2 and irradiation showed better results compared to that with si-RRM2 or irradiation alone. Overexpression of RRM2 caused cell aggregation in S phase, while knockdown of RRM2 caused cell aggregation in G1 phase. In addition, irradiation caused a significant G1 phase arrest, while RRM2 knockdown together with irradiation caused a more significant G1 phase arrest. This suggests that RRM2 mediates cell cycle of CRC cells and affects the radiosensitivity of CRC through cell cycle. This study provides important data support for the development of combined therapy for colorectal cancer.
Key words: RRM2; colorectal cancer; cell cycle; radiosensitivity; therapeutic target
(Acta Laser Biology Sinica, 2024, 33(1): 065-072)
结直肠癌是最常见的癌症之一。目前的研究显示,结直肠癌是癌症死亡的第三大病因[1],其5年和10年的相对生存率分别为65%和58%[2]。结直肠癌最有效的治疗方法是早期直肠结肠切除术,可联合放射治疗、化学治疗和免疫治疗[2-3]。应用放射治疗可能会在手术前缩小肿瘤的体积,并在手术后杀死剩余的肿瘤细胞。然而,放射治疗耐受是影响结直肠癌患者预后的主要因素之一,因此,迫切需要探索新的治疗方法来提高结直肠癌的放射敏感性[4]。目前研究发现,紫杉醇、曲妥珠单抗、西妥昔单抗等靶向治疗联合放射治疗可提高抗肿瘤的疗效[5-6],且介导成纤维细胞生长因子(fibroblast growth factor,FGF)抑制剂(JNJ-42756493)[7]、X-射线修复交叉互补蛋白2 (X-ray repair cross complementing protein 2,XRCC2)[4,8]有效地增强结直肠肿瘤细胞的敏感性,因此,探讨更多的治疗靶点对结直肠癌的放射增敏具有重要的价值。本研究旨在筛选能够应用到联合治疗结直肠癌的潜在靶点。
核糖核苷酸还原酶(ribonucleotide reductase,RNR)是DNA复制和增强细胞活力必不可少的酶,可催化从核苷二磷酸(nucleoside diphosphate,NDP)(RNA构件)到脱氧核糖核苷二磷酸(deoxy-nucleoside diphosphate,dNDP)(DNA构件)的转化。核糖核苷酸还原酶(ribonucleotide reductase,RR)包含两个大亚基细胞周期调节基因核糖核苷酸还原酶调节亚基 M1(ribonucleotide reductase regulatory subunit M1,RRM1)和两个小亚基细胞周期调节基因核糖核苷酸还原酶调节亚基 M2(ribonucleotide reductase regulatory subunit M2,RRM2)[7]。目前研究发现,RRM1的水平在整个细胞周期中是稳定表达的,而RRM2的水平在细胞周期的调节中扮演了重要的角色[8-9]。据报道,RRM2能够促进肿瘤进展[10],且有研究将其作为预测结直肠癌存活率的预后生物标志物[11]。然而,目前尚不清楚RRM2是否介导结直肠癌的放射敏感性。因此,本研究旨在通过生物信息学的方法,探讨影响结直肠癌的放射敏感性的靶点及机制,为结直肠癌治疗及靶向药的开发提供依据。
1 材料与方法
1.1 试验材料
1.1.1 临床材料
GSE15781数据从GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)中下载。10例可切除的直肠腺癌患者均接受了术前放射治疗,该GSE15781样本的基因组用于微阵列分析。
1.1.2 试验细胞
正常人结肠直肠黏膜FHC细胞系、人结肠直肠癌细胞系HT-29、T84、SW480和Caco2均购自BeNa Culture Collection(中国北京)。
1.1.3 主要试剂与仪器
试剂:RPMI-1640基礎培养基、胎牛血清(fatal bovine serun,FBS)(Gibco,美国);Trizol 试剂(Invitrogen,美国);Revert Aid First Strand cDNA合成试剂盒(Thermo Fisher Scientific,美国);SYBR-Green聚合酶链式反应(polymerase chain reaction,PCR)Master Mix试剂盒(Takara,日本);抗RRM2(ab57653)(Abcam,USA);pcDNA 3.0载体(Realgene,中国上海);Lipofectamine 2000(Invitrogen,美国);Annexin V/PI凋亡检测试剂盒(Sigma,St. Louis,MO,USA)。
仪器:直线加速器(NMSR600,东软医疗);FACScan仪器(Becton Dickinson,Mountain View,CA);细胞培养箱(GNP1473,上海一恒);实时荧光定量PCR仪(7500 Fast,ABI,美国)。
1.2 方法
1.2.1 生物信息学分析
收集放射治疗前后的肿瘤组织用于基因组微阵列。使用“limma”R软件包分析差异表达基因(differential expressed genes,DEGs)。通过StarBase平台(http://starbase.sysu.edu.cn/index.php)比较RRM2在结直肠癌样本与正常样本中的差异表达。
1.2.2 细胞培养
所有细胞培养在90% RPMI-1640 + 10% FBS的培养液中,置于37℃、5% CO2的潮湿培养箱中培养。
1.2.3 实时荧光定量PCR
根据制造商的方案,使用TRIzol试剂提取培养细胞的所有RNA。利用Revert Aid First Strand cDNA合成试剂,通过随机引物逆转录1 μg总RNA。使用 SYBR-Green PCR Master Mix试剂盒检测RRM2 mRNA的水平。
试验使用的引物为:5'-AACAGCCTCAAGATCATCAGC-3'(GAPDH的上游引物),5'-GGATGATGTTCTGGAGAGCC-3'(GAPDH的下游引物),5'-GCAGCAAGCG ATGGCATAGT-3'(RRM2的上游引物),5'-GGGCTTCTGTAATCTGAACTTC-3'(RRM2的下游引物)。采用2-ΔΔCT方法测量mRNA的相对水平。
1.2.4 蛋白质印迹
细胞总蛋白在放射免疫沉淀法(radio immunoprecipitation assay,RIPA)缓冲液中裂解,用8%~12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离后转移至硝酸纤维素膜上。转移后,膜在室温下用磷酸盐吐温缓冲液(phosphate buffer solution tween,PBST)中的2%牛血清白蛋白(bovine serum albumin,BSA)封闭1 h。然后,将膜与一抗放置在含有1% BSA的PBST中,在4℃下孵育过夜。最后,将膜与辣根过氧化物酶(horseradish peroxidase,HRP)二抗孵育1 h后,使用增强型化学发光(enhanced chemiluminescence,ECL)蛋白质印迹检测试剂观察条带。
1.2.5 细胞转染
将细胞(每孔5×103个)接种到96孔板上。为了过表达RRM2,本研究先将含有RRM2
(ATGGCTTCGGCAGCAGTNTCTCTTGGGGCTAGGCTAATTGGACAGAACGTGCCGAAGTNGCTGTGCGCGGAGTCGTGA,ATGGCTCGTNGAGACTGGCACAAGACGAAGGAAATCATTCTA AAAGGATCTGATTGGATTCTCGGAGAACTCAAAACTTCTGGTCTCCGTGGAAGA和ATGGCGACCATACAAATTGGTGAAGATACGATCACTGTCCTTCAAATTTCCGAACGATGTCTTCTCTTGTTTCACTTGAGCGTTCGCATTCTGGGCTGA)开放阅读框(open reading frame,ORF)序列的质粒克隆到的pcDNA 3.0载体(Realgene)上,再按照制造商的方法指导进行下一步操作。RRM2的siRNA和scramble阴性对照获自Invitrogen,根据制造商的要求,通过Lipofectamine 2000转染到细胞中。
siRNA的靶序列为:5'-AAACCCGAGGAGAGAUAUUTT-3',5'-GGAGCGAUUUAG CCAAGAATT-3'和5'-GCACUCUAAUGAAGCAAUATT-3'。阴性对照的siRNA为5'-UUCUCCGAACGUUGACACGUTT-3'。本研究共设置了3个处理组,分别为转染阴性对照质粒的对照(normal control,NC)組、RRM2组及si-RRM2组。
1.2.6 细胞放射治疗的处理方法
当细胞生长达到80%时,在直线加速器上以2 Gy/min的剂量率在35 cm × 35 cm的视野中进行6 MV X射线照射。不同放射治疗剂量(0、2、4、6、8、10 Gy)处理后,采用相关方法对细胞的活力、凋亡及周期进行检测。通过设置不同的放疗剂量,筛选出半数抑制浓度(inhibitory concentration 50,IC50)用于后面的放疗处理。之后,本研究设置了6个组别,分别为NC组、si-RRM2组、RRM2组、正常对照3 Gy照射组(3 Gy组)、si-RRM2和3 Gy照射组(si-RRM2+3 Gy组)、RRM2和3 Gy照射组(RRM2+3 Gy组),用于验证RRM2对细胞及放疗处理后的作用
1.2.7 噻唑兰(MTT)法
将细胞以每孔5 × 103个的量在96孔板中培养24 h,转染构建好的载体,然后在正常培养液中培养。接下来,将细胞暴露于0、2、5、10 Gy的不同剂量的电离辐射中。板中的每个孔都补充有噻唑兰(thiazolyl bue,MTT)溶液(5 mg/mL,20 μL)。4 h后,移去培养液,每孔加入100 μL二甲基亚砜(dimethyl sulfoxide,DMSO)。最后,在490 nm处检测细胞吸光度。所有试验至少进行3次重复。
1.2.8 细胞凋亡和细胞周期分析
转染后收集转染细胞,并将它们接种到6孔板上。用冰冷的磷酸盐缓冲溶液(phosphate buffer solution,PBS)洗涤细胞,然后用70%乙醇溶液在4℃下固定过夜。将固定的细胞在PBS中洗涤10 min,在RNase A(1 mg/mL)中于37℃下培养30 min,然后进行PI/RNase染色。在FACScan仪器(Becton Dickinson,Mountain View)下分析细胞的凋亡和周期分布。使用流式细胞术和Annexin V/PI凋亡检测试剂盒检测凋亡细胞的存在。
1.3 统计学方法
采用SPPS软件对本研究的数据进行统计分析,所有计量数据以平均值±标准差(x±s)表示。采用独立样本t检验比较两组差异的显著性。采用单因素方差分析检测两组以上的组间差异性,进一步采用Tukey法进行两两比较。P<0.05为差异有统计学意义。
2 结果与分析
2.1 生物信息学筛选基因结果
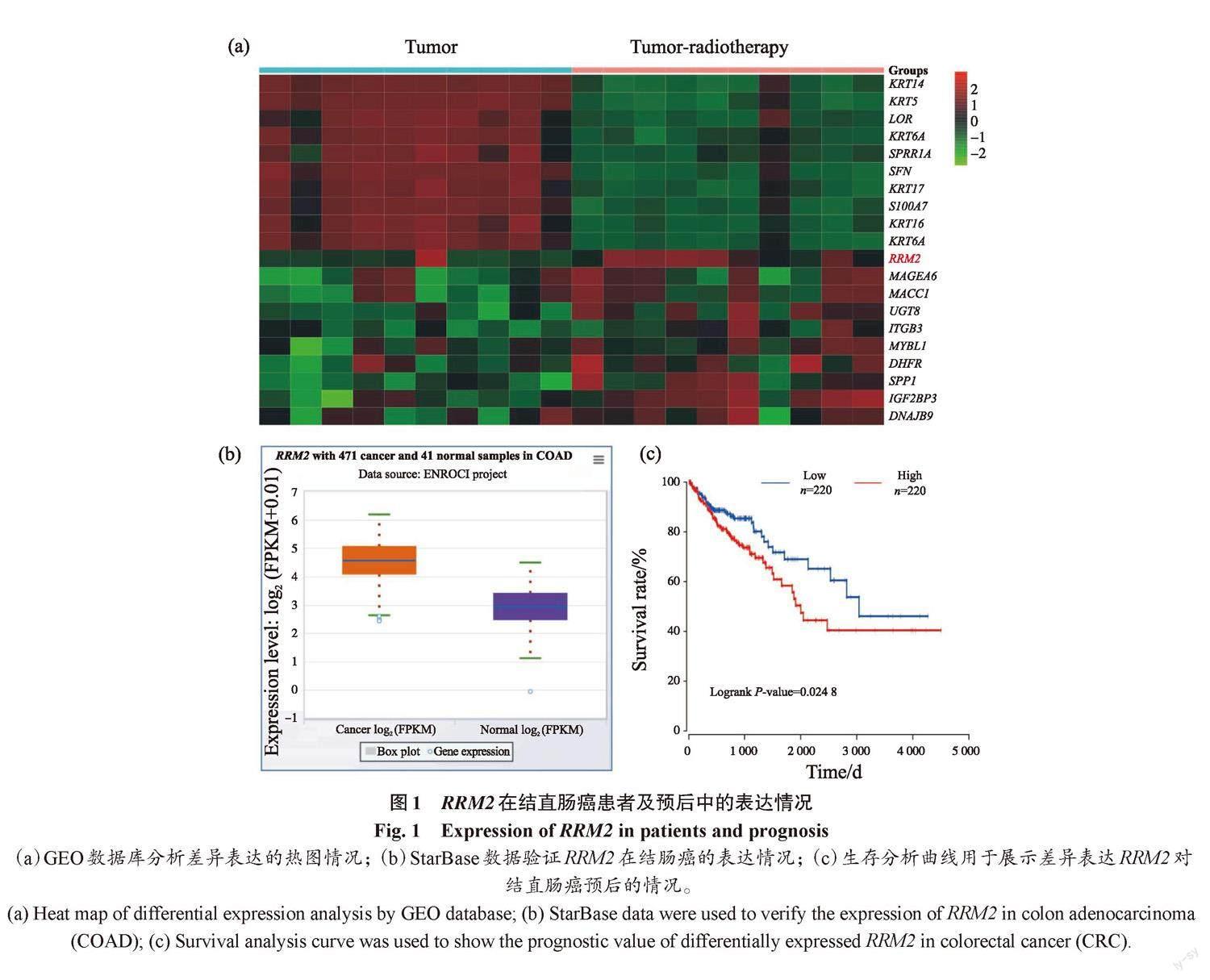
首先,通过GEO数据库发现,RRM2在放射治疗后的患者组织中显著升高,且排在首位(图1a)。进一步通过StarBase平台分析发现,RRM2表达在结肠癌样本中升高(图1b)。预后结果显示,结直肠癌患者的RRM2高表达也与结直肠癌患者的不良预后有关(图1c)。因此,本研究选择RRM2进行后续试验。
2.2 RRM2调节肿瘤细胞活力的情况
RRM2蛋白在结直肠癌细胞系(T84、SW480、HT-29和Caco2)中的表达显著高于正常肠上皮细胞系FHC,在T84和HT-29细胞中的表达比其他两个结直肠癌细胞系更高,差异有统计学意义(F =4.57,P<0.05)(图2)。这说明,RRM2的过表达会导致HT-29和T84细胞系中RRM2的显著上调。在处理后的第4天时,3组细胞中RRM2过表达组的细胞活力(3.87±0.25)显著高于NC组(2.45±0.18)(F=5.74,P<0.05),而si-RRM2组的细胞活力(1.97±0.15)显著低于NC组(2.45±0.18)(F=5.74,P<0.05),且随着处理时间验证,这种趋势并未改变。因此,以下研究应用了T84和HT-29细胞系。
2.3 不同放射劑量对细胞活力的影响
在不同剂量照射下,HT-29细胞和T84细胞的存活率显著下降。在两种细胞系中,经计算,辐射的IC50约为3 Gy。试验使用3 Gy剂量来照射细胞,分组为NC组、si-RRM2组、RRM2组、3 Gy组、si-RRM2+3 Gy组及RRM2+3 Gy组。3 Gy剂量照射HT-29和T84细胞后,RRM2的表达显著下调(P<0.05)。用MTT法测定细胞活性,结果如图3所示,与NC组比较,过表达RRM2可显著促进细胞活力,而抑制RRM2后,细胞活力被抑制。随后,在放疗处理的同时施加RRM2干扰,发现与3 Gy组比较,过表达RRM2能够延缓放疗对细胞的杀伤作用,而抑制RRM2后这种杀伤作用被显著促进。这些结果说明,抑制RRM2的表达与3 Gy辐射后效果相同,都显著抑制了细胞活力,而与NC 组相比,RRM2的过表达和辐照后的细胞活力没有显著差异
(表1、2)。
2.4 细胞的放射敏感性变化
与NC组的细胞凋亡率[(8.53±1.04)%和(8.73±0.95)%]相比,过表达RRM2的肿瘤细胞的细胞凋亡率降低[(5.54±0.87)%和(5.80±0.47)%],而抑制RRM2的表达则会导致细胞凋亡率[(17.58±3.48)和16.70±2.13)%]升高。与单独使用si-RRM2或单独辐照相比,si-RRM2和辐照的组合显示出了更好的效果。在细胞周期分析中,RRM2的过表达会导致S期细胞聚集,而RRM2的敲低会导致G1期细胞聚集[(47.30±6.27)%和46.70±5.14)%]。此外,辐照可导致显著的G1相停滞[(46.48±6.17)%和47.95±7.15)%],而RRM2的敲低与辐照一起可导致更显著的G1相停滞[(71.05±6.04)%和70.98±5.08)%](图4,表3、4)。
3 讨论
放射抗性是接受根治性放射治疗的结直肠癌患者治疗失败和死亡的主要原因。然而,目前对放射治疗耐受的机制尚不明确。本研究应用生物信息学的方式寻找可能在介导结直肠癌放射敏感性中起重要作用的枢纽基因。选择放射治疗前后收集结直肠肿瘤组织的GEO基因组微阵列,鉴定出4 269个DEGs。通过差异倍数及统计学意义的聚类分析后发现,RRM2排在差异首位,可能介导结直肠癌的放射敏感性。
目前研究发现,RRM2是一种预后生物标志物,可促进结直肠癌的侵袭性,并预测较差的存活率[12-13]。本研究发现,与正常结肠直肠细胞系相比,RRM2在结肠直肠癌细胞系中具有显著的高表达。通过对4种结直肠癌细胞的RRM2的表达进行分析,并筛选RRM2高表达的细胞系,进行后续功能学验证,结果发现:RRM2的过表达会导致细胞活力增强,并导致细胞在S期积累;相反,RRM2的敲低会导致细胞活力降低,并导致癌细胞停留在G1期。本研究数据证实,抑制RRM2的表达能够抑制结直肠癌的进展,这一作用可能是由RRM2靶向细胞周期进程所参与调控的。目前已研究了多种调节细胞周期的策略来提高癌细胞的放射敏感性。据报道,金雀异黄素[2]、miR-15家族[14]均能通过靶向细胞周期来提高肿瘤的放射敏感性。本文对辐射与RRM2的调节相结合进行了研究,以了解潜在的联合治疗机制。与仅抑制RRM2或单独放射治疗辐照处理相比,通过辐射抑制RRM2可对G1期细胞活力和细胞周期聚集的抑制产生更显著的影响。由于细胞在G2/M期对辐射最敏感,且G1期比S期更敏感[15-19],可以推断,RRM2对结直肠癌细胞的放射增敏作用是由于细胞停留在G1期而不是S期引起的,RRM2可能是结直肠癌放射增敏的潜在治疗靶点。此外,本研究发现,抑制RRM2和辐照联合处理能够显著增强这一作用。这一结果说明,RRM2可能是其发挥作用的核心分子,这也进一步验证了我们的猜想。然而,虽然本研究在体外试验中验证了RRM2的作用,但仍缺少必要的体内及临床样本数据,这将是未来深入研究的主要方向之一。
本研究证实了RRM2在结直肠癌细胞中的高表达并参与了癌细胞对辐射的反应,发现RRM2介导了结直肠癌细胞的细胞周期调节,结合放射可产生更显著的作用。总之,该研究发现了一种用于结直肠癌放射治疗的新型潜在靶标RRM2,并鼓励进一步研究以了解其调控机制。
参考文献(References):
[1] 陈安祺, 原娜, 赵威威, 等. 高迁移率族蛋白B-1对结直肠癌放疗敏感性的调控作用机制研究进展[J]. 山东医药, 2022, 62(12): 107-111.
CHEN Anqi, YUAN Na, ZHAO Weiwei, et al. Research progress in the mechanism of high-mobility group protein B-1 regulating the radiosensitivity of colorectal cancer[J]. Shandong Pharmaceutical, 2022, 62(12): 107-111.
[2] JI D B, ZHAN T C, LI M, et al. Enhancement of sensitivity to chemo/radiation therapy by using miR-15b against DCLK1 in colorectal cancer[J]. Stem Cell Reports, 2018, 11(6): 1506-1522.
[3] SHI L P, GUO H L, SU Y B, et al. MicroRNA-149 sensitizes colorectal cancer to radiotherapy by downregulating human epididymis protein 4[J]. American Journal of Cancer Research, 2018, 8(1): 30-38.
[4] CHEN L, ZHU Z, GAO W, et al. Systemic analysis of different colorectal cancer cell lines and TCGA datasets identified IGF-1R/EGFR-PPAR-CASPASE axis as important indicator for radiotherapy sensitivity[J]. Gene, 2017, 627: 484-490.
[5] DUONG J, STEWARD-LORD A, NARIYANGADU P, et al. PH-0494 treatment outcomes of stereotactic ablative radiotherapy on oligometastases from colorectal cancer[J]. Radiotherapy and Oncology, 2021, 161(S1): 20210071.
[6] FLAMARIQUE S, CAMPO M, ASIN G, et al. Stereotactic body radiation therapy for liver metastasis from colorectal cancer: size matters[J]. Clinical & Translational Oncology, 2020, 22(12): 2350-2356.
[7] FU K, ZHANG K, ZHANG X Y. LncRNA HOTAIR facilitates proliferation and represses apoptosis of retinoblastoma cells through the miR-20b-5p/RRM2/PI3K/AKT axis[J]. Orphanet Journal of Rare Diseases, 2022, 17(1): 119.
[8] SHAN J L, WANG Z, MO Q P, et al. Ribonucleotide reductase M2 subunit silencing suppresses tumorigenesis in pancreatic cancer via inactivation of PI3K/AKT/mTOR pathway[J]. Pancreatology, 2022, 22(3): 401-413.
[9] TANG B F, XU W T, WANG Y J, et al. Identification of critical ferroptosis regulators in lung adenocarcinoma that RRM2 facilitates tumor immune infiltration by inhibiting ferroptotic death[J]. Clinical Immunology, 2021, 232: 108872.
[10] XIONG W, ZHANG B, YU H X, et al. RRM2 regulates sensitivity to sunitinib and PD-1 blockade in renal cancer by stabilizing ANXA1 and activating the AKT pathway[J]. Advanced Science (Weinheim, Baden-Wurttemberg, Germany), 2021, 8(18): 2100881.
[11] JIANG X P, LI Y Y, ZHANG N N, et al. RRM2 silencing suppresses malignant phenotype and enhances radiosensitivity via activating cGAS/STING signaling pathway in lung adenocarcinoma[J]. Cell & Bioscience, 2021, 11(1): 74.
[12] LIU Q, GUO L J, QI H Y, et al. A MYBL2 complex for RRM2 transactivation and the synthetic effect of MYBL2 knockdown with WEE1 inhibition against colorectal cancer[J]. Cell Death & Disease, 2021, 12(7): 683.
[13] CHANG C C, LIN C C, WANG C H, et al. miR-211 regulates the expression of RRM2 in tumoral metastasis and recurrence in colorectal cancer patients with a k-ras gene mutation[J]. Oncology Letters, 2018, 15(5): 8107-8117.
[14] MA J J, ZHANG F, SUN P. miR-140-3p impedes the proliferation of human cervical cancer cells by targeting RRM2 to induce cell-cycle arrest and early apoptosis[J]. Bioorganic & Medicinal Chemistry, 2019, 28(3): 115283.
[15] GROLMUSZ V K, KARASZI K, MICSIK T, et al. Cell cycle dependent RRM2 may serve as proliferation marker and pharmaceutical target in adrenocortical cancer[J]. American Journal of Cancer Research, 2016, 6(9): 2041-2053.
[16] 余曉晟, 张永海, 刘金昊, 等. 齐墩果酸联合放疗对HepG2细胞周期和凋亡作用的体外研究[J]. 北华大学学报 (自然科学版), 2018, 19(4): 461-464.
YU Xiaosheng, ZHANG Yonghai, LIU Jinhao, et al. In vitro study of oleanolic acid combined with radiotherapy on HepG2 cell cycle and apoptosis[J]. Journal of Beihua University (Natural Science Edition), 2018, 19(4): 461-464.
[17] 杨甜, 吴八路, 江宏强, 等. MAPK14与胃癌放疗抵抗机制实验研究[J]. 中华肿瘤防治杂志, 2019, 26(21): 1599-1605.
YANG Tian, WU Balu, JIANG Hongqiang, et al. Experimental study on the mechanism of MAPK14 and radiotherapy resistance in gastric cancer[J]. Chinese Journal of Cancer Prevention and Treatment, 2019, 26(21): 1599-1605.
[18] ZHAN Y, JIANG L, JIN X, et al. Inhibiting RRM2 to enhance the anticancer activity of chemotherapy[J]. Biomed Pharmacother, 2021, 133(23): 110996.
[19] JIANG X, LI Y, ZHANG N, et al. RRM2 silencing suppresses malignant phenotype and enhances radiosensitivity via activating cGAS/STING signaling pathway in lung adenocarcinoma[J]. Cell and Bioscience, 2021, 11(1): 74.
