不同体色锦鲤体色观察、基因表达以及过表达pnp4a对体色发育的影响
2024-04-13黄靖王海涛王梅符文彭亮跃肖亚梅刘锦辉
黄靖 王海涛 王梅 符文 彭亮跃 肖亚梅 刘锦辉


收稿日期:2023-07-24;修回日期:2023-10-02。
基金项目:国家自然科学基金项目(31802284)。
作者简介:#并列第一作者。黄靖,硕士研究生;王海涛,硕士研究生。
* 通信作者:刘锦辉,副教授,主要从事鱼类遗传发育的研究。E-mail: 13099125@qq.com。
摘 要:锦鲤色彩鲜艳,游姿飘逸,观赏价值高,被称作“会游泳的艺术品”。鱼类体色主要是由皮肤或鳞片上的色素细胞的种类和分布决定的。本文对黑色、白色、黄色和红色4种不同体色锦鲤的鳞片和皮肤的色素细胞组成、分布及形态结构等进行了比较观察,结果显示,鳞片和皮肤的色素细胞组成一致,4种锦鲤均存在着丰富的虹彩细胞,在黑色锦鲤中还观察到了黑色素细胞,黄色锦鲤和红色锦鲤还分布着黄/红色素细胞,在白色锦鲤中只观察到虹彩细胞。利用透射显微镜观察了4种体色锦鲤的虹彩细胞的超微结构,虹彩细胞主要有3种不同形态:梭形、短棒状和空泡状;采用实时荧光定量PCR检测了8个虹彩细胞发育相关基因在4种不同体色锦鲤皮肤中的表达情况,结果显示,8个虹彩细胞发育相关基因在不同体色锦鲤皮肤中均有表达,但表达存在差异,其中alk、pka、sox10、pax3、foxd3和pnp4a基因在红色和黄色锦鲤中相对表达量较高,ltk和alx4a基因在白色锦鲤中相对表达量最高。为进一步证实pnp4a基因在虹彩细胞中的作用,构建了pnp4a過表达重组质粒,并将其显微注射至AB斑马鱼受精卵中,过表达斑马鱼中虹彩细胞明显多于对照组,进一步证实了pnp4a 在鱼类体色形成尤其是在虹彩细胞发生方面发挥着重要作用。
关键词:锦鲤;虹彩细胞;pnp4a;体色发育;基因表达
中图分类号:Q78 文献标志码:ADOI:10.3969/j.issn.1007-7146.2024.01.004
Observation of Body Colour and Gene Expression in Koi of Different Body Colours, and the Effects of Overexpression of pnp4a on Body Colour Development
HUANG Jing#, WANG Haitao#, WANG Mei, FU Wen, PENG Liangyue, XIAO Yamei, LIU Jinhui*
(State Key Laboratory of Developmental Biology of Freshwater Fish, College of Life Science, Hunan Normal University, Changsha 410081, China)
Abstract: Koi is a brightly coloured, elegant fish with high ornamental value, and is known as a “swimming work of art”. Fish body colour is mainly determined by the type and distribution of pigment cells on the skin or scales. In this paper, the composition, distribution and morphology of pigment cells in the scales and skin of four different body colours, namely, black, white, yellow and red koi, were compared. The composition of pigment cells in the scales and skin was consistent, and rich iridescent cells were present in all four koi, with melanophores in black koi, and xanthophores and erythrophores in yellow and red koi. Only iridophores were observed in white koi. The ultrastructure of iridophores in all four koi colours was observed by transmission microscopy, and the iridophores mainly had three different morphologies: pike-shaped, short rod-shaped and vacuolated. Real-time fluorescence quantitative PCR was used to detect the expression of eight iridocyte development-related genes in the skin of four different body colors of koi carp, the results showed that eight genes related to iridophores development were expressed in the skin of different body colours, whereas there were differences in expression, among which the relative expression of alk, pka, sox10, pax3, foxd3 and pnp4a genes was higher in red and yellow koi, while the relative expression of ltk and alx4a genes was the highest in white koi. In order to further confirm the role of the pnp4a genes in iridophores development, the recombinant plasmid of overexpression of pnp4a gene was constructed, and was microinjected into the fertilized eggs of AB zebrafish. In order to further confirm the role of pnp4a gene in fish body colour formation, especially in iridophores, we constructed a pnp4a overexpression recombinant plasmid and microinjected it into the fertilized eggs of zebrafish (AB).
Key words: koi; iridophores; pnp4a; body color development; gene expression
(Acta Laser Biology Sinica, 2024, 33(1): 031-039)
体色是一个重要的生物学性状,在动物的伪装、生存、求偶、繁衍等生命活动中起着重要的作用[1]。鱼类体色主要由皮肤色素细胞随着生长发育不断迁移堆积形成。目前已知的色素细胞类型主要有4种,分别是黑色素细胞、黄色素细胞、红色素细胞和虹彩细胞[2]。鱼类体色着色类型主要有色素色和结构色2种,以及二者的结合[3]。色素色由色素细胞内色素颗粒对特定波长的入射光选择性吸收所形成,如黑色素细胞内的黑色素、黄色素与红色素细胞内的类胡萝卜素[4]。结构色则是由胞内物对光线干涉和散射所形成,如虹彩细胞内鸟嘌呤晶体使鱼体呈现银色、蓝色或金属色泽[5-6]。鱼类体色多样,构成体色图案的色素细胞的种类、分布以及色素相关基团的形态和密度变化均会影响鱼类体色的形成[7-9]。目前,关于黑色素细胞、黄色素细胞和红色素细胞的相关研究较多,而虹彩细胞的相关研究相对较少。
虹彩细胞是硬骨鱼中常见的色素细胞之一,主要分布在皮肤和眼睛中[11]。虹彩细胞的化学本质是嘌呤,其着色相关的细胞器为反射血小板[12],是一种含有鸟嘌呤的晶体结构,其形成与高尔基体的双层膜囊泡有关[13],在各种脊椎动物中产生明亮的反射结构颜色[14]。Morrison[15]认为,虹彩细胞能够通过光学现象决定其呈现的颜色,而反射血小板的宽度和血小板层之间的细胞质间距决定虹彩细胞的最大反射光的波长。虹彩细胞的形成与分化受到多种基因以及遗传因素的调控。cAMP信号传导通路的效应激酶 (cAMP dependent protein kinase,PKA) [16]能够参与色素细胞的分化,H89抑制剂对PKA的抑制促使虹彩细胞数量增加,表明PKA对虹彩细胞的形成和分化具有一定的抑制作用[17]。间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)和相关的白细胞酪氨酸激酶(leukocyte receptor tyrosine kinase,LTK)通过参与内神经嵴的调节来影响斑马鱼体色模式的发生,两者的过表达均会促使虹彩细胞的形成和增加,其中ltk基因对虹彩发育起着主导作用[18-19]。对墨鱼(Sepiella maindroni)的研究验证了alx4a基因能够调控虹彩细胞的分化,在鸟嘌呤合成途径中具有潜在的调节作用[20]。Petratou等[21]通过基因敲除试验验证了缺失sox10的斑马鱼虹彩色素细胞出现缺失,虹彩色素产生失败,证明sox10与pax3在虹彩色素细胞的分化过程中起关键作用。pnp4a被认为是虹彩细胞早期的标记基因[22],是早期虹彩细胞表达所必须的。虹彩细胞的形成促进和维持了黑色素细胞以及黄色素细胞的形成,不同色素细胞共同调控体色图案的生成[23]。
锦鲤(Cyprinus carpio var. koi),属于辐鳍鱼亚纲(Actinopterygii),鲤形目 (Cypriniformes),鲤科(Cyprinidae),鲤属(Cyprinus),是风靡当今世界的一种高档观赏鱼,有“水中活寶石”的美称[10]。锦鲤体色艳丽且复杂多变,体表分布着丰富的虹彩细胞,是研究虹彩细胞的绝佳对象之一。锦鲤按照颜色斑纹来分类,主要有单色类、双色类和三色类。目前的研究对象主要集中在双色和三色锦鲤中,而关于单色锦鲤的研究相对缺乏。
本论文以4种不同单色(黑色、白色、红色、黄色)的锦鲤为试验材料,对这4种锦鲤的皮肤和鳞片色素细胞的组成、结构及分布等特征进行比较观察,并利用透射电镜对锦鲤的虹彩细胞的超微结构进行了分类总结,检测了8个虹彩细胞发育相关基因在4种不同体色锦鲤皮肤中的表达,研究了pnp4a基因在鱼类体色发育中的作用。相关研究成果为观赏鱼类的分子遗传选育和品质改良提供了重要的理论指导。
1 材料与方法
1.1 试验材料
试验所用野生型AB斑马鱼(Danio rerio)来自中国科学院水生生物研究所国家斑马鱼资源中心,所用4种不同体色的锦鲤来自长沙花鸟市场,4种不同体色锦鲤如图1所示。
图1 4种不同体色锦鲤
Fig. 1 Four different body colors of koi
(a)白色锦鲤;(b)黄色锦鲤;(c)黑色锦鲤;(d)红色锦鲤。
(a) White koi; (b) Yellow koi; (c) Black koi; (d) Red koi.
1.2 4种不同体色锦鲤组织学观察
将4种不同体色锦鲤用MS-222(100 mg/L)麻醉后,使用经75%酒精消毒后的剪刀和镊子采集颈背部鳞片和皮肤。因其鳞片较薄且透明,在经过生理盐水清洗干净后,可置于载玻片上制成临时玻片,在显微镜下观察并对色素细胞的类型、形态和分布情况进行记录。采集的皮肤组织经生理盐水清洗后,一部分切成4 mm×4 mm的组织块。组织块经聚乙二醇和聚乙烯醇的水溶性混合物包埋后,利用冰冻切片机进行切片(表皮层),切片厚度为10 μm,中性树胶封片,使用显微镜观察并对色素细胞的形态和分布进行记录。另一部分皮肤组织尽量剔除肌肉,取样体积小于1 mm3,快速投入2.5%戊二醛中,4℃固定10 h以上。0.2 mol/L的磷酸缓冲盐溶液(phosphate buffered saline,PBS)清洗3次,每次10 min。1%饿酸固定液固定2 h,0.2 mol/L的PBS清洗3次,每次10 min。经10%至100%丙酮梯度脱水,环氧丙烷置换10 min后,环氧树脂Epon812浸透包埋。EMUC6超薄切片机切片,醋酸双氧铀染色2 h过夜。利用透射电子显微镜(HT7800,日本)观察并拍照。
1.3 总RNA的提取及反转录PCR反应
用总RNA试剂盒(OMEGA,美国)提取锦鲤皮肤组织的mRNA, PrimerScript RT Reagent Kit (Takara公司)反转录合成cDNA后,进行alk(XM_042742958.1)、pka(XM_042718134.1)、sox10(XM_042719427.1)、pax3(XM_019072770.2)、ltk(XM_042774590.1)、alx4a(XM_019090555.2)、foxd3(XM_042758374.1)和pnp4a(XM_042734177.1)基因的mRNA水平检测,以β-actin为内参,用GraphPad Prism软件分析这些体色相关基因在不同体色锦鲤皮肤中的表达情况,进行3次以上重复试验。引物序列参照表1。
1.4 pnp4a基因的过表达
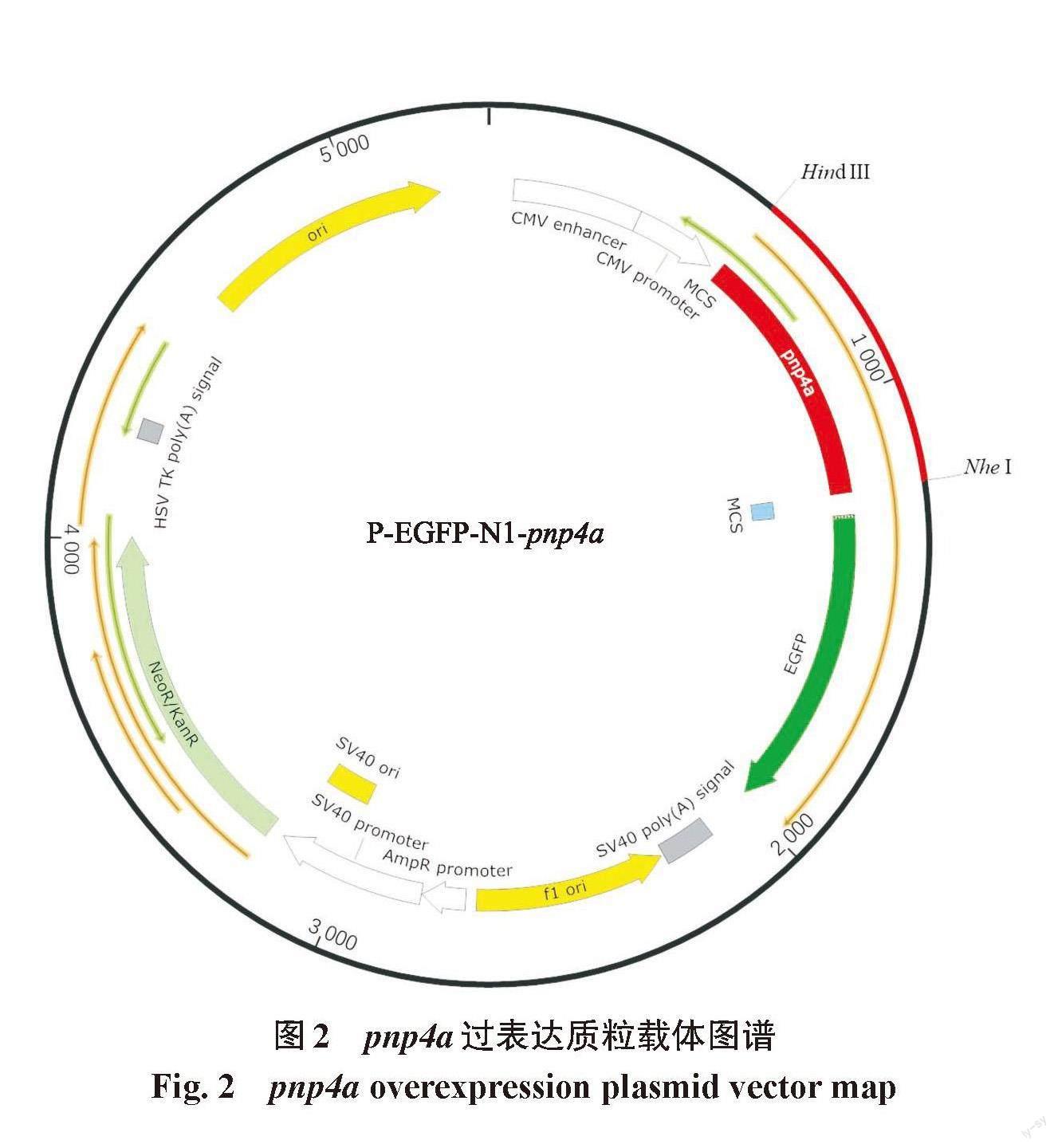
首先,使用HiPure Total RNA Midi Kit RNA提取试剂盒(Magen公司,R4124)进行斑马鱼胚胎RNA的提取,再用反转录试剂盒(TAKARA公司,RR047A)进行反转录得到斑马鱼cDNA。根据NCBI基因库中上传的斑马鱼pnp4a基因序列(NM_001002102.1)筛选得到其蛋白编码区(coding sequence,CDS),比较过表达所选择的质粒载体与基因序列,筛选得到Hind III与Nhe I双酶切位点。使用引物设计原则在CDS区上下游两端设计带有人工添加酶切位点的引物。以反转录得到的斑马鱼cDNA为模板,加入设计的引物,进行PCR扩增,得到目的片段。将其与P-EGFP-N1质粒载体进行连接得到过表达重组质粒(图2)。在显微注射仪上将所构建的过表达质粒显微注射至AB斑马鱼胚胎中,显微注射的过表达质粒的质量浓度控制在100~200 ng/μL,并且注射P-EGFP-N1质粒载体作为对照。然后,在荧光显微镜下观察质粒的表达情况、用总RNA试剂盒(OMEGA,美国)提取对照组和试验组斑马鱼的mRNA,PrimerScript RT Reagent Kit(Takara公司)反转录合成cDNA后,进行pnp4a基因的mRNA水平检测,β-actin为对照,用GraphPad Prism软件分析该基因在不同时期的表达情况,进行3次以上重复试验。
图2 pnp4a过表达质粒载体图谱
Fig. 2 pnp4a overexpression plasmid vector map
2 结果与分析
2.1 4种不同体色锦鲤色素细胞的显微观察
鳞片显微观察显示:4种体色锦鲤鳞片上均分布有大量排列紧密的梭形虹彩细胞,白色锦鲤鳞片(图3a~3c)上无其他色素细胞类型;黄色锦鲤鳞片(图3d~3f)上还分布有黄色素细胞,且黄色素细胞分布十分广泛;黑色锦鲤鳞片(图3g~3i)上还分布有黑色素细胞和黄色素细胞,黑色素细胞分布在鳞片基区,排列紧密呈现高度分化的团状,有少量黄色素细胞分布在黑色素细胞周围;红色锦鲤鳞片(图3j~3l)上还分布有红色素细胞,红色素细胞呈现高度聚集的滴状且分布广泛。在鳞片的不同区域上,色素细胞的分布和种类同样具有差异。同时,不同区域上的鳞片大小、色素细胞分布、色素细胞形态、色素细胞大小和数量也具有差异。
皮肤冰冻切片观察显示:白色锦鲤皮肤表皮层无色素细胞分布,色素层仅分布虹彩细胞(图4a~4c);黄色锦鲤表皮层仅分布黄色素细胞,色素层连续分布有大量虹彩细胞,表皮层和色素层均无黑色素细胞存在(图4d~4f);黑色锦鲤表皮层和色素层均分布有虹彩细胞、黄色素细胞和黑色素细胞(图4g~4i);红色锦鲤表皮层仅分布有大量红色素细胞,色素层间断分布虹彩细胞和红黄色素细胞,表皮层和色素层均无黑色素细胞存在(图4j~4l)。
2.2 4种不同体色锦鲤虹彩细胞的超微结构观察
通过透射电子显微镜观察4种不同体色锦鲤皮肤,在电镜下可观察到3种类型虹彩细胞反光板结构:第一类为呈梭形的虹彩细胞(图5a~5c);第二类为呈短棒状的虹彩细胞(图5d~5f);第三类为呈空泡状的虹彩细胞(图5g~5i)。虹彩细胞反光板均呈银白色,反光小板平行排列或者紧密相邻,长短大小不一。同一个体不同的组织部位的虹彩细胞类型存在差异。本文透射电镜以背部皮肤为研究对象,4种不同体色的锦鲤在背部区域并不是都存在这3种类型的虹彩细胞。其中黑色锦鲤中空泡状虹彩细胞几乎无分布,梭形虹彩细胞在白色锦鲤中分布最多,红色和黄色锦鲤中均分布有这3种类型的虹彩细胞。
2.3 虹彩细胞发育相关基因在4种不同体色锦鲤皮肤中的表达分析
运用反转录PCR检测了alk、pka、sox10、pax3、foxd3、pnp4a、ltk和alx4a这8个虹彩细胞发育相关的基因在不同体色锦鲤皮肤中的表达情况(图6)。8个基因在4个不同体色锦鲤中均有表达,但表达情况存在差异:alk、pka、sox10、pax3、foxd3和pnp4a基因在红色和黄色锦鲤中相对表达量较高,在黑色和白色锦鲤中相对表达量较少;ltk和alx4a基因在白色锦鲤中相对表达量最高,在黑色、黄色和红色锦鲤中相对表达量较少。
2.4 AB斑马鱼pnp4a基因的过表达
为进一步证实pnp4a基因在虹彩细胞中的作用,利用P-EGFP-N1质粒构建了pnp4a基因过表达质粒载体(图2)。采用显微注射技术,并通过体式荧光显微镜进行荧光筛選,获得了具有荧光的阳性胚胎(图7a~7c),绿色荧光持续10 d后消失,注射情况如表2所示。显微镜下观察并分析表型特征,受精后第11天开始,眼部虹膜发育,虹彩细胞才开始形成。第15天,腹部虹彩细胞分化明显,在不同背景下观察,发现试验组(图7f~7g)斑马鱼虹彩细胞远多于对照组(图7d~7e)。利用实时荧光定量PCR分析比较了pnp4a基因在试验组和对照组中不同时期的相对表达量(图7h),结果显示,试验组pnp4a基因的表达量远远高于对照组。
3 討论
鱼类色素细胞种类丰富,体色模式具有多样性。鳞片为皮肤组织的衍生物,色素细胞多分布在真皮层、鳞片和鱼鳍上。黑色素细胞、红色素细胞、黄色素细胞和虹彩细胞是鱼类中4种常见的色素细胞[24]。色素体可以选择性地吸收特定波长光,同时反射其他波长的光,并与色素细胞相互作用,形成不同的体色图案[25]。除此之外,体色图案也受到遗传因素、环境因素和食物营养成分等多种因素的影响。
锦鲤作为一种风靡全球的高档观赏鱼类,现如今已经成为众多学者的研究对象。结合鳞片显微观察、皮肤冰冻切片观察和皮肤透射电镜观察的结果,本研究对4种不同体色锦鲤的色素细胞种类、分布和形态分布特征进行了观察总结。我们发现在白色、黄色、黑色和红色锦鲤鳞片上均分布着大量且致密的虹彩细胞,不同体色锦鲤在黑色素细胞、黄色素细胞和红色素细胞的分布上存在显著差异,其中黑色素细胞仅在黑色锦鲤上存在,白色锦鲤未观察到其他色素细胞类型,黄色素细胞和红色素细胞在黄色和红色锦鲤上广泛分布。透射电镜结果显示,4种体色锦鲤中存在3种类型的虹彩细胞:梭形、短棒状和空泡状。周康奇等[26]在鹦鹉鱼鳞片超微结构中观察到了棍棒状和杆状的虹彩细胞,同我们观察到的短棒状和梭形结果一致,此外,我们还发现了呈现空泡状的虹彩细胞。不同的形态和分布特征同样也是虹彩细胞呈色的重要影响因素之一。壁虎能够发出绿色的荧光,而导致这种现象的原因是其分布的两种类型的虹彩细胞,荧光虹膜体和基底型非荧光虹膜体,后者可能起到镜子的作用,增强荧光[17];在巨型蛤蚌中虹膜细胞直径和层间距的特定组合是其产生特定颜色的关键[27]。
为进一步探究虹彩细胞,本研究选取了8个与虹彩细胞相关的基因(alk、pka、foxd3、sox10、pax3、alx4a、ltk和pnp4a),对它们在不同体色锦鲤皮肤中的mRNA相对表达水平进行检测。alk基因通过参与内神经脊的调节来影响斑马鱼体色模式的发生,过表达alk基因将会促使虹彩细胞的形成和数量增加[18-19]。pka被cAMP激活后,通过磷酸化蛋白质参与到细胞分化、生长等各种生命活动中,包括色素细胞内的色素小体细胞器的运输[28]。foxd3属于叉头类转录因子,在迁移前的神经嵴细胞中表达,其对虹彩细胞的分化是必需的。缺失foxd3的斑马鱼部分神经嵴衍生物出现了分化缺陷,包括软骨细胞、外周神经元细胞、胶质细胞以及虹彩细胞,其中,虹彩细胞大量减少,而黑色素细胞和黄色素细胞基本不受影响[29]。alk、pka和foxd3基因在黄色和红色锦鲤皮肤中相对表达量较高,推测二者可能参与红黄色素细胞的发育。sox10在早期神经嵴细胞发育和分化中具有重要的作用,缺少sox10使得快速迁徙的神经嵴细胞未达到成熟阶段就会死亡[30]。sox10基因对斑马鱼黑色素细胞、黄色素细胞和虹彩细胞的发育都是必需的,推测sox10在黄色和红色锦鲤中相对表达量高,显示了其对红黄色素细胞的发育具有重要作用。pax3在神经嵴发育过程中起着重要作用[31],是斑马鱼神经嵴细胞分化为黄色素细胞和肠神经元所必须的。pax3在黄色和红色锦鲤中相对表达量较高,进一步佐证了其在黄色素细胞发育中的重要作用。alx4a编码一种转录因子,在虹彩细胞中高度富集。在斑马鱼中敲除alx4a 基因,受精后4 h时发现突变体仅在眼睛处观察到虹彩细胞,表明虹彩细胞不能完成分化[32]。ltk编码属于受体酪氨酸激酶类的白细胞酪氨酸激酶[33]。在斑马鱼中,ltk在迁移前的神经嵴细胞中表达,随后在虹彩细胞谱系中持续稳定表达。alx4a和lkt在白色锦鲤皮肤中显著表达,这与白色皮肤中虹彩细胞数量多的现象具有一致性,进一步证明了lkt在虹彩细胞发育中的作用。
pnp4a基因是虹彩细胞早期发育的标记基因。范云鹏等[34]发现,pnp4a基因在花鲫和红鲫各个组织以及发育的各个时期中均有表达。Kuriyama等[35]研究发现,pnp4a基因在青鳉中被敲除后,导致虹彩细胞色素沉着减少。本研究观察阳性胚胎的体色发育过程,发现其发育至第15天时,试验组虹彩细胞显著多于对照组。荧光定量结果显示,pnp4a基因在试验组斑马鱼中各时期的表达量显著高于对照组,说明pnp4a是虹彩细胞形成和发育的重要调控基因。以上研究进一步证实,pnp4a基因对于虹彩细胞形成具有重要作用。不同的色素细胞类型和分布特征是导致锦鲤呈现不同体色的重要原因,与此同时,不同的基因表达水平也和体色息息相关,以上因素共同作用、相互影响,最终使得锦鲤体色丰富多彩。本研究结果为观赏鱼类的体色改良研究积累了基础资料。
参考文献(References):
[1] 王梅, 张永勤, 黄靖, 等. 红斑马鱼体色观察及敲除mitfa基因对其体色发育的影响[J]. 激光生物学报, 2022, 31(1): 19-26.
WANG Mei, ZHANG Yongqin, HUANG Jing, et al. Observation of red zebrafish body color and the effect of knocking out mitfa gene on its body color development[J]. Acta Laser Biology Sinica, 2022, 31(1): 19-26.
[2] 张广婧, 王梅, 刘利生, 等. Casper斑马鱼体色观察及过表达mitfa对其体色发育的影响[J]. 激光生物学报, 2021, 30(5): 429-434.
ZHANG Guangjing, WANG Mei, LIU Lisheng, et al. Observation of the body color zebrafish casper mutant and the effect of overexpression of mitfa on its body color[J]. Acta Laser Biology Sinica, 2021, 30(5): 429-434.
[3] SCHARTL M, LARUE L, GODA M, et al. What is a vertebrate pigment cell[J]. Pigment Cell & Melanoma Research, 2015, 29(1): 8-14.
[4] LUO M K, LU G Q, YIN H R, et al. Fish pigmentation and coloration: molecular mechanisms and aquaculture perspectives[J]. Reviews in Aquaculture, 2021, 13(4): 2395-2412.
[5] GUR D, PALMER B A, LESHEM B, et al. The mechanism of color change in the neon tetra fish: a light-induced tunable photonic crystal array[J]. Angewandte Chemie International Edition, 2015, 54(42): 12426-12430.
[6] SALIS P, LORIN T, LAUDET V, et al. Magic traits in magic fish: understanding color pattern evolution using reef fish[J]. Trends in Genetics, 2019, 35(4): 265-278.
[7] SUGIMOTO M. Morphological color changes in fish: regulation of pigment cell density and morphology[J]. Microscopy Research & Technique, 2002, 58(6): 496-503.
[8] SALIS P, LORIN T, LEWIS V, et al. Developmental and comparative transcriptomic identification of iridophore contribution to white barring in clownfish[J]. Pigment Cell & Melanoma Research, 2019, 32(3): 391-402.
[9] SINGH A P, DINWIDDIE A, MAHALWAR P, et al. Pigment cell progenitors in zebrafish remain multipotent through metamorphosis[J]. Developmental Cell, 2016, 38(3): 316-330.
[10] 李瀟轩, 郑端端, 罗明坤, 等. 不同体色锦鲤和“福瑞鲤2号”mtDNA D-loop序列遗传变异分析[J]. 上海海洋大学学报, 2023, 32(2): 266-274.
LI Xiaoxuan, ZHENG Ruirui, LUO Mingkun, et al. Genetic variation in mtDNA D-loop sequences of koi of different body colors and “Furui carp No.2”[J]. Journal of Shanghai Ocean University, 2023, 32(2): 266-274.
[11] PRTZEL D, HE? M, SCHWAGER M, et al. Neon-green fluorescence in the desert gecko pachydactylus rangei caused by iridophores[J]. Scientific Reports, 2023, 11(1): 297.
[12] TAKEUCHI I K. Electron microscopy of two types of reflecting chromatophores (iridophores and leucophores) in the guppy, lebistes reticulatus peters[J]. Cell & Tissue Research, 1976, 173(1): 17-27.
[13] WRIGHT G M, MCBURNEY K M. Changes in the ventral dermis and development of iridophores in the anadromous sea lamprey, petromyzon marinus, during metamorphosis: an ultrastructural study[J]. Histology & Histopathology, 1992, 7(2): 237-250.
[14] GUNDERSEN R E, RIVERA E R. An ultrastructural study of the development of the dermal iridophores and structural pigmentation in poecilia reticulata (peters)[J]. Journal of Morphology, 1982, 172(3): 349-359.
[15] MORRISON R L. A transmission electron microscopic (TEM) method for determining structural colors reflected by lizard iridophores[J]. Pigment Cell & Melanoma Research, 2010, 8(1): 28-36.
[16] HAIDAR M, RAMDANI G, KENNEDY E J, et al. PKA and apicomplexan parasite diseases[J]. Hormone & Metabolic Research, 2016, 49(4): 296-300.
[17] COOPER C, ERICKSON S, YIN S, et al. Protein kinase a signaling inhibits iridophore differentiation in zebrafish[J]. Journal of Developmental Biology, 2018, 6(4): 23.
[18] FADEEV A, MENDOZA G P, IRION U, et al. Alkals are in vivo ligands for alk family receptor tyrosine kinases in the neural crest and derived cells[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(4): 630-638.
[19] MO E S, CHENG Q N, RESHETNYAK A V, et al. Alk and Ltk ligands are essential for iridophore development in zebrafish mediated by the receptor tyrosine kinase Ltk[J]. Proceedings of the National Academy of Sciences, 2017, 114(45): 12027-12032.
[20] JANG H S, CHEN Y, GE J, et al. Epigenetic dynamics shaping melanophore and iridophore cell fate in zebrafish[J]. Genome Biology, 2021, 22(1): 282.
[21] PETRATOU K, SUBKHANKULOVA T, LISTER J A, et al. A systems biology approach uncovers the core gene regulatory network governing iridophore fate choice from the neural crest[J]. PLoS Genetics, 2018, 14(10): e1007402.
[22] CURRAN K, LISTER J A, KUNKEL G R, et al. Interplay between foxd3 and mitf regulates cell fate plasticity in the zebrafish neural crest[J]. Developmental Biology, 2010, 344(1): 107-118.
[23] FROHNHOFER H G, KRAUSS J, MAISCHEIN H M, et al. Iridophores and their interactions with other chromatophores are required for stripe formation in zebrafish[J]. Development, 2013, 140(14): 2997-3007.
[24] 徐偉, 李池陶, 曹顶臣, 等. 几种鲤鲫鳞片色素细胞和体色发生的观察[J]. 水生生物学报, 2007, 36(1): 67-72.
XU Wei, LI Chitao, CAO Dingchen, et al. Observation of pigment cells and body color occurrence in the scales of several carp species[J]. Journal of Aquatic Biology, 2007, 36(1): 67-72.
[25] WANG C H, WACHHOLTZ M, WANG J, et al. Analysis of the skin transcriptome in two oujiang color varieties of common carp[J]. PLoS One, 2014, 9(3): e90074.
[26] 周康奇, 潘贤辉, 牟春艳, 等. 血鹦鹉鱼鳞片及色素细胞的显微和超微结构研究[J]. 淡水渔业, 2020, 50(5): 47-54.
ZHOU Kangqi, PAN Xianhui, MU Chunyan, et al. Microscopic and ultrastructural studies on scales and chromatophore of blood parrot cichlid[J]. Fresh Water Fishery, 2020, 50(5): 47-54.
[27] GHOSHAL A, ECK E, GORDON M, et al. Wavelength-specific forward scattering of light by Bragg-reflective iridocytes in giant clams[J]. Journal of the Royal Society Interface, 2016, 13 (120): 1742-5662.
[28] SHEETS L, RANSOM D G, MELLGREN E M, et al. Zebrafish melanophilin facilitates melanosome dispersion by regulating dynein[J]. Current Biology: CB, 2007, 17(20): 1721-1734.
[29] STEWART R A, ARDUINI B L, BERGHMANS S, et al. Zebrafish foxd3 is selectively required for neural crest specification, migration and survival[J]. Developmental Biology, 2006, 292(1): 174-188.
[30] 芮孝. 鯉、鲫复制 sox10 基因的表达和功能分化研究[D]. 舟山: 浙江海洋大学, 2018.
RUI Xiao. Expression and functional differentiation of duplicated sox10 genes in common carp and crucian carp[D]. Zhoushan: Zhejiang Ocean University, 2018.
[31] AKOLKAR D B, ASADUZZAMAN M, KINOSHITA S, et al. Characterization of pax3 and pax7 genes and their expression patterns during different development and growth stages of Japanese pufferfish takifugu rubripes[J]. Gene, 2016, 575(1): 21-28.
[32] JANG H S, CHEN Y, GE J, et al. Epigenetic dynamics shaping melanophore and iridophore cell fate in zebrafish[J]. Genome Biology, 2021, 22(1): 282.
[33] DORNBURG A, WANG Z, WANG J, et al. Comparative genomics within and across bilaterians illuminates the evolutionary history of alk and ltk proto-oncogene origination and diversification[J]. Genome Biology and Evolution, 2021, 13(1): 1-15.
[34] 范云鹏, 赵韩, 罗世民, 等. 花鲫早期体色发育和几个体色相关基因在不同鲫的表达分析[J]. 激光生物学报, 2019, 28(4): 343-352, 373.
FAN Yunpeng, ZHAO Han, LUO Shimin, et al. Early body color development and expression analysis of several body color related genes in different crucian carp[J]. Acta Laser Biology Sinica, 2019, 28(4): 343-352, 373.
[35] KURIYAMA T, MIYAJI K, SUGIMOTO M, et al. Ultrastructure of the dermal chromatophores in a lizard with conspicuous body and tail coloration[J]. Zoological Science, 2006, 23(9): 793-799.
