叶面真菌群落对白粉病发病的分子生态响应机制
2024-04-13黄海涛刘文仪杨文武张建铎米其利李菁菁陈义强李浩斌尹华群高茜
黄海涛 刘文仪 杨文武 张建铎 米其利 李菁菁 陈义强 李浩斌 尹华群 高茜

收稿日期:2023-08-13;修回日期:2023-10-07。
基金項目:云南省烟草化学重点实验室开放课题项目(2021539200340244)。
作者简介:#为并列第一作者。黄海涛,副研究员,主要从事烟草育种方面的研究。刘文仪,硕士研究生。
* 通信作者:高茜,副研究员,主要从事烟草育种方面的研究。E-mail: gaoqian@ynzy-tobacco.com。
摘 要:叶面微生物群落组成与植物叶部病害发生密切相关,但植物真菌性叶部病害的发病程度与叶面真菌群落组成及多样性的关联机制仍然未知。本研究利用真核生物内源转录间隔区(ITS)扩增子高通量测序技术,在茄科作物白粉病不同发病程度下,研究了叶面真菌群落的组成和多样性差异,解析了叶面真菌分子生态网络拓扑性质的变化规律,并探明了叶面真菌群落系统发育装配的生态过程。多样性分析表明,随着白粉病病情程度加重,叶面真菌群落丰富度及多样性逐渐下降;网络分析表明,相较于中度和重度感病植株,轻微发病植株叶面真菌网络的节点和连接数更多,网络密度、聚集系数和平均连通度更高。在不同发病程度的植株中,叶面真菌群落的系统发育装配的生态过程均由随机性主导,但随着发病程度加重,叶面真菌群落趋向于系统发育扩散。综上所述,病原菌入侵改变了叶面真菌群落结构,扰动了真菌群落之间的相互作用和群落系统发育的生态装配过程,这些结果为深入认识白粉病病害与叶面真菌群落关联机制和生产上防控该病具有重要意义。
关键词:白粉病;叶面微生物;真菌群落;生态网络;群落装配
中图分类号:S432 文献标志码:ADOI:10.3969/j.issn.1007-7146.2024.01.009
Response in Fungal Community on Plant Leaves to Powdery Mildew
HUANG Haitao1#, LIU Wenyi2#, YANG Wenwu1, ZHANG Jianduo1, MI Qili1, LI Jingjing3, CHEN Yiqiang3, LI Haobin4, YIN Huaqun5, GAO Qian1*
(1. Yunnan Key Laboratory of Tobacco Chemistry, R&D Center of China Tobacco Yunnan Industry Co., Ltd, Kunming 650231, China; 2. College of Environment and Ecology, Hunan Agricultural University, Changsha 410128, China; 3. Technical Center of Fujian Tobacco Industry Co., Ltd, Xiamen 361022, China; 4. Yuxi Cigarette Factory, Hongta Group, Yuxi 653100, China;
5. School of Minerals Processing and Bioengineering, Central South University, Changsha 410083, China)
Abstract: The composition of microbial communities on leaf surface is closely related to plant foliar diseases. However, the response in fungal community on plant leaves to the severity of pant diseases are still unknown. In this study, we used high-throughput ITS amplicon sequencing technology to investigate the differences in the composition and diversity of fungal community on plant leaves with different disease severities of powdery mildew disease in Solanaceae crops. We analyzed the changes in the topological properties of molecular ecological networks of fungal community and explored the ecological processes of community phylogenetic assembly. Diversity analysis showed that as the severity of powdery mildew disease increased, the richness and diversity of fungal communities gradually decreased. Network analysis revealed that compared to plants with moderate and severe infection, plants with mild disease symptoms had more nodes and connections in the ecological network, with higher network density, clustering coefficient, and average connectivity. Among the plants with different disease severities, the ecological processes of phylogenetic assembly in fungal communities were dominated by stochastic processes, whereas the fungal communities tended to have phylogenetic dispersion with increasing severity of powdery mildew. In conclusion, invasive pathogens alter the existing community structure, disrupt the interactions between fungal communities, and influence the ecological processes of community phylogenetic assembly. These findings provide a deep insight into the association between powdery mildew disease and the fungal community on plant leaves.
Key words: powdery mildew; phyllosphere microorganisms; fungal community; ecological network; phylogenetic structure
(Acta Laser Biology Sinica, 2024, 33(1): 073-079)
白粉病(powdery mildew)是在全球范围内广泛流行的植物真菌病害,其病原菌为二孢白粉菌(Golovinomyces cichoracearum)[1-2],可导致作物叶片光合作用减少、生长受损、早衰和产量下降等,每年对农业造成了巨大的经济损失[3]。例如:南非白粉病造成的年平均经济作物损失为20%~30%;在奥地利、爪哇岛、马其顿王国和苏门答腊,农作物白粉病频发[4],每年损失产值4亿~5亿美元。从生态学的角度看,白粉病的发生是叶面微生物群落结构稳态改变的过程,其微生物群落结构和多样性的变化规律已有一定的研究。例如:感染白粉病后,南瓜(Cucurbita moschata)叶片细菌的数量、多样性和丰富度均增加[5];高抗蔷薇(Rosa)的真菌多样性降低,而高感蔷薇的真菌多样性则增加[6]。这些结果表明,白粉病的发生可能改变了叶面微生物的群落多样性,并且真菌和细菌对白粉病的响应机制存在差异,但白粉病发病程度与患病植株叶面微生物结构及多样性的关联机制研究仍较少。
叶面微生物生态网络及群落系统发育装配与作物质量、发病密切相关。Lei等[7]发现,作物叶面真菌群落组装过程显著影响了作物质量;Tao等[8]研究发现,茄科作物感染叶斑病后,随着侵染变严重,叶面网络的复杂性降低,这表明作物病害是影响叶面微生物群落装配的关键因素。然而,关于白粉病的发生如何改变感病植株叶面真菌相互作用和群落系统发育装配的生态过程仍未清楚。
高通量测序技术被广泛应用于探索环境微生物的多样性及其功能研究,是目前环境微生物组研究的关键技術。本研究以白粉病感病作物为研究对象,利用内源转录间隔区(internally transcribed spacer,ITS)扩增子高通量测序技术探究叶面真菌群落多样性及组成,旨在揭示叶面真菌群落的演替规律、微生物相互作用网络变化和群落系统发育装配。本研究结果发现了白粉病发病程度与微生物群落多样性、微生物相互作用网络、群落系统发育密切相关。这些研究结果对深入理解白粉菌侵染对植株叶面真菌群落的影响具有重要意义,可为白粉病的生态防控提供理论基础。
1 材料与方法
1.1 样品采集
在云南省昆明市(24°23'N,102°10'E)进行了感染白粉病烟草样品的采集。分别从轻微、中度和严重感染白粉病的烟叶中各随机选取了6株进行采样,分别编号为S(轻微发病)、M(中度发病)和I(重度发病)。在采集过程中,使用消毒剪刀将发病叶片剪下,并置于无菌取样袋中。所有样品均放入低温保藏箱,再迅速带回实验室置于-80℃冰箱中保存备用。
1.2 样品DNA提取、扩增及测序
采用十六烷基三甲基溴化铵(Hexadecyl trimethyl ammonium Bromide,CTAB)法对植株叶面样品进行DNA提取,具体方法参照李渊等[9]的研究。吸取1 000 μL CTAB裂解液至2.0 mL EP管里,加入溶菌酶,将适量的样品加入裂解液中,65℃水浴,期间颠倒混匀数次使样品充分裂解。样品总DNA提取完毕后,质量浓度和纯度使用NanoDrop测定,纯度A260 nm/A280 nm值要求在1.8~2.0。以微生物DNA[9]为模板,采用引物ITS1FI2(5'-GTGARTCATCGAATCTTTG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')对真菌ITS2区域进行PCR扩增。PCR反应体系包含Phusion酶12.5 μL,正向引物和反向引物各2.5 μL,模板DNA为50.0 ng,加ddH2O至25.0 μL。PCR扩增反应条件为:98℃初始变性30 s;98℃变性10 s,54℃退火30 s,72℃延伸45 s,共32个循环;最后72℃延伸10 min,降温至4℃保存。利用gel extraction kit(OMEGA Bio-Tek Inc)纯化PCR产物。利用Qubit 2.0 Fluorometer(Invitrogen)对其定量,建库后,在 Illumina NovaSeq PE250 平台上进行高通量测序(联川公司,LC-Bio Technology Co.,Ltd),得到已去接头的FASTQ 格式原始数据。
1.3 序列处理和统计分析
利用 QIIME 2[10] 软件处理原始测序数据。按barcode 拆分样品序列,低质量序列[质量控制(quality control,QC)<20;读长 <200 bp]和嵌合体被去除后,以97%的相似水平将序列聚类生成可操作分类单元(operational taxonomic units,OTU),并构建特征表;利用OTU代表性序列构建系统进化树,并进行物种注释。
利用microeco 0.5.1包[11] 对细菌群落进行生态数据统计和可视化分析,采用Venn图分析组间的共有和特有扩增子序列变异体(amplicon sequence variants,ASVs),使用Ggplot2包绘制物种丰度图,基于Kruskal-Wallis秩和检验和多重比较方差分析检验组间的细菌群落Alpha多样性差异。采用主坐标分析(PCoA)对微生物群落进行降维分析,利用Bray-Curtis距离计算群落beta多样性。基于Spearman 相关性系数(P<0.05)构建分子生态网络(meolecular ecological network analysis,MENs),通过随机矩阵理论(random matrix theory,RMT)确定最优相关系数阈值,使用 Gephi[12]绘制网络图。采用picante包[13]计算微生物群落的净谱系亲缘关系指数(net relatedness index,NRI)和最近种间亲缘关系指数(nearest taxon index,NTI)。所有统计分析均在R 3.4.0 [14]环境中实现。
2 结果与分析
2.1 群落演替
2.1.1 不同发病程度植株叶面真菌ASVs丰度和Alpha多样性
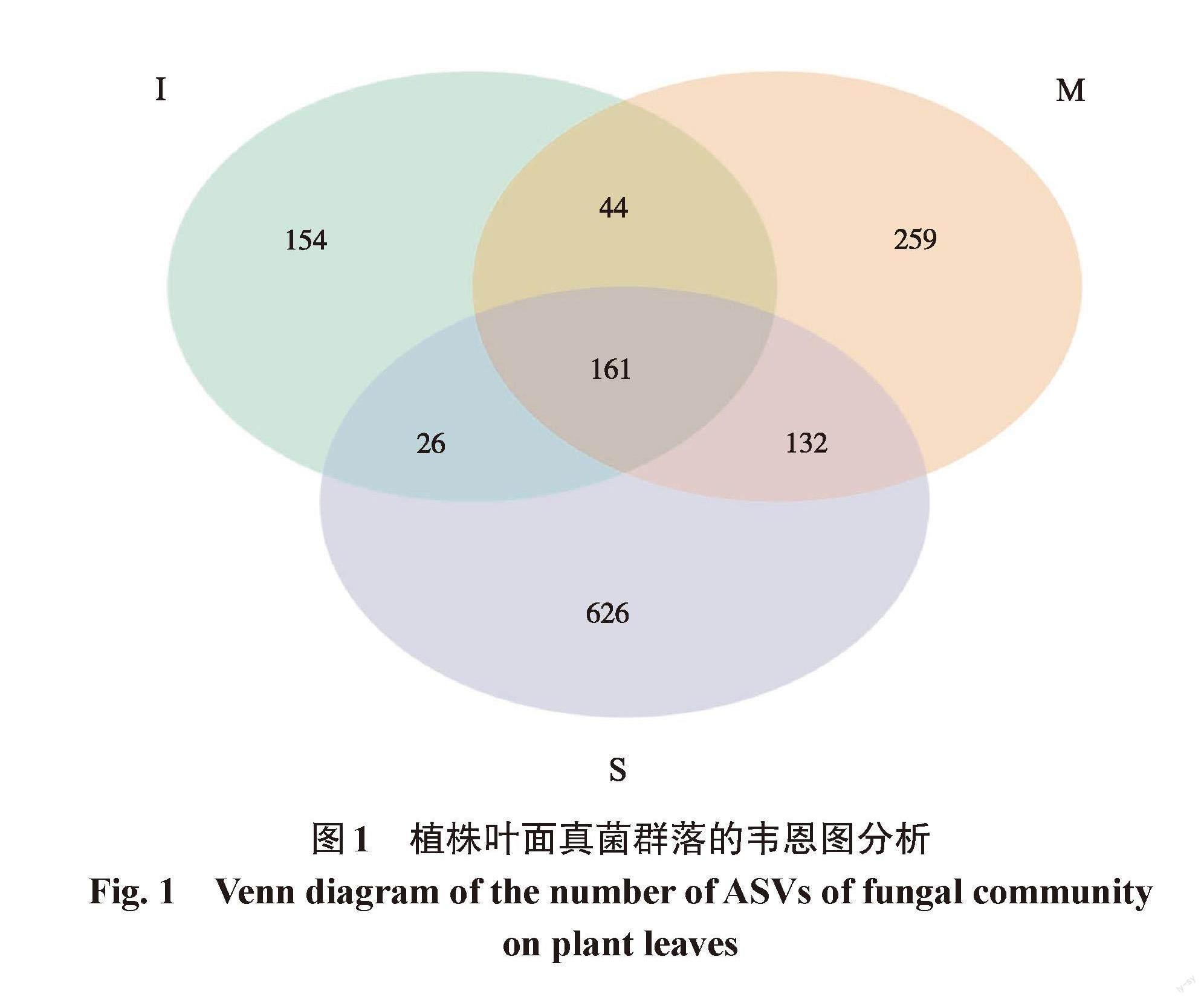
通过ITS扩增子高通量测序技术对植株叶面真菌群落组成进行检测,共得到12 488个扩增子序列变异体(ASVs)。如图1所示,3个不同病害程度植株叶面共有的ASVs共161个(8.36%),而轻微(S)、中等(M)、严重(I)发病植株叶面特有的真菌ASVs数分别为626、259和154个。轻微发病植物叶面特有的真菌ASVs数是中等发病植株的2.42倍,严重发病植株的4.06倍,病害的发生显著减少了特有真菌ASVs数量。
图1 植株叶面真菌群落的韦恩图分析
Fig. 1 Venn diagram of the number of ASVs of fungal community on plant leaves
如圖2所示,轻微发病的植物叶面Shannon多样性指数为1.60±0.86,高于中度发病(1.28±0.05)和重度发病(1.08±0.03)的植物叶面Shannon多样性指数。此外,轻微发病植物的叶面Simpson指数为0.49,低于中度和重度发病的植物叶面Simpson指数0.57和0.54。这表明,随着白粉病发病程度加重,植株叶面真菌多样性逐渐降低。
2.1.2 属水平上不同感病程度植物叶面真菌的
群落组成
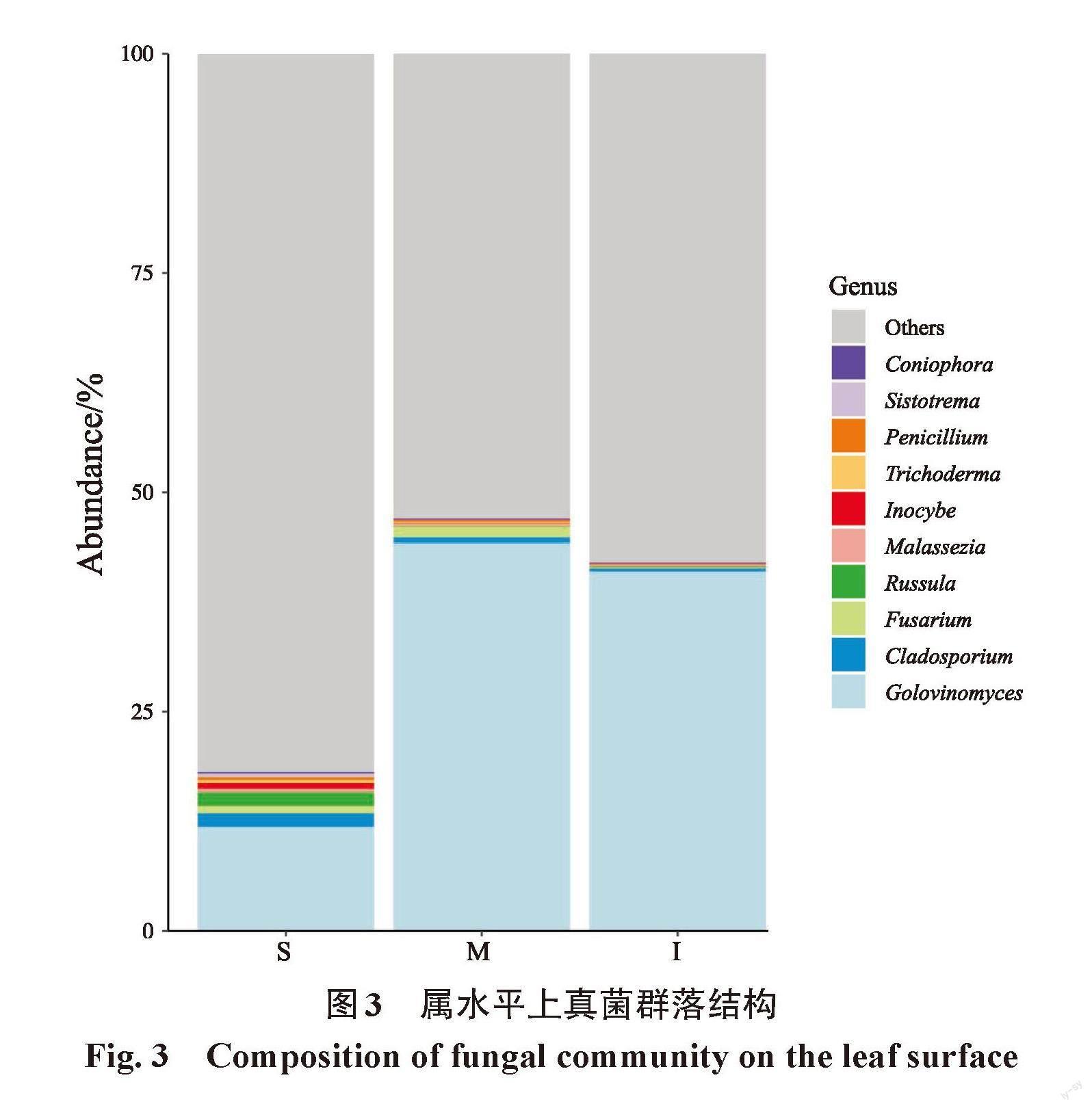
在属分类水平上,如图3所示,白粉病发病植株叶面真菌群落主要由高氏白粉菌属(Golovinomyces)、枝孢属(Cladosporium)、镰刀菌属(Fusarium)、红菇属(Russula)和马拉色菌属(Malassezia)组成。在白粉病轻微患病植株叶面中,高氏白粉菌属的相对丰度为11.86%,明显低于中度(44.21%)和重度(40.93%)患病植株叶面高氏白粉菌属的相对丰度,表明随着发病程度的加重,高氏白粉菌属的相对丰度呈现出先增加后减少的趋势。在白粉病重度患病植物的叶面真菌微生物群落中,枝孢属、红菇属、马拉色菌属和木霉属(Trichoderma)的相对丰度分别为0.38%、0.10%、0.20%和0.01%,低于中度发病植株的相对丰度(0.63%、0.11%、0.29%、0.16%),也低于轻微发病植株的相对丰度(1.51%、1.62%、0.38%、0.37%)。这些结果表明,白粉病会对叶面真菌群落的相对丰度产生影响,进而可能影响叶际微生物的结构与功能。
2.1.3 真菌群落组成的 PCoA分析
主坐标分析(PCoA)表明,如图4a所示,主成分1(PCo1)和主成分2(PCo2)可解释白粉病患病植株叶面真菌群落组成的93.5%,其中PCo1的解释度为68.6%,PCo2的解释度为24.9%。轻微发病的植物叶面真菌群落主要分布在PCo1的正值区域,而中度和重度发病的叶面真菌群落主要分布在PCo1的负值区域。
β多样性分析表明,如图4b所示,随着发病程度增加,叶面真菌β多样性逐渐降低,即I(0.10) 2.2 分子生态网络 为了研究植株叶面真菌群落相互作用与白粉病患病程度之间的关系,我们基于随机矩阵理论构建了S、M、I 的分子生态网络。结果显示:轻微发病植株的节点个数(vetex)为324个,连接数(edge)为2 586个,平均连接度(average degree)为22.14;相较之下,中度发病植株节点个数(107)、连接数(186)和平均连接度(3.48)显著减少,而重度发病植株节点个数(53)、连接数(52)和平均连接度(1.96)也显著减少。这表明轻微发病植株叶面中真菌网络物种间关系更加复杂,网络密度、聚集系数和平均连通度更高(表2)。 网络中物种间的相互关系可以分为正相关和负相关,前者意味着物种具有相似的生态位或存在共生关系,而后者则表示它们之间存在竞争或捕食关系。在3个不同发病程度植株网络中,正相关关系占主导地位。在不同患病程度的植株叶面,S的正相关性最高(97.77%),高于M(93.01%)和I(96.54%),这表明在这些植物的叶面中真菌之间主要存在协同合作关系,竞争关系相对较少。这也意味着随着白粉病发病程度加重,叶面真菌互作网络的竞争关系比例逐渐提高(图5)。 2.3 不同发病程度植株叶面群落谱系结构 如图 6 所示,白粉病发病植株叶面真菌群落的βNTI绝对值全部在0到2之间,表明感病植株叶面真菌群落装配由随机性过程主导。如表3所示:在轻微发病组中,有1个样品的NRI大于0,而有5个样品的NRI小于0,此外,2个样品的NTI大于0,而4个样品的NTI小于0;在中度发病组中,6个样品的NRI和NTI均小于0;在重度发病组中,有6个样品的NRI和NTI均大于0。这些结果表明,在不同感病程度植株叶面群落中,系统发育指数NRI和NTI的变化趋势相同。随着感病程度的增加,患病植株叶面群落谱系结构呈现由聚集到发散的变化。在轻微感染病害的植株中,大部分样品叶面真菌群落表现为谱系发散,少数表现为谱系聚集;在中度感染病害的植株中,叶面真菌群落表现为谱系发散;在严重感染的植株中,叶面真菌群落表现为谱系聚集。 3 讨论 叶际微生物在塑造植物第一层免疫力防线方面发挥着至关重要的作用[15]。随着对叶面微生物的关注逐渐增加,它们在抗病原体研究中的应用也越来越广泛[16-17]。本研究旨在探究叶面真菌群落与白粉病的严重程度之间的关系,结果表明,白粉菌的侵染与叶面真菌群落的多样性和微生物的相互作用密切相关。 大量研究表明,随着病害的发生,作物微生物群落的多样性会降低[18-19]。Liu等[20]的研究发现,微生物群落多样性的变化可以用来指示微生物群落的变化。在我们的研究中,中度和重度发病组植株叶面真菌多样性指数低于轻度发病组(图2)。与之前的研究结果一致[21-22],在作物发病初期,病原菌的丰度相对低,没有对群落产生显著影响,在叶面资源欠缺的条件下,病原菌与其他微生物的竞争加强,并在一定程度上促进了群落多样性的增加。然而,随着病原菌的定殖和增殖,叶面微生物群落原有的平衡被打破,导致群落多样性明显降低。 微生物之间的相互作用是叶面微生物组的重要组成部分[23]。已有研究显示[8],感染野火病的植株,随着病害程度增长,叶面真菌网络的复杂程度降低,真菌网络的节点个数、连接数和平均连接度等拓扑属性也降低。相似地,我们的结果表明,随着白粉病病情加重,植株叶面真菌网络的复杂性降低,表现为网络节点数、连接数和平均连接度的减少(表2),并且负相互作用的比例增加。与Cordero等[24]的研究一致,随着病原菌的侵染,发病后期真菌与病原菌负相互作用增加,病原菌与其他真菌进行资源竞争。 生态组装过程对于构建微生物群落至关重要[25]。Wang等[26]的研究指出,茄科作物叶面细菌群落的大部分βNTI值落在-2和+2之间,表明随机过程主导了叶面细菌群落系统发育装配。同样,我们也发现,发病植株叶表面真菌群落NTI在-2到2之间,表明随机过程在群落过程中起着关键作用。然而,Liu等[27]的研究指出,土传病病原菌入侵过程中,番茄作物根际细菌群落系统发育装配的确定性过程重要性逐渐加强,并表现为系谱系结构聚集。这与我们的研究结果趋势一致,即随着发病变严重,叶面真菌群落谱系结构逐渐聚集。这些结果表明,病原菌的入侵可能竞争性排斥大部分具有较弱竞争力的物种,而与发育相似且具有较强竞争力的物种共存。 综上所述,本研究揭示了白粉病不同发病程度植物叶面真菌群落的组成、分子生态网络拓扑性质和群落系统发育装配的差异。白粉菌的侵染导致叶面真菌群落的多样性下降,改变了植株叶面真菌相互作用网络结构,并增加真菌之间竞争关系的比例,谱系结构由发散到聚集。本研究对深入理解白粉病病害与叶面真菌群落关联机制具有重要意义,为缓解和防控白粉病害提供了重要依据。 参考文献(References): [1] 邢荷荷, 梁晨, 于静, 等. 青岛地区烟草白粉病病原[J]. 菌物学报, 2015, 34(1): 159-163. XING Hehe, LIANG Chen, YU Jing, et al. Pathogen causing tobacco powdery mildew in Qingdao[J]. Mycosystema, 2015, 34(1): 159-163. [2] 贾桥东, 张保全, 王卫民, 等. 烟草白粉病的研究进展[J]. 江苏农业科学, 2019, 47(4): 94-97. JIA Qiaodong, ZHANG Baoquan, WANG Weimin, et al. Research progress on tobacco powdery mildew[J]. Jiangsu Agricultural Science, 2019, 47(4): 94-97. [3] 汪漢成, 杨双剑, 许冬青, 等.苯并噻二唑对漂浮育苗烟草白粉病的诱导抗性及其对烟苗安全性研究[J]. 植物保护, 2012, 38(6): 123-126. WANG Hancheng, YANG Shuangjian, XU Dongqing, et al. Fungicidal activity of benzothiadiazole to Erysiphe cichoracearum and its safety to tobacco seedlings[J]. Plant Protection, 2012, 38(6): 123-126. [4] 朱贤朝, 王彦亭, 王智发, 等. 中国烟草病害[M]. 北京: 中国农业出版社, 2002: 75-80. ZHU Xianchao, WANG Yanting, WANG Zhifa, et al. Chinese tobacco diseases[M]. BeiJing: Beijing China Agriculture Press, 2002: 75-80. [5] 罗路云, 张卓, 金德才, 等. 南瓜白粉病不同病情等级下叶际细菌群落结构和多样性[J]. 植物病理学报, 2017, 47(5): 688-695. LUO Luyun, ZHANG Zhuo, JIN Decai, et al. Phyllosphere bacterial diversities and community structures on pumkin with different severities of powdery mildew[J]. Acta Phytopathologica Sinica, 2017, 47(5): 688-695. [6] 白维晓, 孙玮宏, 肖瑞桐, 等. 两种不同白粉病抗性野生蔷薇内生真菌群落结构[J]. 微生物学通报, 2019, 46(6): 1300-1308. BAI Weixiao, SUN Weihong, XIAO Ruitong, et al. Fungal endophytic communities of two wild rosa species with different powdery mildew susceptibility[J]. Microbiology China, 2019, 46(6): 1300-1308. [7] LEI X, ZHI Q Q, HU X, et al. Influence of association network properties and ecological assembly of the foiar fungal community on crop quality[J]. Frontiers in Microbiology, 2022, 13(5): 78-95. [8] TAO J M, CAO P J, XIAO Y S, et al. Distribution of the potential pathogenic Alternaria on plant leaves determines foiar fungal communities around the disease spot[J]. Environmental Research, 2021, 200(9): 268-181. [9] 李渊, 张永杰, 刘杏忠, 等. 利用CTAB法和子囊孢子破壁法提取冬虫夏草菌DNA[J]. 菌物研究, 2013, 11(4): 261-265. LI Yuan, ZHANG Yongjie, LIU Xingzhong, et al. Extraction of genomic DNA of osinensis with CTAB method and ascospore wall breaking method[J]. Journal of Fungal Research, 2013, 11(4): 261-265. [10] BOLYEN E, RIDEOUT J R, DILLON M R, et al. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2[J]. Nature Biotechnology, 2019, 37(8): 852-857. [11] LIU C, CUI Y M, LI X Z, et al. Microeco: an R package for data mining in microbial community ecology[J]. FEMS Microbiology Ecology, 2020, 97(2): 255-262. [12] DENG Y, JIANG Y H, YANG Y F, et al. Molecular ecological network analyses[J]. BMC Bioinformatics, 2012, 113(5): 1471-2015. [13] STEGEN J C, LIN X, FREDRICKSON J K, et al. Quantifying community assembly processeand identifying features that impose them[J]. The ISME Journal, 2013, 7(11): 2069-2079. [14] R CORE Team. R: a language and environment for statistical computing. R foundation for statistical computing [CP]. Vienna, Austria. https://www.R-project.org/. [15] ZHANG Z, LUO L Y, TAN X Q, et al. Pumpkin powdery mildew disease severity influences the fungal diversity of the phyllosphere[J]. Peer J, 2018, 6(4): 4559-4572. [16] JULIA A, VORHOL T. Microbial life in the phyllosphere[J]. Nature Reviews Microbiology, 2021, 10(12): 828-840. [17] 陳大为, 张树武, 刘佳, 等. 黄瓜白粉病菌拮抗真菌鉴定及生防效果评价[J]. 中国生物防治学报, 2017, 33(3): 427-432. CHEN Dawei, ZHANG Shuwu, LIU Jia, et al. Identification of Antagonistic fungus against Sphaerotheca fuliginea and evaluation of its biocontrol efficacy[J]. Chinese Journal of Biological Control, 2017, 33(3): 427-432 [18] WANG R, ZHANG H C, SUN L G, et al. Microbial community composition is related to soil biological and chemical properties and bacterial wilt outbreak[J]. Scientific Reports, 2017, 7(5): 343-350. [19] YANG H W, LI J, XIAO Y H, et al. An integrated insight into the relationship between soil microbial community and tobacco bacterial wilt disease[J]. Frontiers in Microbiology, 2017, 8(11): 2179-2183. [20] LIU H, BRETTELL L E, SINGH B, et al. Inking the phyllosphere microbiome to plant health[J]. Trends in Plant Science, 2020, 25(9): 841-844. [21] TAO J M, QIN C, FENG X, et al. Traits of exogenous species and indigenous community contribute to the species colonization and community succession[J]. Frontiers in Microbiology, 2018, 9(10): 3087-3089. [22] CHEN T, NOMURA K, WANG X L, et al. A plant genetic network for preventing dysbiosis in thephyllosphere [J]. Nature, 2020, 580 (4): 653-657. [23] MITJA N P, REMUS E, SCHLECHTER R O, et al. Phyllosphere Microbiology: at the interface between microbial individuals and the plant host[J]. New Phytologist, 2018, 4(5): 1327-1333. [24] CORDERO O X, DATTA M S. Microbial interactions and community assembly at microscales[J]. Current Opinion in Microbiology, 2017, 31(6): 227-234. [25] SLOAN W T, LUNN M, WOODCOCK S, et al. Quantifying the roles of immigration and chance in shaping prokaryote community structure[J]. Environmental Microbiology, 2006, 8(4): 732-740. [26] WANG Z H, FU C W, TIAN J Y, et al. Responses of the bacterial community of tobacco phyllosphere to summer climate and wildfire disease[J]. Frontiers in Microbiology, 2022, 13(12): 976-1050. [27] LIU H, SUN F F, PENG J W, et al. Deterministic process dominated belowground community assembly when suffering tomato bacterial wilt disease[J]. Multidisciplinary Digital Publishing Institute, 2022, 12(5): 1024-1029.
