过氧自由基氧化对花生球蛋白结构及聚集行为的影响
2024-04-12汪海燕李玟君李玉蝶宋青云庞子皓肖一郎汪超李玮
汪海燕,李玟君,李玉蝶,宋青云,庞子皓,肖一郎,汪超,李玮
(湖北工业大学 生物工程与食品学院,湖北 武汉 430000)
花生蛋白由90%的盐溶性蛋白和10%的水溶性蛋白组成,而盐溶蛋白中含有73% 的花生球蛋白[1]。花生中的球蛋白具有良好的热稳定性、复杂的空间构象以及维持空间构象所需要的疏水键、二硫键和离子键等功能性官能团,可作为一种优良原料广泛应用于食品领域[2]。花生球蛋白是花生蛋白中最重要的组分,直接影响花生蛋白的结构和理化性质。因此花生球蛋白更适于花生蛋白的结构和理化性质改性机理的深入研究。
花生在日常贮藏和加工过程中,容易发生脂质氧化反应,导致产品保质期缩短并产生异味,影响食用价值。蛋白质经氧化后羰基化合物含量增加,蛋白的分子间作用力被破坏,高级结构改变并形成交联聚集,因此通过研究蛋白质的理化性质、光谱特征、反应位点等可反映氧化对蛋白质的作用规律[3]。已有研究人员使用了各种活性氧或脂质过氧化的副产物来模拟蛋白质氧化,发现蛋白质的氧化会影响食物蛋白质的结构和功能特性,例如肉蛋白[4]和大豆蛋白[5]。另外李志豪[6]研究2,2′-盐酸脒基丙烷对瓜籽蛋白的影响发现,在低氧化度(0~1 mmol/L)时,籽瓜种仁分离蛋白质产生可溶性聚集体。随着蛋白质氧化程度的增加,共价键交联可能导致这些可溶性聚集体进一步聚集,产生不溶性聚集体,导致籽瓜种仁分离蛋白质溶解度降低。
目前,对于花生球蛋白的改性研究主要集中在物理研究方面,如热处理和高压处理[7],而对花生球蛋白氧化的研究较少。2,2′-盐酸脒基丙烷[2,2′-azobis(2-amidinopropane),AAPH]有氧热分解产生的过氧自由基是脂质过氧化反应中最主要的自由基中间体[8]。因此,本研究采用AAPH 在有氧条件下热分解产生的过氧自由基代表花生蛋白氧化酸败中产生的脂质自由基,研究脂质自由基氧化对花生球蛋白结构的影响,以期更深入地了解花生蛋白的氧化机理,为合理开发花生蛋白提供参考。
1 材料与方法
1.1 材料与试剂
花生蛋白粉:上海源叶生物科技有限公司;AAPH:上海麦克林生化科技有限公司;三羟甲基氨基甲烷[tris(hydroxymethyl)aminomethane,Tris]、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、5,5′-二硫代双(2-硝基苯甲酸)[5,5′-dithio bis-(2-nitrobenzoic acid),DTNB]、甘氨酸:广州赛国生物科技有限公司;硫酸铵、无水磷酸二氢钠、十二水合磷酸氢二钠:国药集团化学试剂有限公司。所用试剂均为分析纯。
1.2 仪器与设备
FreeZone12L 真空冷冻干燥机:美国LABCONCO公司;F-7000 荧光分光光度计:日本日立公司;M200 PRO 酶标仪:瑞士Tecan 公司;Zetasizer Nano-ZS 型纳米粒度和Zeta 电位分析仪:英国Malvern 公司;JSM-6390LV 扫描电子显微镜:日本电子JEOL 公司;Vertex 70 傅里叶红外光谱仪:德国Bruker 公司。
1.3 试验方法
1.3.1 花生球蛋白的提取
参考陈鹏枭等[9]的方法并加以修改,称取适量花生蛋白粉溶于0.5 mol/L NaCl、pH7.9 的磷酸盐缓冲液中,在室温下搅拌2 h 后,于4 ℃环境下,以4 000 r/min离心30 min,取沉淀用上述磷酸盐缓冲液按1∶5(g/mL)复溶,然后透析48 h,冻干备用。
1.3.2 过氧自由基氧化花生球蛋白的制备
参考杨曦等[10]的方法并略加修改,称取1 g 花生球蛋白溶于100 mL 0.01 mol/L 磷酸盐缓冲液中(pH7.4),分别加入浓度为0.5、1.0、5.0、10.0、15.0 mmol/L 的AAPH,37 ℃避光反应24 h 后,冰浴降温至4 ℃,于4 ℃透析72 h,冻干后为氧化花生球蛋白,以不加AAPH 的花生球蛋白作为空白对照。
1.3.3 花生球蛋白浊度的测定
称取10 mg 样品溶于10 mL 0.01 mol/L 磷酸盐缓冲液中(pH7.0),在40 ℃的水浴锅中水浴30 min 后取出,冷却后在600 nm 处测定吸光度,以吸光度代表浊度。
1.3.4 游离巯基含量的测定
参考范婷等[11]的方法并略加修改,称取9 mg 的样品溶于3 mL 的Tris-甘氨酸缓冲液(pH8.0)中,取2.5 mL上述溶液并在其中加入20 μL DTNB 试剂,混合均匀避光反应10 min,在412 nm 处测上清液吸光度。游离巯基含量(X,μmol/g)的计算公式如下。
X=73.53×A412nm×D/C
式中:A412nm为吸光度;D为稀释倍数,1.01;C为蛋白浓度,mg/mL。
1.3.5 粒径的测定
参考杨晨[12]的方法并略加修改,称取10 mg 样品溶于10 mL 0.01 mol/L 磷酸盐缓冲液中(pH7.0),搅拌均匀后4 000 r/min 离心20 min,取上清液,然后将上清液通过0.45 μm 滤膜除去不溶性的杂质后进行粒径的测定。
1.3.6 Zeta 电位的测定
参考李学鹏等[13]的方法并略加修改,称取10 mg样品溶于10 mL 0.01 mol/L 磷酸盐缓冲液中(pH7.0),搅拌均匀后4 000 r/min 离心20 min 取上清液,然后将上清液通过0.45 μm 滤膜除去不溶性的杂质后进行Zeta 电位的测定,测定温度为25 ℃,温度平衡时间为2 min。
1.3.7 内源荧光的测定
参考朱增芳[14]的方法并略加修改,称取10 mg 样品溶于10 mL 0.01 mol/L 磷酸盐缓冲液中(pH7.0),使用荧光分光光度计测定蛋白质的固有发射荧光光谱,在290 nm 处激发,扫描波段为300~400 nm,狭缝宽为5 μm,灵敏度为1,记录光谱的最大发射波长以进行分析。
1.3.8 傅里叶红外光谱的测定
参考沈明娟等[15]的方法略作修改,称取1 mg 冻干氧化花生球蛋白和100 mg 干燥的KBr 粉末在研钵中混匀并充分研磨,称取适量进行压片,在4 000~400 cm-1内测定红外吸收光谱,吸光分辨率2 cm-1,扫描次数32 次,利用OMNIC 软件对图谱进行分析,并利用Peakfit Version 4.12 软件对图谱中酰胺Ⅰ区(1 700~1 600 cm-1)进行解析,根据二级结构分区计算各区域内子峰面积占总峰面积之比,确定蛋白质4 种二级结构的相对含量。
1.3.9 扫描电子显微镜测定
参考王莉[16]的方法略作修改,采用扫描电子显微镜,取冻干后少量花生球蛋白样品,将样品均匀涂抹在带导电胶的干净样品台上,随后样品经喷金处理30 min,在20 kV 电压下用扫描电子显微镜观察其微观形貌,放大倍数为800 倍。
1.4 数据处理与分析
所有试验均重复3 次以上,试验结果采用Origin Pro 2021 软件分析作图,SPSS 25.0 软件进行显著性分析。P<0.05 表示差异显著。
2 结果与分析
2.1 过氧自由基氧化对花生球蛋白浊度的影响
浊度是指溶液对光线通过时所产生的阻碍程度,包括悬浮物对光的散射和溶质分子对光的吸收,可以反映氧化过程中蛋白质的聚集状态。样品在600 nm下的吸光度表示其浊度,其结果如图1 所示。

图1 不同浓度的AAPH 对花生球蛋白浊度的影响Fig.1 Effect of different concentrations of AAPH on the turbidity of arachin
由图1 可知,花生球蛋白随浓度的增加其浊度也显著增加(P<0.05),表示其浊度的吸光度由0.20±0.01增加至0.44±0.01,15.0 mmol/L 氧化时导致浊度上升程度最高,上升了1.2 倍。氧化后的花生球蛋白浊度明显上升,说明羟自由基氧化使蛋白质之间发生交联反应,导致蛋白溶液光学密度增加[15]。这表明氧化使蛋白质分子结构发生了变化,形成了小分子聚集体,且随氧化程度的上升,小分子聚集体逐渐增多,浊度上升,这也与Jiang 等[17]的结果一致。魏娜[18]的研究结果也表明,在同一温度下,鸭肉肌原纤维蛋白的浊度大小与羟自由基浓度成正比,氧化作用会影响鸭肉肌原纤维蛋白不可溶聚集体的生成,导致其浊度的增加。
2.2 过氧自由基氧化对花生球蛋白游离巯基的影响
巯基以自由基形式存在或形成二硫键,在蛋白质的二级、三级结构中发挥重要作用。游离巯基含量可以用来表征花生球蛋白的氧化程度,不同浓度的AAPH对花生球蛋白的游离巯基的影响如图2 所示。

图2 不同浓度的AAPH 对花生球蛋白游离巯基的影响Fig.2 Effect of different concentrations of AAPH on free sulfhydryl group of arachin
由图2 可知,随着氧化程度的增加,花生球蛋白的游离巯基含量显著下降(P<0.05),从(14.62±0.08)μmol/g 下降到(7.77±0.25)μmol/g。当AAPH 浓度为15.0 mmol/L 时,游离巯基含量相比对照组降低了48.62%,表明花生球蛋白经AAPH 氧化后,可能会发生可逆的氧化反应,使巯基氧化为二硫键和次磺酸状态,同时也可能发生不可逆的氧化,导致花生球蛋白游离巯基的下降[3]。杨曦等[19]也发现自由基氧化可导致蛋白质的游离巯基含量降低,自由基氧化可影响巯基和二硫键交互反应平衡常数的改变。巯基是维持蛋白质结构的一种重要的作用力,巯基含量的降低意味着蛋白质结构发生改变。
2.3 过氧自由基氧化对花生球蛋白粒径的影响
不同浓度的AAPH 对花生球蛋白粒径的影响如图3 所示。

图3 不同浓度的AAPH 对花生球蛋白粒径的影响Fig.3 Effect of different concentrations of AAPH on the particle size of arachin
由图3 可知,不同AAPH 浓度下,花生球蛋白的粒径总体分布在100~1 000 nm 之间,未氧化的花生球蛋白的粒径明显低于氧化后的花生球蛋白的粒径,且随着AAPH 浓度的增加氧化花生球蛋白粒径分布开始向大尺寸方向移动,平均粒径也从(153.94±3.31)nm增加到(196.80±3.06)nm。这可能是氧化使蛋白分子的疏水基团暴露,在二硫键和次级键的作用下空间结构发生交联,生成较大的蛋白质聚集体,表现为蛋白的平均粒径增大[3]。Ye 等[20]的研究也出现了同样的结果,AAPH 氧化可导致形成花生蛋白可溶性聚集体。尤翔宇[21]在采用AAPH 氧化米糠蛋白时,氧化米糠蛋白粒径分布也随AAPH 浓度的增加呈上升趋势。本研究中,浊度的试验结果与粒径变化的结果一致,进一步说明氧化会使蛋白质分子发生聚集,从而使其粒径增大。
2.4 过氧自由基氧化对花生球蛋白Zeta 电位的影响
Zeta 电位的绝对值可以表征溶液的稳定性。氧化花生球蛋白的电位变化如图4 所示。

图4 不同浓度的AAPH 对花生球蛋白Zeta 电位的影响Fig.4 Effect of different concentrations of AAPH on Zeta potential of arachin
由图4 可知,加入0.5 mmol/L AAPH 后,电位绝对值开始降低,当AAPH 浓度为1.0 mmol/L 时,电位绝对值降低幅度明显没有AAPH 浓度为0.5 mmol/L 时降低幅度大,说明氧化改变了花生球蛋白的电位绝对值,从而改变了蛋白溶液的稳定性。然而随着AAPH浓度的增加,电位绝对值又呈现不同程度的下降,在AAPH 浓度为15.0 mmol/L 时,电位绝对值降低幅度最大,从(24.17±0.06)mV 下降到(15.93±0.05)mV,降低了34.09%(P<0.05),说明高浓度的氧化剂会较大程度地影响溶液的稳定性。蛋白质带电荷主要是因为氨基酸带电荷,蛋白质在过氧自由基的攻击下,一些氨基酸被氧化,导致蛋白质电荷绝对值降低,由于所带电荷绝对值的减少,蛋白质之间静电相互作用力减小,这也是蛋白质在氧化后溶解度降低的原因之一[22],此结果与本试验的氧化后花生球蛋白浊度的变化相互印证。这说明AAPH 氧化使得花生球蛋白氨基酸残基发生变化,从而破坏花生球蛋白溶液的稳定性,改变花生球蛋白的结构。
2.5 过氧自由基氧化对花生球蛋白荧光光谱的影响
色氨酸最大荧光发射波长可以表示色氨酸残基在蛋白质中的相对位置,通常用作检测蛋白质构象变化[23]的标记物。色氨酸残基在290 nm 激发下,可以在300~400 nm 内发出荧光[5]。不同浓度的AAPH 对花生球蛋白荧光扫描图谱的影响如图5 所示。

图5 不同浓度的AAPH 对花生球蛋白荧光扫描图谱的影响Fig.5 Effect of different concentrations of AAPH on fluorescence scanning spectra of arachin
由图5 可知,在0~1.0 mmol/L AAPH 之间,最大发射波长从301.4 nm 逐渐增加到301.6 nm,然后在5.0 mmol/L AAPH 时开始下降,在15.0 mmol/L AAPH下,最大发射波长降到300.1 nm。荧光发射向较长波长的位移(红移)表明发色团(色氨酸残基)更容易暴露于亲水环境中,而较短的波长(蓝移)更容易暴露于疏水环境中[23]。这可能是因为在较低的氧化剂浓度时,花生球蛋白暴露出色氨酸残基,随着AAPH 浓度的增加,一些暴露的疏水基团参与了疏水作用,形成了不可溶性聚集体,这也与前面的试验结果(浊度增加、粒径增大)相一致,说明氧化致使花生球蛋白发生聚集。
2.6 过氧自由基氧化对花生球蛋白红外扫描光谱的影响
傅里叶变换红外光谱表征蛋白质二级结构的主要技术方法之一,酰胺I 带(1 700~1 600 cm-1),是反映蛋白质二级结构变化最常用的谱带[24]。红外光谱中蛋白酰胺Ⅰ带常被划分为β-折叠(1 636~1 620 cm-1,1 696~1 677 cm-1)、无规则卷曲(1 648~1 640 cm-1)、α-螺旋(1 658~1 649 cm-1)、β-转角(1 670~1 659 cm-1)[15]。经AAPH 氧化后,花生球蛋白的二级结构变化如图6所示。

图6 不同浓度的AAPH 对花生球蛋白二级结构的影响Fig.6 Effect of different concentrations of AAPH on the secondary structure of arachin
由图6 可知,随着AAPH 浓度的上升,α-螺旋明显下降,β-折叠和无规则卷曲明显上升,说明氧化使花生球蛋白的二级结构发生了较大变化,呈现由α-螺旋向β-折叠和无规卷曲转变的趋势。陈晓思等[22]的研究发现,随着AAPH 浓度的升高,兔肉肌原纤维蛋白的α-螺旋含量逐渐降低,这与本研究结果一致。α-螺旋结构主要依靠蛋白质分子内的氢键维持,而自由基攻击蛋白质的氨基使得蛋白质分子内氢键减少,从而导致蛋白质去折叠化[25]。魏娜[18]的研究表明过氧自由基氧化可使鸭肉肌原纤维蛋白的α-螺旋的含量减小,β-折叠和无规则卷曲含量增大,表明过氧自由基能促进氢键的断裂,使鸭肉肌原纤维蛋白朝着不稳定的方向转变。
为进一步研究氧化后花生球蛋白二级结构的变化,绘制了AAPH 浓度与花生球蛋白二级结构的相关性热图,如图7 所示。
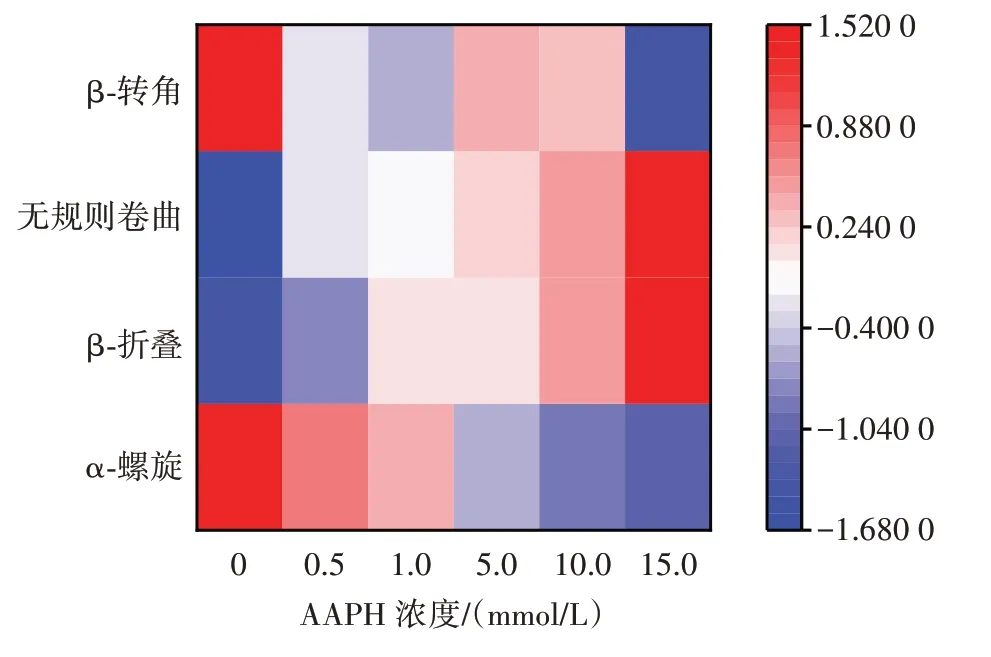
图7 AAPH 浓度与花生球蛋白二级结构的相关性热图Fig.7 Heatmap of correlation between AAPH concentration and the secondary structure of arachin
热图中颜色越接近红色,表示相对值越高,越接近蓝色,表示相对值越低。从图7 可看出,AAPH 浓度与β-折叠和无规则卷曲的变化有较强的正相关,与α-螺旋有较强的负相关。
2.7 过氧自由基氧化对花生球蛋白微观形态的影响
花生球蛋白过氧自由基氧化的微观形态如图8所示。

图8 不同浓度的AAPH 氧化后花生球蛋白的扫描电子显微镜图Fig.8 Scanning electron microscope of arachin oxidized by different concentrations of AAPH
由图8 可知,经对比发现,经0.5 mmol/L AAPH氧化后,花生球蛋白明显聚集起来;当AAPH 浓度为1.0 mmol/L 时,花生球蛋白分子聚集变得更加紧实;5.0 mmol/L 时,可看出蛋白分子内部结构逐渐变得松散;当AAPH 浓度为15.0 mmol/L 时,相比AAPH 浓度为10.0 mmol/L 花生球蛋白表面孔隙明显增大,且呈现明显的“蜂窝”状结构,这与张雪春等[3]的研究结果相似。可能是AAPH 氧化使花生球蛋白分子结构变化,内部松散结构伸展,巯基和疏水基团暴露,并发生相互作用,形成聚集体,这也与花生球蛋白经氧化游离巯基含量逐渐降低,浊度逐渐上升,粒径增大的结果相对应。周非白[26]研究的猪肉肌原纤维蛋白氧化后的微观形态也呈现同样的结果,表明氧化使得蛋白质结构发生了变化。
3 结论
本研究通过AAPH 氧化花生球蛋白,分析其对花生球蛋白结构和聚集行为的影响。结果表明,经AAPH氧化后花生球蛋白溶液浊度显著增加(P<0.05),这是由氧化后形成蛋白聚集体所造成,这与氧化后花生球蛋白的粒径显著增加,形貌孔径显著增大的现象相一致。同时AAPH 对花生球蛋白的氧化使其游离巯基含量和电位绝对值下降,降低了花生球蛋白的稳定性,经氧化后花生球蛋白的二级结构显示由α-螺旋向β-折叠和无规则卷曲转化的趋势。氧化后花生球蛋白荧光最大发射波长的蓝移与红移,与花生球蛋白中色氨酸及其残基在低浓度氧化剂下结构稳定性降低、高浓度氧化剂下参与聚集体有关。由此可见,花生球蛋白经过AAPH 氧化后会发生聚集且其结构稳定性降低,可对花生球蛋白的改性机理研究提供依据。
