副干酪乳酪杆菌Glory LP16 对调节小鼠肠道菌群功能的影响
2024-04-12杨柳项芳琴王海霞姜海莘李柏良
杨柳,项芳琴,王海霞,姜海莘,李柏良
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
在人体微生物组成中,肠道菌群是一个微小但起着关键作用的部分,它参与调节宿主体内的平衡,对宿主体内的生理功能产生影响[1]。近年来,越来越多的研究者将目光聚集到肠道菌群,对不同健康状态的菌群进行分析,研究结果表明,肠道菌群在肠道健康和各种疾病中发挥着重要的作用[2],其中副干酪乳酪杆菌是重要的一环。
副干酪乳酪杆菌是乳杆菌属中的重要成员,它是一种革兰氏阳性菌。经研究发现副干酪乳酪杆菌在人体肠道中大量存在且对肠道菌群具有调节作用,在发酵乳制品和发酵蔬菜肉中也有大量存在[3]。副干酪乳酪杆菌具有多种功能,可以有效抑制致病菌和腐败菌的繁殖,通过调节细胞因子的分泌,降低免疫激活作用,从而降低肠易激综合征的炎症反应[4]。此外,副干酪乳酪杆菌还能促进消化和吸收,它可以分解食物中的复杂碳水化合物和蛋白质,释放出营养物质,提高食物的可利用性。同时,副干酪乳酪杆菌还具有保护肠道黏膜、维持肠道菌群平衡的作用,有助于改善肠道健康。除了在食品领域的应用,副干酪乳酪杆菌还被广泛应用于保健品、药品和化妆品等领域[5]。
副干酪乳酪杆菌在肠道系统中能够固定生存繁殖并且在此过程中对肠道有良性影响,从而对机体进行正向调节[6]。Marzotto 等[7]将副干酪乳酪杆菌混合在酸乳中喂食给1~2 岁婴儿,发现92%实验对象粪便中含有副干酪乳酪杆菌并且含量最高,这说明副干酪乳酪杆菌能够在人体内定植。Verdenelli 等[8]对成年人进行分组实验,研究结果显示,成年人在摄入副干酪乳酪杆菌后,肠道蠕动明显增强,表明副干酪乳酪杆菌在调节人体排便方面起到积极的作用。
本研究以副干酪乳酪杆菌Glory LP16 为研究对象,参考保健食品功能评价检验方法进行实验。通过研究副干酪乳酪杆菌Glory LP16 对小鼠体质量和肠道菌群丰度的影响,组织病理学分析、肠道屏障的测定、肠道通透性的测定和短链脂肪酸的测定,进而研究副干酪乳酪杆菌Glory LP16 对肠道健康调节效果,以期为进一步开展和副干酪乳酪杆菌在食品方面应用提供依据。
1 材料与方法
1.1 材料与试剂
副干酪乳酪杆菌Glory LP16 冻干粉(实验室检测菌株规格为1.4×1011CFU/g):金华银河生物科技有限公司;普通灭菌饲料、垫料:北京维通利华实验动物技术有限公司;脂多糖(lipopolysaccharide,LPS)检测试剂盒、D-乳酸检测试剂盒:泉州科诺迪生物科技有限公司;5~6 周龄雄性BALB/c 小鼠[(无特定病原体(Specific pathogen free,SPF)级]:斯贝福(北京)生物技术有限公司。
1.2 仪器与设备
超净工作台(DL-CJ-2NDI):苏州安泰空气技术有限公司;电热恒温培养箱(BG-160):上海一恒科技有限公司;立式蒸汽灭菌器(LS-28HD):上海申安医疗器械厂;台式高速离心机(TGL-16G):上海安亭科技仪器厂;超低温冰箱(DW150):青岛海尔集团;酶标仪(Multiskan GO)、荧光定量聚合酶链式反应仪(abi 7500):美国赛默飞公司;粪便处理仪(PhenoMaster):德国TSE Systems 公司;光学显微镜(CX21):日本奥林巴斯公司;气相色谱(7890B):美国Agilent 公司。
1.3 方法
1.3.1 实验动物
48 只BALB/c 小鼠,饲养环境为温度22 ℃、湿度50%,12 h 光照,标准饲料喂养,自由饮水。适应性饲养1 周,随机将实验动物分成4 组,每组12 只。实验过程中所有动物操作均按照东北农业大学《实验动物管理条例》进行,经东北农业大学动物伦理委员会批准。
1.3.2 剂量分组及受试样品给予时间
小鼠被随机分为4 组:对照组、副干酪乳酪杆菌Glory LP16 低剂量组、副干酪乳酪杆菌Glory LP16 中剂量组、副干酪乳酪杆菌Glory LP16 高剂量组。其中对照组小鼠灌胃等体积的生理盐水,各组样品进行14 d实验。具体分组见表1。
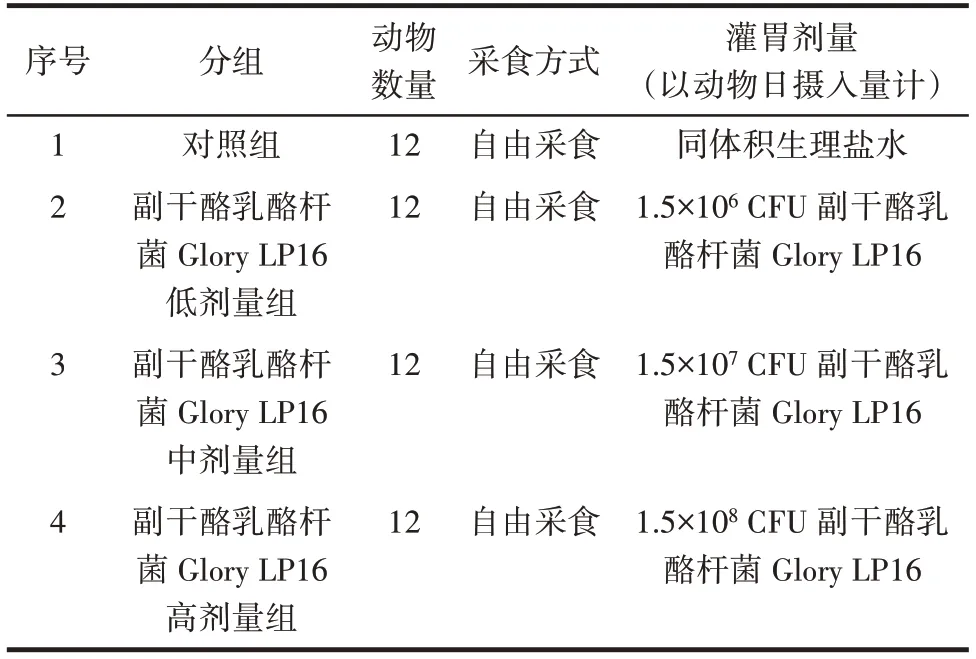
表1 实验分组Table 1 Experimental grouping
1.3.3 样品准备
在每日灌胃前,分别取一定量的副干酪乳酪杆菌Glory LP16 菌粉按照浓度溶解在生理盐水中。
1.3.4 指标测定
1.3.4.1 体质量变化
记录小鼠实验结束时空腹体质量。
1.3.4.2 肠道菌群变化
在每天给小鼠进行灌胃前,在无菌环境中,从小鼠的肛门内获取0.1 g 的粪便样品,并进行10 倍系列稀释,分别接种在双歧杆菌琼脂、乳酸杆菌选择性琼脂、伊红美蓝琼脂、叠氮钠-结晶紫七叶苷琼脂和胰胨-亚硫酸盐-环丝氨酸琼脂平板,检测粪便中双歧杆菌、乳杆菌、肠杆菌、肠球菌、产期荚膜梭菌数量。培养结束后,通过观察菌落形态、进行革兰氏染色和生化反应等鉴定方法,计算出每克湿便中的菌落数量,公式如下。
C= lg(T×N/M)
式中:C为菌落数量,lg(CFU/g);T为平均菌落计数,CFU/g;N为稀释倍数;M为取样质量,g。
在最后一次灌胃后的24 h 内,使用相同的方法进行样品采集和检测。观察并记录双歧杆菌、乳杆菌、肠球菌、肠杆菌和产气荚膜梭菌的变化情况。
1.3.4.3 组织病理学分析
经过苏木素伊红(hematoxylin and eosin,HE)染色后通过显微镜观察肠道病理结构。
1.3.4.4 肠道屏障的测定
利用实时定量聚合酶链式反应(real-time polymerase chain reaction,RT-PCR)检测肠道黏蛋白1(mucin1,MUC1)、黏蛋白2(mucin2,MUC2)和紧密连接蛋白[闭锁小带蛋白1(zonulaoccludens1,ZO-1)、Occludin和Claudin-1]相关基因的mRNA 表达水平而测定肠道屏障。
1.3.4.5 肠道通透性的测定
利用试剂盒测定肠道中LPS 和D-乳酸的含量。
1.3.4.6 短链脂肪酸的测定
在粪便样本盒中放入盲肠内容物1 g。用粪便处理仪处理样品并配制悬浊液(质量分数10%)。将1 mL悬浊液和200 μL 巴豆酸与偏磷酸混合溶液混合均匀并在-20 ℃下冷冻1 d。解冻后,离心3 min(8 000 r/min,4 ℃),蛋白质被清除分离。最后用0.22 μm 过滤器过滤上清液后得到待测样品,样品用气相色谱进行测定。
1.4 数据处理与分析
数据采用平均值±标准差表示,利用SPSS 26.0 软件进行Duncan′s test 差异显著性分析。当P<0.05 时,表示差异显著;P<0.01 为差异极显著,P>0.05 为差异不显著。使用Graph Pad 软件进行绘图分析。
2 结果与分析
2.1 副干酪乳酪杆菌Glory LP16 对小鼠体质量的影响
副干酪乳酪杆菌Glory LP16 对小鼠体质量的影响如图1 所示。
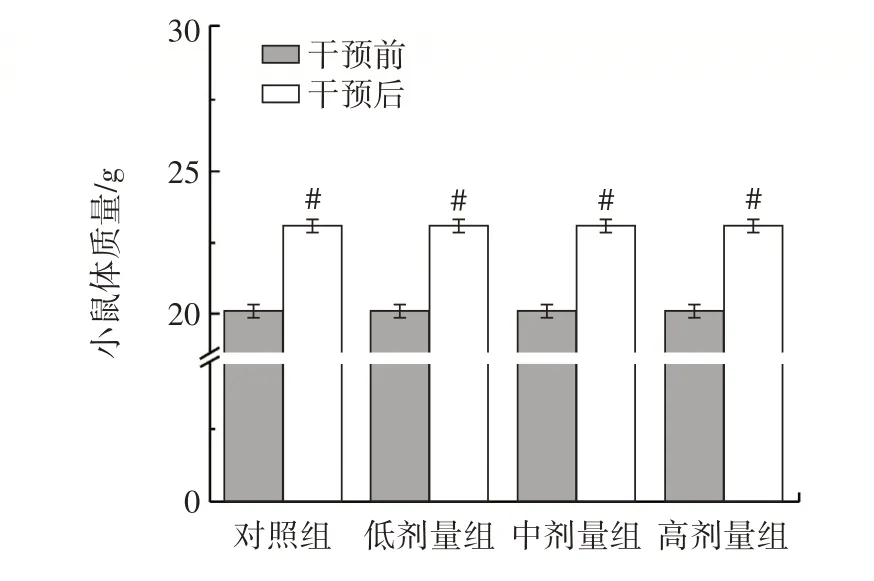
图1 副干酪乳酪杆菌Glory LP16 对小鼠体质量的影响Fig.1 Effect of Lactobacillus paracasei Glory LP16 on body weight of mice
由图1 可知,干预前,各组小鼠体质量无明显差异。与干预前相比,干预14 d 后各组小鼠体质量显著增加(P<0.05),但各组之间无明显差异,这意味着副干酪乳酪杆菌Glory LP16 对小鼠的消化吸收、代谢或者其他生理过程产生了积极的影响,对小鼠的生长无不良影响[9]。
2.2 副干酪乳酪杆菌Glory LP16 对肠道菌群的影响
副干酪乳酪杆菌Glory LP16 对小鼠肠道菌群的影响如图2 所示。
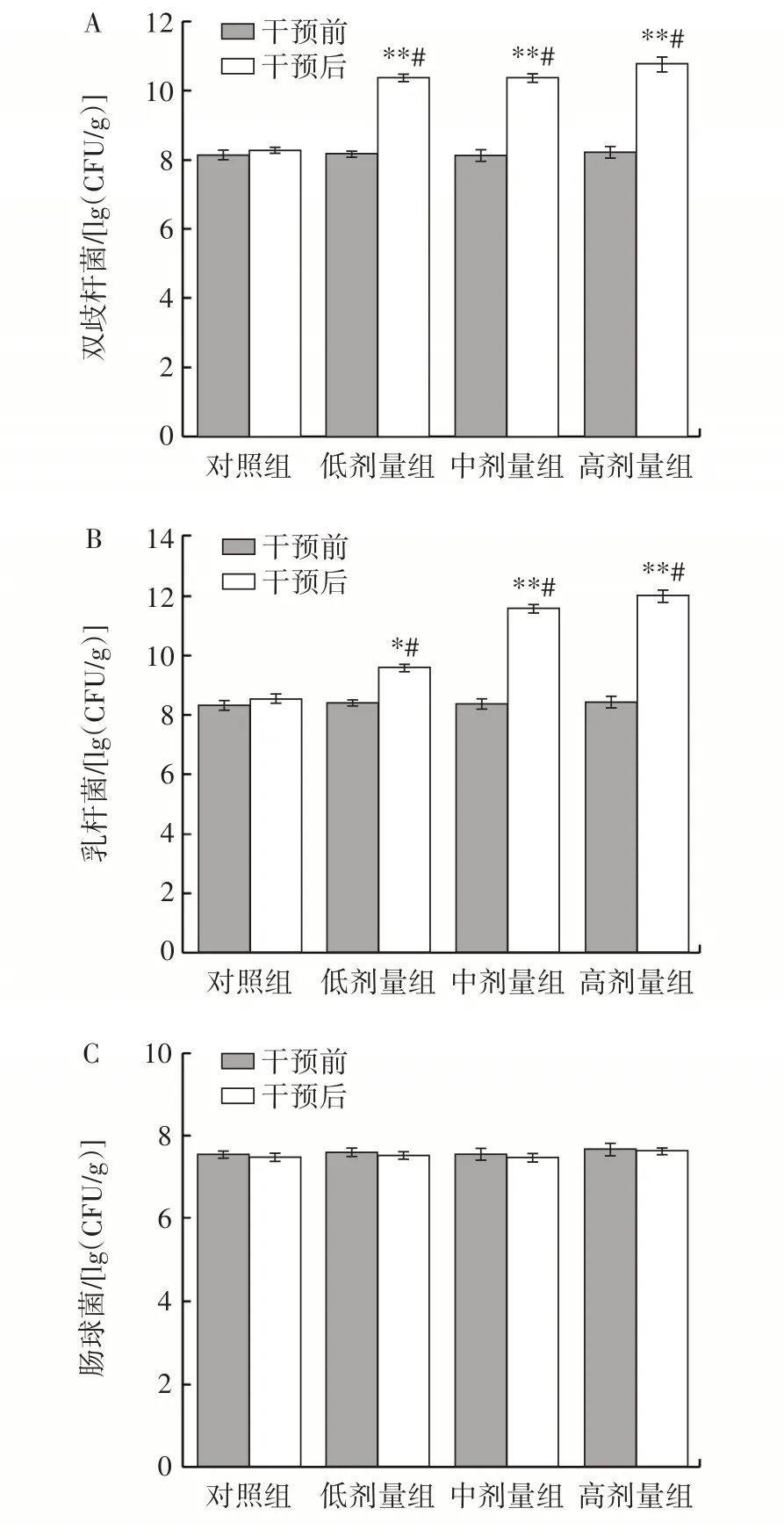
图2 小鼠肠道菌群的变化Fig.2 Changes in intestinal flora of mice
由图2 可知,小鼠在干预前,小鼠粪便中各类菌含量无显著差异(P>0.05),这表明不同组的小鼠肠道菌群较为一致。干预前后相比,对照组小鼠粪便中的肠道菌群无显著差异(P>0.05);各组小鼠灌胃给予副干酪乳酪杆菌Glory LP16 14 d 后,小鼠粪便内乳杆菌、双歧杆菌均显著增加(P<0.05);肠杆菌和肠球菌未见显著变化(P>0.05);产气荚膜梭菌显著减少(P<0.05)。干预后与对照组相比,灌胃给予副干酪乳酪杆菌Glory LP16 14 d 后,低、中、高剂量组小鼠粪便双歧杆菌极显著升高(P<0.01);中、高剂量组小鼠粪便乳杆菌极显著升高(P<0.01),产气荚膜梭菌极显著降低(P<0.01);低剂量组小鼠粪便乳杆菌显著升高(P<0.05),产气荚膜梭菌显著降低(P<0.05);其他组别小鼠粪便菌群无显著性差异(P>0.05)。这可能与小鼠的周龄有关,随着周龄的增长,小鼠的肠道容量也增加,从而导致肠道菌群种类和数量以及肠道环境发生变化,但总体趋势是益生菌的含量增加,致病菌含量减少[10-11]。根据保健食品检验与评价技术规范中的判定标准,如果双歧杆菌或乳杆菌明显增加,而肠球菌、肠杆菌、产气荚膜梭菌减少或无明显变化或增加幅度低于双歧杆菌、乳杆菌的增加幅度,则可以判定样品在调节肠菌群功能方面具有阳性效果。根据干预后肠道菌群变化符合阳性结果判定标准的推论,可以得出,副干酪乳酪杆菌LP16 具有调节肠道菌群的作用。
2.3 副干酪乳酪杆菌Glory LP16 对小鼠肠道组织病理分析
HE 染色的结果反映了各实验组小鼠小肠的组织病理变化情况,并可以以此来评价副干酪乳酪杆菌Glory LP16 对肠黏膜组织结构的影响。副干酪乳酪杆菌Glory LP16 对小鼠肠道组织病理分析如图3所示。
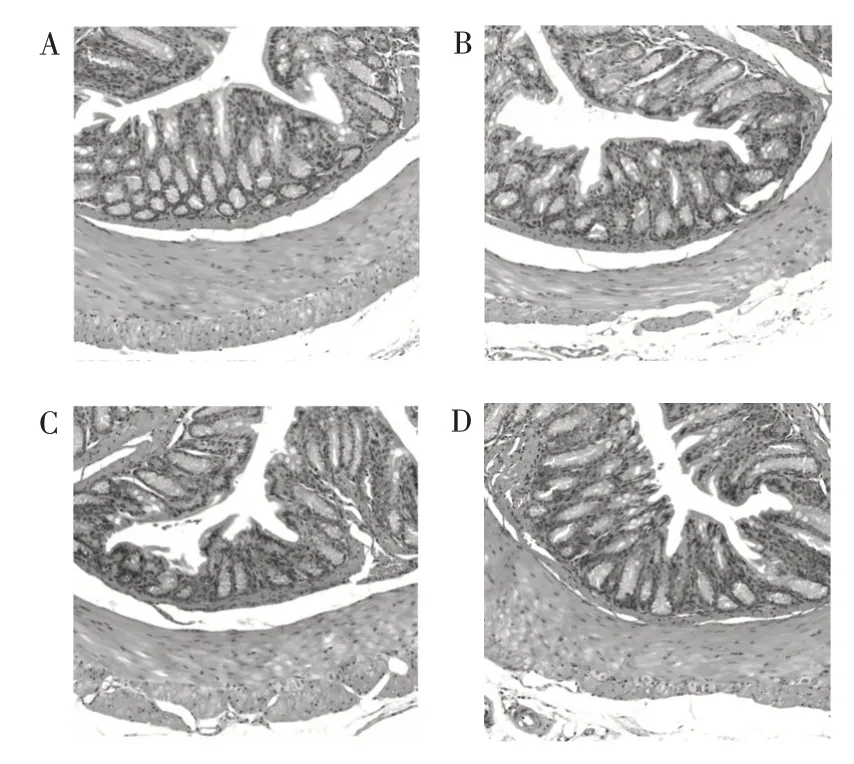
图3 小鼠结肠组织病理学(HE 染色)Fig.3 Mouse colon histopathology(HE staining)
由图3 可知,与对照组相比,低、中、高剂量组的小鼠结肠黏膜腺体排列整齐,上皮组织完整清晰,隐窝、杯状细胞无损伤,无炎症细胞浸润,无溃疡面。因此,可以推断副干酪乳酪杆菌Glory LP16 没有破坏肠黏膜组织结构,维持了肠道组织完整性,这与Pachlová 等[12]研究结果一致。
2.4 副干酪乳酪杆菌Glory LP16 对小鼠肠道屏障的影响
根据已有研究,黏蛋白1(MUC1)、黏蛋白2(MUC2)和紧密连接蛋白(Claudin-1、Occludin、ZO-1)的mRNA 表达量可以间接反映肠道屏障的功能。各组小鼠黏蛋白和紧密连接蛋白的相关mRNA 表达量表达水平比较如表2 所示。
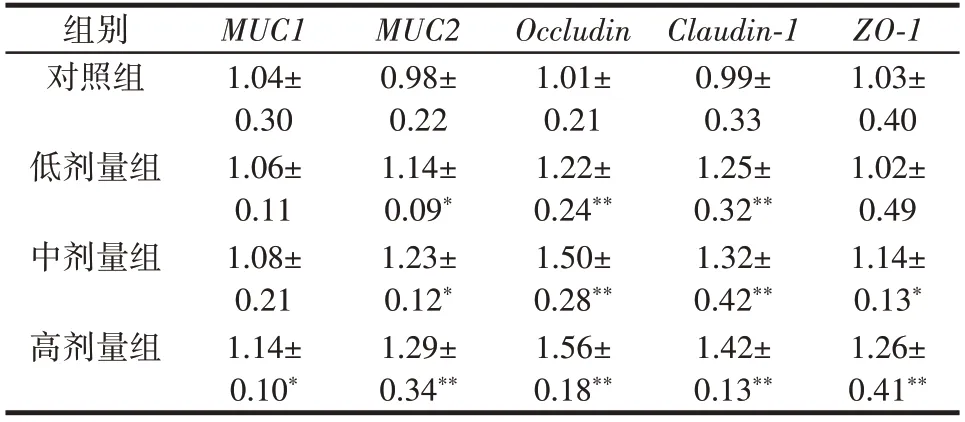
表2 各组小鼠黏蛋白和紧密连接蛋白的相关mRNA 表达量表达水平比较Table 2 Expression of mRNAs related to mucin and tight junction proteins in mice of each group
由表2 可知,与对照组相比,副干酪乳酪杆菌组小鼠肠道MUC1、MUC2、Occludin、ZO-1与Claudin-1蛋白的mRNA 表达量都增加,差异呈显著性(P<0.05)。随着副干酪乳酪杆菌剂量的增加,黏蛋白和紧密连接蛋白的mRNA 表达量也随之增加。这表明副干酪乳酪杆菌还能够调节紧密连接蛋白的表达,增强肠道上皮细胞之间的连接性,加强肠道屏障的完整性,副干酪乳酪杆菌通过多种机制,促进肠道屏障的功能,有助于维护肠道健康和预防肠道疾病[13]。
2.5 副干酪乳酪杆菌Glory LP16 对小鼠肠道通透性的影响
在分子水平上,LPS 和D-乳酸是评估肠道屏障损伤的重要指标。LPS 通常存在于革兰氏阴性菌的外膜中,可以增加胃肠黏膜上皮的通透性,使内毒素能够通过细胞旁透作用进入肠内,从而引起细胞因子的失控性表达,加剧肠道炎症[14]。体内脂多糖炎症模型是目前较为常见的肠黏膜损伤免疫应激模型[15]。本研究使用LPS 检测试剂盒和D-乳酸检测试剂盒分别检测小鼠血清中LPS 和D-乳酸的含量,从而探究副干酪乳酪杆菌对小鼠肠道屏障通透性的影响,结果如图4 所示。
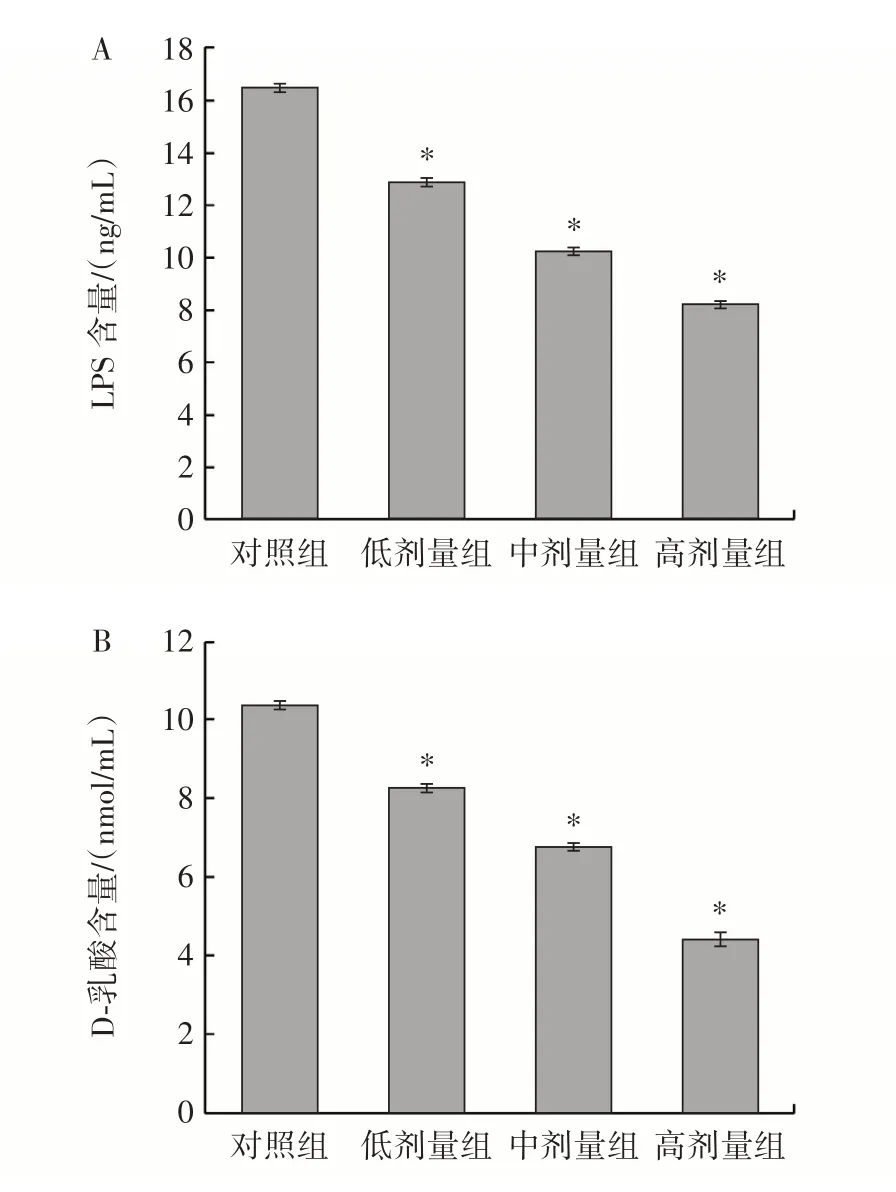
图4 肠道通透性测定Fig.4 Measurement of intestinal permeability
由图4 可知,与对照组相比,副干酪乳酪杆菌组中LPS 和D-乳酸的含量显著降低(P<0.05)。这表明副干酪乳酪杆菌可以有效提升肠道屏障,减少LPS 和D-乳酸的泄漏。结果表明副干酪乳酪杆菌对维护肠道屏障功能有积极影响。
2.6 副干酪乳酪杆菌Glory LP16 对小鼠肠道短链脂肪酸含量的影响
肠道短链脂肪酸(short chain fatty acids,SCFAs)也称作挥发性脂肪酸,作为一种重要的微生物代谢产物,由难消化多糖的糖酵解产生[16],在宿主局部环境和系统环境中的多个靶标中发挥着关键作用,特别是在肠道屏障和免疫中[17]。SCFAs 的种类和数量决定于肠道菌群和机体生理状态等因素[18]。肠道内SCFAs 的含量不仅可以反映肠道细菌的活力,还强烈影响着肠道细胞代谢[19]。其中乙酸、丙酸和丁酸是常见的代谢产物。副干酪乳酪杆菌Glory LP16 对小鼠肠道短链脂肪酸含量如图5 所示。
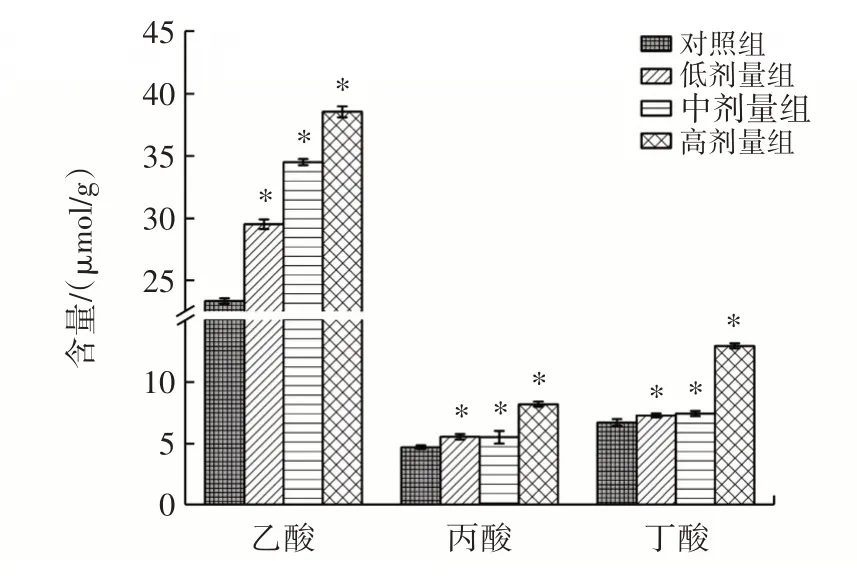
图5 小鼠肠道短链脂肪酸含量Fig.5 Content of short-chain fatty acid
由图5 可知,与对照组相比,干预14 d 后短链脂肪酸含量显著提高(P<0.05)。乙酸含量明显高于丁酸及丙酸的含量,这可能是由于副干酪乳酪杆菌通过糖类的代谢途径产生乙酸。在糖类的代谢过程中,副干酪乳酪杆菌Glory LP16 将糖类分解为较小的分子,然后进一步代谢产生乙酸。这个过程需要多个酶的参与,包括糖类分解酶、乙酰辅酶A 合成酶等[20]。副干酪乳酪杆菌Glory LP16 可能具有较高的糖类代谢酶活性,导致乙酸的生成量较高[21]。丁酸和丙酸含量相对较低可能是因为副干酪乳酪杆菌Glory LP16 在其他代谢途径上的酶活性不够优化。除了糖类代谢途径,副干酪乳酪杆菌还可以通过其他代谢途径产生SCFAs,如蛋白质和脂肪的代谢[22]。然而,副干酪乳酪杆菌Glory LP16 可能在这些代谢途径上的酶活性相对较低,导致丁酸和丙酸的生成量较低。这表明副干酪乳酪杆菌Glory LP16 有助于小鼠肠道中乙酸、丙酸和丁酸的合成。
3 讨论
肠道健康是当下世界持续关注的重点健康问题,维持肠道菌群在数量上和分布上的平衡状态对维护机体健康具有重要意义[23]。本研究发现副干酪乳酪杆菌Glory LP16 对小鼠生长具有积极作用,对能量的摄取和利用起着重要调节作用。摄入副干酪乳酪杆菌Glory LP16 的小鼠小肠黏膜组织结构完好,腺体排列整齐,这与田丰伟等[24]关于副干酪乳酪杆菌LC01 调节人体肠道菌群的结果一致。摄入副干酪乳酪杆菌Glory LP16 的小鼠促进了肠道中双歧杆菌和乳杆菌的增殖,根据保健食品检验与评价技术规范中调节肠道菌群和通便功能评价方法,可推测摄入副干酪乳酪杆菌Glory LP16 对于改善肠道微生态,促进肠道健康具有积极的作用。
肠道屏障功能对于肠道炎症的发展至关重要[25]。黏蛋白(MUC1、MUC2)和紧密连接蛋白(Claudin-1、Occludin、ZO-1)是构成肠黏膜屏障的重要成分,影响着肠道黏膜的通透性和完整性。黏蛋白在肠道上皮细胞表面形成黏膜屏障,当其异常表达导致屏障结构破坏时,会引发肠道炎症的发生[26]。本研究发现,高剂量组副干酪乳酪杆菌Glory LP16 的摄入可以显著提高黏蛋白(MUC1、MUC2)和紧密连接蛋白(Claudin-1、Occludin、ZO-1)的mRNA 表达水平。此外,高剂量组小鼠血清中LPS 和D-乳酸的含量显著降低,短链脂肪酸(乙酸、丙酸、丁酸)含量增加。这均表明副干酪乳酪杆菌Glory LP16 可以通过提高肠道屏障功能来发挥作用,从而维护肠道的完整性和健康。这一研究结果与其他类似的研究结果相似,进一步验证了副干酪乳酪杆菌Glory LP16 在肠道屏障保护方面的作用[27-28]。
4 结论
副干酪乳酪杆菌Glory LP16 对小鼠生长和调节肠道菌群方面具有积极的作用,同时还能够维护小鼠肠道组织的完整性、增强肠道屏障、改善肠道通透性,并且提高短链脂肪酸的含量。本研究结果为副干酪乳杆菌Glory LP16 益生菌制剂的合理应用以及保健食品的开发提供了理论依据。
