模拟冷链物流过程中温度波动对牛肉丸品质劣变及干耗的影响
2024-04-12李华乐王兆明陈琪琪袁晶晶徐宝才
李华乐,王兆明,2,陈琪琪,袁晶晶,徐宝才,2*
(1.合肥工业大学 食品与生物工程学院,安徽 合肥 230031;2.合肥工业大学 动物源食品绿色制造与资源挖掘安徽省重点实验室,安徽 合肥 230031)
随着生活水平的提高,肉类预制菜产业在我国得到了快速发展,为广大消费者提供了丰富、便利的食品选择。肉类预制菜以其独特的口感、较高的营养价值和便捷性,受到人们的喜爱。然而,肉类预制菜产业的发展,离不开冷链物流的支持。冷链物流作为食品产业链中的重要一环[1],其稳定性直接影响食品的品质和安全性[2]。在肉类预制菜产业中,冷链物流保证了肉制品从生产、加工到销售的每一个环节都能在适宜的温度环境下进行,最大程度地保持肉制品的新鲜度和风味。因此,冷链物流的运行效率和稳定性,成为保证肉制品品质的关键。然而,实际操作中,冷链物流过程中的温度波动是难以完全避免的[3],且其对肉制品的品质和安全性影响十分显著。特别是在长距离运输和极端气候条件下,温度波动会加速肉制品的品质劣变[4]。近年来,冷链物流所使用的设备和技术已经显著改善,但是肉品品质劣变问题仍然存在[5]。
肉类预制菜不仅营养价值高,而且风味独特。但在冷链物流中,温度波动引起的冰晶形成和生长可能会破坏肉类的微观结构,导致细胞内营养成分的流失,进而对其感官品质和营养价值产生不良影响,具体表现为食品的色泽、口感和风味的变化[6]。此外,冰晶生长可能导致包装破裂,增加了微生物污染的风险,进而影响食品的卫生安全。因此,对冷冻过程中的冰晶生长进行有效控制是确保冷冻牛肉丸品质的关键环节。
冷藏干耗也是影响肉品品质的一个重要因素。干耗产生的原因是肉品冷藏过程中水分与外界空气进行热湿交换。当肉品的表面湿度降低时,会导致肉品表面脂肪氧化、口感变差、肉质变硬等多种问题的产生,严重时会使肉品无法食用[7]。针对这一问题,相关领域的专家以及学者们积极开展了一系列肉品冷链物流方面的研究工作并取得了一定进展[8]。研究表明,肉品保存的温度一旦出现较大的波动,就会使肉品产生的干耗现象更加剧烈[9],导致肉品品质发生明显变化。因此,对于肉品冷链物流中温度波动的影响以及相关技术的研究具有重要的意义。
本文以冷冻牛肉丸为例,通过模拟冷链过程中常见的温度波动现象,探讨温度波动对牛肉丸品质劣变及干耗的影响。探讨冷链物流中其他因素(如水分分布、冰晶形态等)对牛肉丸品质的影响,并对未来肉品冷链物流的发展趋势和研究方向进行展望,以期为肉品冷链物流领域的研究提供参考。
1 材料与方法
1.1 材料与试剂
牛后腿肉(18~20 月龄):市售。样品收集后,放置在保温箱中覆上碎冰,并于当天运至合肥工业大学食品与生物工程学院肉品加工与创新实验室进行样品处理。
NaCl、碳酸氢钠、三聚磷酸钠、玉米淀粉、大豆分离蛋白、氯化钾、硫代巴比妥酸(thiobarbituric acid,TBA)、三氯乙酸(trichloroacetic acid,TCA)、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、盐酸、硼酸、氧化镁、碳酸钙:国药集团化学试剂有限公司;平板计数琼脂培养基(plate counting agar medium,PCA)、总巯基检测试剂盒、无水乙醇:生工生物工程(上海)股份有限公司;溴甲酚绿、甲基红:上海麦克林生化科技有限公司。所用试剂均为分析纯。
1.2 仪器与设备
绞肉机(HX-J681A):佛山市海迅电器有限公司;冰箱(BC/BD-318HD):青岛海尔特种电冰柜有限公司;均质器(TTL-260):北京同泰联科技发展有限公司;多功能酶标仪(Synergy H1):美国Bio-Tek 仪器公司;振荡培养箱(BSD-250):上海博迅实业有限公司医疗设备厂;高温高压灭菌锅(YX280A):上海三申医疗器械有限公司;高速冷冻离心机(CT14RD):上海天美生化仪器设备工程有限公司;数显恒温水浴锅(HH-2):江苏金坛金城国胜实验仪器厂;pH 计(Five Easy Plus):梅特勒-托利多仪器(上海)有限公司;质构仪(TA.XT plus):英国Stable Micro Systems 公司;核磁共振成像分析仪(NMI20):苏州纽迈分析仪器股份有限公司;分光测色仪(TS7600):深圳市三恩时科技有限公司;光学显微镜(SMZ800N):苏州南光电子科技有限公司。
1.3 试验方法
1.3.1 试验设计
新鲜的牛后腿肉去除可见的脂肪与结缔组织后,分割成块状清洗干净置于绞肉机中搅碎,加入0.2%氯化钠、0.5% 碳酸氢钠、0.3% 三聚磷酸钠、3% 玉米淀粉、3% 大豆分离蛋白、20% 冰水等配料斩拌成肉糜,制成(25±2)g 的肉丸。在50 ℃温水中定型15 min 后转移到75 ℃水中5 min,待其冷却后采用托盘包装进行分装。将处理好的样品进行冷链运输过程模拟,分为冷链一、冷链二。其中,冷链一(记为L1)全程-18 ℃,冷链二(记为L2)处于温度波动状态。在每个关键点采集3 个样本作为平行样本,并根据不同的采样点进行编号,每个采样点另取一份样品放置于-80 ℃的冰箱中备用。试验设计见图1。
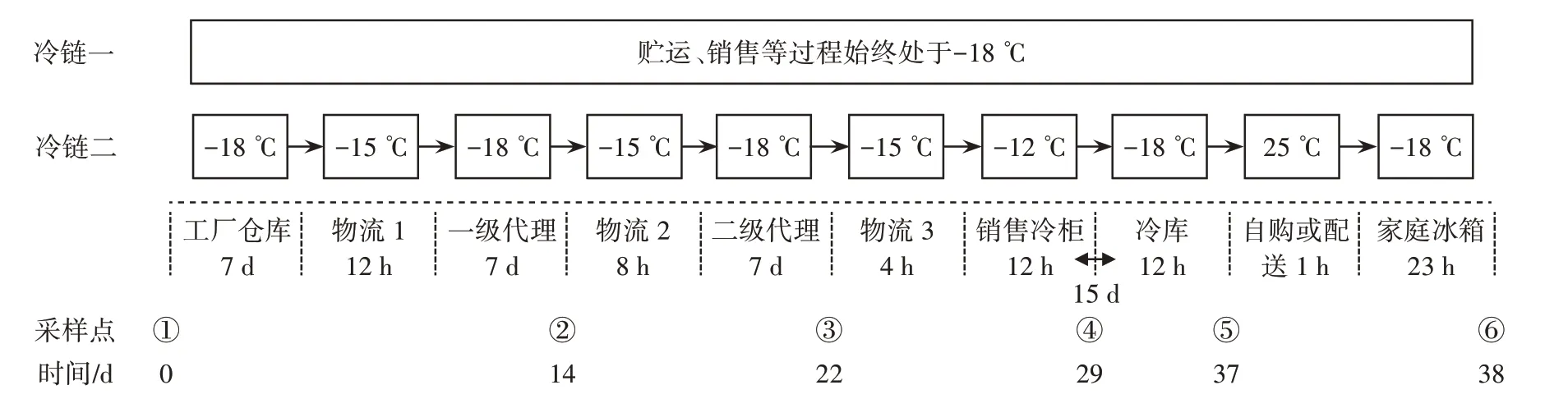
图1 试验设计Fig.1 Design of experiments
1.3.2 色泽测定
使用分光测色仪测量不同处理组牛肉丸样品的色泽,选取样品表面不同部位进行测定,每个处理组进行3 次平行试验以获得平均值,分别记录L*值、a*值、b*值。为使测量结果更加准确,测量前先对分光测色仪进行校准。
1.3.3 pH 值测定
pH 值根据Lan 等[10]的方法进行测定,使用均质器将10 g 样品在90 mL KCl 溶液(0.1 mol/L)中均匀化2 min 制备匀浆。利用pH 计进行测定。
1.3.4 质构的测定
参考张洁等[11]的方法并稍加修改,样品的全质构选用质构仪的P/36R 探头进行测定。将样品切成约1 cm×1 cm×1 cm 的立方体置于探头下,对样品的硬度、弹性、咀嚼度进行测定。设定仪器测试参数:测前速度为1 mm/s;测试速度为5 mm/s;测后速度为5 mm/s;两次压缩之间的时间延迟为5 s,样品压缩距离为40%;触发力为5 g。
1.3.5 菌落总数(total viable count,TVC)的测定
菌落总数的测定参考王明娟等[12]的方法,将10 g牛肉丸样品放置在90 mL 无菌生理盐水(0.9% NaCl)中,用无菌均质器均质2 min,取出1 mL 上清液,进行10 倍梯度稀释,采用PCA 培养基平板倾注法进行微生物培养,于37 ℃培养48 h。每组进行3 次平行试验,取平均值,结果以菌落总数的对数lg(CFU/g)表示。
1.3.6 总巯基含量测定
使用总疏基检测试剂盒[5,5′-dithiobis-(2-nitrobenzoic acid),DTNB 法]说明书进行测量。
1.3.7 脂质氧化测定
采用硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)来测定脂质氧化的程度[13]。将在4 ℃下解冻3 h 的样品切碎(以下解冻方法相同),取5 g 样品于250 mL 锥形瓶,加入50 mL 7.5%的三氯乙酸溶液(含0.01%乙二胺四乙酸二钠),然后50 ℃水浴振荡30 min,冷却至室温后,用两层定量滤纸过滤,取5 mL 滤液,与5 mL 0.02 mol/L TBA 溶液混合,在90 ℃水浴条件下静置30 min。使用相同浓度的TCA混合物作为空白对照,并通过比色法测定532 nm 波长下的吸光度。结果以丙二醛含量(X,mg/kg)表示,计算公式如下。
X=C×V×1 000/(m×1 000)
式中:C为试样溶液丙二醛浓度,μg/mL;V为试样溶液定容体积,mL;m为试样质量,g。
1.3.8 水分指标的测定
1.3.8.1 冻结干耗损失率的测定
在贮藏前将牛肉丸样品依次编号并称重W1(g),在每个采样点再次称取其质量W2(g),冻结干耗损失率(G,%)的计算公式如下。
G=(W1-W2)/W1×100
1.3.8.2 离心损失率的测定
取5 g 牛肉丸样品M1,置于带有滤纸的离心管中,8 000×g离心10 min 后取出称其质量M2,离心损失率(L,%)的计算公式如下。
L=(M1-M2)/M1×100
1.3.8.3 蒸煮损失率的测定
参考张燕等[14]的方法,称取牛肉丸样品质量m1(g),置于75 ℃水浴中煮至中心温度为70 ℃保持20 min 后取出,擦干表面水分后称其质量m2(g)。蒸煮损失率(Z,%)的计算公式如下。
Z=(m1-m2)/m1×100
1.3.8.4 低场核磁共振分析
低场核磁共振弛豫的测定参考谢勇[15]的方法并稍加修改,先将解冻的牛肉丸样品修整为1 cm×1 cm×2 cm 后放入15 mm 核磁管中。使用Niumag NMR 分析软件和carr-purcell-meiboom-gill(CPMG)序列测量横向弛豫时间(T2)。将收集到的样品的T2衰减曲线转换为弛豫模型进行合并和反演。通过multiple spinecho(MSE)成像序列获取质子密度图像,将样品分为4 层进行分析,间隙为0.5 mm,每层的宽度为2.9 mm,图像中的质子密度的分布通过Niumag NMR 分析软件处理。
1.3.9 冰晶形态的观察
参考Luan 等[16]的方法并稍加修改,使用预先冷却至-18 ℃的刀片从不同处理组的牛肉丸样品中切下1 cm×1 cm×1cm 的肉样,然后立即放入肌肉组织固定液中固定24~48 h,整个操作过程均在低温环境中进行以保持完整的冷链。固定完成后用70% 乙醇浸泡20 min 脱水处理,乙醇挥发后进行石蜡包埋、切片染色,最后用光学显微镜观察。
1.4 数据处理
所有试验都通过3 份平行样品进行3 次独立重复试验,统计分析采用SPSS 软件25.0 版。利用单因素方差分析和邓肯检验分析数据,p<0.05 被认为是显著的。
2 结果与讨论
2.1 pH 值与色泽的变化
模拟冷链期间牛肉丸的pH 值变化见图2。
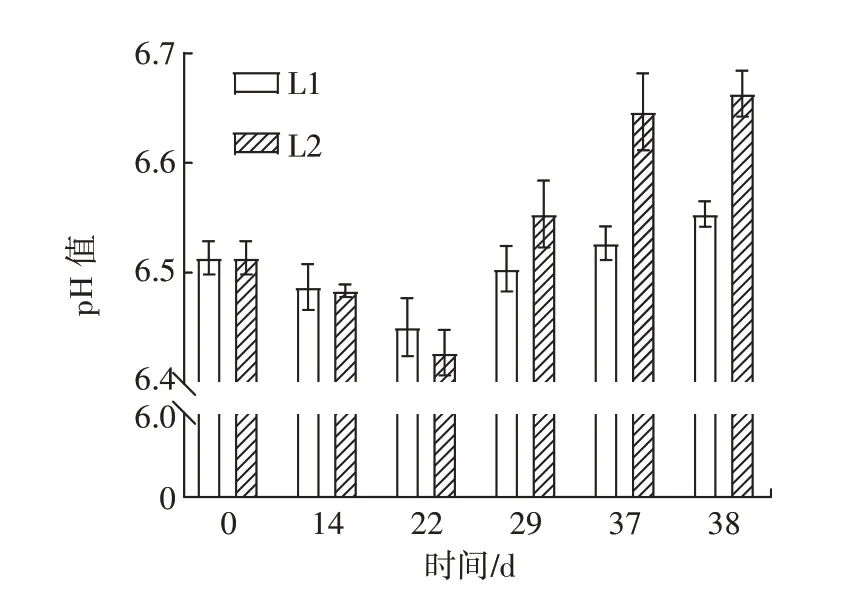
图2 不同处理组样品pH 值变化Fig.2 pH changes of samples in different treatment groups
由图2 可知,在整个过程中不同处理组的样品pH值均呈现出先降低后升高的趋势。牛肉丸的初始pH值为6.51,在第22 天时冷链一处理的样品pH 值降低到6.45,冷链二处理组降低到6.42。随后两组的pH值均呈上升趋势,在模拟的第38 天时分别上升到6.55、6.66。在肉制品中,pH 值的变化通常被认为与肉品的色泽、风味有一定的关系,冷冻过程中脂肪的氧化反应会产生酸性物质,使样品pH 值降低。细菌活性也会对pH 值产生影响,冷冻过程抑制了细菌活性,但随着细菌的死亡和腐败,蛋白质分解产物和其他碱性化合物的释放会导致pH 值升高[17]。此外,随着时间的推移,样品中冰晶也在不断生长,肉体系的蛋白完整性遭到破坏,微生物酶将蛋白质与核苷酸等分解,造成碱性化合物累积使样品在后续的贮藏过程中pH 值不断升高。这可能是样品pH 值产生变化的主要原因。此外,在温度波动的情况下,样品的pH 值变化幅度较恒温冷链更大。
肉制品色泽是评价肉制品是否新鲜的重要指标,也是影响消费者购买行为的主要因素之一。不同处理组样品色泽变化结果见表1。
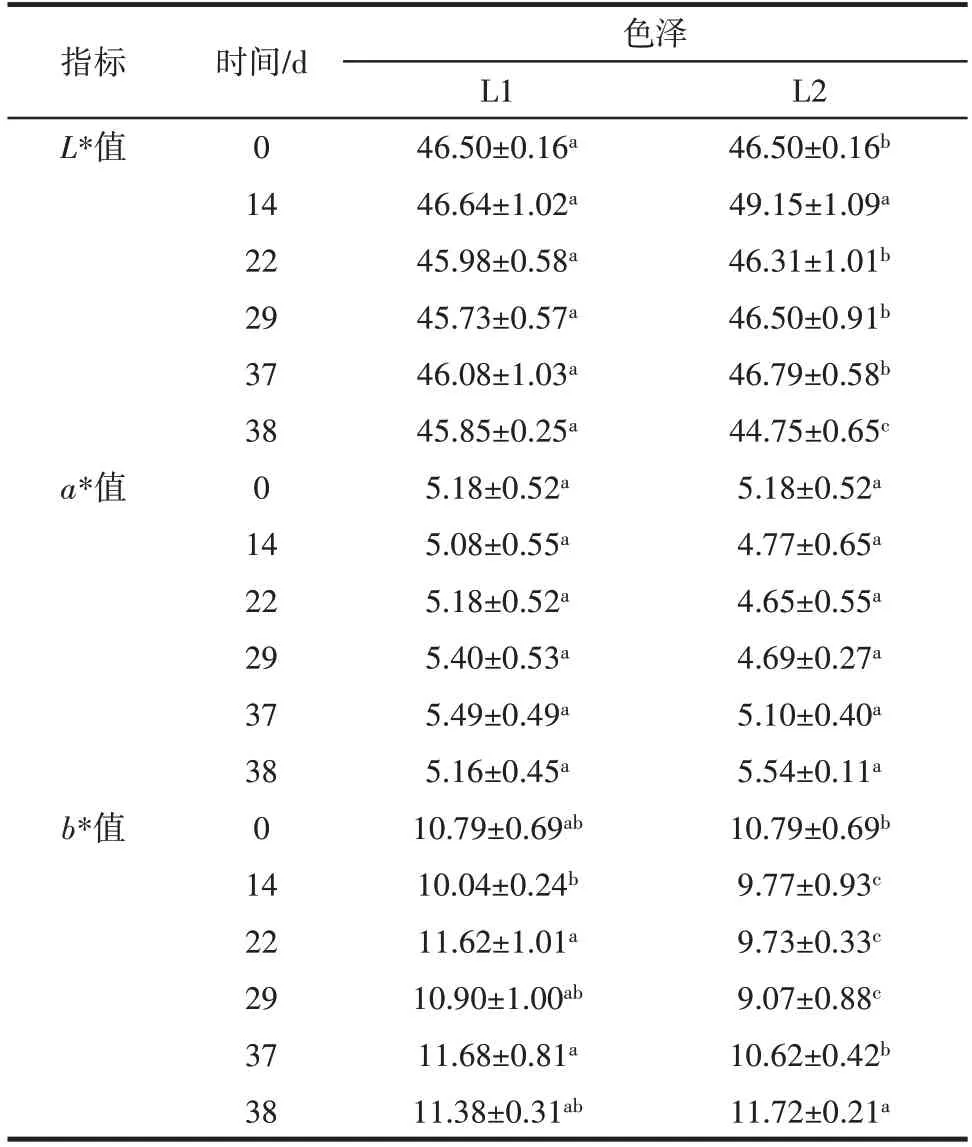
表1 不同处理组样品色泽变化Table 1 Color changes of samples in different treatment groups
由表1 可以看出,在模拟冷链的过程中,冷链一处理组的样品L*值与a*值无显著差异(p>0.05)。b*值整体上呈现出上升趋势。相比之下,冷链二处理组中a*值在整个过程中并无显著变化(p>0.05),L*值由初始的46.50 在14 d 后增加到49.15,而后在第38 天时降低到44.75,b*值呈现出先下降后上升的趋势,与恒温处理组(L1)相比,温度波动处理组(L2)的L*值、a*值与b*值的变化幅度更大。这可能是由于温度波动导致的脂质氧化和蛋白质氧化等变质反应加剧,影响了肉丸的色泽[18]。
2.2 质构分析
质构与肉制品的感官属性和适口性具有很高的相关性,决定了产品的品质[19]。不同处理组样品质构变化见图3。
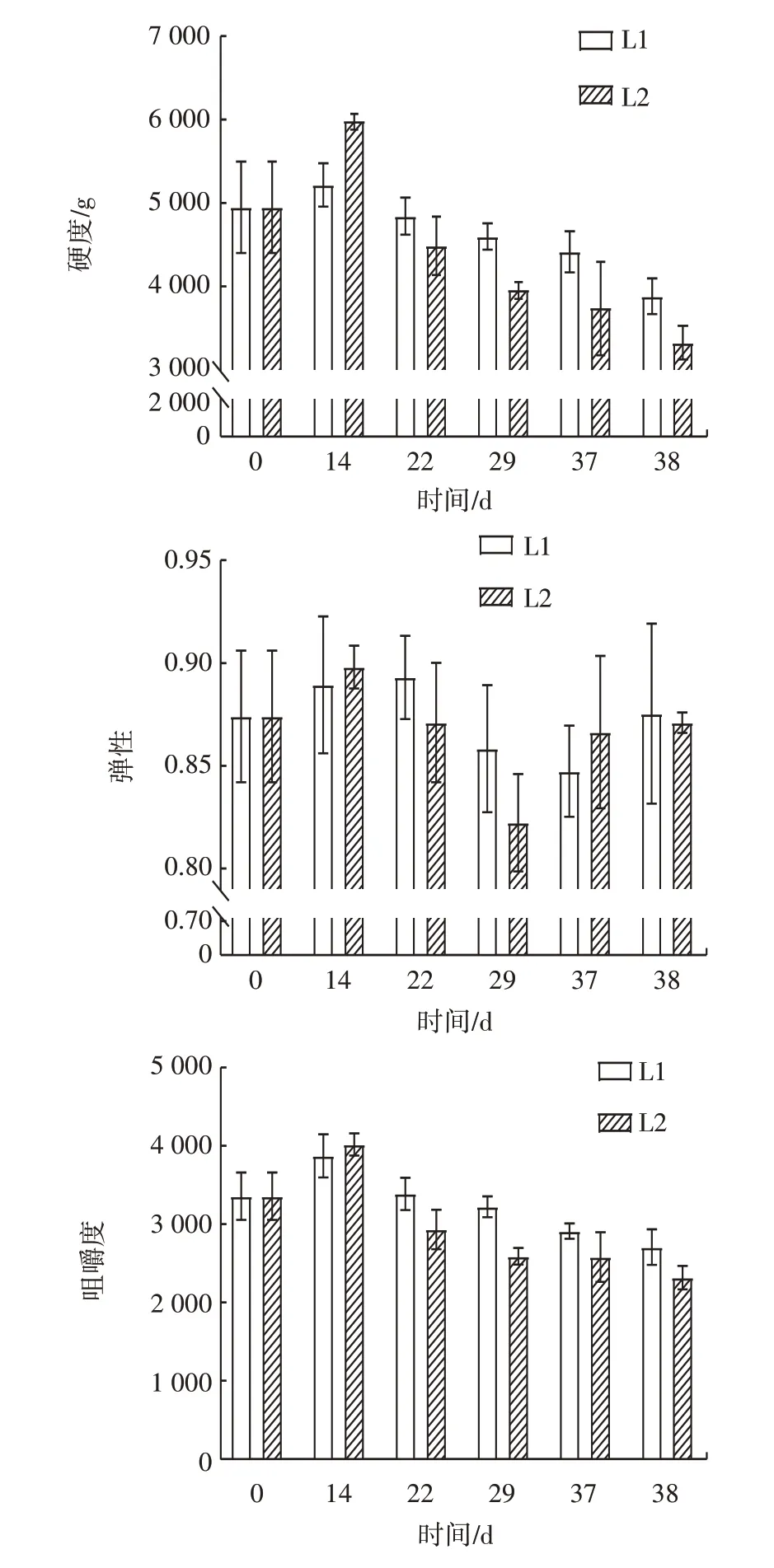
图3 不同处理组样品质构变化Fig.3 Texture changes of samples in different treatment groups
由图3 可知,在整个模拟冷链物流的过程中,0~14 d 时,牛肉丸硬度与咀嚼度均增加,这可能是由于蛋白质的变性和水分的流失。然而14~38 d 时随着贮藏时间的延长,硬度与咀嚼度逐渐降低。这种变化可能是由于蛋白质的分解和水分重新分布的影响,导致牛肉丸变得更柔软、更易咀嚼。同样地,牛肉丸的弹性也在贮藏过程中发生变化。初始阶段,牛肉丸可能具有一定的弹性,但随着贮藏时间的延长,弹性整体呈下降趋势。这可能是蛋白质的降解、水分的流失以及脂肪的氧化等因素共同作用的结果。此外,冷链二处理组相比于冷链一处理组的质构特性变化更为明显。这可能是因为冷链二处理组处于温度波动的环境下,加速了冰晶的生长。冰晶的生长会影响肉中内部组织结构的完整性,破坏肌原纤维蛋白三维凝胶结构并导致水分发生迁移,使其质构特性受到更大的影响[17]。
2.3 菌落总数的变化
通常肉类表面会受到各种腐生微生物的污染。在肉制品中,细菌的生长会引起一系列变化,比如产生不悦的味道、气味和改变质地,最终导致不可食用。不同处理组样品菌落总数变化如图4 所示。
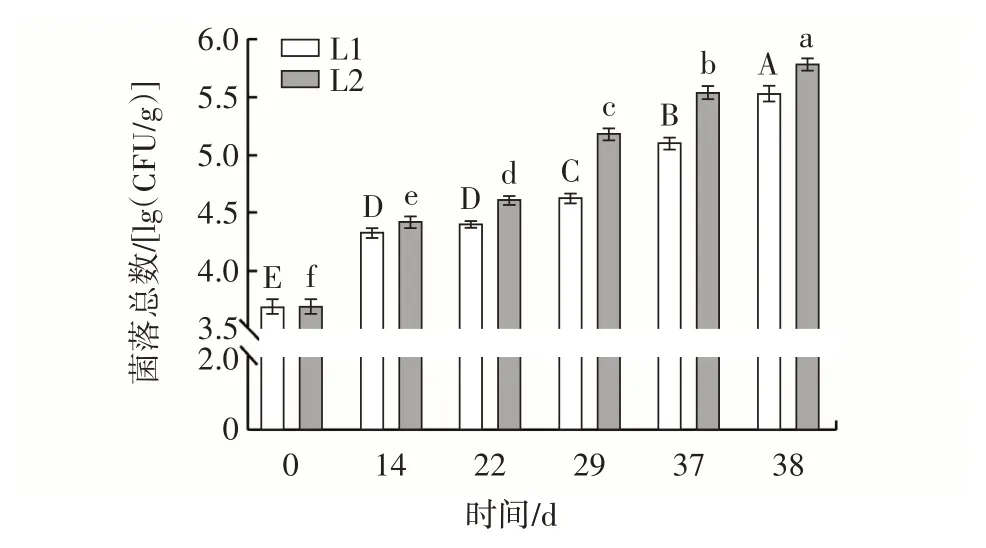
图4 不同处理组样品菌落总数变化Fig.4 Changes in total bacterial count of samples in different treatment groups
由图4 可知,在整个模拟冷链过程中不同处理组的菌落总数均呈不断上升趋势。其中冷链一处理组由初始的3.68 lg(CFU/g),在第38 天时上升至5.54 lg(CFU/g)。在整个模拟冷链过程中,冷链二牛肉丸样品中的菌落总数均高于冷链一,并且在第38 天时达到5.79 lg(CFU/g)。低温冷冻能够有效地抑制微生物生长繁殖,但在温度波动过程中,样品中蛋白质、脂质等物质的渗出为嗜冷微生物的生长提供了更多营养物质[20]。
2.4 贮藏过程中氧化指标分析
图5 描述了牛肉丸在不同处理条件下TBARS 值的变化。
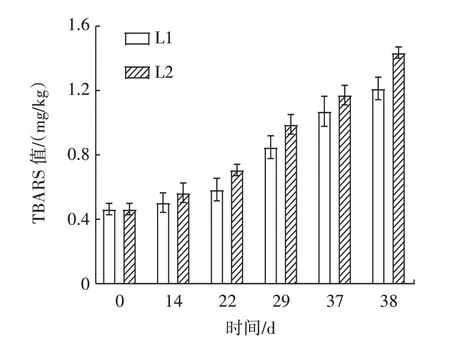
图5 不同处理组样品TBARS 值变化Fig.5 TBARS changes of samples in different treatment groups
由图5 可知,两组样品的TBARS 值均随着时间的延长而逐渐增加。与冷链二处理组相比,冷链一处理组样品在恒温状态下表现出更低的TBARS 值,表明温度波动加剧了脂质氧化程度。同时,脂质氧化是一级反应,作为一种温度依赖性反应,温度越高,氧化反应越快,这与已有研究发现,兔肉在冷藏和超低温贮存期间TBARS 值不断增加的结果相一致[18]。
TBARS 值是评价肉制品脂质氧化程度的常用指标。结果表明,牛肉丸在贮藏过程中发生了脂质氧化。一般来说,温度波动会加速冰晶的生长从而引起样品微观结构的破坏,导致氧化酶、脂肪酶等流出[21],同时在低水分活度下,干耗造成表面水分升华,留下孔洞,从而增加了与氧气的接触,这也是加速冷链二处理组氧化的重要原因。
蛋白质氧化会导致巯基含量减少,因为巯基易受自由基攻击氧化形成二硫键。因此,巯基含量的变化是反映蛋白质氧化程度的重要指标之一[22],不同处理组样品总巯基含量变化见图6。
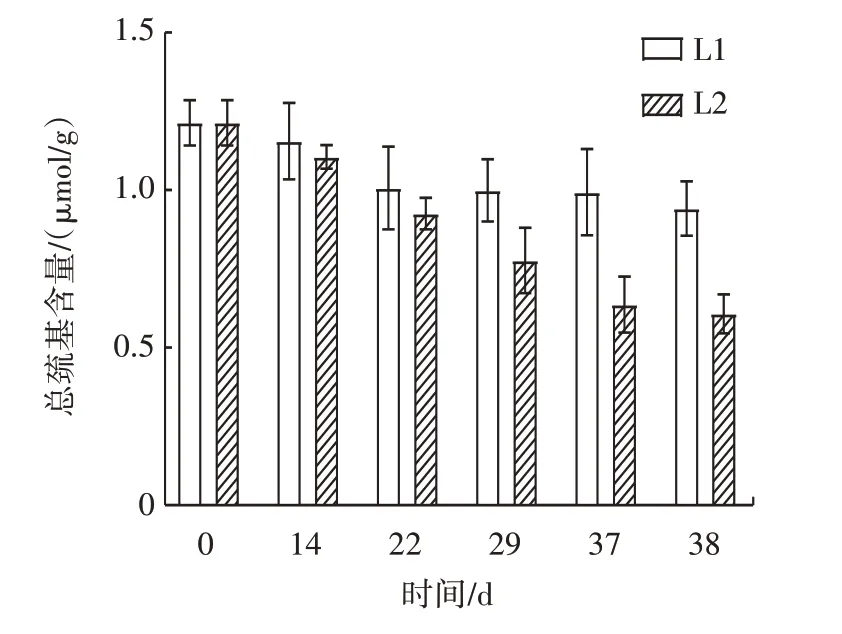
图6 不同处理组样品总巯基含量变化Fig.6 Changes in total sulfhydryl of samples in different treatment groups
由图6 可知,随着时间的延长,各处理组的总巯基含量都呈现下降趋势。相似地,文献[23]研究发现肌原纤维蛋白中巯基含量在冷藏过程中呈下降趋势,因为总巯基可与活性氧(reactive oxygen species,ROS)反应,形成磺酸、二硫键等氧化产物,从而降低总巯基含量[24],先前的研究也报告了类似的趋势[25-26]。其中冷链一处理组总巯基含量在整个过程中高于冷链二。冷链一由初始的1.121 μmol/g 至第38 天时下降到0.941 μmol/g,冷链二处理组经38 d 后下降到0.607 μmol/g。这可能是由于温度波动过程中样品的巯基更容易被氧化,形成分子内或分子间的二硫键[27]。
2.5 贮藏过程中牛肉丸持水性变化
2.5.1 贮藏过程中牛肉丸干耗损失的变化
不同处理样品干耗损失率变化见表2。
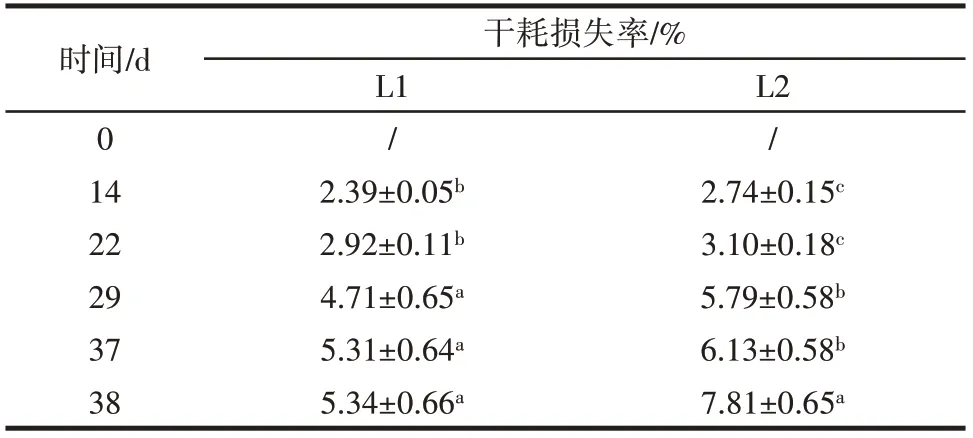
表2 不同处理组样品干耗损失变化Table 2 Changes in drying loss of samples in different treatment groups
由表2 可知,随着时间的延长,样品的干耗损失率逐渐增加,其中冷链二在整个过程中表现出更高的干耗损失率,这是因为在整个模拟冷链运输的过程中,冷链二处理组处于温度波动的条件下,样品内部形成了更大的冰晶体,从而引起了组织结构的破坏[28],进而导致肉丸的保水性降低,干耗损失率不断上升。
2.5.2 贮藏过程中牛肉丸离心损失与蒸煮损失的变化
持水力是评价肉品品质的重要指标,而离心损失率和蒸煮损失率均是评价肉品持水力的重要指标。不同处理组样品离心损失率与蒸煮损失率变化见图7。
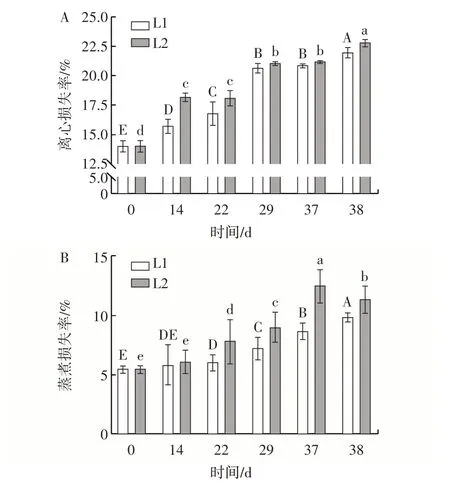
图7 不同处理组样品离心损失率与蒸煮损失率变化Fig.7 Changes in centrifugal loss and cooking loss of samples in different treatment groups
如图7A 所示,随着时间的延长,不同处理组牛肉丸样品的离心损失率整体呈现出不断上升的趋势,其中冷链一处理组的牛肉丸样品的离心损失率由初始的14.1% 经过38 d 后上升到22.0%。相比之下,冷链二处理组的样品在第29 天时离心损失率就已经达到21.1%,在第38 天时上升到22.8%。在整个过程中冷链一处于恒温状态,其离心损失率始终低于冷链二处理组,这可能与样品中冰晶形态与氧化程度有一定的关联[29]。
由图7B 可知,不同处理组的牛肉丸样品在整个模拟冷链过程中均呈现整体上升的趋势,且不同处理组之间的蒸煮损失率存在较大差异,其中冷链二处理组在第29 天时蒸煮损失率已经达到9.01%,与冷链一蒸煮损失率的最高值相接近。这与牛肉丸贮藏方式密切相关,在温度波动条件下,样品中蛋白三维网状结构更容易遭到破坏,纤维之间的水分更容易流出[30],从而使冷链二处理组的样品具有更高的蒸煮损失率。这与研究发现冰晶的生长会导致蛋白凝胶性能下降、氧化变性与结构遭到破坏,进而降低其持水能力的结果相一致[20]。综上,温度波动能够加快肉制品持水力的降低。
2.5.3 贮藏过程中牛肉丸水分迁移的变化
通过对牛肉丸样品进行低场核磁共振分析得到水分分布图,结果如图8 所示。
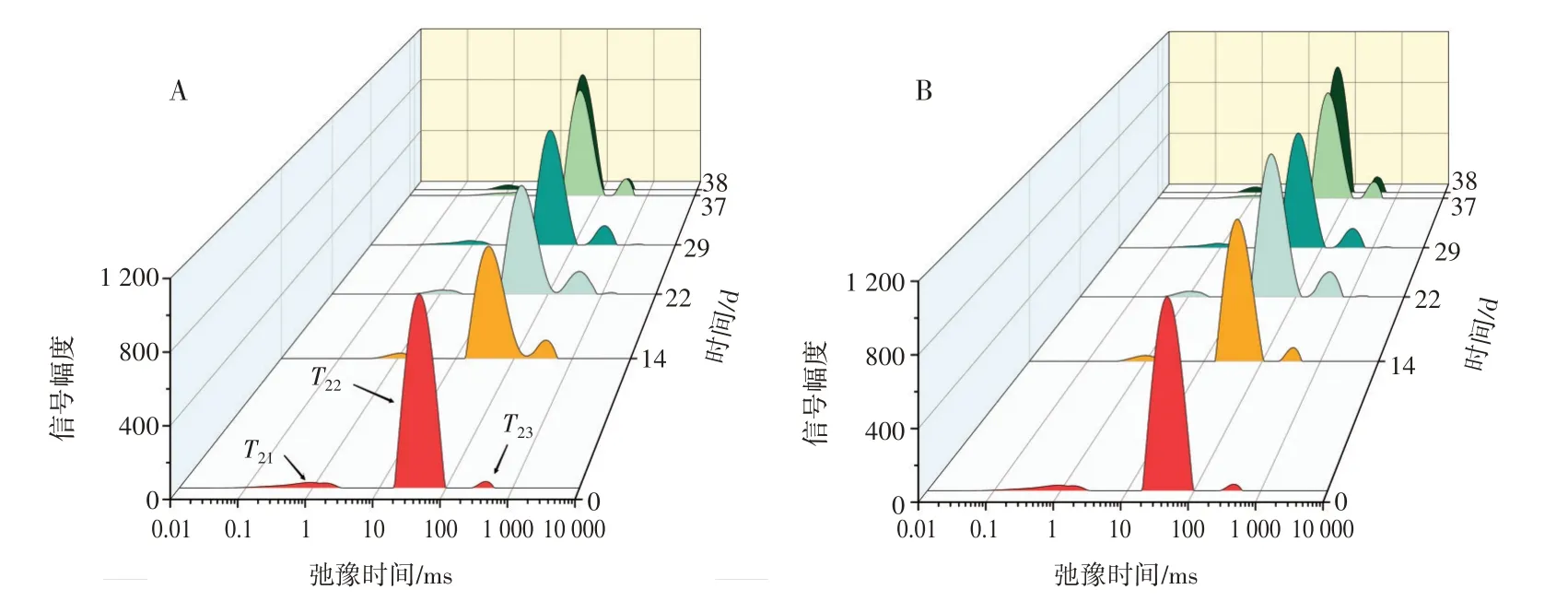
图8 不同处理组样品的T2 水分弛豫图Fig.8 T2 relaxation images of water in samples in different treatment groups
由图8 可知,T21在0.1~10 ms 代表结合水,T22在10~100 ms 代表不易流动水,T23在100~1 000 ms 代表自由水。随着温度波动次数增加,冷链一与冷链二处理组样品结合水含量有所降低,但变化并不明显,不易流动水含量随着时间的延长而有所降低,自由水含量呈先上升后下降的趋势,这可能是肉丸内部组织结构遭到破坏所导致。而后自由水以汁液的形式流出,自由水含量降低,因此肉丸中总含水量降低。这种现象在冷链二处理组中表现得更为明显,这可能是由于随着温度波动次数的增加,肌原纤维内的水分迁移到细胞外,形成了更大的冰晶体,对肉丸组织和细胞结构的破坏加剧。Ali 等[31]也在鸡胸肉冻融循环过程中发现了相同的变化趋势。
2.6 微观结构
冰晶大小对冷冻肉制品的品质具有重要影响。因此,通过观察冰晶形态可以更好地了解肉制品品质的变化。不同处理组样品冰晶形态变化见图9。

图9 不同处理组样品冰晶形态变化Fig.9 Changes in ice crystal morphology of samples in different treatment groups
由图9 可知,牛肉丸中存在许多圆形白色空腔结构。其中,较大的圆形空腔为脂肪部分,较小的则可能是水或空气造成。温度波动对冻藏样品中的冰晶形态有明显影响。在储存过程中,温度波动可能导致冰晶重新结晶,从而对组织结构造成不良影响。冷链二处理组牛肉丸的冰晶面积和直径与冷链一处理组存在差异,表明温度波动使冰晶面积增加,在加剧对组织结构破坏的同时影响了其保水能力和汁液流失的程度[32]。
3 结论
研究结果表明,冷链物流在温度波动条件下对冷冻牛肉丸的品质存在明显影响。在温度波动条件下,牛肉丸的脂质氧化、蛋白质氧化、持水性和冰晶形态等均受到了影响。温度波动加剧了脂质和蛋白质的氧化程度,降低了牛肉丸的持水性,改变了冰晶的大小和形态。此外,温度波动对肉丸的色泽也会产生负面影响。因此,要确保冷冻牛肉丸的品质,关键在于冷链运输过程中严格控制温度,避免温度波动。未来冷链物流领域的研究重点将集中在通过研究新技术、提升监管能力以及优化包装材料等方式来减少外界温度对产品的影响,从而提高产品在温度波动条件下的稳定性。这对于冷冻食品的冷链管理和品质控制具有重要的参考价值。
