不同胆碱类离子液体对豌豆蛋白功能特性的影响
2024-04-12姜佩芸王玉山许舜滢李书红陈野陈桂芸
姜佩芸,王玉山,许舜滢,李书红,陈野,陈桂芸
(天津科技大学 食品科学与工程学院,天津 300457)
豌豆(PisumsativumL.)是全球重要栽培作物之一,富含23.10%~30.90%的蛋白质和其他重要营养成分,如碳水化合物、脂肪、维生素、矿物质等[1-3]。豌豆蛋白是一种全价蛋白质,包含所有人体必需的氨基酸,且赖氨酸含量丰富[4-5]。其结构主要包括11S 球蛋白(300~400 kDa)、7S 球蛋白(150~180 kDa)以及清蛋白(5~80 kDa)[6-8]。近年来,豌豆蛋白因价格低廉、低致敏性、氨基酸谱均衡等优点,在食品包装、人造肉、生物材料等领域受到广泛应用。例如,豌豆蛋白制成的生物膜可替代传统塑料包装,延长食品保质期,提高食品安全性[9-10]。在人造肉方面,由于豌豆蛋白价格低廉、无转基因风险、致敏性低,成为动物蛋白质替代品的主要来源[11]。在营养递送方面,豌豆蛋白可作为活性成分如益生菌、姜黄素、多酚、维生素等的载体[12]。虽然豌豆蛋白成本低、营养价值高、使用安全且不会引起过敏反应,但豌豆蛋白中高含量的球蛋白(65.00%~80.00%)导致其溶解性差,进而影响乳化、起泡、凝胶等功能[13],限制了其在食品工业的深加工与开发。
为提高豌豆蛋白在工业中的利用率,有研究对豌豆蛋白进行物理、化学和酶的改性。例如,Jiang 等[14]研究了pH 值转换和超声联合过程对豌豆蛋白功能特性和结构的影响。黄科礼[15]发现淀粉酶酶解辅助喷射蒸煮处理工艺可制备高溶解性的豌豆蛋白。Shah等[16]通过改变豌豆分离蛋白的二级结构,提高其溶解度、发泡能力和稳定性、乳液稳定性和持水性。因此,改变蛋白质结构可改善豌豆蛋白功能特性,进一步拓宽其在食品领域的应用前景。
离子液体又被称为低温熔融盐,是一种在室温下呈液态的化合物,通常由有机阳离子和无机或有机阴离子构成。因其绿色、多用途的特性,被视为生物分子(如蛋白质)的优质溶剂[17]。近年来,离子液体在有机合成、材料制备、萃取分离和气体收集等领域展示出广阔的应用前景,特别在食品领域中的蛋白质处理方面。例如,赵刚[18]采用聚合物固载离子液体进行生物样品蛋白质的分离纯化。张泽宇等[19]在离子液体中制备大豆蛋白胶黏剂。张文学[20]使用超声辅助离子液体诱导大豆分离蛋白分子解离和重聚集,提高其溶解度。陈甜[21]从鱼鳞中提取胶原蛋白,并利用离子液体对其进行改性处理。
目前,常用的咪唑类和吡啶类离子液体展现出中等或高等毒性,为了满足绿色和安全的需求,离子液体的研究和制备逐渐向利用天然产物或其衍生物为原料的方向发展。胆碱是人体必需的微量营养素,也是一种绿色溶剂,其具有较好的溶解能力,被广泛应用于生物医药和食品工业中。胆碱是强碱,能与各种酸中和生成胆碱类离子液体,其毒性比常见的咪唑类或吡啶类离子液体低约两个数量级[22]。张博[23]采用胆碱类离子液体溶解蚕蛹,发现其能易于打开蛋白质本身的氢键和二硫键,增加其溶解性。李志勇[24]发现蛋白质在胆碱类离子液体中的溶解特性主要由静电作用力和疏水作用力驱动。
本研究以豌豆蛋白为原料,研究56.00%胆碱类离子液体对提高豌豆蛋白溶解性的作用,考察氯化胆碱([Ch][Cl])、乙酸胆碱([Ch][Ac])、乳酸胆碱([Ch][La])、磷酸胆碱([Ch][Ph])、柠檬酸胆碱([Ch][Ci])离子液体中豌豆蛋白溶解特性、平均粒径与泡沫稳定性等理化性质,并通过研究豌豆蛋白的红外光谱、紫外光谱与微观形貌,分析胆碱类离子液体中豌豆蛋白聚集状态与结构变化,以期为扩大豌豆蛋白应用,开发高品质食品可食包装、组织材料提供数据支持。
1 材料与方法
1.1 材料与试剂
豌豆分离蛋白:嘉吉食品(天津)有限公司;牛血清白蛋白:北京索莱宝科技有限公司;磷酸、乳酸、乙酸(均为分析纯):天津市津科精细化工研究所;氢氧化胆碱、氯化胆碱、柠檬酸胆碱(均为分析纯):上海麦克林生化科技股份有限公司。
1.2 仪器与设备
精密电子天平(BL-200A):丹纳赫西特传感工业控制(天津)有限公司;紫外-可见分光光度计(UV-200):天津普瑞斯仪器有限公司;冷冻干燥机(FD-10):北京德天佑科技发展有限公司;傅里叶变换红外光谱仪(VECTOR22):德国布鲁克公司;粒度仪(BT-90):丹东市百特仪器有限公司;扫描电子显微镜(SU1510):日本日立公司;台式高速离心机(TD5K):长沙东旺实验仪器有限公司;电热恒温水浴锅(HWSY21-K4):金坛市金城国胜实验仪器厂;pH 计(PHS-25):上海今迈仪器仪表有限公司;超声波清洗机(JP-040ST):深圳市洁盟清洗设备有限公司;多头磁力加热搅拌器(HJ-6A):浙江恒岳仪器有限公司;密度黏度仪(BT90 型):北京优莱博技术有限公司;高速剪切机(FA30D):上海弗鲁克科技发展有限公司。
1.3 方法
1.3.1 离子液体的制备
将氯化胆碱分别与磷酸、乙酸和乳酸3 种溶液按照质量比1∶1 两两中和,振荡均匀,配制出质量分数均为56.00%的[Ch][Ph]、[Ch][Ac]和[Ch][La]离子液体。将[Ch][Ci]与[Ch][Cl]粉末溶于蒸馏水中,摇晃均匀,配制浓度均为56.00%(质量分数)的[Ch][Ci]与[Ch][Cl]离子液体。
1.3.2 样品制备
称取0.3 g 豌豆蛋白分别溶解于10 mL 不同胆碱类离子液体中([Ch][Cl]、[Ch][Ac]、[Ch][La]、[Ch][Ph]和[Ch][Ci])。在25 ℃条件下,用磁力搅拌器搅拌2 h,使其充分混匀。随后将离子液体与豌豆蛋白混合液在120 W 的功率下超声处理30 min,并且在50 ℃条件下水浴30 min。处理后的离子液体-豌豆蛋白混合液在4 000 r/min 下离心10 min,将离心后的上清液装入透析袋(分子量8 000~14 000 Da)中,最后将透析袋置于蒸馏水中用多头磁力加热搅拌器搅拌,透析48 h 后冻干成粉。相同条件下,将豌豆蛋白溶于蒸馏水作为空白对照组。
1.3.3 蛋白质溶解度的测定
以牛血清白蛋白(bovine serum albumin,BSA)为标准,绘制标准曲线,按照Bradford 的方法[25],测定豌豆蛋白的溶解度。将1.3.2 中配制的豌豆蛋白-离子液体在4 000 r/min 条件下离心10 min 取上清液,上清液中蛋白质含量与总蛋白质含量之比为豌豆蛋白溶解性。
1.3.4 黏度的测定
将豌豆蛋白-离子液体液置于10 mL 量筒中,使用密度黏度仪测定混合液在25 ℃条件下的黏度。
1.3.5 粒径测定
使用粒度仪测量豌豆蛋白-离子液体中豌豆蛋白的平均粒径大小。取一定量的豌豆蛋白-离子液体以匀速离心法(4 000 r/min)进行固-液分离,并对稀释50 倍的上清液进行平均粒径测定。
1.3.6 紫外全波长扫描
取1 mg 不同离子液体处理的豌豆蛋白冻干粉复溶于10 mL 蒸馏水中,随后将溶液置于石英比色皿中,用紫外-可见分光光度计在波长200~400 nm 范围扫描。
1.3.7 起泡性测定
取10 mL 豌豆蛋白溶液(记作V0,mL)置于50 mL量筒中,用高速剪切机将豌豆蛋白溶液以10 000 r/min的速度剪切2 min 后,静置1 min 并记录样品的总体积(标记为V1,mL)。待静置30 min 后重新记录样品总体积(标记为V2,mL)和剩余液体的体积(标记为V3,mL)。豌豆蛋白的起泡性(W1,%)和泡沫稳定性(W2,%)按以下公式计算。
1.3.8 傅里叶变换红外光谱(Fourier transform infrared,FI-IR)测定
将150 mg 溴化钾与1.0 mg 冻干粉样品混合,进行均匀的研磨和压片,以确保样品的一致性。然后,将样品进行傅里叶变换红外光谱扫描分析。扫描范围为400~4 000 cm-1,分辨率为4 cm-1。
1.3.9 扫描电子显微镜观察
将复溶后的豌豆蛋白溶液滴于1 cm2大小的小玻璃板上进行充分平铺,在室温自然风干。等待样品干燥完全后将其吸附在导电胶上。将导电的样品样板表面纳入到真空两级射极沉积器的反倾结构区,使用蒸发和镀金的方式完成处理。使用扫描电子显微镜在15 kV 电压下观察处理后的豌豆蛋白形貌。
1.4 统计学分析
采用SPSS 27 软件对试验数据进行处理及显著性分析,显著性水平设为0.05。
2 结果与分析
2.1 不同胆碱类离子液体对蛋白质溶解度的影响
不同离子液体的pH 值和黏度如表1 所示,蛋白质的溶解度如图1 所示。
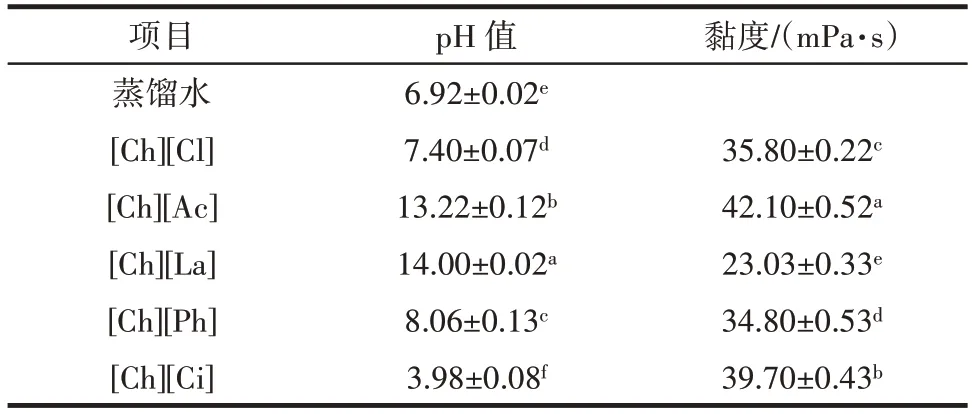
表1 胆碱类离子液体的pH 值与黏度Table 1 pH and viscosity of different choline ionic liquids
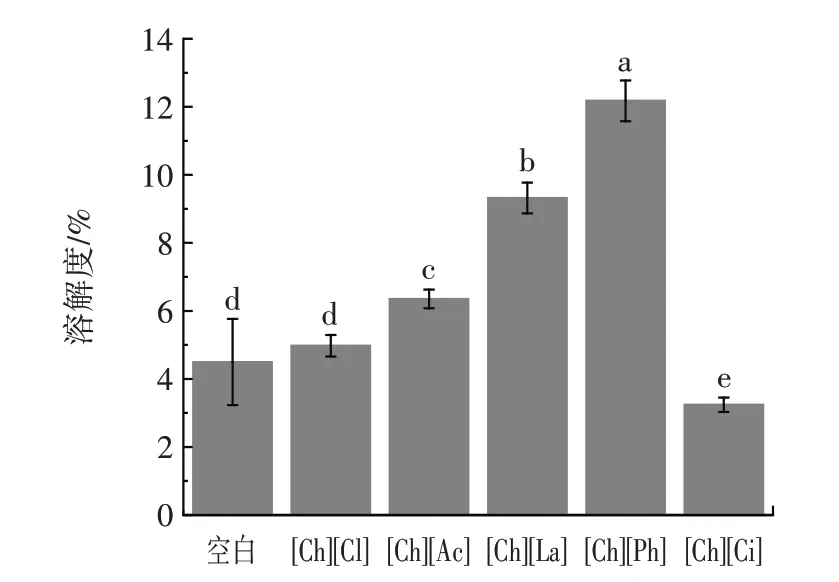
图1 不同胆碱类离子溶液中豌豆蛋白的溶解度Fig.1 Solubility of pea protein in different choline ionic liquids
由表1 可知,[Ch][La]和[Ch][Ac]离子液体为强碱性,黏度分别为23.03 mPa·s 和42.10 mPa·s,[Ch][Ph]离子液体为弱碱性,黏度为34.80 mPa·s,[Ch][Cl]为中性,黏度为35.80 mPa·s,而[Ch][Ci]为强酸性,黏度为39.70 mPa·s。
由图1 可知,空白组的豌豆蛋白溶解度为4.50%,非酸性离子液体([Ch][La]、[Ch][Ac]、[Ch][Ph]和[Ch][Cl])对豌豆蛋白的溶解度均有提高,尤其[Ch][Ph]的蛋白质溶解度最高为12.70%。这可能与豌豆蛋白结构的展开,以及蛋白质间的疏水作用力的减小有关。有研究指出,在碱性离子液体中,蛋白质结构会发生局部去折叠而形成熔球态结构,致使蛋白质侧链相互作用减弱,平均粒径减小,蛋白质与溶液间的静电作用增强,进而显著提高蛋白质的溶解性[26]。溶解度的提高可能还与离子液体黏度大、可以与豌豆蛋白之间形成作用力更强的氢键有关[23]。但综合考虑,离子液体的pH 值变化相对于黏度变化而言,对于豌豆蛋白溶解特性的提升贡献更大。
2.2 不同胆碱类离子液体中豌豆蛋白的平均粒径
不同胆碱类离子液体中豌豆蛋白的平均粒径和粒径分布分别见图2 和图3。
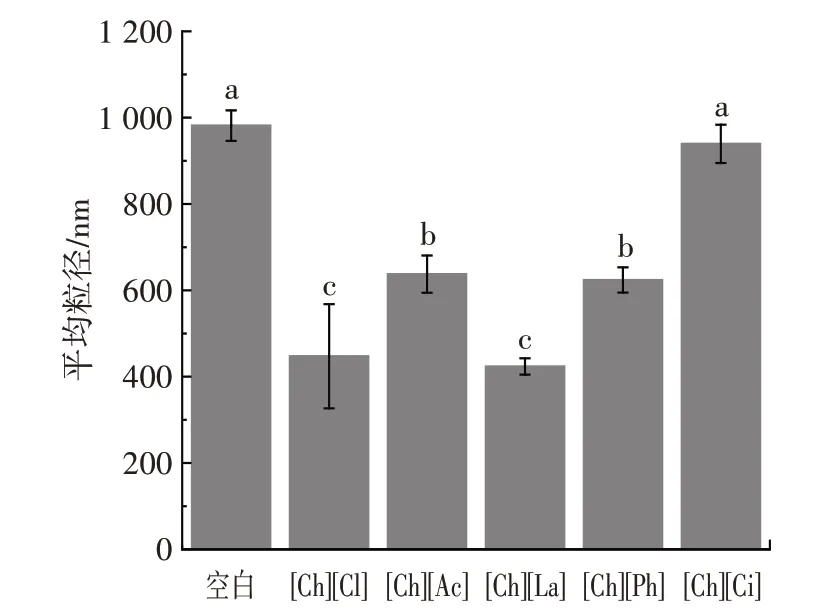
图2 不同胆碱类离子液体中豌豆蛋白平均粒径Fig.2 Average particle size of pea protein dissolved in different choline ionic liquids
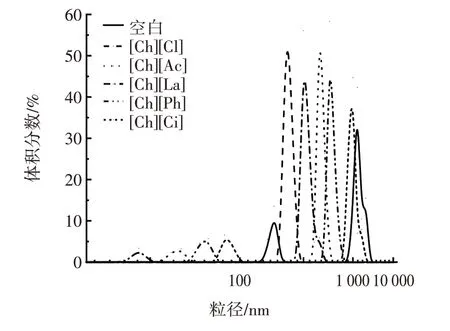
图3 溶解于不同胆碱类离子液体中豌豆蛋白的粒径分布Fig.3 Particle size distribution of pea protein dissolved in different choline ionic liquids
由图2、图3 可知,天然豌豆蛋白在水溶液中的平均粒径为981 nm。与水溶液中的豌豆蛋白相比,胆碱类离子液体可有效降低蛋白平均粒径。[Ch][Cl]与[Ch][La]离子液体中蛋白平均粒径显著降至447 nm 和423 nm,[Ch][Ac]和[Ch][Ph]降至637 nm 和624 nm。此趋势也在其他蛋白溶于离子液体研究中被报告。Yang等[27]使用离子液体1-乙基-3-甲基咪唑氯盐([EMIM][Cl])诱导了胶原蛋白解聚,平均粒径减小。张文学[20]使用1-丁基-3-甲基咪唑六氟磷酸盐([BMIM][PF6])和1-丁基-3-甲基咪唑氯盐([BDMIM][Cl])促使大豆分离蛋白可溶性增加,平均粒径减小。然而,[Ch][Ci]中的豌豆蛋白平均粒径仍为939 nm,与天然豌豆蛋白相比没有显著变化,这可能是因为[Ch][Ci]本身呈酸性,离子液体在促使豌豆蛋白由不溶性聚集体转化为可溶性后,在酸性环境下发生了重聚集,从而使得[Ch][Ci]平均粒径几乎未下降。
2.3 不同胆碱类离子液体对豌豆蛋白起泡性与泡沫稳定性的影响
溶解于不同胆碱类离子液体中豌豆蛋白的起泡性和泡沫稳定性见图4 和图5,泡沫稳定性宏观照片见图6。
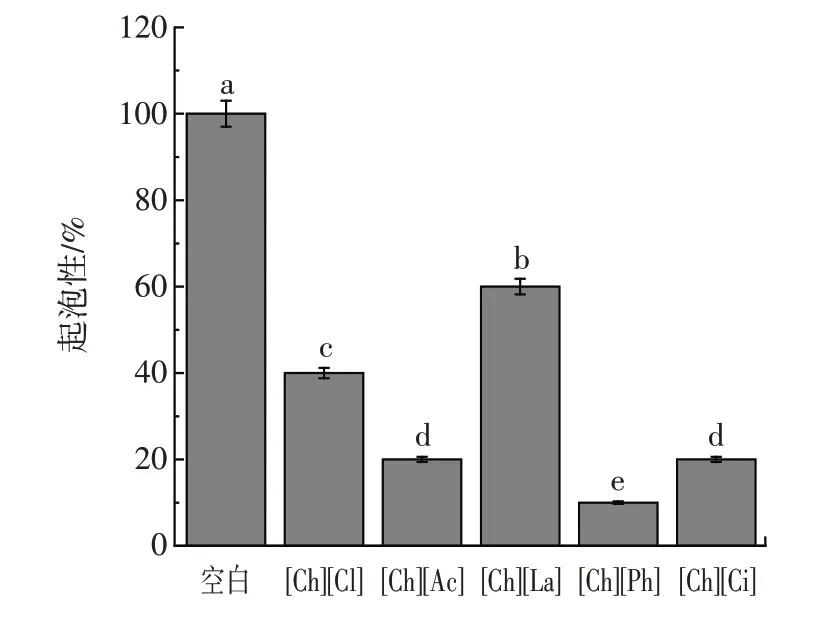
图4 溶解于不同胆碱类离子液体中豌豆蛋白的起泡性Fig.4 Foaming properties of pea protein dissolved in different choline ionic liquids
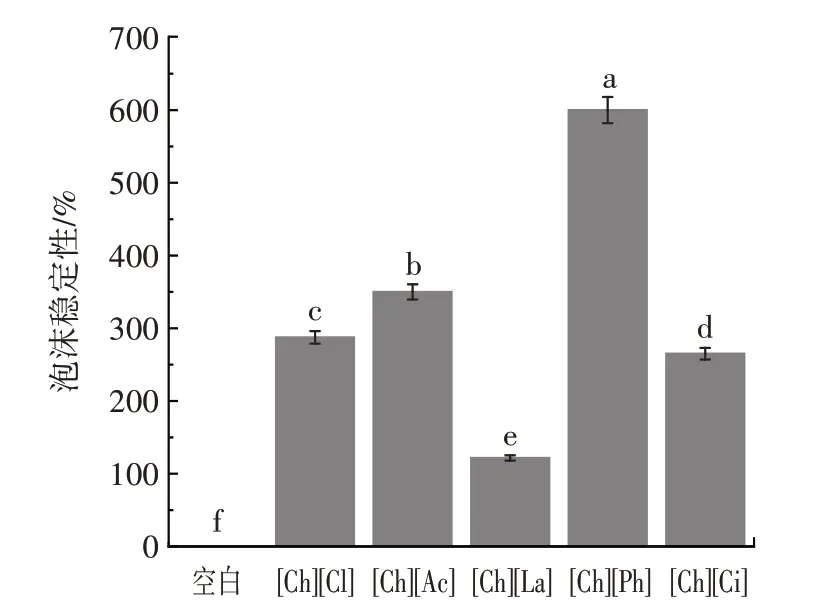
图5 溶解于不同胆碱类离子液体中豌豆蛋白的泡沫稳定性Fig.5 Foam stability of pea protein dissolved in different choline ionic liquids
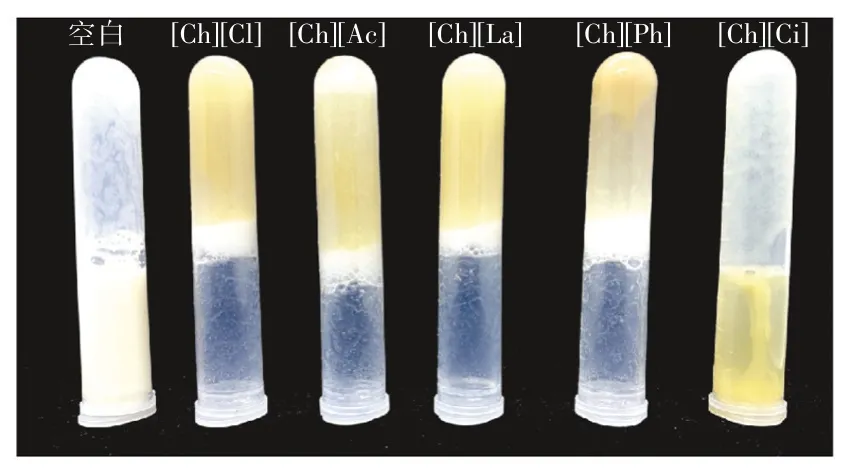
图6 泡沫稳定性宏观照片Fig.6 Macroscopic pictures of foam stability
蛋白质良好的溶解度是提高起泡性与泡沫稳定性的条件之一。由图4 和图5 可知,天然豌豆蛋白的泡沫稳定性极差。虽然胆碱类离子液体中豌豆蛋白起泡性有所下降,但泡沫稳定性显著提升至600.00%。该结果表明,离子液体有效改善了豌豆蛋白的界面特性。溶解于不同离子液体中的豌豆蛋白不仅具有良好的泡沫稳定性,其所形成的泡沫形态非常致密。图6 为6 组样品静置30 min 后将其倒置的宏观照片,可以看出[Ch][Cl]、[Ch][Ac]、[Ch][La]和[Ch][Ph]中的豌豆蛋白泡沫致密,因此可以支撑起溶液,使其无法自然流下。总之,离子液体改性后蛋白起泡性较空白组降低而泡沫稳定性显著升高(p<0.05),离子液体中蛋白形成的泡沫更不易因为空气膨胀而发生泡沫崩溃,界面间蛋白膜的稳定性提高。
2.4 不同胆碱类离子液体对豌豆蛋白侧链基团的影响
不同离子液体中豌豆蛋白的紫外-可见光光谱见图7。
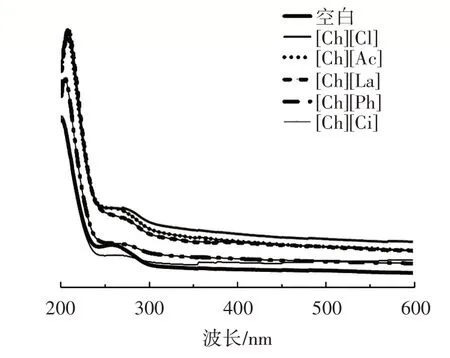
图7 胆碱类离子液体中豌豆蛋白的紫外-可见光光谱Fig.7 Ultraviolet-visible spectrum of pea protein dissolved in choline ionic liquids
蛋白质因其具有芳香族氨基酸(苯丙胺酸、酪氨酸、色氨酸)因而在近紫外区(200~400 nm)存在特征吸收峰,可通过判断其吸收峰的位置和强度变化来分析离子液体对豌豆蛋白侧链基团的影响。由图7 可知,豌豆蛋白在200~220 nm 和260~280 nm 有两个明显的紫外吸收峰,分别由肽键C O 基团的n-π 跃迁和色氨酸及酪氨酸残基跃迁引起。与水溶液中豌豆蛋白相比,[Ch][Cl]、[Ch][Ac]、[Ch][La]、[Ch][Ph]中豌豆蛋白在200~280 nm 的紫外吸收峰相较于空白组显著增强。结果表明,离子液体能使蛋白质的C O 基团和酪氨酸杂环残基暴露,影响豌豆蛋白的侧链环境。离子液体作为低温熔融盐,其导电能力和极性改变了氨基酸残基的环境,促使蛋白质三级结构变化中色氨酸与酪氨酸残基等极性基团的暴露,从而提高其溶解性。
2.5 不同胆碱类离子液体对豌豆蛋白二级结构的影响
不同离子液体中溶解的豌豆蛋白在400~4 000 cm-1波长范围内的红外光谱见图8。
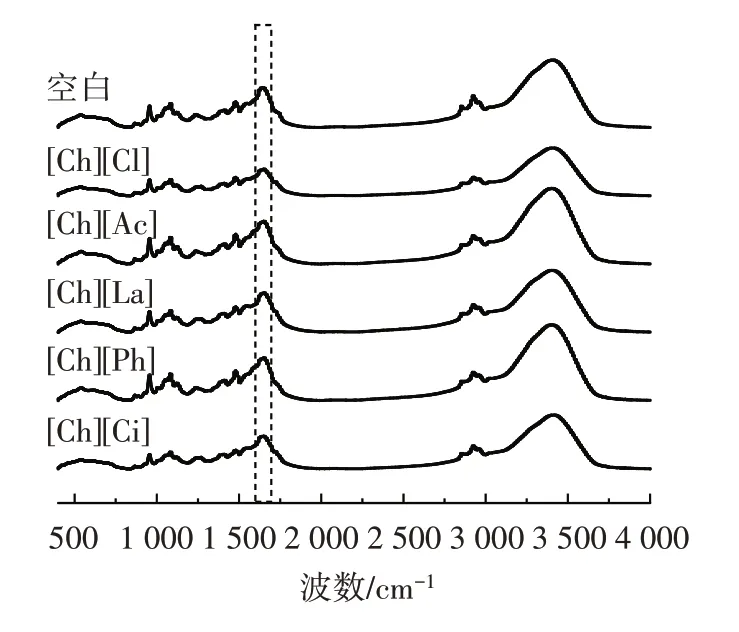
图8 溶解于不同离子液体中豌豆蛋白的FI-IR 图谱Fig.8 FT-IR spectra analysis of pea protein dissolved in different ionic liquids
由图8 可知,豌豆蛋白酰胺I 带吸收峰(1 660 cm-1)、C—H 对称伸缩峰(2 960 cm-1)、O—H 与N—H 伸缩峰(3 280 cm-1)峰形未发生明显变化,但对应波数与峰强度发生了改变,说明胆碱类离子液体中豌豆蛋白的结构发生了一定改变。其中3 200~3 500 cm-1范围内[Ch][Cl]、[Ch][La]、[Ch][Ph]、[Ch][Ci]峰强度降低,说明此时豌豆蛋白发生氢键相互作用,O—H 伸缩振动减弱。
不同离子液体对豌豆蛋白二级结构的影响见表2。
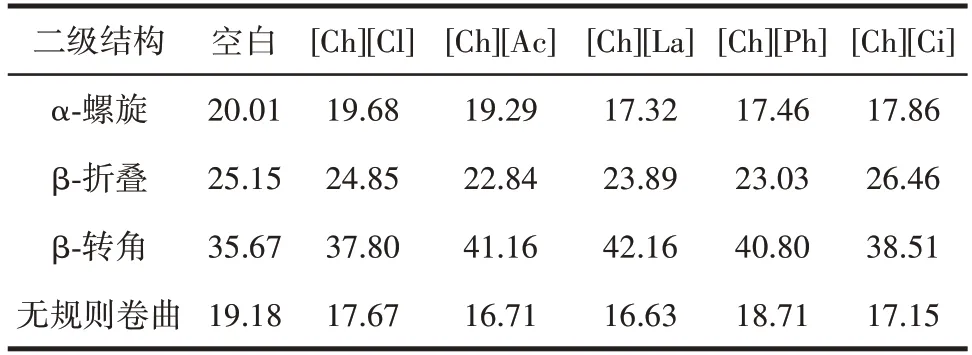
表2 胆碱类离子液体中豌豆蛋白二级结构百分比变化Table 2 Percentage of secondary structure of pea protein in choline ionic liquids %
蛋白质酰胺I 带对应峰的谱带面积表征蛋白质的二级结构变化[28]。由表2 可以看出,溶解于胆碱类离子液体中的豌豆蛋白的α-螺旋减少,其中[Ch][Ph]中豌豆蛋白α-螺旋由20.01%降至17.46%。α-螺旋是蛋白质中最紧密、最稳定的二级结构,其含量降低意味着豌豆蛋白的整体刚性降低,蛋白链的灵活性提升,从而导致豌豆蛋白的溶解性增加。[Ch][Cl]、[Ch][Ac]、[Ch][La]、[Ch][Ph]中豌豆蛋白β-折叠含量降低,其中[Ch][Ph]中豌豆蛋白β-折叠由25.15% 降至23.03%,说明这4 种离子液体会诱导豌豆蛋白去折叠。有研究表明,β-折叠含量或许与蛋白质亚基的疏水相互作用有关,疏水相互作用的变化会导致β-折叠含量变化[29]。综上所述,α-螺旋和β-折叠的减少均有利于蛋白质疏水性降低,这与之前关于蛋白质溶解度增加的结论一致。胆碱类离子液体中β-转角含量的增多,[Ch][Ph]中豌豆蛋白β-转角由35.67% 增至40.08%,说明豌豆蛋白形成了更多的无序结构。
2.6 不同胆碱类离子液体对豌豆蛋白微观形貌的影响
不同离子液体中豌豆蛋白的扫描电子显微镜图(放大倍数5 000 倍)见图9。

图9 豌豆蛋白的扫描电子显微镜图Fig.9 Scanning electron microscopy images of pea protein
由图9 可知,天然豌豆蛋白为球状聚集物,表面较为平整(图9 a)。不同离子液体溶解的豌豆蛋白表面均呈现出不同程度的凹陷且平均粒径均减小,其中[Ch][Cl]中的豌豆蛋白,表面出现向内凹陷(图9 b)。[Ch][Ac]与[Ch][La]中的豌豆蛋白表面坑洼程度进一步加剧,[Ch][Ph]中的豌豆蛋白表面出现了大量细小孔洞,表面粗糙(图9 e)更为杂乱,且为小颗粒聚集。[Ch][La]与[Ch][Ph]对豌豆蛋白的凝聚状态影响最明显,这一现象与红外光谱、紫外光谱的结果一致,与离子液体促进了豌豆蛋白二级结构无序化和三级结构的展开有正相关性。离子液体可显著降低蛋白质的聚集状态,增大蛋白凝聚物的比表面积,该形貌有利于提高蛋白的溶解性。[Ch][Ci]中的豌豆蛋白(图9 f)平均粒径几乎没有改变,且表面光滑平整,有聚集现象,这也进一步解释了酸性的[Ch][Ci]离子液体会导致豌豆蛋白的聚集,溶解度反而下降的原因。
3 结论
[Ch][Cl]、[Ch][Ac]、[Ch][La]、[Ch][Ph]离子液体中豌豆蛋白溶解性、泡沫稳定性和平均粒径均有明显改善,其中[Ch][Ph]对豌豆蛋白的功能性改善效果最佳,蛋白质的溶解度增加至12.70%,泡沫稳定性增加至600.00%。这与上述胆碱类离子液体呈碱性、溶液黏度大以及促使蛋白质二级结构的变化有关。在离子液体中,豌豆蛋白凝聚状态改变,发色基团的暴露,蛋白结构趋于无序,蛋白凝聚具有更小的平均粒径和更大的比表面积。总之,胆碱类离子液体是一种提高豌豆蛋白溶解性和泡沫稳定性的良好溶剂。本文制备的豌豆蛋白-离子液体具有较高的溶解性,对扩大豌豆蛋白应用性,进一步开发食品可食包装、组织材料等领域有一定的理论价值。
