稻瘟病菌MoZds1的功能分析
2024-04-08黄昌丽朱学明鲍坚东俞晓平林福呈
黄昌丽,朱学明,李 琳,鲍坚东,俞晓平,林福呈,
(1.中国计量大学 生命科学学院,浙江 杭州 310018; 2.农产品质量安全危害因子与风险防控国家重点实验室,浙江省农业科学院 植物保护与微生物研究所,浙江 杭州 310021)
稻瘟病菌(Magnaportheoryzae)属于半知菌类真菌,具有两种生理状态,即无性态和有性态[1],可以危害多种草本植物,包括水稻(Oryzasativa)、小麦(Triticumaestivum)、大麦(Hordeumvulgare)、玉米(Zeamays)、燕麦(oats)、黑麦(rye)、(Eleusinecorocana)、多年生黑麦草(Loliumperenne),以及杂草和观赏草[2]。水稻(Oryzasativa)为禾本科多年生草本植物,稻瘟病菌主要寄主之一。稻瘟病菌分布遍布世界,对亚洲和非洲水稻危害最为严重[3],同时也对南北美洲小麦造成巨大损失[4]。在中国的各个水稻种植地区每年均有稻瘟病害发生,稻瘟病菌侵染水稻的不同部位,形成苗瘟、叶瘟、枝梗瘟、秆瘟、谷粒瘟、穗颈瘟和节瘟,其中叶瘟和穗颈瘟危害最大更为常见[5-7]。根据近十年《全国植保专业统计资料》统计,稻瘟病菌在我国水稻主产区造成的产量损失约达37.49万t[8]。目前主要从生物防治(生防菌、次级代谢产物)[9-10]、化学防治(三环唑、稻瘟灵和嘧菌酯)[11-14]和抗性育种[15]等方面对稻瘟病菌进行预防与治理,其防治原理都离不开稻瘟病菌的生长发育及侵染机制。
在酿酒酵母中,Zds1p定位于胞质溶胶、隔膜和细胞皮层,Zds2p定位于细胞核[16],Zds调控细胞壁的强度和形态,维持细胞壁完整性。ZDS1的缺失除了对酿酒酵母细胞形状有轻微影响外,没有产生明显表型。然而,zds1-zds2双突变体生长缓慢,有明显的有丝分裂延迟,并产生细长的细胞和芽。细胞进入有丝分裂由有丝分裂周期蛋白依赖性激酶(cyclindependent kinase)的激活和蛋白磷酸酶2A (PP2A)的抑制控制[17],Zds蛋白是Cdks和PP2A的调节因子。Cdc55是PP2A复合物的调节B亚基,在有丝分裂过程中发挥各种功能。Cdc55会拮抗Cdk1活性并使Cdk1底物脱磷,Zds1/Zds2却能在细胞质中结合PP2A-Cdc55,从而促进有丝分裂进入并允许细胞核中有丝分裂的Cdk1的完全激活[18]。在有丝分裂后期,Zds1p抑制PP2A-Cdc55并诱导Cdc14p的释放,Cdc14p磷酸酶在有丝分裂退出过程中对抗Cdks活性使Cdks失活,以促进有丝分裂的退出和胞质分裂的完成[19]。
MPS1-MAPK是调控稻瘟病菌生长发育及致病的一种信号途径,丝裂原活化蛋白激酶Mps1与酿酒酵母Slt2同源[20]。真菌细胞被封闭在刚性细胞壁中,该壁赋予细胞形状并介导细胞与环境之间的所有交换[21]。尽管真菌细胞壁足够坚固,可以承受高压,但其组织和结构应不断重塑,以促进生长和发育。因此,在病原真菌中,保持细胞壁完整性的能力对于在其宿主上建立疾病至关重要[22]。一种确保细胞壁在不同环境中持续完整的信号转导途径已在酿酒酵母中得到表征[23],而这一信号转导途径的核心是由Bck1、Mkk1/2和Slt2组成的丝裂原激活蛋白(MAP)激酶级联。Mps1-MAPK信号通路同源于酵母中的Bck1-Mkk1/Mkk2-Slt2信号通路,在稻瘟病菌中主要调控细胞壁的完整性。mps1突变体对真菌细胞壁消化酶过敏,是维持稻瘟病菌细胞壁完整性所必需的。mps1突变体产生气生菌丝的能力有限导致分生孢子产量减少,但分生孢子的形态和萌发均正常。mps1突变体可以激发植物防御反应,无法使水稻幼苗发病,但可以侵染损伤叶片和叶鞘。此外,Mps1调节α-1,3-葡聚糖的积累,α-1,3-葡聚糖是细胞外壁层的一种成分,可在植物感染期间提供对几丁质酶的保护[24]。
在稻瘟病菌中,菌丝的生长发育对稻瘟病菌致病具有重要作用,MoZDS1基因的缺失会显著抑制稻瘟病菌落的生长。为了探究MoZds1的生物学功能,本研究对稻瘟病菌中MoZDS1基因进行了详细的研究,旨在明确MoZds1在稻瘟病菌中的功能,为深入了解稻瘟病在生长发育及致病过程中的调控机制以及药物靶点的解析和挖掘奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 实验植物与菌株
实验所用到的植物为HordeumvulgareZJ-8大麦和OryzasativaCO39水稻。稻瘟病菌菌株为菌Guy11(英国皇家科学院院士Nick Talbot 实验室惠赠)、大肠埃希菌感受态为EscherichiacoliDH5α(Trans T1, 北京全式金生物技术有限公司)、农杆菌为AgrobacteriumtumefaciensAGL1(上海唯地生物技术有限公司)。
1.1.2 培养基及试剂
培养基:LB培养基、CM培养基、AIM培养基、SD-N培养基、MM培养基。
试剂:DNA聚合酶、限制性内切酶EcoR I、BamH I、Hind Ⅲ、XbaI、cDNA逆转录酶、重组酶和连接酶、琼脂糖凝胶DNA回收试剂盒、质粒DNA提取试剂盒、核酸染料、CFW(Calcofluor white,钙荧光白)染料、DAPI(4′,6-diamidino-2-phenylindole,4′,6-二脒基-2-苯基吲哚)染料、DNA Marker、蛋白Marker、SDS-PAGE预制胶、GFP抗体标签。
1.2 实验方法
1.2.1 目的基因的获取
在真菌基因数据库(https://fungidb.org/fungidb/app/)中根据其基因号获取MGG_03837的CDS序列及其上下游2 kb左右的碱基序列。
1.2.2 目的基因的敲除
利用软件Primer Premier 6.0与BioXM 2.6设计引物,扩增MoZDS1基因上下游序列,与HPH抗性基因连接在PKO3A载体上,在大肠埃希菌中获得重组质粒,利用农杆菌介导的ATMT法对稻瘟病菌MoZDS1基因进行敲除,获得ΔMozds1敲除突变体并进行敲除验证。
1.2.3 回补体的构建
设计引物,将目的基因片段同绿色荧光蛋白(GFP)基因序列连接在PKD5载体上,在大肠埃希菌体内表达,将质粒转入农杆菌AGL1中,用ATMT法转化法诱导ΔMozds1敲除突变体的分生孢子。待转化子长出后挑取菌丝在荧光显微镜下观察转化子荧光,进行回补验证。
1.2.4 敲除突变体致病性检测
大麦叶片致病性检测:取生长旺盛的稻瘟病菌野生型Guy11、敲除突变体、回补体,用打孔器取下相同大小的菌饼,接种在离体大麦叶片上,用涂布器刮洗下孢子。用无菌水将孢子沉淀稀释至1×105mL-1,吸取孢子滴25 μL,滴在大麦叶片上,一片叶片滴加三滴菌液。将大麦叶片置于25 ℃恒温培养箱光照16 h黑暗8 h交替培养4 d,观察大麦叶片发病情况并拍照记录。
水稻叶片致病性检测:取3 mL浓度为1×105mL-1的孢子液,用孢子喷雾器均匀喷洒在水稻植株上,密封,25 ℃黑暗培养2 d后,16 h光照与8 h黑暗交替培养4 d,观察水稻发病情况并拍照记录。
以上实验每组做3个重复,每个实验重复3次。
1.2.5 表型分析
菌落生长分析:取生长旺盛的稻瘟病菌野生型Guy11,敲除突变体、回补体,接种在9 cm的CM固体培养基平板中央,每个菌株做3个重复,25 ℃恒温培养7 d,观察菌落形态并拍照记录。采用十字交叉法测量菌落直径,并记录。重复3次。
菌丝形态分析:取菌落形态分析中生长7 d的菌落平板,用无菌解剖刀切取相同大小菌丝块,整齐平放在无菌载玻片上。将放有菌丝块的载玻片放在保湿盒中,在25 ℃恒温培养箱中黑暗培养24 h,在显微镜下观察菌丝及分生孢子梗生长形态,并拍照记录。
孢子形态及产孢量分析:将孢子液滴在载玻片上,置于显微镜下观察孢子形态并拍照记录,测量孢子的长度与宽度并记录。吸取少量混匀孢子液,滴在血球计数板上计算出总产孢量。用CFW和DAPI染液对孢子进行隔膜和细胞核染色,置于荧光显微镜下,UV照射观察。
附着胞的形成率及糖原降解率测定:吸取25 μL孢子液滴在疏水膜中央,置于保湿盒中,在25 ℃恒温培养箱中黑暗培养0、4、8、12、24 h,记录4 h和8 h附着胞的形成率。用KI/I2染液进行糖原染色,观察并记录0、8、12、24 h时分生孢子和附着胞中糖原降解率。
1.2.6 敲除突变体细胞壁胁迫分析
以CM培养基为基础,配制 0.005% SDS(sodium dodecyl sulfate,十二烷基硫酸钠)和200 μg·mL-1CR(Congo Red,刚果红)的细胞壁胁迫培养基,接种,观察并记录不同细胞壁胁迫环境下稻瘟病菌的生长情况。
1.2.7 蛋白免疫印迹实验Western blot
将野生型Guy11和ΔMozds1突变体分别在CM液体培养基中培养2 d后转入SD-N饥饿诱导培养基中诱导4 h和8 h,采用TCA丙酮法提取蛋白,利用GFP抗体并通过Western blot 来检测GFP-MoAtg8和GFP的相对含量。
2 结果与分析
2.1 稻瘟病菌MoZDS1鉴定与分析
我们前期通过高通量基因敲除技术获得一株严重影响稻瘟病菌营养生长的基因缺失突变体,基因序列号为MGG_03837,基因功能注释为假定蛋白,为了探究其功能,我们将MGG_03837蛋白序列通过NCBI BLAST在酵母数据库中进行比对,发现MGG_03837与酿酒酵母Zds1蛋白序列具有4%的覆盖度和64%的置信度,因此我们将稻瘟病菌MGG_03837蛋白命名为MoZds1(图1-A)。通过ArthoDB数据库检索发现,在真菌中普遍存在Zds1同源蛋白,他们主要存在于子囊菌纲(Sordariomycetes)、散囊菌纲(Eurotiomycetes)、酵母纲(Saccharomycetes)、座囊菌纲(Dothideomycetes)和丝菌纲中(Hyphomycetes)(图1-B)。接下来,我们通过生物信息学方法构建了MoZds1的系统发育树,发现稻瘟病菌Zds1与粗壮脉纹孢菌(Neurosporacrassa)、镰刀菌(Fusariumgraminearum)和炭疽菌(Colletotrichumorbiculare)具有较近的亲缘关系,而与曲霉(Aspergilluspseudonomius)、链格孢菌(Alternariaviburni)以及酵母(Saccharomycescerevisiae)具有较远的亲缘关系(图1-C、D)。
2.2 稻瘟病菌MoZds1结构预测与敲除分析
为了探究稻瘟病菌中MoZds1的具体功能,我们利用蛋白结构预测工具AlphaFold2对稻瘟病菌和酿酒酵母的Zds结构域的结构进行了预测,结果显示,稻瘟病菌MoZds_C结构域含有2个α螺旋结构,置信度pLDDT为80.8。在酿酒酵母中,ScZds_C也含有2个α-螺旋结构,置信度pLDDT为91.5(图2-A),说明该结构已接近真实结构水平。通过三维结构联配后发现MoZds_C和ScZds_C高度重合,RMSD为0.385(图2-B、C),说明该结构域在酵母和稻瘟病菌中高度保守。我们推测MoZds1在稻瘟病菌中也有和酿酒酵母中相似的功能。因此,通过基因敲除手段获得MoZDS1基因缺失突变体。通过验证,发现在1 000 bp位置的内参基因Tubilin条带在野生型Guy11与ΔMozds1敲除突变体中均可见,而ΔMozds1敲除突变体中只存在2 000 bp的重组条带,野生型Guy11中仅存在500 bp的目的基因条带,证明MoZDS1敲除成功。
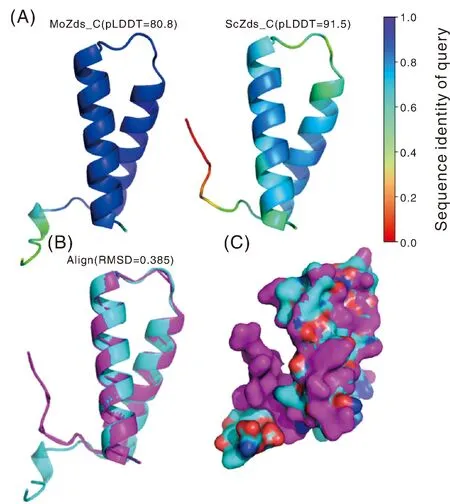
图2 稻瘟病菌MoZds_C结构域结构分析Fig.2 Domain structure analysis of MoZds_C in M. oryzae
2.3 MoZds1调控稻瘟病菌营养生长、产孢和附着胞的形成
将野生型Guy11、ΔMozds1和互补菌株ΔMozds1-C接种于CM培养基中培养7 d,发现ΔMozds1敲除突变体的生长速度明显减慢,菌落表面菌丝绒毛不明显,呈粗糙凹凸状(图3-A、C)。为探究ΔMozds1对菌丝生长和产孢的影响,通过菌落横截面切片观察孢子梗和孢子情况,从图3-B中可以看出,相比于野生型Guy11和互补菌株ΔMozds1-C,ΔMozds1敲除突变体分生孢子梗较密且长有大量分生孢子,缺少细长的气生菌丝,统计分析发现ΔMozds1敲除突变体单位面积内产孢量显著高于野生型和互补菌株(图3-E),推测MoZds1参与稻瘟病菌气生菌丝和分生孢子的形成。接下来,我们对分生孢子进行形态观察,发现ΔMozds1敲除突变体孢子多以三隔孢子为主,呈梨形,通过对分生孢子的长宽进行了测量,发现ΔMozds1敲除突变体与野生型Guy11和互补菌株相比,孢子的长度显著减小。然而,虽然孢子形态发生改变,但经隔膜染色和细胞核观察统计发现ΔMozds1敲除突变体和野生型及互补菌株相比在隔膜和细胞核形成方面并无显著差异(图3-D)。通过附着胞统计观察,结果如图3-F所示,发现在4 h时ΔMozds1敲除突变体分生孢子附着胞的形成量远高于野生型Guy11和回补体ΔMozds1-C,在8 h时,ΔMozds1敲除突变体、野生型Guy11和回补体ΔMozds1-C中附着胞的形成率无显著差异。
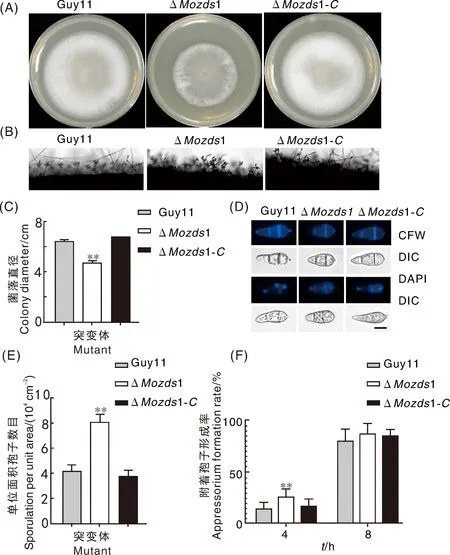
图中星号代表显著性差异(*, P<0.05; **, P<0.01), 下同。标尺=10 μm。Asterisks represent significant differences (*, P<0.05; **, P<0.01), the same as below. Scale =10 μm.图3 ΔMozds1突变体基本表型分析Fig.3 Phenotypic analysis of ΔMozds1 mutants
2.4 MoZds1参与稻瘟病菌的致病进程
为了解MoZds1是否影响稻瘟病菌的致病进程,我们分别将野生型Guy11、ΔMozds1和互补菌株ΔMozds1-C以菌饼的形式接种于大麦叶片。培养4 d后发现,无论是野生型Guy11、互补菌株ΔMozds1-C还是ΔMozds1突变体,都在大面叶片中形成了扩展性病斑(图4-A-1)。接下来,我们将相同浓度的孢子接种到大麦叶片上,进一步观察发现突变体在接种4 d后形成的病斑面积小于野生型Guy11和互补菌株ΔMozds1-C(图4-A-2),说明MoZds1影响稻瘟病菌的侵染。为了进一步验证Mozds1对水稻致病力的影响,我们采用孢子喷雾的形式将相同浓度的孢子接种于活体水稻叶片上,培养5 d后发现,ΔMozds1突变体在水稻叶片上也形成了菌斑,但菌斑面积显著小于野生型Guy11和互补菌株ΔMozds1-C(图4-B),说明MoZds1参与稻瘟病菌的致病进程。

图4 ΔMozds1突变体致病性分析Fig.4 Pathogenicity analysis of ΔMozds1 mutants
2.5 Mozds1参与对细胞壁胁迫因子的响应
稻瘟病菌的生长、发育、产孢、侵染等各个过程均受环境因素的影响,在长期的进化过程中,稻瘟病菌形成了一套自身的完整应对机制,不同蛋白对不同的环境可以做出相应调节,以维持自身各项生命活动的正常运行。在酿酒酵母中,有报道Zds1参与细胞壁的合成。为探究ΔMozds1突变体对细胞壁胁迫因子的敏感性,我们对ΔMozds1突变体做了抗逆性测定。我们从生长旺盛的ΔMozds1敲除突变体、野生型Guy11和回补体ΔMozds1-C菌板上用打孔器打下4 mm大小的菌块接种在含0.005%的SDS培养基、200 μg·mL-1的刚果红CR培养基上(图5-A),以CM为对照,测量不同胁迫环境下3种菌种的生长直径,利用公式抑制率(%)=(野生型菌落直径-敲除突变体菌落直径)/野生型菌落直径×100计算出不同细胞壁胁迫因子对稻瘟病菌的生长抑制率,结果如图5-B所示。在SDS和CR细胞壁胁迫培养基上,胁迫因子对ΔMozds1突变体的抑制率均显著高于野生型Guy11,由此可见,MoZds1参与稻瘟病菌细胞壁的完整性形成。
2.6 MoZds1荧光定位于细胞质
由于蛋白发挥的功能通常与其在细胞中的定位相关联,为进一步探究MoZds1的功能,我们对它在细胞中的定位情况进行了分析。首先我们通过构建GFP-MoZds1表达载体,并连接H3强启动子,利用大肠埃希菌并结合ATMT法诱导ΔMozds1敲除突变体,通过PCR验证GFP-MoZds1的导入情况。将验证正确的转化子分生孢子及菌丝体置于荧光共聚焦显微镜下通过观察绿色荧光位置判断MoZds1的定位情况,结果如图6所示。在分生孢子中,绿色荧光存在于孢子液泡中,而在生长旺盛的菌丝中,我们可以明显看到MoZds1呈细胞质定位。

GFP-MoZds1在分生孢子与菌丝中的荧光定位,标尺=10 μm。Fluorescence localization of GFP-MoZds1 in conidia and mycelia, scale =10 μm.图6 GFP-MoZds1荧光定位分析Fig.6 Fluorescence localization analysis of GFP-MoZds1
2.7 MoZds1影响糖原的降解
由于附着胞的形成与分生孢子中的糖原降解相关联[25],因此我们进一步探究了分生孢子在形成附着胞过程中分生孢子与附着胞中的糖原降解率。通过KI/I2染液染色,结果如图7-A所示,在8 h时分生孢子中的糖原均有一半转移到附着胞中,3种菌株的分生孢子之间并无明显差异。在12 h时,ΔMozds1敲除突变体分生孢子中有大半均已降解,降解率远高于野生型Guy11和回补体ΔMozds1-C,同时突变体附着胞中糖原也有部分已经降解。到24 h时ΔMozds1敲除突变体与野生型Guy11突变体和分生孢子中的糖原几乎均完全降解,但回补体的附着胞中还有部分糖原残留(图7-B、C),我们猜想这可能与回补体上的强启动子过表达MoZDS1有关。综合整个糖原降解的过程,可以看出ΔMozds1敲除突变体的分生孢子与附着胞中糖原降解速率均快于野生Guy11,由此可以说明MoZds1可以延缓糖原的降解速率。
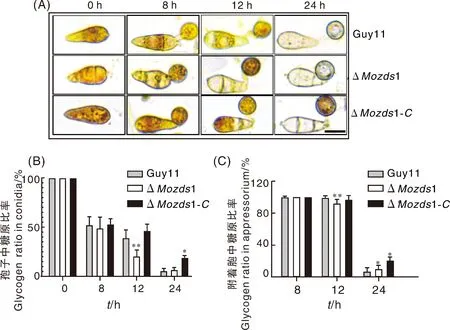
标尺=10 μm。Scale =10 μm.图7 分生孢子及附着胞的糖原降解情况观察Fig.7 Observation of glycogen degradation of conidia and appressorium
2.8 ΔMozds1敲除突变体细胞自噬分析
稻瘟病菌整个生命活动的正常进行离不开细胞自噬。在有利生长环境中,细胞自噬通常处于较低水平。但在营养缺乏、饥饿难耐的情况下,细胞自噬水平就会提高[26-27]。在稻瘟病菌分生孢子萌发侵染过程中,细胞自噬通过降解分生孢子中的糖原、甘油和脂滴等物质,促进分生孢子的萌发和侵染[28]。为研究MoZds1是否参与稻瘟病菌细胞自噬的过程,我们利用GFP-Atg8来检测ΔMozds1敲除突变体细胞自噬水平,并通过Western blot 来检测GFP-MoAtg8和GFP的相对含量。结果发现,未经饥饿诱导时,ΔMozds1敲除突变体与野生型G11中的游离的GFP相对含量大致相同(图8),且经过SD-N饥饿处理4 h和8 h后两者所含的游离GFP含量仍然相差不大。
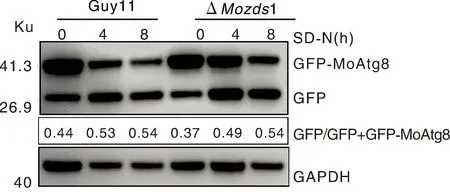
图8 GFP-Atg8与GFP表达量分析Fig.8 GFP-Atg8 and GFP expression levels
3 讨论
在恶劣的环境中,稻瘟病菌经常受到来自环境中各种因素的影响,因此维持细胞内部的相对稳定十分重要,在此过程中,细胞壁起着关键作用。细胞壁能抵抗外界机械压力维持细胞形状,并在细胞正常代谢、离子交换和渗透压平衡中扮演重要角色。在细胞生长和形态发生过程中,细胞完整性通路(cell wall integrity pathway, CWI)主要负责协调细胞壁的变化并应对外界细胞壁压力,维持细胞壁完整性的信号调节[29]。CWI信号通路由一系列细胞表面传感器组成,这些传感器与一种名为Rho1的小G蛋白相连。其中研究最为透彻的是Pkc1激活的丝裂原激活蛋白(MAP)激酶级联Rho1效应通路。CWI信号传导的MAP激酶级联是由Pkc1、MEKK(Bck1)、Mkk1/2和MAP激酶(Mpk1/Slt2)组成的线性途径,是酵母中调节交配、高渗透压反应、菌丝侵入性生长、孢子形成和细胞壁应激反应的五种MAP激酶信号途径之一。在稻瘟病菌中,Mps1-MAPK信号通路与酵母中的Bck1-Mkk1/Mkk2-Slt2信号通路功能相同,都主要负责细胞壁的完整性调控[30]。MoPkc1是酵母Pkc1的同源蛋白,在稻瘟病菌中能够调控稻瘟病菌生长发育并直接参与对Mps1-MAPK信号通路的调控[31]。在裂殖酵母中,细胞需要Zds1来保持细胞壁的完整性。其C端序列与酿酒酵母Zds1p和Zds2p的C端具有高度同源性,Zds1p和Zds2p的C端是酿酒酵母的功能域[32]。相同地,Zds1的C端也是裂殖酵母的功能域,过表达Zds1的C端比过表达Zds1全长的产孢率高,Zds1的N端区域负调节C端功能区[16]。在本次研究中,MoZds1也参与分生孢子的形成,但ΔMozds1敲除突变体单位面积产孢量远高于野生型Guy11,说明Zds1负调控分生孢子的形成,结合ΔMozds1敲除突变体的菌丝分析可知,Zds1也参与气生菌丝的形成。ΔMozds1敲除突变体的分生孢子与附着胞中糖原降解速率在12 h时与野生型存在差异,在4 h时附着胞的形成率高于野生型,我们认为ΔMozds1敲除突变体通过加快糖原降解速率使分生孢子体内膨压在短时间内升高,进而加快附着胞的形成速率。裂殖酵母Zds1参与细胞壁的强度和形态,细胞表现出圆形细胞形态。我们观察到在稻瘟病菌中GFP-MoZds1也具有类似裂殖酵母Zds1-GFP的细胞质定位[16],同时分生孢子表现出偏圆形的形态。因此,我们推测MoZds1也参与稻瘟病菌细胞壁完整性途径。经细胞壁胁迫因子SDS和CR胁迫测定,果然得出相同结论,我们认为ΔMozds1敲除突变体菌落形态粗糙生长较缓慢也与细胞壁遭到破坏相关。在裂殖酵母和酿酒酵母中,Zds1敲除体均表现出钙敏感性[33]。另外Zds1/Zds2可控制Cdc55的皮层和细胞质定位,Cdc55在细胞质中可以促进有丝分裂的进入,当Zds1/Zds2缺失时Cdc55会在细胞核中积累,核Cdc55会阻止有丝分裂的退出[34]。多项研究均表明,Zds1蛋白调节PP2A-Cdc55的上游信号,在控制有丝分裂过程中发挥重要作用[18-19,35-37]。本研究对MoZds1的功能从营养生长、产孢、致病、胁迫、定位以及细胞自噬方面进行了观察统计与分析,发现MoZds1正调控稻瘟病菌气生菌丝的生长,抑制分生孢子的形成,协助致病侵染过程,参与维持稻瘟病菌细胞壁完整性途径,呈细胞质定位但对细胞自噬无显著影响。MoZds1的其他功能有待进一步挖掘,后续研究工作可参考酵母Zds1相关研究,从钙敏感性和Cdc家族基因相互作用关系入手,探究MoZds1在细胞分裂方面是否发挥作用。
