鸡腺苷琥珀酸裂解酶互作蛋白的筛选及其功能分析
2024-04-08陈友波石钰仕赵德鹏谭启松
余 欢,李 辉,陈友波,石钰仕,赵德鹏,龙 霞,谭启松
(贵州大学 动物科学学院,高原山地动物遗传育种与繁殖教育部重点实验室,贵州 贵阳 550025)
肌苷酸(inosine monophosphate, IMP)作为众多畜禽肉质风味评价指标之一,其含量是目前衡量肉类新鲜程度的重要指标,是公认的影响肌肉风味的重要物质。IMP来源是2个体内合成途径和三磷酸腺苷的分解过程,合成途径包括以氨基酸、磷酸核糖、一碳单位和CO2等原料为主的从头合成途径[1]和体内嘌呤核苷或游离嘌呤合成IMP的补救途径[2]。腺苷琥珀酸裂解酶(adenylosuccinate lyase,ADSL)是IMP合成酶系中催化合成嘌呤核苷酸起始合成与循环中的唯一双功能酶[3],是畜禽体内IMP合成的关键酶。因此,编码腺苷琥珀酸裂解酶的ADSL基因被认为是影响肌肉IMP含量的主效基因[4]。相关研究表明,ADSL基因与畜禽IMP含量具有显著相关性[5-7]。张梅[8]对玫瑰冠鸡的研究结果表明,ADSL基因的表达与肌肉的IMP含量呈显著正相关。刘长青等[9]用荧光定量PCR检测了ADSL基因在北京油鸡的心、肝、脾、肺、肾、腿肌、胸肌和脑等组织的表达情况,结果显示,ADSL基因在胸肌中表达水平最高。Yuan等[10]研究显示,草鱼ADSL基因在肌肉中的表达水平最高,而在鱼鳃中表达量最低。以上研究表明,ADSL基因与畜禽肉质相关,其表达水平在不同组织中均有差异,但是其在肌肉中明显高表达。目前,关于ADSL蛋白对肌肉风味的影响机制报道较少。
赤水乌骨鸡,又名“竹香鸡”,原产于贵州省赤水市,因其肉质鲜美、风味独特、营养丰富,受到广大消费者喜爱。本研究以赤水乌骨鸡为对象,采用免疫共沉淀(co-immunoprecipitation, Co-IP)联合高效液相色谱串联质谱联用技术(LC-MS/MS)进行蛋白质谱分析,筛选出与鸡ADSL蛋白相互作用的细胞蛋白,并进行互作蛋白的生物信息学分析,旨在为进一步深入探究鸡ADSL基因在肌肉的表达调控机制提供参考。
1 材料与方法
1.1 材料
pEGFP-C1质粒来自贵州大学动物遗传育种与繁殖教育部重点实验室,细胞来源为本课题组保存的原代细胞,大肠埃希菌感受态TOP10细胞购自贵州宏达尔生物科技有限公司,ADSL基因的干扰载体为本课题组前期构建、保存[11]。
1.2 主要试剂
DNA凝胶回收试剂盒和无内毒素小提中量试剂盒-离心柱型购于天根生化科技(北京)有限公司;4%多聚甲醛、1×RIPA裂解液(弱)、TriX-100通透液、蛋白酶抑制剂(PMSF)、1×PBS缓冲液、脱脂奶粉、DMEM-F12基础培养基购于北京索莱宝科技有限公司;兔抗绿色荧光蛋白(GFP)单克隆抗体购自Proteintech公司(美国);辣根过氧化物酶(HRP)结合的亲和山羊抗兔抗体(H+L)购自ABclonal公司;RevertAid First Strand cDNA Synthesis Kit、T4 DNA连接酶、DNA Marker、PfuTaqDNA高保真聚合酶、限制性内切酶(XhoⅠ和EcoRⅠ)、Pierce经典磁珠式免疫沉淀试剂盒、LipofectamineTM 3000 转染试剂盒购自Thermo Fisher公司;细胞转染试剂使用Neofect DNA转染试剂盒;细胞核染料DAPI、SDS-PAGE蛋白上样缓冲液(5×)和ECL发光显色液购于上海碧云天生物技术公司;聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)和胎牛血清购自GIBCO公司;TRIzol购自南京诺唯赞生物科技股份有限公司;Opti-MEMTM购自贵州格瑞恩公司;anti-desmin、山羊抗兔IgG-cy3购自北京博奥森生物技术有限公司;其他试剂均为国产分析纯。
1.3 鸡ASDL基因真核表达载体的构建和鉴定
根据NCBI网站的鸡ADSL基因序列(基因登录号:NM_205529.2),利用primer 5.0软件筛选出酶切位点(XhoⅠ和EcoRⅠ),根据ADSL基因的蛋白质编码序列(coding sequence, CDS)和酶切位点设计引物(上游引物序列5′-TGGACGAGCTGTACAAGTCCGGACTCAGATCTCGAG-GCATGGCGACCCCCTGCGCCGAGGAGGACCCG-C-3′,带下划线的序列是XhoⅠ酶切位点;下游引物序列5′-GATCCCGGGCCCGCGGTACCGTCGA-CTGCAGAATTCTTAAAGTGTCAGCTCAATTTTC-CCACCCATCAT-3′,带下划线的序列是EcoRⅠ酶切位点),由北京擎科生物科技股份有限公司合成相关引物。
提取赤水乌骨鸡成肌细胞总RNA,逆转录成cDNA后,扩增ADSL基因。利用无缝克隆试剂盒将纯化后的PCR产物和酶切后的pEGFP-C1表达载体连接并转化进大肠埃希菌感受态TOP10细胞中。利用质粒提取试剂盒提取阳性单克隆菌种的质粒DNA,进行双酶切验证。将酶切验证正确的质粒送北京擎科生物科技股份有限公司进行测序验证。
1.4 细胞培养与鉴定
复苏赤水乌骨鸡成肌细胞,使用Desmin抗体对成肌细胞的肌间线蛋白(desmin)进行鉴定。在含5% CO2的37 ℃细胞培养箱中,用含15%胎牛血清的DMEM-F12培养基(添加1%青霉素和1%链霉素)在六孔板中培养赤水乌骨鸡成肌细胞,当六孔板中的成肌细胞密度生长到80%左右,弃去原有的培养基,加入无菌1×PBS冲洗3次;每孔加入800 μL预冷的4%多聚甲醛后固定30 min,清洗3次后加入800 μL 0.2%(体积分数)的Triton X-100溶液,室温孵育15 min;清洗3次后加入200 μL稀释的山羊血清(稀释比1∶500,每孔),37 ℃封闭30 min;清洗3次后加入100 μL一抗Desmin(1∶500稀释),4 ℃冰箱内孵育过夜。弃掉一抗清洗3次,在避光的暗室,加入100 μL Cy3标记的山羊抗兔IgG-Cy3(1∶500稀释),37 ℃孵育1 h。清洗3次后加入200 μL DAPI细胞核染料,室温孵育5~7 min,再次清洗3次,最后加入600 μL抗荧光猝灭剂,在荧光倒置显微镜下观测。
1.5 转染和融合蛋白的Wester blot检测
将成肌细胞置于细胞六孔板中,用含15%胎牛血清、1%青霉素和1%链霉素的DMEM-F12培养基,置于37 ℃,在含5% CO2的细胞培养箱培养。待细胞密度达到80%左右,提前2 h将待转染细胞的培养基更换成同等浓度不含双抗的DMEM-F12培养基。将2 μg提取的质粒DNA用100 mL OPTI-MEM溶液稀释,充分混匀;向混合液中加入2 μL Neofect DNA转染试剂,混匀后,室温静置15~30 min。将转染复合物加入细胞培养基中后放入培养箱中培养24 h。
将pEGFP-C1和pEGFP-C1-ADSL转染后的成肌细胞用PBS清洗3次,加入1×RIPA细胞裂解液进行裂解,裂解30 min后,使用细胞刮收集细胞,4 ℃、12 000×g离心10 min,收集细胞总蛋白。加入适量的蛋白上样缓冲液,煮沸后进行SDS-PAGE凝胶电泳分离。通过湿转转移系统(BIO-RAD,美国)将蛋白转印至PVDF膜上,用含TBST(TBS+Tween)的5%脱脂奶粉封闭2 h;弃掉液体,加入anti-GFP兔单克隆抗体,4 ℃摇床过夜孵育;用TBST溶液清洗3次后,加入HRP标记山羊抗兔IgG (H+L),室温孵育1.5 h;用TBST溶液清洗3次后,使用ECL发光液进行显色并拍照。
1.6 重组蛋白的亚细胞定位分析
将转染pEGFP-C1和pEGFP-C1-ADSL的成肌细胞用PBS洗3次,依次加入预冷的4%多聚甲醛,室温固定30 min,然后用3% Triton X-100通透处理10 min,再用PBS清洗3次,加入稀释后的DAPI细胞核染料,静置8 min后用PBS清洗3次,最后置于倒置荧光显微镜下观察结果。将获得的荧光图片用Photoshop CS6进行合并(merge)处理,以荧光共定位的方法来确定重组蛋白的亚细胞定位情况。
1.7 免疫共沉淀
把成肌细胞接种于六孔板,待细胞密度达80%左右时,分别将pEGFP-C1-ADSL和pEGFP-C1转染成肌细胞。在细胞转染后24 h,用PBS清洗细胞3次,然后用免疫沉淀裂解缓冲液裂解细胞,4 ℃、13 000×g离心10 min后,收集上清液,向每个样品中加入10 μg anti-GFP兔单克隆抗体,混合均匀后在4 ℃过夜。向样品中加入25 μL Pierce蛋白A/G,混匀后室温孵育1 h。用磁力架收集磁珠,经过免疫沉淀裂解缓冲液清洗磁珠3次后,加入500 μL超纯水轻柔混匀,弃上清液。重复2次后,向磁珠中加入100 μL蛋白上样缓冲液,室温静置10 min,分离磁珠,保留上清液。
1.8 LC-MS/MS分析
蛋白质复合物送至金开瑞生物工程有限公司(武汉)用于LC-MS/MS质谱鉴定。将蛋白样品进行还原烷基化和酶解处理,酶解产生的多肽用C18柱子除盐,抽干后用15 μL上样缓冲液(含0.1%甲酸和3%乙腈)溶解多肽,上LC-MS/MS(ekspertTM nanoLC,AB Sciex TripleTOF5600-plus)仪器进行分析,LC-MS/MS下机后,将原始下机数据提交到Proteinpilot 5.0 (Applied Biosystems,Sciex)软件中进行数据库检索。在设置可信度conf≥95%、unique peptides≥1时,检测样品中所含蛋白质的种类与数量。
1.9 细胞蛋白的生物信息学分析
利用维恩图(Venn图)在线软件(http://bioinformatics.psb.ugent.be/webtools/Venn/)绘制C1标签组和C1-ADSL重组蛋白组交集的蛋白数量;利用在线网站UniProt (https://www.uniprot.org)进行蛋白的基因本体(gene ontology, GO)注释(包含生物学进程、细胞组分和分子功能);利用KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库(http://www.genom e.jp/kegg/mappe r.html)分析蛋白参与的信号通路;利用STRING Version 11.0在线网站(https://string-db.org/)进行蛋白互作网络图的绘制。
1.10 ADSL基因与相关基因之间的调控表达研究
根据生物信息学分析,筛选出RPL4、PDLIM5、ACTG1、SRSF10这4个基因,设计这些基因的特异性引物,通过在成肌细胞中转染ADSL过表达载体和用LipofectamineTM 3000 转染ADSL干扰载体后(方法参考说明书),检测ADSL过表达和沉默状态下成肌细胞中RPL4、PDLIM5、ACTG1和SRSF10的表达情况,探究ADSL基因与它们之间的调控关系。
2 结果与分析
2.1 鸡ADSL基因重组真核表达载体的鉴定
以逆转录合成的cDNA为模板,使用特异性引物PCR扩增鸡ADSL基因的CDS,利用无缝克隆技术导入pEGFP-C1载体质粒中。电泳检测结果显示,目的片段长度为1 495 bp(图1-A),与预期结果一致。对pEGFP-C1-ADSL载体进行XhoⅠ和EcoRⅠ双酶切,结果显示,pEGFP-C1-ADSL酶切后分别获1 495 bp和4 686 bp的目的基因条带,与预测大小一致(图1-B)。测序结果表明,鸡ADSL基因重组真核表达载体pEGFP-C1-ADSL构建成功。
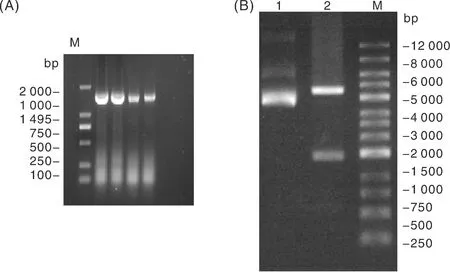
A,鸡ADSL基因的PCR扩增图;B,重组真核表达载体双酶切鉴定图,其中1号泳道为pEGFP-C1质粒,2号泳道为重组质粒pEGFP-C1-ADSL的双酶切。M为DNA marker。A, PCR amplification plot of chicken ADSL gene; B, double-enzyme identification plot of recombinant eukaryotic expression vector. In which, lane 1 was tpEGFP-C1 plasmid, lane 2 was the biallelic graph of recombinant plasmid pEGFP-C1-ADSL. M was DNA marker.图1 鸡ADSL基因PCR扩增和重组质粒的双酶切鉴定结果Fig.1 PCR amplification of chicken ADSL gene and double digestion identification of recombinant plasmids
2.2 鸡成肌细胞的培养与鉴定
对赤水乌骨鸡成肌细胞进行免疫荧光鉴定,结果如图2所示:图2-A是明场下的赤水乌骨鸡成肌原代细胞;图2-B是使用DAPI进行核染后的赤水乌骨鸡成肌细胞,可见细胞核颜色为明亮的蓝色;图2-C为使用一抗与成肌细胞进行孵育,一抗与成肌细胞中的desmin(肌间线蛋白)相结合,再与二抗(Cy3标记的山羊抗兔IgG-Cy3)发生作用后,进行荧光检测可见成肌细胞被染为明亮的红色,图2-D是图2-B与图2-C的叠加图,可见红色部分为成肌细胞中的desmin,表明成功复苏赤水乌骨鸡成肌细胞。

A,明场图;B,DAPI核染图;C,一抗反应荧光图;D,B与C的叠加。A, Bright-field picture; B, DAPI nuclear staining picture; C, Fluorescence plot of primary antibody reaction; D, Superimposition of B and C.图2 赤水乌骨鸡成肌细胞鉴定结果Fig.2 Identification results of myoblasts of Chishui black-bone chicken
2.3 鸡ADSL基因在细胞中的表达
将pEGFP-C1和pEGFP-C1-ADSL转染赤水乌骨鸡成肌细胞后,对重组蛋白进行检测,结果显示,获得了大小为82 ku左右的pEGFP-C1-ADSL重组蛋白条带(图3),与预测大小(81.9 ku)相一致。
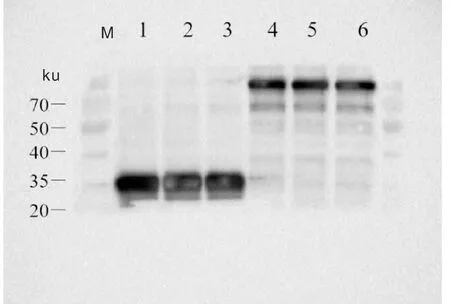
M为蛋白质分子量标准;1、2、3号泳道为pEGFP-C1蛋白印迹图;4、5、6泳道为pEGFP-C1-ADSL蛋白印迹图。M was protein marker; Lanes 1, 2, and 3 were pEGFP-C1 protein blots, and lanes 4, 5 and 6 were pEGFP-C1-ADSL protein blots.图3 pEGFP-C1和pEGFP-C1-ADSL在成肌细胞中的蛋白质印迹Fig.3 Western blotting of pEGFP-C1 and pEGFP-C1-ADSL in myoblasts
2.4 鸡ADSL的亚细胞定位
对pEGFP-C1标签蛋白和pEGFP-C1-ADSL重组蛋白的亚细胞定位进行分析,结果发现,EGFP标签蛋白主要定位在细胞质,而ADSL蛋白在细胞核和细胞质均存在(图4)。

图A、B、C为pEGFP-C1标签蛋白,图D、E、F为pEGFP-C1-ADSL重组蛋白。绿色是分别用pEGFP-C1和pEGFP-C1-ADSL转染成肌细胞后的发光效果图,蓝色是DAPI核染结果。Figures A, B and C were pEGFP-C1 tag protein, and Figures D, E and F were pEGFP-C1-ADSL recombinant protein. The green color was the luminescence effect of myoblasts transfected with pEGFP-C1 and pEGFP-C1-ADSL respectively, and the blue color was the DAPI nuclear staining result.图4 pEGFP-C1和pEGFP-C1-ADSL在成肌细胞中的亚细胞定位Fig.4 Subcellular localization of pEGFP-C1 and pEGFP-C1-ADSL in myoblasts
2.5 互作蛋白鉴定
利用LC-MS/MS技术把与GFP-ADSL重组蛋白和GFP标签蛋白结合的蛋白进行蛋白质谱鉴定,在可信度conf≥95、unique peptides≥1时,样品ADSL(GFP-ADSL)、C1(GFP-C1)质谱产生的二级谱图数分别为16 057、13 090,解析的二级谱图数分别为2 616、1 593,分别鉴定出916、598个肽段数。另外,3次重复实验中至少出现2次的蛋白被视为存在相互作用,结果发现与GFP-C1标签相互作用的蛋白有161个,与GFP-ADSL重组蛋白相互作用的细胞蛋白有197个。使用Venn在线软件分析发现,有94个蛋白可能与ADSL蛋白存在相互作用关系(图5),部分蛋白信息见表1。
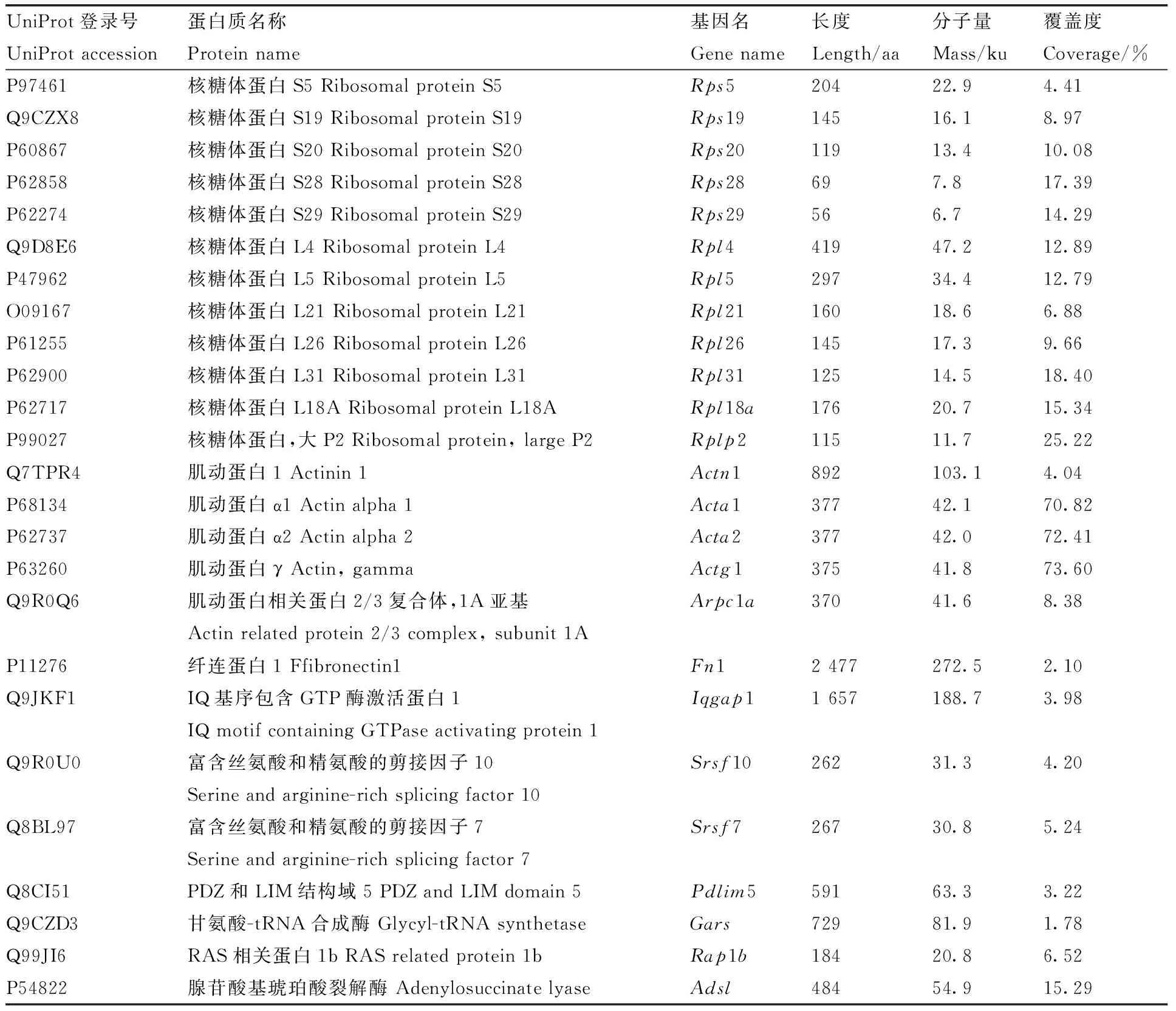
表1 与鸡ADSL蛋白相互作用的部分蛋白列表Table 1 List of selected proteins interacting with chicken ADSL protein
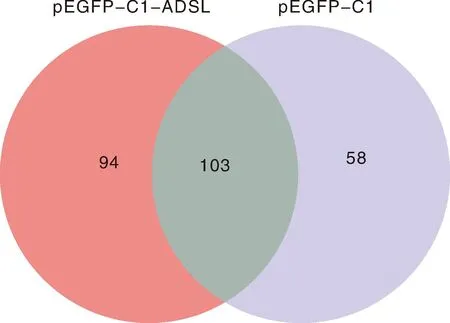
图5 pEGFP-C1-ADSL和pEGFP-C1互作蛋白的Venn图Fig.5 Venn diagram of pEGFP-C1-ADSL and pEGFP-C1 interacting proteins
2.6 GO功能注释
GO功能注释表明,大部分互作细胞蛋白具有多种功能,参与多种细胞内生物反应。生物过程富集结果表明,它们主要参与细胞进程、生物调节和刺激反应等生物过程;细胞组分分析显示,这些蛋白主要定位于细胞结构体、胞内和含蛋白质的复合物上;鸡ADSL蛋白富集的分子主要发挥结合、结构分子活性和催化活性的分子功能(图6)。
2.7 与鸡ADSL蛋白互作的蛋白的KEGG通路分析
利用KEGG信号通路对质谱鉴定到的互作蛋白进行通路富集,获得的信号通路见图7。与鸡ADSL蛋白互作的蛋白同时参与多条信号通路,主要参与代谢、遗传信息处理、环境信息处理、细胞过程、有机系统和疾病等信号通路。
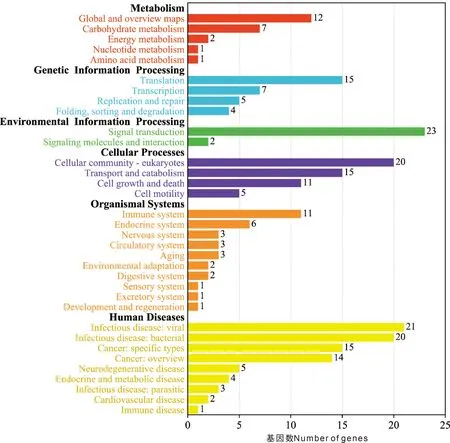
Metabolism,代谢;Genetic information processing,遗传信息处理;Environmental information processing,环境信息处理;Cellular processes,细胞过程;Organismal systems,有机系统;Human diseases,人类疾病。图7 与鸡ADSL蛋白互作的蛋白的KEGG通路分析Fig.7 KEGG pathway analysis of proteins interacting with chicken ADSL protein
2.8 鸡ADSL蛋白的蛋白质-蛋白质相互作用(PPI)网络图
为研究鸡ADSL蛋白相互作用网络信息,利用在线软件STRING绘制PPI网络图。将上文得到的94个蛋白导入STRING软件,发现有9个蛋白没有相关信息(图8-A)。通过知网查询与ADSL相关的基因,引入61个不在质谱数据的蛋白,得到由146个蛋白构成的共1 261个网络节点蛋白互作图(图8-B)。为得到更清晰的蛋白信息图,利用Cytoscape对该结果进行cytoHubba数据优化,结果见图8-C,圆圈越往内表示这些蛋白互作关系越强烈,颜色越深表示相关性越强。

A,引入61个蛋白前;B,引入61蛋白后;C,Cytoscape优化后。A, Before the introduction of 61 proteins; B, After the introduction of 61 proteins; C, Cytoscape optimized.图8 鸡ADSL蛋白的PPI网络图Fig.8 PPI network diagram of chicken ADSL protein
2.9 ADSL基因表达对相关基因表达的影响
ADSL基因过表达时,成肌细胞内RPL4、PDLIM5基因表达水平显著(P<0.05)降低,ACTG1、SRSF10基因表达水平极显著(P<0.01)升高(图9-A);当ADSL基因沉默后,成肌细胞内RPL4和ACTG1基因的表达水平极显著(P<0.01)上调,PDLIM5、SRSF10基因表达水平无显著变化(图9-B)。
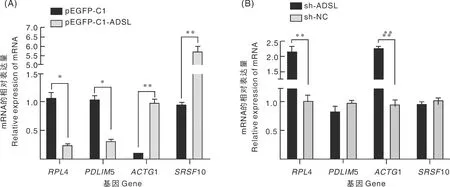
*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。* and ** meant significant differences at the levels of P<0.05 and P<0.01, respectively.图9 ADSL基因过表达(A)和沉默(B)对相关基因表达的影响Fig.9 Effect of ADSL gene overexpression (A) and silencing (B) on the expression of related genes
3 讨论
ADSL作为调控家禽IMP的重要候选基因,对家禽肉质品质的改良有着重要参考价值[12]。目前关于ADSL基因的研究多集中在单核苷酸多态性和IMP相关性的研究上,栾德琴[13]的研究表明,鸡ADSL基因表达水平较高,属于影响IMP沉积的重要基因。ADSL基因主要在肌肉中,尤其是家禽胸肌中高表达。本研究以赤水乌骨鸡成肌细胞为研究对象,利用Co-IP联合LC-MS/MS的方法,检测与鸡ADSL相互作用的蛋白,进而研究其在胸肌中高表达的原因与机制。
真核表达载体pEGFP-C1是一种自带绿色荧光的蛋白,可以与目的基因形成融合蛋白,并在真核细胞内高表达[14],利用pEGFP-C1来研究目的基因编码的蛋白的生物学功能是现在常用的一种实验手段。间接免疫荧光实验结果显示,赤水乌骨鸡pEGFP-C1-ADSL融合蛋白定位于细胞质和细胞核。Zhou等[15]通过在DF-1细胞内过表达GFP和GFP-CHBRD2,利用Co-IP联合LC-MS/MS蛋白质谱鉴定技术,鉴定到233个与GFP互作的蛋白,414个与GFP-CHBRD2互作的蛋白;Venn分析发现只有225个蛋白与GFP-CHBRD2有互作关系。本实验通过Co-IP联合LC-MS/MS蛋白质谱鉴定技术,在pEGFP-C1蛋白样品中鉴定到161个蛋白,pEGFP-C1-ADSL样品中鉴定到197个蛋白,二者之间有103个共有蛋白,Venn结果显示,只有94个蛋白与pEGFP-C1-ADSL有互作关系。蛋白质之间通过形成蛋白复合物在特定的时空内完成特定的功能,研究蛋白质相互作用对于全面揭示蛋白质的功能是必要的[16]。这些互作蛋白主要参与代谢、遗传信息处理、环境信息处理、细胞过程、有机系统和疾病等几种信号通路,这些蛋白大部分具有复合功能,参与多条通路,在多种生物功能中都在发挥作用。
本次鉴定到12个蛋白属于核糖体蛋白家族的成员,它们分别是Rps5、Rps19、Rps20、Rps28、Rps29,以及Rpl4、Rpl5、Rpl21、Rpl26、Rpl31、Rpl18a和Rplp2,它们不但参与蛋白质的生物合成,同时参与细胞的分裂与分化,对细胞增殖和细胞凋亡也起到重要的调节作用[17],对基因的表达发挥着关键调控功能。其次,Actg1、Actn1、Arpc1a、Fn1和Iqgap1参与肌动蛋白细胞骨架调节。SRSF10能够促进成肌细胞的分化,在横纹肌发育、成肌细胞分化中发挥重要调控作用[18],对肌肉的发育有着重要意义。在这些蛋白中,Gars[19]、Rap1b[20]、Srsf10[21-22]、Acta1[23-24]、Rpl26[25]、Pdlim5[26]、Actg1[27]、Copb1[28]等蛋白都与畜禽肉质风味等相关,以上8个蛋白可能与鸡ADSL蛋白存在互作关系。ADSL基因过表达时,RPL4的表达受到了抑制,将ADSL进行沉默以后,RPL4的表达水平显著上升,这可能与RPL4的高度保守性有关,表明ADSL与RPL4在赤水乌骨鸡成肌细胞中可能存在反向调控的关系。ACTG1不仅位于肌细胞,也存在在非肌细胞内,它不仅参与细胞分裂,还在细胞运动和迁移等活动中发挥功能。ADSL处于过表达和沉默时,ACTG1的表达均表现为上调,ADSL作为调控风味的主效基因在肌肉中出现了高表达的现象,当ADSL过表达时,ACTG1表达上调,当ADSL沉默时,ACTG1表达依旧上调,可能是因为ACTG1是一类作为细胞骨架成分而存在的蛋白质,具有高度保守性,它作为内部细胞运动的介质而存在,对维持细胞骨架和肌细胞的正常发育均起到重要作用。
4 结论
本研究构建了鸡ADSL基因的重组真核表达载体pEGFP-C1-ADSL,并将该载体转入赤水乌骨鸡的成肌细胞,随后利用Co-IP联合LC-MS/MS技术鉴定到94个与鸡ADSL存在互作的蛋白。pEGFP-C1-ADSL重组蛋白于细胞核和细胞质。GO功能注释表明,这些蛋白在细胞进程、生物调节和刺激反应等生物过程中发挥作用;KEGG信号通路分析显示,这些蛋白主要参与代谢、遗传信息处理、环境信息处理、细胞过程、有机系统和疾病等通路。
