枣树novel-miR16靶基因ZjTCP4鉴定及生物信息学分析
2024-04-08张露荷王多锋张广忠吕斌燕张洋军
张露荷,王多锋,张 德,张广忠,赵 通,吕斌燕,张洋军,李 毅
(1.甘肃省林业科学研究院,甘肃 兰州 730020; 2.甘肃农业大学 林学院,甘肃 兰州 730070)
干旱是世界上最严重的自然灾害之一。我国地处典型季风气候区,干旱灾害的影响尤为突出[1]。干旱缺水是限制沙漠、戈壁区农业发展的关键因素,枣树作为一种抗旱性较强的经济林树种,其林地也出现了严重的土壤干燥化问题,给枣树正常生长造成了障碍。枣树花小、人工去雄困难、坐果率低且胚败育现象严重,使得枣树杂交育种非常困难,所以生物技术育种是枣树未来育种的主要途径。前人通过转录组分析,鉴定了许多参与干旱响应的基因,如枣树的抗坏血酸过氧化物酶基因(ZjAPX基因)[2],耐旱相关的转录因子有DREB、NAC、MYB、TCP等,但对这些基因的转录后调控机理还不清楚。miRNA是一类非编码小分子RNA,通常在转录后水平调控靶基因的表达,参与植物的生长发育,响应着各种非生物胁迫和生物胁迫。虽然已经报道了枣树枣疯病[3]、酸枣在盐胁迫下miRNA的一些研究[4],证实miRNA在调控植物干旱胁迫反应中发挥着重要的调控作用[5],但关于miRNA调控枣树响应干旱胁迫的研究未见报道。
TCPs是一类植物特有的转录因子,通过调控下游基因的表达,在调控植物的形态构型、配子体发育、昼夜节律以及胁迫响应等多种生命活动过程发挥着重要作用;是响应干旱胁迫、盐胁迫、高温胁迫等非生物胁迫的十分重要的转录因子。已有研究表明,TCPs转录因子主要通过调节细胞增殖和植物激素途径来调控植物器官发生和形态构型[6]。最近研究解析了TCP基因编码蛋白与下游靶基因启动子DNA互作的调控模式[7]。TCP转录因子在调控植物生长发育和胁迫响应中的功能被广泛鉴定,其结构和调控机理被相继报道[8]。已经鉴定了许多植物中的TCP 基因;如在拟南芥中鉴定了24个TCP成员,在水稻中发现了26个TCP成员,在毛竹基因组中有19个TCP成员,紫花苜蓿中发现了40个TCP成员,这些基因大多数都定位于细胞核[9],作为转录因子主要在细胞核里面发挥调控功能。转录因子 TCP4 参与下胚轴延伸、次生细胞壁的形成、子叶的舒展、叶片形态和表皮毛分化等植物生长发育过程[10]。大豆的转录因子TCP4可以通过调节乙烯和脱落酸信号来响应干旱胁迫[11]。
关于枣树 TCP转录因子的功能研究还鲜有报道[12]。选择干旱敏感型枣树品种冬枣和耐旱型枣树品种赞皇大枣为实验材料,通过small RNA-seq和降解组测序技术在枣树全基因组水平挖掘干旱相关的miRNAs及其调控的靶基因,对枣树干旱相关的miRNAs的鉴定得知:干旱胁迫和正常浇水相比较,novel-miR16在冬枣和赞皇大枣中都差异表达,说明枣树novel-miR16响应干旱胁迫;RT-qPCR分析表明,novel-miR16在干旱胁迫下明显差异表达[13]。对枣树干旱相关的miRNA靶基因的鉴定中,验证了TCP4为枣树novel-miR16的靶基因,靶基因功能注释和相关研究报道表明TCP类转录因子响应干旱胁迫。因此,选择novel-miR16研究其在枣树响应干旱胁迫过程中的功能。本研究从枣树中研究发现novel-miR16的靶基因为TCP转录因子,并在枣树中克隆到ZjTCP4基因的序列,对该基因进行生物信息学分析,亚细胞定位和干旱胁迫下的表达分析,以期为TCP转录因子响应干旱胁迫的机理研究提供参考。
1 材料与方法
1.1 试验材料
本氏烟草无菌苗由陕西博瑞德生物科技有限公司提供。培养室温度为26 ℃,光照1 500 lx,12 h光照、12 h黑暗。赞皇大枣枣树苗由河北农业大学提供。载体及试剂:DH5α感受态细胞购自北京全式金生物技术有限公司,pMD®19-T Vector购自TaKaRa公司,pART-CAM-EGFP由陕西博瑞德生物科技有限公司提供,植物总RNA提取试剂盒购自天根生化科技(北京)有限公司,DNA 胶回收试剂盒、DL2000 Marker、DNA聚合酶和各类限制性内切酶均购自上海生物工程有限公司。
1.2 数据库与分析软件
已知植物miR319成熟体序列从miRNA数据库 (http://www.mirbase.org)中获得;枣树novel-miR16靶基因利用在线预测软件psRNATarget (http://plantgrn.noble.org/psRNATarget/)预测获得,novel-miR16的靶基因序列在枣树基因组数据库(Ziziphus_jujuba.version2_13chr )中下载获得;Expasy(http://www.expasy.org/tools)用于枣树novel-miR16靶基因ZjTCP4编码蛋白的基本性质分析;软件UNAFold (http://www.bioinfo.rpi.edu/applications/mfold/old/rna/)预测novel-miR16前体序列的二级结构;利用DNAMAN(Lynnon Biosoft, San Ramon, CA, USA)构建系统进化树。
1.3 枣树novel-miR16序列和结构分析
将高通量测序获得枣树novel-miR16成熟体序列与miRNA数据库miRBase中已知的植物miRNA成熟序列比对,分析其保守性。利用在线分析软件UNAFold (http://www.bioinfo.rpi.edu/applications/mfold/old/rna/)预测novel-miR16前体序列的二级结构。
1.4 枣树novel-miR16靶基因的预测
根据高通量测序获得枣树novel-miR16的成熟体序列;利用植物miRNA靶基因在线预测软件psRNATarget预测枣树novel-miR16的靶基因,通过对靶基因的功能注释鉴定其功能。
1.5 枣树novel-miR16靶基因ZjTCP4的验证
为了验证枣树novel-miR16预测的靶基因,我们用RNA连接酶介导的RLM-5′RACE(Invitrogen公司的GeneRaeer 试剂盒)对枣树novel-miR16预测靶基因的降解位点进行了验证。采集枣树叶片并提取总RNA,连接RNA接头并反向转录获得cDNA,根据 GeneRacer试剂盒5′接头引物和靶基因ZjTCP4的特异性引物(Outer primer:5′-CAAGCCTCTTGCTTCTGATCC-3′和Inner primer:5′-CTGTGAATTTGTACAATTGCTTTC-TTAGCAACCTGTGAATTTGTACAATTGCTTTCTT-AGCAAC-3′)进行重叠PCR扩增获得靶基因ZjTCP4的5′端序列,PCR扩增片段经凝胶电泳纯化回收后克隆到pMD19-T进行测序,通过分析靶基因的降解位点来验证预测枣树novel-miR16靶基因。
1.6 枣树TCP4基因的克隆
在枣树基因组数据库(Ziziphus_jujuba.version2_13chr)中下载获得ZjTCP4(CCG006181)基因序列,利用软件DNAMAN设计枣树ZjTCP4 基因的PCR 克隆引物;正向引物:5′-CGGGATCCTAACATGGAC GCCATCAATC TC-3′,退火温度67.5 ℃;反向引物:5′-CGAGCTCCAATCTCACAAACCACTCTCTTCTTC-3′,退火温度67 ℃;并送生物工程有限公司。以提取到的枣树叶片总 RNA 为模板,按AMVcDNA合成试剂盒合成cDNA,用ZjTCP4 基因特异的引物进行PCR 扩增,反应体系:TaqPCR Master Mix(上海生工,货号:B639295)10 μL,ZjTCP4-F(10 μmol·μL-1) 1 μL, ZjTCP4-R(10 μmol·μL-1) 1 μL, 模板cDNA 1 μL,ddH2O 7 μL。将PCR产物与pMD®19-T Vector 载体进行连接,用热激法将连接产物转入大肠埃希菌 DH5α感受态细胞进行测序。
1.7 ZjTCP4的生物信息学分析
利用在线分析工具Expasy(http://web.expasy.org/protparam/)分析ZjTCP4基因编码多肽的等电点、分子量及相关理化性质;Swiss-Model(http://swissmodel.expasy.org/)预测枣树ZjTCP4基因编码蛋白质三级结构模型;用TMHM-M-2.0(http://www.cbs.dtu.dk/services/TMHMM/)软件进行ZjTCP4基因编码蛋白跨膜结构域分析;利用SignalP 3.0 Server (http://www.cbs. dtu.dk/services/SignalP)信号肽预测软件分析ZjTCP4基因编码蛋白信号肽;利用NetPhos 2.0 Server软件进行ZjTCP4基因编码蛋白质的翻译后加工修饰预测;利用软件ProtScale(http://web.expasy.org/protscale/)分析ZjTCP4基因的亲疏水性;利用Plant-mPLoc蛋白亚细胞定位预测软件预测ZjTCP4基因的作用位置[14];通过软件DNAMAN(Lynnon Biosoft, San Ramon, CA, USA)对靶基因ZjTCP4及拟南芥TCP转录因子构建系统进化树。
1.8 ZjTCP4亚细胞定位
将靶基因ZjTCP4与亚细胞定位载体pART-CAM-EGFP连接构建表达载体,将本氏烟草植株置于白色荧光灯下一段时间使叶片气孔打开,再用注射器将导入亚细胞定位载体的菌液注入烟草植株叶片的表皮,直到看到液体扩散,再侵染其他部位,侵染后,用记号笔圈定侵染区域。然后将叶片喷水,套上保鲜袋后置于黑暗环境培养过夜。培养48 h后打开保鲜袋,培养72 h后切取标记区域,撕下烟草叶片表皮在荧光显微镜下观察拍照。
1.9 枣树novel-miR16及靶基因ZjTCP4在干旱胁迫下的表达分析
通过qRT-PCR技术检测枣树novel-miR16及其靶基因ZjTCP4在赞皇大枣枣树品种中的表达情况,赞皇大枣为定干80 cm 的3年生截干苗。2020年秋季将枣树苗栽植在花盆中后,将花盆埋在地里面越冬。2021 年7月在甘肃农业大学的标准设施温室进行盆栽的干旱试验,干旱处理的土壤含水量为田间持水量的25%±5%,定期用土壤湿度计进行监测,用称重法进行测定和浇水。分别提取干旱胁迫0、5、10、15、20、25 d时赞皇大枣枣树的叶片总RNA,并用One Step PrimeScript1 miRNA cDNA synthesis kit(TaKaRa)试剂盒反转录获得各自的cDNA,检测枣树novel-miR16及其靶基因ZjTCP4在干旱胁迫不同时期的表达情况,以ef1a基因为内参基因,PCR条件为:94 ℃预变性10 min;94 ℃变性 20 s,58 ℃ 退火30 s,设置35个循环。最后用2-ΔΔCT公式计算novel-miR16及其ZjTCP4基因在不同时间的相对表达量。
2 结果与分析
2.1 枣树novel-miR16的二级结构分析
UNAFold 预测novel-miR16前体序列的二级结构表明,其二级结构具有miRNA典型的发夹结构(图1),20 bp的novel-miR16成熟体序列(UUGGACU GAAGGGAGCUCCC)位于二级结构的5′端。

红色部分表示novel-miR16成熟序列。Mature novel-miR16 sequences are in red.图1 枣树novel-miR16二级发夹结构Fig.1 The secondary hairpin structures of novel-miR16 in Chinese jujube
2.2 枣树novel-miR16的保守性分析
为了研究枣树novel-miR16的功能,我们分析了枣树novel-miR16成熟体序列的保守性,结果表明,枣树novel-miR16的成熟体序列与miRBase中植物miR319成熟体序列高度保守,与67个已知植物miR319成熟体序列完全相同,与其他33个已知植物miR319成熟体序列仅有1个碱基差异。因此,认为novel-miR16为枣树miR319家族成员。
2.3 枣树novel-miR16靶基因的预测
枣树novel-miR16靶基因利用psRNATarget软件预测获得(表1)。通过对预测靶基因的序列比对和结构域分析表明,枣树novel-miR16靶基因与TCP转录因子高度同源,且具有TCP转录因子特征结构域,属于TCP转录因子家族,并将靶基因命名为ZjTCP4(CCG006181)。

表1 枣树novel-miR16的靶基因预测Table 1 Predicted target genes of novel-miR16 in Chinese jujube
2.4 枣树novel-miR16靶基因ZjTCP4的验证
为了进一步验证novel-miR16预测的靶基因ZjTCP4,我们利用RLM-5′RACE技术对novel-miR16在靶基因ZjTCP4上的切割位点进行验证。靶基因ZjTCP4的降解位点多数都在novel-miR16结合位点的第10和11个核苷酸的位置 (图2),表明ZjTCP4为枣树novel-miR16的靶基因。
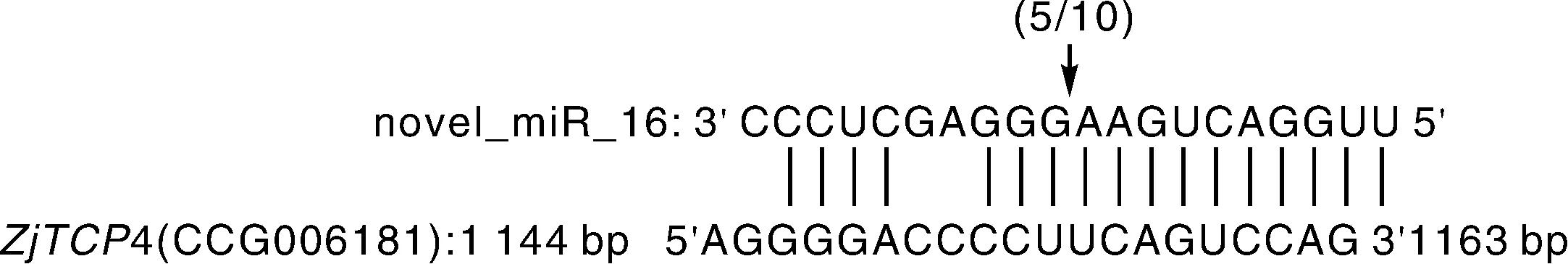
图2 枣树novel-miR16靶基因的验证Fig.2 Verification of novel-miR16 target mRNA in Chinese jujube
2.5 枣树ZjTCP4基因的克隆
以ZjTCP4-F和ZjTCP4-R 为引物,在枣树中扩增ZjTCP4基因,扩增获得1 386 bp大小的预期条带(图3),初步判定靶基因ZjTCP4(CCG006181)扩增成功,将PCR产物与克隆载体连接后送上海生物工程有限公司进行测序,测序结果表明,扩增序列与ZjTCP4(CCG006181)序列只有3个碱基的差异,说明该基因扩增成功。
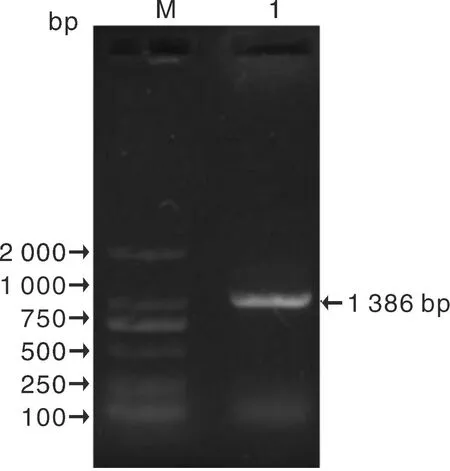
M,2 000 bp ladder Marker;1,PCR 产物。M, 2 000 bp ladder Marker; 1, PCR products.图3 PCR产物电泳检测Fig.3 Result of electrophoresis of PCR products
2.6 枣树ZjTCP4基因的生物信息学分析
2.6.1 枣树ZjTCP4基因编码蛋白质理化性质分析
生物信息学分析表明,ZjTCP4基因的全长cDNA序列为1 386 bp,预测编码452个氨基酸的多肽,预测编码蛋白质的等电点(pI)为6.51,分子量为49 091.55 u。其分子量、等电点及其预测蛋白质的长度与已报道拟南芥、水稻和杨树等模式植物TCP转录因子家族成员极为相似。
2.6.2 枣树ZjTCP4基因编码蛋白质三级结构
Swiss-Model预测枣树ZjTCP4基因编码蛋白质三级结构模型,结果表明,该基因主要有2个α螺旋和2个折叠,详细结果见图4。

A,ZjTCP4基因编码的蛋白质三级结构预测;B,ZjTCP4基因编码的蛋白质跨膜结构域分析图;C,ZjTCP4基因编码的蛋白质信号肽预测;D,ZjTCP4基因编码蛋白质翻译后加工修饰预测;E,ZjTCP4基因编码的蛋白质疏水性分析。A, Tertiary structure prediction of protein encoded by ZjTCP4 gene;B, Transmembrane domain analysis of protein encoded by ZjTCP4 gene; C, Signal peptide prediction of protein encoded by ZjTCP4 gene;D, Post-translational modification prediction of protein encoded by ZjTCP4 gene; E, Hydrophobicity analysis of protein encoded by ZjTCP4 gene.图4 ZjTCP4基因编码的蛋白质生物信息分析图Fig.4 Bioinformatics analysis of protein encoded by ZjTCP4 gene
2.6.3 枣树ZjTCP4基因的跨膜结构域分析
用TMHM-M-2.0软件进行ZjTCP4基因编码蛋白跨膜结构域分析,结果表明,该基因没有跨膜结构域,应该是一个膜内或膜外蛋白,详细见图4。
2.6.4ZjTCP4基因的信号肽分析
利用SignalP 3.0 Server软件预测ZjTCP4编码蛋白的信号肽,结果表明,该基因编码蛋白未发现信号肽(图4),可能为非分泌性蛋白。
2.6.5 枣树ZjTCP4基因编码蛋白翻译后加工修饰预测
对ZjTCP4翻译后加工修饰的预测发现,ZjTCP4基因编码蛋白有较高的磷酸化修饰,磷酸化修饰位点有76个,其中Ser磷酸化修饰位点 39个,Thr 磷酸化修饰位点17个(图4)。
2.6.6 枣树ZjTCP4基因编码蛋白疏水性分析
ZjTCP4基因编码蛋白亲水性分析表明,该基因整体的亲水性明显强于疏水性,为亲水性蛋白质(图4)。
2.6.7 枣树novel-miR16靶基因ZjTCP4的亚细胞定位预测
利用Plant-mPLoc蛋白亚细胞定位预测软件分析ZjTCP4基因编码蛋白在细胞内的作用位置,结果表明,该基因定位于细胞核,与预期结果一致,也符合转录因子的位置特征。
2.6.8 枣树ZjTCP4基因的保守性分析
将枣树ZjTCP4基因编码蛋白与拟南芥33个TCP转录因子进行序列比对分析,并用DNAMAN(Lynnon Biosoft, San Ramon, CA, USA)构建系统进化树。结果表明,枣树ZjTCP4基因编码的氨基酸序列与拟南芥AtTCP4最为相似,与拟南芥AtTCP17,AtTCP18和AtTCP12的相似性也较高,详细结果见图5。
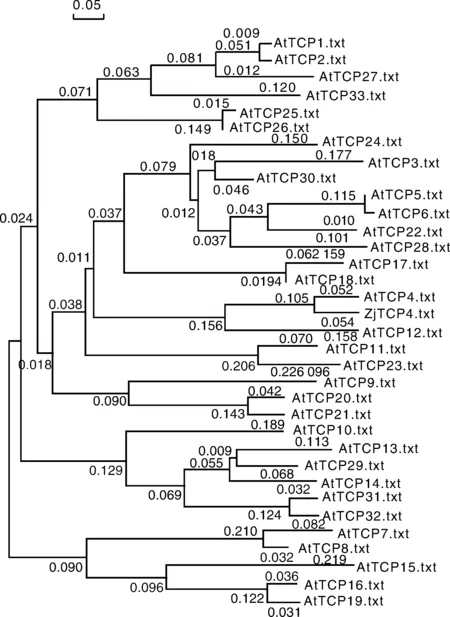
图5 ZjTCP4基因编码的蛋白质系统进化树Fig.5 Phylogenetic tree of protein encoded by ZjTCP4
2.7 枣树novel-miR16靶基因ZjTCP4的亚细胞定位验证
将构建的pCAM-GFP-ZjTCP4载体和pCAM-GFP空载体(阴性对照)注射至烟草叶片,黑暗环境培养48 h后用激光共聚焦显微镜在488 nm波长处观察拍照。结果显示:空载体pCAM-GFP定位于细胞质、细胞核和细胞膜中,而pCAM-GFP-ZjTCP4融合蛋白主要定位于细胞核(图6)。
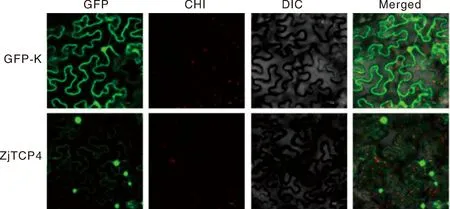
从左到右分别为 CK/基因的 GFP 绿色荧光蛋白、CHI、明场和3个通道的叠加照片。From left to right, superimposed photos of GFP green fluorescent protein, CHI, bright field and three channels of CK/gene, respectively.图6 ZjTCP4基因的亚细胞定位图Fig.6 Subcellular localization of the ZjTCP4 protein
2.8 枣树novel-miR16及靶基因ZjTCP4响应干旱胁迫
为了检测枣树novel-miR16及靶基因ZjTCP4(CCG006181)是否响应干旱胁迫,本研究利用qRT-PCR分析了枣树novel-miR16及靶基因ZjTCP4 (CCG006181)在干旱胁迫不同时期的表达模式。结果表明,枣树novel-miR16及靶基因ZjTCP4(CCG006181)在响应干旱胁迫的过程中呈现相反的表达模式,枣树novel-miR16在响应干旱胁迫的过程中上调表达,而其靶基因ZjTCP4(CCG006181)在干旱胁迫下下调表达(图7)。
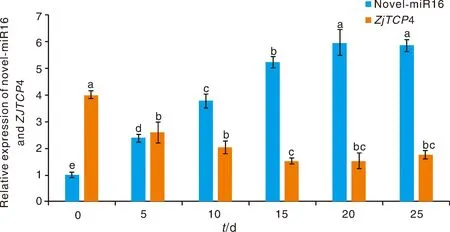
同一基因不同时间点间没有相同小写字母表示差异显著(P<0.05)。No identical lowercase letters between different time points of the same gene indicate significant differences (P<0.05).图7 枣树novel-miR16及基因靶ZjTCP4在干旱胁迫下的表达分析Fig.7 The expression level of novel-miR16 and ZjTCP4 under drought stress in Chinese jujube
3 讨论
3.1 novel-miR16是枣树中保守的miR319家族成员
MiR319是植物中最为保守miRNA家族之一[15-16]。另外,miR319靶向TCP转录因子在植物中同样保守[17-19]。已知miR319靶向TCP转录因子在多种植物发育和对各种胁迫的响应中发挥重要作用[17,20]。例如,在盐胁迫下,miR319在拟南芥[16]、小麦[21]、蔓生弯草[19]和柳枝稷[22]等多种植物中都上调表达,而其靶基因TCP类转录因子下调表达。这说明miR319靶向TCP转录因子的调控模式在植物中也同样保守。本研究在枣树中鉴定出1个 miR319 家族新成员(novel-miR16),保守性分析表明,枣树novel-miR16的成熟体序列与miRBase中植物miR319成熟体序列高度保守,与67个已知miR319成熟体序列完全相同,与其他33个已知miR319成熟体序列仅有1个碱基差异。表明novel-miR16是枣树中保守的miR319家族成员之一。另外,靶基因预测表明,枣树novel-miR16的靶基因为ZjTCP4(CCG006181),5′-RACE对靶基因ZjTCP4 (CCG006181)验证表明,其切割位点多数呈现在novel-miR16结合位点的第10和11个核苷酸之间,这与拟南芥miR319对靶基因TCP4的切割位点一致,说明植物miR319与靶基因TCP类转录因子的剪切位点在不同物种间保守性较强。
3.2 枣树novel-miR16靶向ZjTCP4基因响应干旱胁迫
众所周知,miRNA通过调控其靶基因的表达来调节植物对干旱胁迫的响应,大量响应干旱胁迫的miRNA及其靶基因已在多种植物中被鉴定出来[23-26]。由于miRNA在转录后调控靶基因mRNA的降解,miRNA与靶基因呈现相反的表达模式,因此,通常通过分析miRNA与靶基因在胁迫下的表达模式来鉴定miRNA在胁迫响应中的功能。例如,拟南芥在磷胁迫下miR399的表达量上升,而靶基因泛素结合酶基因UBC24下调表达[24];水稻在冷胁迫下miR159的表达量会明显降低,导致其靶基因MYB3R-2类转录因子表达量的升高而增强水稻的耐冻性[25];植物miR395的靶基因为APS基因,植物中miR395表达量的降低会导致其靶基因APS表达量的积累,最终会使植物体内谷胱甘肽的含量增加,提高植物对多种非生物胁迫的抗性[26]。
本研究通过高通量测序在枣树中鉴定出1个miR319新成员novel-miR16,并通过生物信息学分析和实验验证鉴定出其靶基因ZjTCP4。研究发现,TCP 转录因子通过激活或抑制下游干旱相关基因的表达,在植物响应逆境胁迫中发挥着重要的调控作用[27-28]。也有报道表明,miR319与TCP存在靶向关系,响应着植物逆境胁迫过程。我们利用qRT-PCR检查novel-miR16及靶基因ZjTCP4 (CCG006181)在干旱胁迫不同时期的表达模式发现,枣树novel-miR16及靶基因ZjTCP4 (CCG006181)在响应干旱胁迫的过程中呈负相关,枣树novel-miR16在响应干旱胁迫的过程中上调表达,而其靶基因ZjTCP4 (CCG006181)在干旱胁迫下下调表达。这与在模式植物中的研究结果基本一致[29-30]。研究发现,在拟南芥、水稻、白菜、棉花、兰花的TCP基因中发现了miR319的靶基因位点,并且在胁迫条件下miR319与TCP基因的表达模式就是呈负相关关系。miR319主要是通过靶向转录因子,参与影响调控植物的激素合成、信号转导、抗逆作用和生长发育。有研究表明:过表达水稻miR319可以提高水稻的耐盐性[17],与本研究结果相似。因此,本研究表明,枣树novel-miR16通过靶向调控ZjTCP4转录因子响应干旱胁迫,干旱胁迫下枣树novel-miR16的上调表达导致靶基因ZjTCP4 (CCG006181)下调表达来提高枣树的耐旱性。TCP4转录因子可能在ABA和JA激素介导的干旱胁迫响应中起正调控作用,这可以为深入解析枣树novel-miR16靶向TCP4转录因子调控植物响应干旱胁迫的分子机理提供了理论基础。
4 结论
本研究在枣树中鉴定出miR319家族成员novel-miR16,并通过靶基因预测和实验验证鉴定出枣树novel-miR16的靶基因为ZjTCP4(CCG006181)转录因子。通过分析枣树novel-miR16及靶基因ZjTCP4转录因子在干旱胁迫下的表达模式,结果表明,在干旱胁迫下枣树novel-miR16上调表达,而其靶基因ZjTCP4 (CCG006181)下调表达,表明novel-miR16及其靶基因ZjTCP4在枣树对干旱胁迫的响应过程中发挥着重要的调控作用,但枣树novel-miR16靶向ZjTCP4调控枣树响应干旱胁迫的分子机制还需进一步研究。
