基于PCR-DGGE技术分析浓香白酒窖泥梭菌多样性
2024-04-02吴玉轩汪俊卿刘玉涛张梦梦任广花王文洁崔吉鹏
吴玉轩,汪俊卿,刘玉涛,张梦梦,任广花,王文洁,崔吉鹏
(1.齐鲁工业大学(山东省科学院)生物工程学院,山东济南 250353;2.济南趵突泉酿酒有限责任公司技术质量部,山东济南 250115)
窖池固态酿造是我国浓香型白酒的独特生产方式。酒醅与窖池四周的窖泥大面积直接接触,为酿造微生物提供了良好的生存环境,也是合成己酸乙酯、丁酸、己酸等多种关键风味物质微生物的重要来源。不同窖池生产的浓香型白酒存在品质差异,这主要由于窖池中的窖泥在长期的酿造过程中,窖泥的理化因素(如含水量、有效磷、腐殖质、有效钾、pH值、铵态氮等)会发生变化,这些变化会对窖泥中优势微生物的富集起到较好的促进作用[1-4]。如窖泥的含水量可影响土壤的酸碱度和窖泥是否板结;pH 值变化不仅能够改变窖泥性质,影响窖泥微生物群落结构,而且能够影响微生物的代谢和促进酒精发酵,进而提高优质白酒的得率;铵态氮可使窖泥中的营养物质直接被窖泥中的微生物吸收,能够有效促进微生物的生长和代谢,对改善窖泥品质具有重要作用等等,由此可知理化指标可间接反映窖泥的微生物群落结构及其丰度[5-7]。
梭菌属(Clostridium)微生物是浓香型白酒风味物质形成的重要菌群之一,窖泥中梭菌纲微生物是浓香型白酒酿造过程重要的生香菌,它们能够产生多种脂肪酸,对浓香型白酒典型风格的形成发挥着重要作用。白酒发酵体系是多菌种参与的体系,梭菌之间、梭菌和其他微生物之间都会存在相互作用。如梭菌利用其他种属微生物的代谢产物为底物生长并代谢。C.kluyveri可以利用C.ljungdahlii产生的乙酸和乙醇合成丁酸和己酸。对浓香型白酒窖泥微生物追踪发现,窖泥是厌氧菌的持续释放源,厌氧菌(Clostridium、Petrimonas、Sedimentibacter和Syntrophomonas等)会不断的迁移到酒醅当中。Gao[11]发现窖泥中的Caproiciporducens、Caloramator、Sedimentibacter和Caldicoprobacter等细菌迁移到了酒醅当中,而且这些微生物增加了酒醅微生物的多样性,并产生了丰富的挥发性酸和直链醇,改善了白酒的风味[9-11]。
本实验以山东某酒厂优质老窖泥作为研究对象,通过聚合酶链式反应-变性梯度凝胶电泳技术结合窖泥理化性质,探究优质窖泥的梭菌微生物群落结构和丰度,为稳固窖泥质量提供了技术参考和理论依据。
1 材料与方法
1.1 材料、试剂及仪器
窖泥采集:具体见1.2.1。
试剂及耗材:Gelstain 染液、Easytaq DNA 聚合酶、DNA maker,北京全式金生物科技有限公司提供;DNA 提取试剂盒、Dia Spin 柱式PCR 产物纯化试剂盒、去离子甲酰胺、丙烯酰胺,生工生物工程(上海)股份有限公司;窖泥,来自山东某酒厂浓香型白酒车间。
仪器设备:PCR反应扩增仪,美国BIO-RAD公司;凝胶成像系统,生工生物工程(上海)股份有限公司;ST16R高速冷冻离心机,美国Thermo公司。
1.2 实验方法
1.2.1 窖泥样品采集
窖泥样品:取10个窖泥样品,分别为A班的A-1、A-2、A-3、A-4、A-5 号窖池和B 班的B-1、B-2、B-3、B-4、B-5 号窖池。均采集于山东某酒厂优质窖池的池底泥,将样品保存在无菌自封袋中,迅速放置到-20 ℃备用。取样方法参照五点取样法,如图1 所示分别在窖池底部的五个点进行取样,在每个点分别取10 g 左右的窖泥样品,然后将样品混合均匀后置于无菌袋中,记录样品信息及相关理化指标,于-20 ℃保存备用。
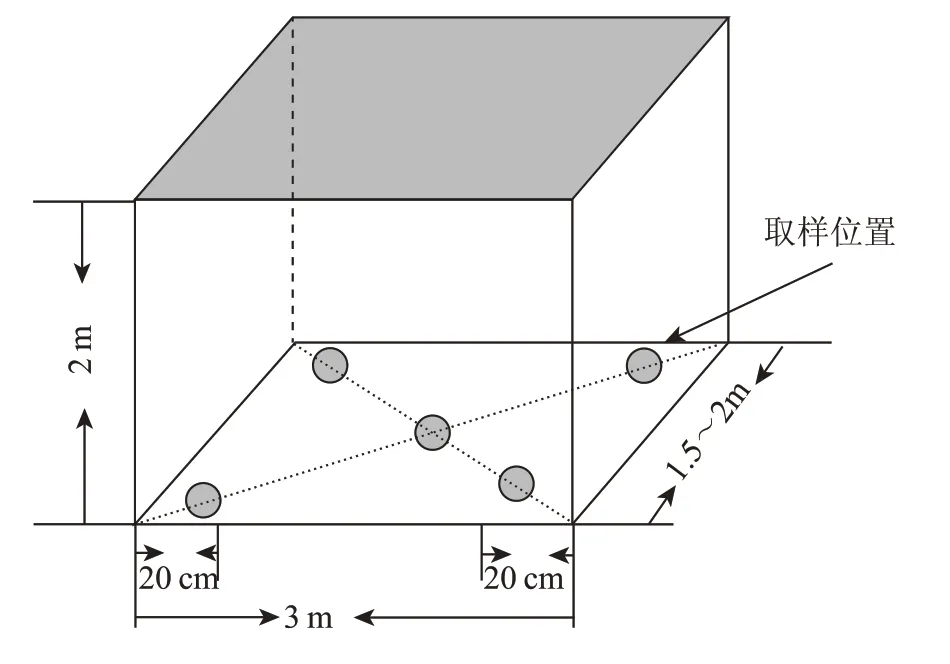
图1 窖池底部取样示意图
1.2.2 窖泥理化指标的测定
含水量测定:烘干法;pH 值:电位法;氨态氮:采用比色法;腐殖质:采用油浴法;有效磷:采用钼酸铵比色法。具体操作方法参照白酒生产技术全书[1]。
1.2.3 窖泥微生物DNA提取
将窖泥样品取出解冻,称取0.23 g,按照生工土壤DNA 提取试剂盒说明书进行窖泥总DNA 的提取。
1.2.4 窖泥梭菌的PCR扩增
以提取到的窖泥总DNA 为模板。使用引物SJ-F(GC)和引物SJR 对窖泥微生物中的梭菌进行PCR扩增,引物及扩增程序参考卢振试验方法[12-13]。
1.2.5 窖泥梭菌的变性梯度凝胶电泳
电泳完毕后取45 μL PCR 产物进行DGGE 分析。采用变性梯度为50%~55%、质量分数8%的聚丙烯酰胺凝胶在1×TAE 缓冲液中60 V、60 ℃条件下电泳930 min。
使用gelatain 染液染色30 min,然后用超纯水脱色30 min,利用凝胶成像系统拍照[14-17]。
1.2.6 条带测序
用灭菌的手术刀切下待回收的DGGE 条带,以引物SJ-F 和SJ-R 进行PCR 扩增,扩增产物连接至大肠杆菌Trans1-T1 感受态细胞,经蓝白斑筛选和M13F/R引物PCR检测后置于LB培养液中培养,将菌液进行测序分析。
2 结果与分析
2.1 理化指标检测
由图2 可知,参照赵长青窖泥指标进行比较[5],所挑选的10 个优质窖泥水分含量检测,A-1、B-1、B-4、B-5 为二级窖泥指标,A-2、A-3、A-4、A-5、B-2、B-3 为一级窖泥指标;pH 数据检测结果表明,B-1、B-4 为二级窖泥指标,其余皆为一级窖泥指标;腐殖质的检测结果显示,所挑选的10 个窖泥所含有的腐殖质含量均满足一级窖泥质量要求;有效磷和氨态氮检测结果表明,除B-1 有效磷满足一级窖泥指标外,其余优质窖池的窖泥检测数据均高于文献中一级窖泥指标。查阅文献可知不同酒厂的窖泥理化指标因培养环境、地理位置、测定方法等因素而没有一个统一的标准范围,不同酒企要根据窖池的实际情况,依据酒厂窖泥理化指标的长期实验数据积累和生产经验来确定窖泥的参考指标。窖泥中绝大多数微生物以铵盐和含氮有机物作为养料,氨态氮可以为窖泥中细菌的生长提供营养物质,故窖泥中氨态氮含量高可以判定窖泥的质量较好。有效磷是土壤中植物直接吸收利用的磷,是微生物生长、繁殖的必需成分之一,因此,较高的有效磷含量可以作为窖泥质量较优的指标。综上所述,理化分析结果表明所选10 个窖泥在理化参数层面均符合优质窖泥的要求[21-22]。

图2 窖泥理化检测
2.2 琼脂糖凝胶电泳
实验结果如图3 所示,所测10 个窖池泥中扩增到的梭菌条带清晰明亮,且对照未扩增出目的条带,说明扩增的结果可用于以下实验的进行。

图3 琼脂糖凝胶电泳
2.3 变性梯度凝胶电泳
2.3.1 DGGE指纹图谱的丰度和优势度比较
如图4 和图5 所示,在优质窖池泥中扩增出大量的梭菌纲微生物。条带的数目代表了微生物种类,在B-2 号窖池泥中测出的梭菌纲微生物最多,有21 种;在B-1 号窖池泥测出的梭菌纲最少,有8种。这些优质窖池泥中分离出的共有微生物较多。条带的宽度和亮度代表了微生物的含量,条带越宽越亮,该微生物的含量就越大,在这些优质窖池泥中扩增出大量的优势微生物,如15 号(图5 所示的标号)在各自的泳道中均占到了5.2 %以上的比例[18-20]。

图4 窖池泥梭菌DGGE指纹图谱

图5 窖池泥梭菌群落丰度示意图
条带(代表菌)在各自泳道中所占的比例如表1所示(以下标号同图4 中的标号),4 号、7 号、15 号、23 号均存在于所有的窖泥中。在A-3、A-4 和B-1号窖池含量最多的菌是4 号菌;A-2 号窖池含量最多的菌是12 号菌;A-4 号窖池中含量最多的菌是14 号菌;A-1 号窖池含量最多的菌是中15 号菌;B-2、B-3、B-4 及B-5 号窖池含量最多的菌是13 号菌。根据泳道中各条带所占比例可知B 班的5 个窖池中有4 个窖池的最优菌是相同的,优质窖池的优势功能菌集中在这几种菌[23-25]。

表1 泳道中各条带所占比例
2.3.2 DGGE指纹图谱的相似性比较
根据DGGE 指纹图谱的条带光密度值对检测的10 个窖池进行聚类分析,聚类结果如图6 所示。泳道6单独为一簇;#1(A-1)、#2(A-2)、#4(A-4)聚为一簇,相似度在0.66~0.71 之间;其它6 个泳道聚为一簇,相似度在0.62~0.88 之间。相似度高于0.60 的群体具有较好的相似性,可知#1(A-1)号池、#2(A-2)号池和#4(A-4)号池具有较好的相似性,#7(B-2)号池和#9(B-4)号池的相似性较好,#8(B-3)号池和#10(B-5)号池的相似度较好。由此可见同一班次内的优质窖池的梭菌相似性较好,不同班次的梭菌相似性存在差异。

图6 窖泥梭菌群落相似性指数树状图
2.4 测序结果分析
在DGGE 指纹图谱上选取处于不同位置且清晰明亮的条带,剪切后进行扩增-连接-转化-筛选-测序等一系列操作后获得梭菌的16S rRNA 序列,经分析后结果见表2。
在窖池泥中检测到的梭菌在科水平上有:真细菌科、毛螺菌科、颤螺旋菌科、梭菌科、Caldicoprobacteraceae、Tissierellaceae,其中梭菌科含量最高,其次为毛螺菌科和Tissierellaceae。在属水平上有:嗜碱菌属、丁酸弧菌属、梭菌属、喜热菌属、瘤胃梭菌属、粪球菌属、Sedimentibacter、Caldicoprobacter、Tepidimicrobium、Tissierella、Sporanaerobacter、硫酸盐还原菌属、鲁替孢菌属和Clostridiisalibacter[26]。
Alkalibaculum sporogenes发酵的终产物是醋酸酯;丁酸弧菌能够产生丁酸,为十个优质窖池泥中共有的优势菌,且该菌在无机和有机窖泥中也是共有的优势菌,由此可见该菌是该厂窖泥中普遍存在的优势菌;梭菌MT1 与己酸酯的合成相关;喜热菌能发酵产生甲酸、乙酸、乳酸及乙醇,该菌在有机窖泥中检测出但在无机窖泥中没有检出;Ruminiclostridium papyrosolvens是纤维素降解梭菌,分解纤维素的活性强;粪球菌属,能发酵产物丁酸、乙酸和气体,该菌在有机窖泥中检测出过;沉积微生物(Sedimentibacter)又叫产氢产乙酸菌,能将元素硫、硫酸盐或硫代硫酸盐还原成硫化物(如硫化氢),是非常重要的己酸菌;Caldicoprobacter是在五粮液、泸州老窖等窖泥中检测出的优势菌[27];Tepidimicrobium能够利用乳酸,是降乳酸菌群的优势微生物,是甲酚生产潜在菌;Sporanaerobacter acetigenes能利用一些糖类、多肽和氨基酸发酵产醋酸酯、异丁酸和异戊酸酯;硫酸盐还原菌是一种厌氧、嗜热、硝酸盐和硫代硫酸盐还原菌;鲁替孢菌与纤维素降解有关。硫酸盐还原菌、己酸菌、甲烷菌等共同组成厌氧发酵的循环通路,是优质窖泥的重要标志,由菌的代谢功能可知扩增到的细菌以己酸生成菌和硫酸盐还原菌为主,硫酸盐还原菌在酿酒发酵过程中发挥重要的作用,说明所选的窖池泥里面的功能菌达到益于白酒酿造的平衡状态。大量研究表明,Sedimentbacter、Tissierella、Caldicoprobacter、硫 酸盐还原菌、Sporanaerobacter、喜热菌等是优质窖泥的重要的指示菌[28]。
3 总结
通过对所选山东某酒厂10 个窖泥的水分、pH值、有效磷、氨态氮和腐殖质进行检测,结果显示在理化参数层面均符合优质窖泥标准的要求。
通过PCR-DGGE 技术分析窖泥中微生物群落结构可知,在窖池泥中检测到的梭菌在属水平上有:嗜碱菌属、丁酸弧菌属、梭菌属、喜热菌属、瘤胃梭菌属、粪球菌属、Sedimentibacter、Caldicoprobacter、Tepidimicrobium、Tissierella、Sporanaerobacter、硫酸盐还原菌属、鲁替孢菌属和Clostridiisalibacter,这些菌是优质窖泥的重要的指示菌,可知窖池泥中含有极其丰富的酿酒功能菌。
窖泥测序检测出来的梭菌中的硫酸盐还原菌、己酸菌、甲烷菌等共同组成厌氧发酵的循环通路,并且检测到大量的己酸生成菌和硫酸盐还原菌,其中以Sedimentibacter等为代表的己酸菌所占比重最大。将条带与序列结果对应后发现丁酸弧菌、Sedimentibacter、Caldicoprobacter、Sporanaerobacter acetigenes、鲁替孢菌等菌均存在于所有的窖泥中。其中窖池泥的主要优势菌是硫酸盐还原菌、Sporanaerobacter acetigenes、Sedimentibacter和Caldicoprobacter。
本研究通过对山东某酒厂浓香型白酒中十个窖泥的梭菌种类和丰富度进行探究和比较,揭示了可能在白酒酿造中起关键作用的梭菌菌群,在分子水平上为研究浓香型白酒提供了理论依据。后续可以通过从浓香窖泥中筛选优势梭菌菌株进行培养,研究其相关特性,进一步为浓香型白酒生产提供理论依据。
