喀斯特地区不同海拔对油茶根际土壤丛枝菌根真菌物种群落的影响
2024-04-01曾维军刘燕秦维罗文敏
曾维军 刘燕 秦维 罗文敏


摘要:本研究旨在了解喀斯特地区不同海拔油茶根际土壤丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)的种群多样性及物种分布特征,以提高AMF 在喀斯特地区生态修复中的应用基础。 以贵州喀斯特高、低海拔地区油茶根际土壤为材料,利用Illumina MiSeq 测序平台进行高通量测序,分析AMF 物种多样性及差异。 结果表明,喀斯特地区油茶根际土壤AMF 中球囊霉属(Glomus)占主要地位,整体丰度为87.28%;低海拔油茶根际土壤AMF 群落特异OTU 数和Shannon、Chao1 指数显著高于高海拔,物种多样性较为丰富,且组间AMF 物种聚类较远;油茶根际土壤有机质和有效磷含量与球囊霉属真菌丰度呈显著正相关,相关系数分别为0.58、0.65,表明喀斯特的低磷土壤促进油茶根际球囊霉属的生长,增加土壤碳库,促进油茶对磷的吸收利用。其作用机理待进一步研究验证。
关键词:油茶;喀斯特地区;根际土壤;丛枝菌根真菌;多样性
中图分类号:S154.3文献标识号:A文章编号:1001-4942(2024)01-0105-08
贵州省62%的国土面积为喀斯特地貌,总面积达10.91 万km2,居全国之首,是全球喀斯特发育最典型、最复杂、景观类型最丰富的地区之一[1] 。 喀斯特地貌地表干旱缺水,容易造成石漠化等生态退化问题[2] 。 通过植被恢复缓解石漠化是该地区生态修复的关键,但土壤的缺水和贫瘠导致植物难以定居、生长缓慢[3] 。 油茶是具有重要经济和生态价值的油料植物,贵州引种面积逐年增加,栽培过程中也面临着土壤保水保肥能力弱等问题,制约着油茶果产量和质量的提升。寻找一种提高油茶抗逆性的高效方法成为解决该问题的关键[4-5] 。
近年来研究发现,广泛定植于植物根部的丛枝菌根真菌(AMF) 具有促进宿主营养吸收、抗病、抗旱和改善土壤微生态等功能[6-9] 。 世界上许多国家和地区也规定在特定环境下造林,必须采用菌根化的苗木,以增加移栽的存活率[10-11] 。刘燕等[12] 前期研究也发现,耐旱且油茶果产量稳定的贵州野生油茶,其根系普遍被AMF 定殖。 因此,对AMF 的开发应用是未来研究的热点和趋势。
AMF 的开发利用过程中存在两个主要问题,一是不同AMF 对环境适应性存在差异,二是其高效培养和接种技术有待突破[13-14] 。 贵州喀斯特高、低海拔地區都有野生油茶林分布,不同海拔的油茶可能形成了自己特有的根际AMF 群落。 本研究通过Illumina MiSeq 平台对喀斯特高、低海拔地区野生油茶根际土样进行高通量测序,探究AMF 的物种多样性及其在土壤营养形成中的作用,为AMF 在贵州喀斯特地区油茶绿色种植中的应用提供理论依据。
1 材料与方法
1.1 研究区概况
设置高海拔和低海拔2 个研究区,海拔高度300~2 421 m。 研究区属亚热带季风性和季风性湿润气候,年平均气温11.5 ~ 19.2 ℃,年降水量926.2~1 340.7 mm,年日照时数为1 328 ~ 1 812h,无霜期180~345 d。 样区为野生油茶林,林龄为40~50 年,经度在104.08° E~109.07° E,纬度在24.93° N~27.47° N。 每样地设3 个野生油茶根际土壤采样点,样地详情见表1。
1.2 土壤样品采集
2021 年8 月,在贵州省威宁、册亨、从江、玉屏县的野生油茶分布区内各设置规格为400 m2的3 个相邻样方(20 m×20 m),在每个样方内沿“S”形路径分别选择10 株胸径和树高相近的油茶树,铲除落叶层并挖开上层覆土,剪下细根分枝并轻轻抖动,用毛刷将黏在细根上的土壤刷落到自封袋中。 每个样方内取10 份根际土壤,混匀后4 ℃冰箱保存,用于测定AMF 多样性。 样品的采集与预处理参照?土壤微生物研究原理与方法?[15] 。
1.3 土壤样品测序
根据soil DNA kit(Omega Bio-tek, Norcross,GA,U.S.)使用说明进行总DNA 提取。 1%的琼脂糖凝胶电泳检测基因组DNA 质量,使用Nano ̄Drop2000(Thermo Scientific 公司,美国)测定DNA浓度和纯度。 用两对特异性引物AML1/ AML2(5′ - ATCAACTTTCGATGGTAGGATAGA - 3′;5′-GAACCCAAACACTTTGGTTTCC-3′)和AMV4-5NF/AMDGR(5′-AGCTCGTAGTTGAATTTCG-3′;5′-CCCAACTATCCCTATTAATCAT - 3′) 进行巢式PCR 扩增[16] 。 PCR 反应体系为: 5 × TransStartFastPfu 缓冲液4 mL,2.5 mmol/ L dNTPs 2 mL,上、下游引物(5 mmol/ L)各0.8 mL,TransStart FastPfuDNA 聚合酶0.4 mL,DNA 模板10 mL,超纯水补足至20 mL。 扩增程序如下:95 ℃ 预变性3 min;95 ℃变性30 s,55 ℃退火30 s, 72 ℃延伸45 s,
27 个循环;72 ℃延伸10 min;4 ℃保存。 每样本3个重复。 将同一样本的PCR 产物混合后使用2%琼脂糖凝胶回收,利用AxyPrep DNA Gel Extrac ̄tion Kit(Axygen Biosciences,Union City,CA,USA)纯化,2%琼脂糖凝胶电泳检测其纯度,并用Qua ̄ntusTM Fluorometer(Promega, USA)对回收产物进行检测定量。 使用NEXTFLEX Rapid DNA-SeqKit 对纯化后的PCR 产物进行建库。 委托上海美吉生物医药科技有限公司利用Illumina MiSeq 平台进行测序。
1.4 土壤理化性质检测
土壤全氮、全磷、全钾、有效磷、速效钾含量及pH 值分别参照NY/ T 53—1987、GB/ T 9837—1988、NY/ T 87—1988、NY/ T 1121.7—2014、NY/ T1849—2010、NY/ T - 1241—1999 中方法进行测定;碱解氮采用碱解扩散法测定[17] 。
1.5 数据统计与分析
使用Flash1.2.11 进行pair-end 双端序列拼接;RDP Classifier2.13 进行序列分类注释;Use ̄arch11 进行OTU 统计;Mothur1.30.2 进行Alpha多样性分析,并对样本间的多样性指数进行t 检验;Mega7 和IQ-TREE 进行进化树分析和构建;R语言(version 3.3.1)进行物种Venn 图分析、制作群落柱形图以及NMDS 分析和作图。 最后使用Adobe Illustrator2022 修饰图形。 其中聚类方式采用USEARCH7-uparse 算法,物种分类数据库为maarjam081/ AMOTU。
2 结果与分析
2.1 不同海拔野生油茶根际土壤AMF 群落OTU组成及结构
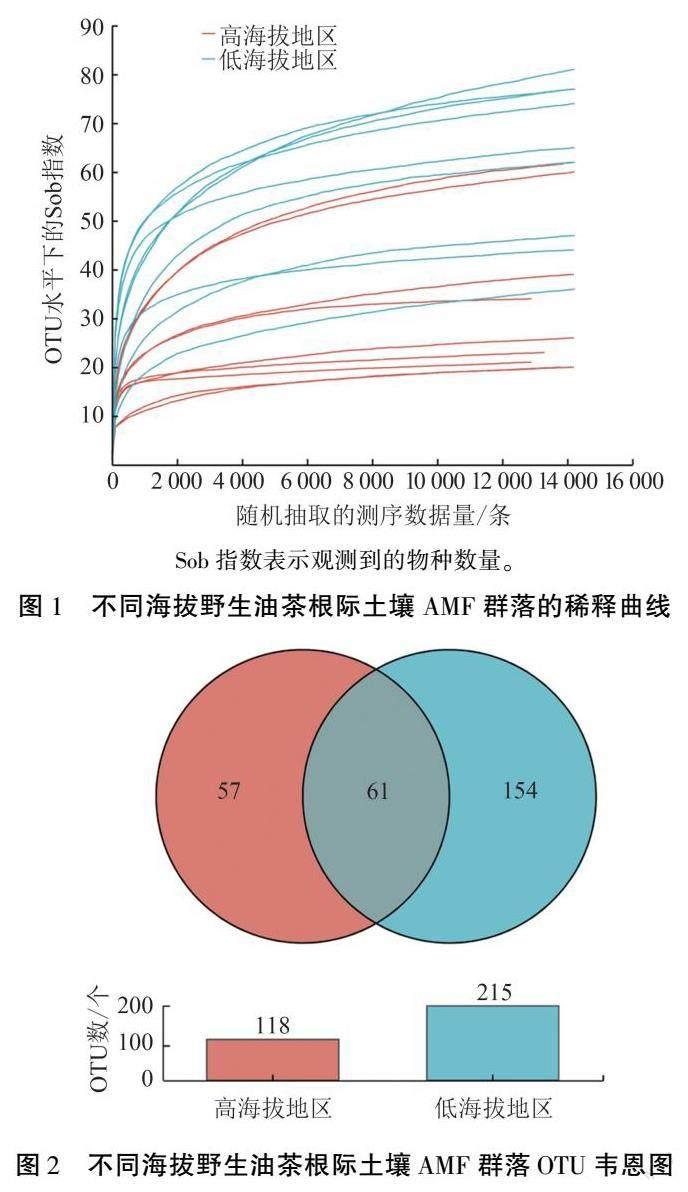
不同海拔野生油茶根际土壤中共获得367 148条高质量序列,样品平均序列为20 397条,总碱基数为79 338 214 bp,平均序列长度为216 bp,序列相似度为0.97,OTU 分类置信度为0.7。由稀释曲线(图1)可知,抽取的序列条数达到14 223条以上,曲线趋于平坦,表明不同处理的土样样本测序数量足够,测序数据合理。 由Venn图(图2)可知,喀斯特高、低海拔地区AMF 群落共有的OTU 数为61 个,占总数的18.32%;高海拔地区特异OTU 数为57 个,占总数的17.12%;低海拔地区特异OTU 数为154 个, 占总数的46.25%。
2.2 不同海拔野生油茶根际土壤AMF 群落结构及多样性
对喀斯特野生油茶根际土壤AMF 群落进行物种注释得到1 纲5 目8 科14 属75 种。 由图3可知,在属水平上,相对丰度排前4 位的属分别为球囊霉属(Glomus,87.28%)、无梗囊霉属(Acau ̄lospora,5. 97%)、盾巨孢囊霉属( Scutellospora,2.78%)、球囊菌纲中不能注釋的菌属(unclassified_c_Glomeromycetes,2.12%),球囊霉属为优势属。喀斯特高、低海拔地区相比,球囊霉属相对丰度差异不显著,无梗囊霉属和球囊菌纲中不能注释的菌属在高海拔地区相对丰度较高。 高海拔地区未发现盾巨孢囊霉属。不同海拔地区野生油茶根际土壤AMF 群落α 多样性指数如表2 所示,高海拔地区Shannon指数和Chao1 指数均显著低于低海拔地区,SHEI指数和PD 指数与低海拔地区相比差异不显著。表明喀斯特高海拔地区的野生油茶根际AMF 群落的多样性和物种总数均显著低于低海拔地区。
2.3 不同海拔野生油茶根际土壤AMF 群落PCoA 分析与样本聚类分析
PCoA 分析可通过降维找出影响野生油茶根际土壤AMF 样本群落组成差异的潜在主成分。由图4 可知,在种水平上,主成分1(PC1)与主成分2(PC2)解释方差分别为51.05%和32.59%;在OTU 水平上,主成分1(PC1)与主成分2(PC2)解释方差分别为24.60%和22.86%,影响野生油茶根际土壤AMF 群落结构的主导因子明显(P <0.05)。在种水平上,同一海拔、同一地点根际土壤3 个重复比较聚集,不同地点之间分化明显,高海拔样点之间的物种分化较低海拔明显。 在OTU水平上聚类情况与种水平上相反。
非度量多维尺度分析(NMDS)可将多维空间的研究对象简化到低维空间进行定位、分析和归类,揭示复杂背景下的简单规律。 由图5 可知,在种水平上,高海拔野生油茶根际土壤样本组的AMF 群落包含了低海拔土壤样本组,且Stress<0.05,具有很好的代表性;在OTU 水平上,不同海拔样本组间存在差异,且Stress<0.2。 PCoA 与NMDS 分析共同验证了贵州喀斯特高、低海拔间野生油茶根际土壤AMF 群落组成差异明显,高海拔样本组涵盖了低海拔的AMF 分子种。
基于weighted normalized unifrac 距离算法对贵州喀斯特高、低海拔野生油茶根际土壤样本进行层级聚类分析(图6)可知,高海拔地区A3 和A6 样本组的AMF 种群相似,聚为一类。 高、低海拔的AMF 物种组成丰度上有较大差异,说明海拔高低能改变AMF 种群结构。 但是低海拔样本组E2 与高海拔A2 组的AMF 种群相似,聚为一类。威宁县草海镇(A3)与从江县拱孑村(D2)两地海拔差为2 052 m,其AMF 群落结构相似性最低。
2.4 AMF 群落与土壤养分因子的相关性分析
通过方差膨胀因子分析(VIF)对7 个影响样本AMF 菌群组成的土壤养分因子进行筛选,保留多重共线性较小的因子,进行后续研究。 由表3可知,筛选后的土壤养分因子分别为全磷、全钾、有效磷、速效钾和有机质,VIF 值均小于10。
通过计算筛选后的土壤养分因子与AMF 物种之间的Pearson 相关系数,获得相关性热图(图7)。 结果表明,球囊霉属与土壤有机质和有效磷呈显著正相关,相关系数分别为0.58、0.65;多样孢囊霉属(Diversispora) 和原囊霉属(Archaeospo ̄ra)与全磷呈极显著正相关,相关系数分别为0.91、0.90;盾巨孢囊霉属与速效钾呈显著负相关,相关系数为-0.61;无梗囊霉属(Acaulospora)与全钾呈极显著负相关,相关系数为-0.78。
3 讨论
除宿主特异性外,AMF 的分布还受气候、土壤条件、纬度、空间隔离、干扰等多种非生物因子的影响[18-22] 。 研究发现,随着海拔的升高,青藏高原草甸AMF 的物种丰度逐渐降低[22] ;在宿主植物和土壤条件相似的情况下,AMF 多样性随气温升高而增加[23-24] 。 本研究发现,低海拔地区油茶根际AMF 群落特异OTU 数、Shannon 指数、Chao1 指数显著高于高海拔地区,表明AMF 物种总数和多样性随海拔的升高而降低;同时AMF 的群落结构也发生了改变,与低海拔地区相比,高海拔地区油茶根际土壤中未发现盾巨孢囊霉属真菌。 本研究中,海拔高度的改变直接导致两地区间较大的年平均气温差,达7.7 ℃,说明野生油茶根际土壤AMF 的物种结构和多样性差异也可能是由纬度、海拔差造成的环境温差导致。 另外,高、低海拔地区的油茶根际AMF 物种可以通过聚类分析分别聚在一起,同时高、低海拔组间又有一定的物种隔离,说明在喀斯特地区海拔差异越大,油茶根际AMF 物种的亲缘关系就越远。
石灰土是喀斯特地区分布最广的非地带性土壤,表现出高钙镁、低磷钾和土壤偏碱性的地球化学特征[25] ,而在一定范围内,低磷土壤会促进AMF 的生长[26-27] 。 研究表明,球囊霉属真菌能分泌球囊霉素,作为一种非专性蛋白,其主要作用是稳定和增加土壤有机碳库、改善土壤团聚体,还可以促进植物对磷的吸收,并能与铅结合在土壤重金属形态转化中具有潜在的重要意義[28-30] 。 本研究中,球囊霉属在AMF 中占据主要地位,并与油茶根际土壤有机质和有效磷含量呈显著正相关,说明喀斯特的低磷土壤能提高油茶根际球囊霉属丰度,使土壤中的球囊霉素含量理论上得到提高,从而改善土壤质量,增加土壤碳库,促进油茶对磷的吸收。
4 结论
贵州喀斯特高、低海拔地区的野生油茶根际土壤AMF 多样性、群落结构、种水平上的聚类关系均具有显著差异,其中低海拔地区的AMF 多样性较丰富,并与高海拔地区存在较为明显的种群亲缘隔离。 另外,喀斯特地区特有的石灰土中缺乏磷、钾,促进了油茶根际AMF 的生长,尤其是球囊霉属,其分泌较多的球囊霉素扩撒到土壤中,可改善土壤质量、增加土壤碳库、促进油茶对磷的吸收利用,从而使油茶根际土壤有机质和有效磷含量增加。 其相关作用机理有待进一步研究验证。
参 考 文 献:
[1] Tang J, Tang X X, Qin Y M, et al. Karst rocky desertificationprogress: soil calcium as a possible driving force[J]. Scienceof the Total Environment, 2019, 649:1250-1259.
[2] 王世杰. 喀斯特石漠化———中国西南最严重的生态地质环境问题[J]. 矿物岩石地球化学通报,2003,22(2):120-126.
[3] 魏源,王世杰,刘秀明,等. 丛枝菌根真菌及在石漠化治理中的应用探讨[J]. 地球与环境,2012,40(1):84-92.
[4] 黄安香,柏文恋,邬能英,等. 贵州油茶主产区土壤重金属环境质量状况及风险评价[J]. 环境化学, 2023,42(4):1325-1336.
[5] 柏文恋,黄安香,杨守禄,等. 贵州油茶主产区土壤养分特征及综合肥力评价[J]. 西南农业学报,2022,35(9):2096-2106.
[6] 刘代军,涂波,施松梅,等. 石漠化地区的生态危机及菌根桑生物修复潜力研究进展[J]. 中国岩溶,2012,31(2):185-190.
[7] Duru M, Cruz P P, Raouda A H K, et al. Relevance of plantfunctional types based on leaf dry matter content for assessingdigestibility of native grass species and species ̄rich grasslandcommunities in spring[J]. Agronomy Journal, 2008, 100(6):1622-1630.
[8] 姜海燕,李敏. 西瓜-辣椒轮作体系AMF 和PGPR 防控线虫的效果[J]. 山东农业科学,2021,53(4):131-134.
[9] 康佳,梁夕金,杨文龙,等. 丛枝菌根真菌(AMF)对盐碱地花生根系土壤微生物的影响[J]. 山东农业科学,2022,54(7):77-84.
[10] Skuji?? J, Allen M F. Use of mycorrhizae for land rehabilitation[J]. MIRCEN Journal of Applied Microbiology and Biotechnol ̄ogy, 1986, 2:161-176.
[11] 魏源,王世杰,刘秀明,等. 喀斯特地区丛枝菌根真菌遗传多样性[J]. 生态学杂志,2011,30(10):2220-2226.
[12] 刘燕,曾维军,秦维,等. 威宁短柱油茶丛枝菌根真菌和深色有隔内生真菌定殖特征及其与果实经济性状的相关性[J]. 江苏农业科学,2023,51(22):145-153.
[13] 杨佳绒,戴冬,陈俊芳,等. 丛枝菌根真菌多样性对植物群落构建和稀有种维持的研究进展[ J]. 植物生态学报,2023,47(6):745-755.
[14] 储薇,郭信来,张晨,等. 丛枝菌根真菌-植物-根际微生物互作研究进展与展望[J]. 中国生态农业学报:中英文,2022,30(11):1709-1721.
[15] 林先贵. 土壤微生物研究原理与方法[M]. 北京:高等教育出版社,2010:112-134.
[16] Van Geel M, Busschaert P, Honnay O, et al. Evaluation of sixprimer pairs targeting the nuclear rRNA operon for characteriza ̄tion of arbuscular mycorrhizal fungal (AMF) communities u ̄sing 454 pyrosequencing[J]. Journal of Microbiological Meth ̄ods, 2014, 106:93-100.
[17] 马献发. 土壤学实验[M]. 北京:中国林业出版社,2020:218-234.[18] Bever J D. Host ̄specificity of AM fungal population growthrates can generate feedback on plant growth [ J]. Plant andSoil, 2002, 244:281-290.
[19] 杨海水. 宿主植物对丛枝菌根真菌的影响———共生功能、地理分布及多样性[D]. 杭州:浙江大学,2013.
[20] 杨蕊毓,邓錡璋,田丽平,等. 不同生境下川麦冬根围土壤丛枝菌根真菌多样性[J]. 西北植物学报,2022,42(1):145-153.
[21] 朱亮,郭可馨,蓝丽英,等. 亚高山森林类型转换对土壤丛枝菌根真菌多样性的影响[J]. 生态学杂志,2020,39(12):3943-3951.
[22] Gai J P, Tian H, Yang F Y, et al. Arbuscular mycorrhizal fun ̄gal diversity along a Tibetan elevation gradient[J]. Pedobiolo ̄gia, 2012, 55(3):145-151.
[23] Koske R E. Distribution of VA mycorrhizal fungi along a latitu ̄dinal temperature gradient[J]. Mycologia, 1987, 79:55-68.
[24] 石国玺,王芳萍,马丽,等. 長期、短期增温对高寒草甸AM真菌群落结构的影响[J]. 草地学报,2021,29(增刊1):179-189.
[25] 罗绪强,王程媛,杨鸿雁,等. 喀斯特优势植物种干旱和高钙适应性机制研究进展[J]. 中国农学通报,2012,28(16):1-5.
[26] Tawaraya K, Saito M, Morioka M, et al. Effect of phosphateapplication to arbuscular mycorrhizal onion on the developmentand succinate dehy ̄drogenase activity of internal hyphae[J].Soil Science and Plant Nutrition, 1994, 40(4):667-673.
[27] 吴强盛,夏仁学,邹英宁. 柑橘丛枝菌根真菌生长与根际有效磷和磷酸酶活性的相关性[J]. 应用生态学报,2006,17(4):4685-4689.
[28] 张健,徐明,吴丽丰,等. 干扰对黔中地区马尾松林土壤球囊霉素的影响[J]. 森林与环境学报,2022,42(1):63-70.
[29] 张健,徐明,王阳,等. 黔中地区不同马尾松群丛土壤球囊霉素分布特征[J]. 生态环境学报,2021,30(12):2303-2308.
[30] 甘佳伟,韩晓增,邹文秀. 球囊霉素及其在土壤生态系统中的作用[J]. 土壤与作物,2022,11(1):41-53.
