中国沙棘HrNHX6 基因的生物信息学分析及其在盐胁迫下的表达模式
2024-04-01肖莎莎费凡董佳伟张丹马玉花
肖莎莎 费凡 董佳伟 张丹 马玉花


摘要:Na+ / H+逆向转运蛋白(NHX)广泛存在于多种生物中,可调节植物响应盐胁迫。 本研究对中国沙棘HrNHX6 进行结构预测和分析,并采用qRT-PCR 技术分析不同浓度NaCl 胁迫下HrNHX6 基因的表达情况。结果如下:①HrNHX6 基因总长为1 347 bp,与月季花等植物NHX6 基因具有较高的同源性。 ②HrNHX6 为稳定的疏水性蛋白,定位于高尔基体膜中,不具有信号肽,含7 个跨膜螺旋结构,且α-螺旋和无规则卷曲为其二级结构的主要构成元件,具有多个修饰位点。 ③盐胁迫下中国沙棘根、茎、叶中的HrNHX6 基因表达上调,说明HrNHX6 基因在中国沙棘响应盐胁迫的过程中可能发挥着重要的调控作用。 本研究结果可为阐明中国沙棘应对盐胁迫的机制奠定基础。
关键词:中国沙棘;盐胁迫;HrNHX6 基因;荧光定量PCR;基因表达
中图分类号:S793.6;Q786文献标识号:A文章编号:1001-4942(2024)01-0017-07
土壤盐碱化是影响农业发展的全球性问题,由于工业污染、化肥过量使用和灌溉不合理等因素的影响,土壤盐碱化的程度不断上升[1] ,已成为影响植物生长的重要问题之一。 盐胁迫不仅会抑制植物种子的萌发,还会加速植物根系的木栓化[2] ,影响根系对水分和营养物质的摄入,从而抑制植物生长发育。
植物耐盐性可表现为Na+ 被Na+ / H+ 逆向转运蛋白(NHX)外排或区隔化以维持细胞内的低Na+水平[3] 。 研究表明,在盐胁迫下,植物利用NHXs 将Na+分离到液泡,可以促使细胞从外界应激环境中吸收水分以维持渗透平衡,调节细胞质中的Na+浓度和pH,保护细胞器[4-5] 。 NHX 基因已在许多植物中被鉴定出来,但不同植物其成员数量不同,例如,拟南芥中有8 个NHX 基因[6] ,葡萄中有6 个NHX 基因[7] ,棉花中有25 个NHX 基因[8] 。 拟南芥的8 个NHX 蛋白中,AtNHX1—At ̄NHX4 定位于液泡膜上,AtNHX5 和AtNHX6 定位于胞体内膜,AtNHX7(AtSOS1) 和AtNHX8 定位于质膜上;根据亚细胞定位,又可将它们分为液泡NHXs( vacuolar NHXs)、内膜NHXs ( endosomalNHXs)、质膜NHXs(plasma membrane NHXs)[6] 。AtNHX1—AtNHX4 通过形成的跨膜质子梯度提供能量,介导Na+区隔化,以减少过量盐离子对细胞的伤害,稳定细胞渗透压,使植物适应盐旱环境;AtNHX5 和AtNHX6 具体定位于跨高尔基体网络,可参与囊泡运输和细胞扩增活性,特别是在液泡运输中具有重要作用,并调节pH 和K+;At ̄NHX7 通过盐超敏感(salt overly sensitivity, SOS)信号传导途径赋予植物耐盐性,SOS 途径包括SOS1(质膜Na+ / H+ 反向运输蛋白)、SOS2(丝氨酸/ 苏氨酸蛋白激酶)和SOS3(钙结合蛋白),其中SOS2 与SOS3 的复合物可调节SOS1 以去除细胞内的Na+ [9-10] ;AtNHX8 可以参与Li+ / H+ 反向转运[11-12] 。 但目前有关NHXs 在中国沙棘应对盐胁迫时的作用机制研究报道相对较少。
中国沙棘(Hippophae rhamnoides subsp. sinen ̄sis)是一种胡颓子科(Elaeagnaceae)沙棘属(Hipp ̄ophae)植物,具有耐旱、抗寒、抗风沙等特性,在我国西北被广泛用于水土保持。 研究表明,在盐胁迫条件下,沙棘渗透压降低,体内脯氨酸、可溶性糖等渗透介质的含量增加,渗透调节能力增强,以使植株适应外界环境[13] ;另一方面,沙棘体内抗氧化酶(POD、CAT、SOD 等)活性增强,可减轻活性氧对植株的伤害[14] ,从而提高沙棘的耐盐性。本研究以中国沙棘的抗盐分子调节机制为切入点,对耐盐相关基因HrNHX6 及其编码蛋白进行结构分析和亚细胞定位预测,同时分析其在不同浓度NaCl 胁迫下的表达模式,旨在为中国沙棘应对盐胁迫的机制阐明奠定基础,同时为高效耐盐基因的发掘提供依据。
1 材料与方法
1.1 试验材料
供试植物材料为长势一致的中国沙棘两年生扦插苗,由青海省西宁市大通县城关苗圃(37°14′45″ N,101°30′15″ E,海拔2 920 m)提供。 2019 年7 月28 日开始盐胁迫试验,将18 盆中国沙棘扦插苗随机分为6 组,分别用500 mL 浓度为0、200、400、600、800、1 000 mmol/ L 的NaCl 溶液浇灌, 3天后再浇灌一次。 每组处理的3 盆作为3 个重复,试验时在花盆底放置一个托盘,及时将漏出的溶液倒回花盆中,以防止水分和盐分的流失。 8月2 日采集根、茎、叶,用超纯水冲洗后用滤纸吸干水分,装入冻存管,置于液氮中速冻,随后放入-80 ℃冰箱保存备用。
1.2 试验方法
将中国沙棘根、茎和叶在液氮中研磨成细粉,依照植物RNA 试剂盒说明书快速提取总RNA,使用PrimeScript Ⅱ 1st Strand cDNA SynthesisKit 反转录质量檢测合格的优质RNA,并通过荧光定量PCR 法分析表达模式,引物(HrNHX6-F:CAATGGATATGTTGCTCCTTCGT, HrNHX6 - R:CTAATGCTGTAAATGATGCTGTGCT)由宝生物工程(大连)有限公司合成。 使用2-ΔΔCt法对基因的相对表达量进行分析,使用Microsoft Excel 2010和SPSS 22 软件进行数据整理与统计分析。
HrNHX6 基因的全长序列通过转录组测序获得。 用DNASTAR 进行核苷酸序列分析和同源比对;用MEME 进行保守基序分析;用ExPASy Prot ̄Param 进行蛋白理化性质分析;用PredictProtein进行亚细胞定位;用NetOGlyc 4.0 Server 进行信号肽和跨膜螺旋区分析;I-TASSER 用于预测蛋白二级结构,SWISS-MODEL 用于预测三级结构;PredictProtein 用于蛋白功能位点的预测。
2 结果与分析
2.1 HrNHX6 基因序列分析
2.1.1 HrNHX6 基因的核苷酸序列分析 HrN ̄HX6 基因序列长度为1 347 bp,含343 个A、288个G、470 个T、246 个C,A+T 的含量(60.36%)高于G+C 的含量(39.64%)。
2.1.2 HrNHX6 蛋白的氨基酸序列分析 HrN ̄HX6 基因编码448 个氨基酸,其中,酸性氨基酸(D、E)36 个,碱性氨基酸(K、R)22 个,极性氨基酸(N、C、Q、S、T、Y)119 个,疏水性氨基酸(A、I、L、F、W、V)190 个,分别占氨基酸总量的8.0%、5.0%、26.6%、42.4%。 在该蛋白中Leu (L)和Ser(S)含量较高,所占比例分别为12.3%和9.8%。
2.1.3 HrNHX6 基因的核苷酸和氨基酸序列同源性分析 将HrNHX6 与10 种植物NHX6 基因的核苷酸和氨基酸序列进行同源比对分析,结果(图1、图2)表明,HrNHX6 与其他植物NHX6 基因核苷酸序列的同源性为82.9%~85.7%,氨基酸序列的同源性则达到84.9%~89.7%,其中中国沙棘与月季花的序列同源性最高。
2.1.4 HrNHX6 基因保守基序分析 通过MEME软件对HrNHX6 的保守基序进行分析,共得到15个保守结构域,每个结构域的长度为50 个保守氨基酸,具有11 个位点,且E 值都显著。 HrNHX6保守基序与橡胶树、山谷白栎、欧洲野苹果等植物NHX6 基因保守基序完全一致(图3)。
2.2 HrNHX6 蛋白结构预测
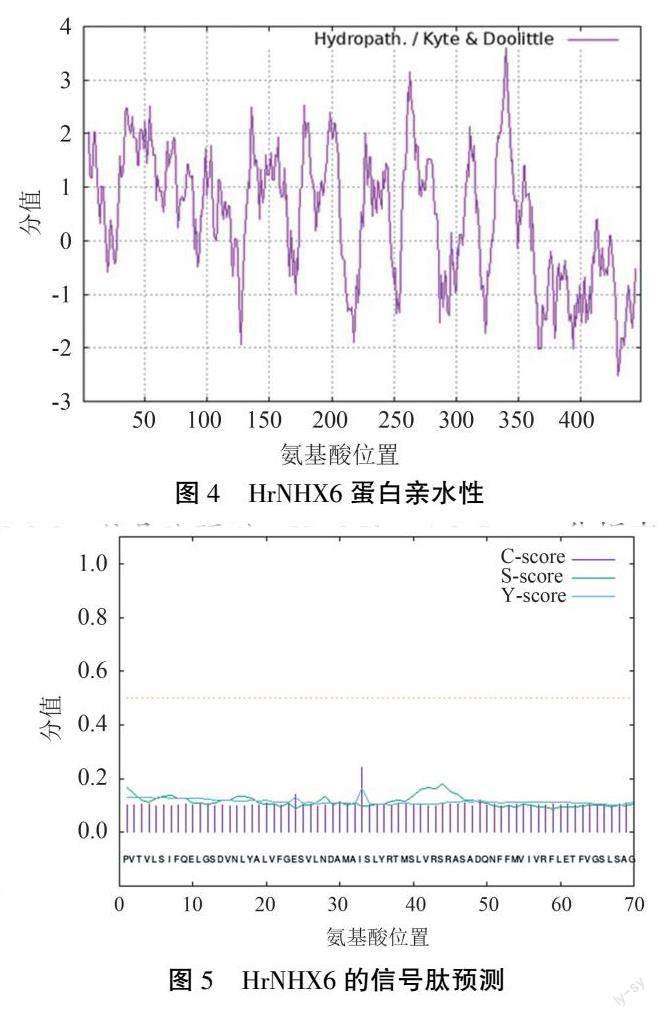
2.2.1 HrNHX6 蛋白理化性质及亚细胞定位 HrNHX6 蛋白分子式为C2260 H3436 N552 O636 S20,分子量为49 156.84 Da,理论等电点为5.475,脂肪系2.2.2 信号肽预测 NetOGlyc 4.0 Server 分析表明,切割位点C 的最大值为0.243,位于第33 位氨基酸;信号肽分数S 的最大值为0.179,位于第44位氨基酸;合并切割位点Y 的最大值为0.164,位于第33 位氨基酸(图5)。 S 的平均值为0.117,预测剪切点在1~28 位氨基酸。 S 的平均值远低于0.5,表明HrNHX6 蛋白是一种没有潜在信号肽位点的非分泌蛋白。
2.2.3 HrNHX6 蛋白结构及功能位点预测 HrN ̄HX6 蛋白二级结构中α-螺旋、无规则卷曲、延伸链、β - 折叠分别占49. 33%、33. 26%、13. 62%、3.79%,α-螺旋和无规则卷曲是其主要构成成分(图6)。 蛋白三维构象如图7 所示。 跨膜区预测结果(图8)显示,HrNHX6 含7 个跨膜螺旋结构,属于跨膜蛋白。
HrNHX6 蛋白功能位点的预测结果显示该蛋白包含多个修饰位点:2 个N-糖基化位点,即始于215 位氨基酸的NLSE 和始于375 位的NESF;2 个蛋白激酶C 磷酸化位点,分别为始于22 位的SPK 和始于220 位的SQR;5 个酪蛋白激酶Ⅱ磷酸化位点,分别为始于77 位的SATD,始于233 位的SLAE,始于317 位的SIHD,始于350 位的TM ̄LE,始于414 位的TALD;9 个N-豆寇酰基化位点,分别为始于31 位的GAIVTF,始于40 位的GTFIAS,始于73 位的GSLISA,始于92 位的GSD ̄VNL,始于145 位的GSLSAG,始于152 位的GVG ̄FTS,始于192 位的GLGLSG,始于304 位的GLR ̄GAM,始于345 位的GGSTGT。
2.3 不同浓度NaCl 胁迫下HrNHX6 基因的表达模式分析
NaCl 胁迫下,中国沙棘根、茎、叶中的HrNHX6基因均上调表达(图9)。 在中国沙棘叶中,其表达量随着NaCl 浓度的增加逐渐升高,当NaCl 浓度超过600 mmo/ L 后,表达量显著升高;在茎中,其表达量呈现先升高后降低的趋势,在400 mmol/ L NaCl 处理下最高,NaCl 浓度继续升高,其表达量略有下降且变化趋于平缓,但均显著高于0~200 mmol/ L NaCl处理;在根中,其表达量则表现为波动上升趋势,在1 000 mmol/ L NaCl 处理下达到最高,除与600mmol/ L NaCl 处理差异不显著外,显著高于其他处理。
3 讨论与结论
本研究结果表明,中国沙棘HrNHX6 基因序列全长为1 347 bp,有15 个保守结构域;HrNHX6为稳定蛋白,定位于高尔基体膜中,这与拟南芥中AtNHX6 定位于胞体如高尔基体内膜[15] 的结论一致。 高尔基体网络被认为是细胞成分运输的中心,连接到内质网、液泡和质膜[16] 。 在盐胁迫下,植物产生大量的次生代谢物并分离破坏细胞结构的盐离子,这都取决于高尔基体网络的作用。 因此推测HrNHX6 的耐盐作用机制可能依赖于高尔基体网络的功能。 HrNHX6 蛋白的疏水性较强,具有多个疏水区,且含有7 个跨膜结构域。 此外,HrNHX6 蛋白為非分泌蛋白,没有潜在的信号肽位点,这与杨平等[17] 的研究结果一致,符合植物NHX 的基本特征。
HrNHX6 蛋白二级结构的主要构成元件为α-螺旋与无规则卷曲,分别占49.33%和33.26%。α-螺旋靠链内氢键维持,两侧分别由疏水性和亲水性氨基酸组成。 疏水侧通过疏水键与磷脂双分子层相互作用将蛋白固定在膜上使得HrNHX6 蛋白具有稳定跨膜结构域,亲水侧则形成空桶状结构使得HrNHX6 蛋白可进行水分跨膜运输。 这些结构特征赋予了HrNHX6 蛋白高效转运水分的功能,与该蛋白具有7 个跨膜螺旋结构的分析结果一致。 此外,功能位点预测表明,中国沙棘HrN ̄HX6 具有2 个N-糖基化位点、2 个蛋白激酶C 磷酸化位点、5 个酪蛋白激酶Ⅱ磷酸化位点、9 个N-豆寇酰基化位点,说明HrNHX6 蛋白可通过糖基化、磷酸化、豆蔻酰化等修饰调节该蛋白的功能和构造进而完成Na+的转运。
植物NHX 在耐盐、调节pH、保持K+ 稳态以及细胞扩张、细胞囊泡的转运等方面发挥着关键作用,可增强石榴[18] 、玉米[19] 、桃[20] 等的耐盐性。盐胁迫下,苜蓿MtNHX6 基因在不同组织中的表达水平不同,且在叶片和根部的表达量较高[21] ;玉米ZmNHX6 基因在根中显著表达[19] ;而在拟南芥幼苗中几乎检测不到AtNHX6 基因的表达[22] 。 这些结果表明不同植物的NHX6 基因在盐胁迫下行使功能的主要组织部位不同。 本研究结果表明,NaCl 胁迫下HrNHX6 基因在中国沙棘根、茎、叶中均上调表达,这与在石榴[18] 和拟南芥[23] 等植物中的研究结果一致;但不同NaCl 浓度下其表达量差异较大,且同一胁迫浓度下其在不同组织中的表达也不同。 此外,中国沙棘HrN ̄HX6 基因受盐胁迫显著诱导,表明中国沙棘HrN ̄HX6 基因在盐胁迫中行使重要的生物学功能。Sandhu 等[21] 研究发现,盐胁迫下MtNHX6 基因在苜蓿根部上调表达的幅度显著高于其他组织。 本研究亦得到相似结果,这可能是由于根组织最先接触到盐胁迫的缘故。 另外,根中HrNHX6 基因表达显著上升有助于根中細胞的Na+ 外排或区隔化,以维持细胞内低Na+水平,从而减轻盐胁迫对植物地上部分的伤害,同时通过渗透调节促进根系吸水。
本研究结果可为中国沙棘HrNHX6 基因功能研究提供一定的理论参考,并为中国沙棘耐盐育种基因的挖掘奠定基础。
参 考 文 献:
[1] Zhu J K. Plant salt tolerance[J]. Trends in Plant Science,2001, 6(2): 66-71.
[2] Tattini M, Gucci R, Coradeschi M A, et al. Growth, gas ex ̄change and ion content in Olea europaea plants during salinitystress and subsequent relief[J]. Physiologia Plantarum, 1995,95(2): 203-210.
[3] Apse M P, Blumwald E. Na+ transport in plants[J]. FEBSLetters, 2007, 581(12): 2247-2254.
[4] Yamaguchi T, Fukada ̄Tanaka S, Inagaki Y, et al. Genes en ̄coding the vacuolar Na+ / H+ exchanger and flower coloration[J]. Plant and Cell Physiology, 2001, 42(5): 451-461.
[5] Apse M P, Aharon G S, Snedden W A, et al. Salt toleranceconferred by overexpression of a vacuolar Na+ / H+ antiport inArabidopsis[J]. Science, 1999, 285(5431): 1256-1258.
[6] Brett C L, Donowitz M, Rao R. Evolutionary origins of eukary ̄otic sodium/ proton exchangers[J]. American Journal of Physi ̄ology:Cell Physiology, 2005, 288(2): C223-C239.
[7] Ayadi M, Martins V, Ben Ayed R, et al. Genome wide identi ̄fication,molecular characterization,and gene expression ana ̄lyses of grapevine NHX antiporters suggest their involvement ingrowth,ripening,seed dormancy,and stress response[J]. Bi ̄ochemical Genetics,2020,58: 102-128.
[8] Akram U,Song Y,Liang C,et al. Genome ̄wide characteriza ̄tion and expression analysis of NHX gene family under salinitystress in Gossypium barbadense and its comparison with Gossypi ̄um hirsutum[J]. Genes, 2020, 11(7): 803.
[9] Qiu Q S, Guo Y, Dietrich M A, et al. Regulation of SOS1, aplasma membrane Na+ / H+ exchanger in Arabidopsis thaliana,by SOS2 and SOS3[J]. Proceedings of the National Academyof Sciences, 2002, 99(12): 8436-8441.
[10] Quintero F J, Ohta M, Shi H, et al. Reconstitution in yeast ofthe Arabidopsis SOS signaling pathway for Na+ homeostasis[J].Proceedings of the National Academy of Sciences, 2002, 99(13): 9061-9066.
[11] Wang M, Zheng Q S, Shen Q R, et al. The critical role of po ̄tassium in plant stress response[J]. International Journal ofMolecular Sciences, 2013, 14(4): 7370-7390.
[12] Meng K, Wu Y. Footprints of divergent evolution in two Na+ /H+ type antiporter gene families (NHX and SOS1) in the ge ̄nus Populus[J]. Tree Physiology, 2018, 38(6): 813-824.
[13] 阮成江,謝庆良. 盐胁迫下沙棘的渗透调节效应[J]. 植物资源与环境学报,2002,11(2):45-47.
[14] 乔枫,耿贵工. 盐碱胁迫对沙棘种子萌发及幼苗抗氧化酶活性的影响[J]. 东北林业大学学报,2012,40(2):17-19.
[15] Bassil E, Ohto M, Esumi T, et al. The Arabidopsis intracellularNa+ / H+ antiporters NHX5 and NHX6 are endosome associatedand necessary for plant growth and development[J]. The PlantCell, 2011, 23(1): 224-239.
[16] Larkin H, Costantino S, Seaman M N J, et al. Calnuc functionin endosomal sorting of lysosomal receptors[J]. Traffic, 2016,17(4): 416-432.
[17] 杨平,蔡小宁,贲爱玲. 盐芥ThNHX1 基因的克隆及序列分析[J]. 江苏农业学报,2007,23(6):556-563.
[18] Dong J M, Liu C Y, Wang Y Y, et al. Genome ̄wide identifi ̄cation of the NHX gene family in Punica granatum L. and theirexpressional patterns under salt stress[J]. Agronomy, 2021,11(2): 264.
[19] Z?rb C, Noll A, Karl S, et al. Molecular characterization ofNa+ / H+ antiporters (ZmNHX) of maize (Zea mays L.) andtheir expression under salt stress[J]. Journal of Plant Physiolo ̄gy, 2005, 162(1): 55-66.
[20] 李淼,李桂祥,刘伟. 桃NHX 基因家族的全基因组鉴定与表达分析[J]. 山东农业科学,2021,53(12):8-16.
[21] Sandhu D, Pudussery M V, Kaundal R, et al. Molecular char ̄acterization and expression analysis of the Na+ / H+ exchangergene family in Medicago truncatula[J]. Functional & Integra ̄tive Genomics, 2018, 18: 141-153.
[22] Yokoi S, Quintero F J, Cubero B, et al. Differential expressionand function of Arabidopsis thaliana NHX Na+ / H+ antiportersin the salt stress response[J]. The Plant Journal, 2002, 30(5): 529-539.
[23] Wang L G, Wu X X, Liu Y F, et al. AtNHX5 and AtNHX6control cellular K+ and pH homeostasis in Arabidopsis: threeconserved acidic residues are essential for K+ transport[ J].PLoS ONE, 2015, 10(12): e0144716.
