连作对植烟土壤微生物群落与环境因子的影响及相关性分析
2024-04-01朱德伦贾孟朱宣全徐照丽王戈王娜邓小鹏杜宇周鹏白羽祥
朱德伦 贾孟 朱宣全 徐照丽 王戈 王 娜 邓小鹏 杜宇 周鹏 白羽祥


摘要:为探究连作对植烟土壤微生物群落和土壤环境因子的影响及其相互作用,对连作和轮作植烟土壤进行16S rRNA 高通量测序,并对土壤理化性质、酶活性、酚酸类物质等环境因子进行测定。 结果表明,连作植烟土壤中鞘氨醇单胞菌属(Sphingomonas)、水恒杆菌属(Mizugakiibacter)、橙色出芽单胞菌属(Gemmatimonas)、人参土黄菌属(Flavisolibacter)相对丰度增加,细菌生态网络复杂度降低;速效钾、有效磷含量增加,水解性氮、硝态氮含量降低,转化酶活性降低,酚酸物质积累。 Pearson 相关性分析表明,土壤速效钾、有效磷、水解性氮、硝态氮和转化酶以及酚酸等环境因子与鞘氨醇单胞菌属、水恒杆菌属、橙色出芽单胞菌属、人参土黄菌属呈显著相关。 可见,连作导致植烟土壤养分失衡,影响土壤微生物群落结构,此结论可为烤烟连作障碍研究提供理论依据。
关键词:植烟土壤;连作;微生物;环境因子;相关性分析
中图分类号:S344.4+S154.3文献标识号:A文章编号:1001-4942(2024)01-0113-06
我国烤烟连作面积占烟草总种植面积的30%~60%,连作障碍累计造成经济损失高达数十亿元[1] 。 烤烟连作障碍主要归因于植烟土壤理化性质的变化、酶活性的降低、化感物质的积累以及不同微生态环境中微生物多样性的变化[2-4] 。其中,土壤微生物群落是关键性因素,其对环境变化响应速度快,对维持土壤生态系统和可持续生产力具有重要意义[5-7] 。
近年来,随着16S rRNA 基因测序等分子生物技术的快速发展,越来越多的学者开始关注土壤环境因子与土壤微生物群落的关系。 土壤理化性质对土壤微生物群落结构具有重要影响[8] 。研究表明,氮元素作为营养物质和能量来源对微生物生长代谢至关重要,磷元素和pH 值可以直接或间接影响土壤微生物群落的空间结构[9-10] 。土壤酶作为微生物功能基因的表达产物[11] ,其活性受相关微生物影响,也是响应土壤微生物的关键微生态因素。 烟草根系分泌的酚酸类物质通过选择性抑制或促进植烟土壤微生物生长[12] ,影响微生物群落结构, 导致土壤微生物生态位改变[13] 。 前人对土壤微生物群落结构和其他微生态环境因子变化特征的研究已相对较为深入,但有关烤烟连作对土壤微生物群落结构的影响,特别是连作条件下土壤微生物群落与环境因子相作关系的研究尚为不足。 因此,本试验以烤烟轮作土壤为对照,研究连作土壤中微生物群落和环境因子的变化特征及其互作关系,以期为研究烤烟连作障碍成因提供一定的理论依据。
1 材料与方法
1.1 试验地概况及材料
试验在云南省烟草农业科学研究院农业研究基地(24°20′11″ N,102°31′38″ E)进行。 该地海拔1 680 m,年平均气温15.9 ℃,年降水量918mm,雨季(4—9 月)降水量占年降水量的79.5%,年日照时数为2 072 h。 试验土为砂质红壤。 设连作(T)和轮作(CK)2 个处理地块,两地块相邻,面积均为666.67 m2,均种植10 年,所用烤烟品种均为‘K326。 轮作处理采用烤烟-油菜-玉米(T-R-C)轮作模式,所用油菜品种为‘玉油5 号,玉米品种为‘曲辰9 号,其他农艺措施一致。 烤烟施用常规烟草专用复合肥(N ∶ P2 O5 ∶ K2 O =16 ∶6 ∶24),其种植和管理按照当地高质量烟草生产技术进行。
1.2 样品采集与处理
通过五点采样法采集土样,每个样点采集0~20cm 土层土壤样品并混合为一个生物重复,每样点3个重复。 各样品过2 mm 筛后分为三部分:一部分风干后用于土壤酶活性测定;一部分4 ℃冰箱保存,用于理化性质测定;一部分液氮速冻后-80 ℃保存,用于土壤细菌和酚酸类物质含量测定。
1.3 测定指标及方法
1.3.1 16S rRNA 基因擴增、文库构建及测序 采用CTAB 法提取土壤样本总DNA,1%琼脂糖凝胶电泳检测DNA 质量,用无菌水稀释至1 ng/ μL。以稀释后的总DNA 为模板,使用带标签序列(Barcode)的特异引物和高效、高精度聚合酶进行反应。 引物对应区域为16SV41881 区,引物为515F-806R。 PCR 产物经2%琼脂糖凝胶电泳检测后用热凝胶回收试剂盒(LMAl Bio)回收。 利用Illumina 公司的Miseq PE250 平台进行测序(广州基迪奥生物技术有限公司)。 将原始数据进行拼接与过滤,基于可操作分类单元(opera ̄tional taxonomic units,OTUs)进行聚类和物种分类分析,结合原始数据,得到基本分析结果。
1.3.2 土壤理化性质和酶活性测定 土壤pH 值通过电位法测定,水土比为2.5 ∶1;有机质、水解性氮、有效磷、速效钾含量分别通过重铬酸钾容量法-外加热法、半微量滴定法、0.5 mo1/ L NaHCO3 浸提-钼锑抗比色法、1 mol/ L NH4 OAC 浸提-火焰光度法测定;土壤过氧化氢酶、脲酶、转化酶活性分别通过高锰酸钾滴定法、靛酚蓝比色法、3,5-二硝基水杨酸比色法测定。
1.3.3 土壤酚酸测定 称取土壤样品100.00 g置于离心管中,加入1 mol/ L 的NaOH 100 mL,静置24 h 后振荡1 h;6 000 r/ min 离心20 min,滤液用12 mol/ L HCl 酸化至pH 值为2.5;2 h 后6 000r/ min 离心20 min 除去腐植酸,0.22 μm 纤维膜过滤上清液,滤液利用高效液相色谱(HPLC)分析,结果根据土壤干重进行转换。 使用Agilent 1200 高效液相色谱仪(安捷伦科技有限公司,美国)测定土壤酚酸化合物,色谱柱为SunFire TMC18(4.6 mm×250 mm,5 μm)(沃特斯科技有限公司,美国),流速为1 mL/ min,柱温为25 ℃,检测波长为280nm。 流动相A(甲醇)和流动相B(pH= 2.5,乙酸水溶液)的特定梯度设定如下:0 min,流动相A30%、B 70%;15 min,流动相A 50%、B 50%;16min,流动相A 70%、B 30%;30 min,流动相A、B100%。 标准样品为对羟基苯甲酸、间苯三酚、香草酸、香兰素、阿魏酸、苯甲酸和肉桂酸,进样量10 μL。 每个分析周期后设10 min 等待期,以消除干扰组分的影响,确保分析结果稳定、可重复。
1.4 數据统计与分析
利用SPSS 22.0 软件进行单因素方差分析、Pearson 相关性分析,采用Microsoft 365 作图,利用Gephi 0.9.2 计算并绘制土壤细菌网络图。
2 结果与分析
2.1 连作对植烟土壤细菌群落结构的影响
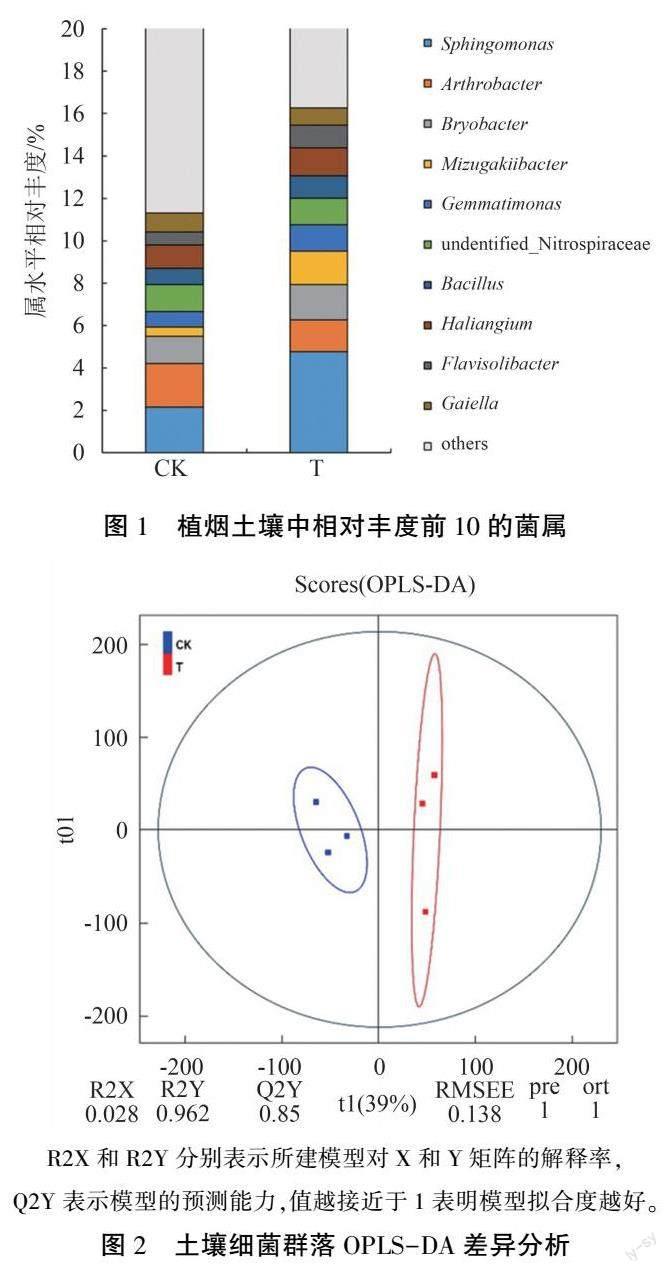
图1 显示,连作植烟土壤细菌群落组成与CK拈存在显著差异,在相对丰度前10 的属(相对丰度>0.01%)中,鞘氨醇单胞菌属(Sphingomonas)、苔藓杆菌属(Bryobacter)、水恒杆菌属(Mizugakii ̄bacter)、芽孢杆菌属(Bacillus)、橙色出芽单胞菌属(Gemmatimonas)、人参土黄菌属(Flavisolibact ̄er)相对丰度分别较CK 提高122.36%、29.43%、250.11%、36.27%、74.61%、74.81%,节杆菌属(Ar ̄throbacter)相对丰度降低26.70%。 偏最小二乘判别分析(OPLS-DA)结果(图2)显示,T 处理样本均位于第一、四象限,CK 样本均位于第二、三象限,表明两处理土壤细菌物种差异性显著;R2、Q2均大于0.8,说明模型拟合度较好。 Pearson 相关性分析( |r |>0.6,P<0.05)确定的土壤细菌共生网络图(图3)表明,两个处理网络节点数基本一致,
但相比于轮作,连作处理共生网络总连接数、平均度数、网络直径、图密度和平均路径长度较低,模块化程度较高(表1),说明连作土壤细菌共生网络拓扑结构复杂度较低。 以上结果表明,烤烟连作可改变土壤细菌群落的物种组成,简化土壤细菌间的相互作用。
2.2 连作对植烟土壤环境因子的影响
连作使植烟土壤理化性质失衡,与CK 相比,连作土壤中速效钾和有效磷含量显著提高,水解性氮和硝态氮含量显著降低(表2);土壤转化酶活性降低25.60%,差异显著(表3);土壤酚酸类物质富集,所测7 种酚酸总含量比CK 高123.58%,差异显著,其中,间苯三酚、对羟基苯甲酸、香草酸、香兰素、阿魏酸和肉桂酸含量显著提高,分别比CK 高875.51%、40.80%、35.48%、20.72%、118.75%、35.29%(表4)。
2.3 连作植烟土壤微生物与土壤环境因子间的Pearson 相关性
土壤细菌与土壤理化性质、酚酸和酶活性三类土壤微生态环境因子的Pearson相关性热图(图4) 表明,鞘氨醇单胞菌属、水恒杆菌属与间苯三酚、对羟基苯甲酸、香草酸、香兰素、阿魏酸、肉桂酸、有效磷、速效钾显著或极显著正相关,与硝态氮、转化酶活性呈显著或极显著负相关,其中水恒杆菌属与水解性氮显著负相关;节杆菌属与对羟基苯甲酸、香草酸、香兰素、肉桂酸、pH 值、脲酶、过氧化氢酶显著或极显著负相关;橙色出芽单胞菌属与间苯三酚、对羟基苯甲酸、香草酸、香兰素、阿魏酸、肉桂酸、脲酶、过氧化氢酶显著正相关;人参土黄菌属与间苯三酚、对羟基苯甲酸、香草酸、阿魏酸、肉桂酸、有效磷、速效钾显著正相关,与硝态氮显著负相关。 以上结果表明,鞘氨醇单胞菌属、节杆菌属、水恒杆菌属、橙色出芽单胞菌属、人参土黄菌属与土壤环境因子具有显著相关性关系。
3 讨论
连作可不同程度改变植烟土壤细菌群落结构,简化土壤细菌共生网络复杂度,本研究与前人研究结果一致[14-15] 。 连作土壤中除节杆菌属丰度显著下降外,鞘氨醇单胞菌属、水恒杆菌属、橙色出芽单胞菌属、人参土黄菌属丰度显著增加。其原因可能源于土壤招募、土壤微生物群落与其他土壤环境因子相互作用后会对某些优势物种提供良好的生长繁殖条件。 例如,拟南芥根分泌的三羧酸循环中间产物L-苹果酸以剂量依赖性方式选择性募集有益的枯草芽孢杆菌FB17[16] ,土壤酸化可招募潜在有益的根瘤菌以增加对枯萎病的抑制[17] 。 优势菌属可能对土壤具有重要作用,例如,鞘氨醇单胞菌属具有生物降解功能[18-22] ,还可缓解土壤重金属污染[23-25] ,关于其他三种菌属对土壤的作用机制尚不明确,有待进一步研究。
Pearson 相关性分析结果表明,鞘氨醇单胞菌属、水恒杆菌属、橙色出芽单胞菌属、人参土黄菌属与土壤环境因子呈显著相关关系。 连作植烟土壤速效钾和有效磷含量显著提升,水解性氮和硝态氮含量显著下降。 烤烟为喜钾作物,连作过程施用大量K2SO4等钾肥导致大量速效钾富集于土壤中。 另有研究表明长期连作增加土壤有效磷含量[26] ,因此,过量的磷素、钾素改变土壤细菌群落[27-28] ,与之呈正相关。 优势菌属与水解性氮、硝态氮和转化酶的负相关关系,可能是由于这些菌属具有反硝化特性[29] ,消耗作为主要氮源的水解性氮和硝态氮,土壤养分循环被打破,促使土壤转化酶活性降低[30-32] 。 此外,酚酸类物质与优势菌属呈正相关,可能是由于酚酸类物质也可用作特定微生物生长繁殖的碳源和氮源[32] ,连作植烟土壤中酚酸类物质积累刺激了某些微生物的生长繁殖使其成为优势菌属。
4 结论
烤烟连作导致植烟土壤速效钾、有效磷过量,水解性氮、硝态氮流失,间苯三酚、对羟基苯甲酸、香草酸、香兰素、阿魏酸、肉桂酸的积累和转化酶活性降低,改变细菌群落结构,降低细菌共生网络复杂度,促进鞘氨醇单胞菌属、水恒杆菌属、橙色出芽单胞菌属、人参土黄菌属相对丰度提升。
参 考 文 献:
[1] 蒋潘强. 不同连作年限对植烟土壤养分的影响[D]. 长沙:湖南农业大学,2015.
[2] Bai Y X, Wang G, Cheng Y D, et al. Soil acidification in con ̄tinuously cropped tobacco alters bacterial community structureand diversity via the accumulation of phenolic acids[J]. Scien ̄tific Reports, 2019, 9(1): 12499.
[3] Zuppinger ̄Dingley D, Schmid B, Petermann J S, et al. Selec ̄tion for niche differentiation in plant communities increasesbiodiversity effects[J]. Nature, 2014, 515(7525): 108-111.
[4] 高群,孟憲志,于洪飞. 连作障碍原因分析及防治途径研究[J]. 山东农业科学,2006(3):60-63.
[5] Schloter M, Dilly O, Munch J C. Indicators for evaluating soilquality[J]. Agriculture Ecosystems and Environment, 2003,98(1/2/3): 255-262.
[6] Avidano L, Gamalero E, Cossa G P, et al. Characterization ofsoil health in an Italian polluted site by using microorganisms asbioindicators[J]. Applied Soil Ecology, 2005, 30(1): 21-33.
[7] Wang L, Liu J, Yuan J L, et al. The study of soil bacterial di ̄versity and the influence of soil physicochemical[J]. Microor ̄ganisms, 2022, 10(10): 1913.
[8] Pan Y, Cassman N, de Hollander M, et al. Impact of long ̄term N, P, K, and NPK fertilization on the composition andpotential functions of the bacterial community in grassland soil[J]. FEMS Microbiology Ecology, 2014, 90(1): 195-205.
[9] Cederlund H, Wessén E, Enwall K, et al. Soil carbon qualityand nitrogen fertilization structure bacterial communities withpredictable responses of major bacterial phyla[J]. Applied SoilEcology, 2014, 84: 62-68.
[10] Fierer N. Embracing the unknown: disentangling the complexi ̄ties of the soil microbiome[J]. Nature Reviews Microbiology,2017, 15(10): 579-590.
[11] Sinsabaugh R L. Phenol oxidase peroxidase and organic matterdynamics of soil[J]. Soil Biology and Biochemistry, 2010, 42(3):391-404.
[12] 焦焕然,周冰谦,杨国红,等. 酚酸类化感物质介导病原真菌协同致害药用植物的研究进展[ J]. 山东农业科学,2021,53(9):141-147.
[13] Qu X H, Wang J G. Effect of amendments with different phe ̄nolic acids on soil microbial biomass activity, and communitydiversity[J]. Applied Soil Ecology, 2008, 39(2): 172-179.
[14] Li B B, Roley S S, Duncan D S, et al. Long ̄term excess nitro ̄gen fertilizer increases sensitivity of soil microbial community toseasonal change revealed by ecological network and metage ̄nome analyses[J]. Soil Biology and Biochemistry, 2021, 160:108349.
[15] Bascompte J. Networks in ecology[J]. Basic and Applied Ecol ̄ogy, 2007, 8(6): 485-490.
[16] Bieger A, Rajakaruna N, Harrison S. Little evidence for localadaptation to soils or microclimate in the post ̄fire recruitment ofthree Californian shrubs[J]. Plant Ecology & Diversity, 2012,7(3): 411-420.
[17] Zhang S T, Liu X J, Zhou L H, et al. Alleviating soil acidifi ̄cation could increase disease suppression of bacterial wilt by re ̄cruiting potentially beneficial rhizobacteria [ J]. MicrobiologySpectrum,2022,10(2): e02333-21.
[18] Miyake O,Ochiai A,Hashimoto W,et al. Origin and diversityof alginate lyases of families PL ̄5 and  ̄7 in Sphingomonas sp.strain A1[J]. Journal of Bacteriology, 2004, 186(9): 2891-2896.
[19] Sasaki M,Akahira A, Oshiman K, et al. Purification of cyto ̄chrome P450 and ferredoxin involved in bisphenol A degrada ̄tion, from Sphingomonas sp. strain AO1[J]. Applied and En ̄vironmental Microbiology, 2005, 71(12): 8024-8030.
[20] Jouanneau Y, Micoud J, Meyer C. Purification and character ̄ization of a three ̄component salicylate 1 ̄hydroxylase fromSphingomonas sp. strain CHY ̄1[J]. Applied and Environmen ̄tal Microbiology, 2007, 73(23): 7515-7521.
[21] Shintani M, Urata M, Inoue K, et al. The Sphingomonas plas ̄mid pCAR3 is involved in complete mineralization of carbazole[J]. Journal of Bacteriology, 2007, 189(5): 2007-2020.
[22] Aly H A H, Huu N B, Wray V, et al. Two angular dioxygenas ̄es contribute to the metabolic versatility of dibenzofuran ̄degrad ̄ing Rhodococcus sp. strain HA01[J]. Applied and Environmen ̄tal Microbiology, 2008, 74(12): 3812-3822.
[23] Achal V, Savant V V, Reddy M S. Phosphate solubilization bya wild type strain and UV ̄induced mutants of Aspergillus tubin ̄gensis[J]. Soil Biology and Biochemistry, 2007, 39(2): 695-699.
[24] Khan A L, Waqas M, Kang S M, et al. Bacterial endophyteSphingomonas sp. LK11 produces gibberellins and IAA andpromotes tomato plant growth [ J]. Journal of Microbiology,2014, 52: 689-695.
[25] Asaf S, Khan A L, Khan M A, et al. Osmoprotective functionsconferred to soybean plants via inoculation with Sphingomonassp. LK11 and exogenous trehalose [ J]. Microbiological Re ̄search, 2017, 205: 135-145.
[26] 趙芸晨,王治江,孙晓娟,等. 制种玉米连作恒量施磷对灌漠土与潮土中磷素利用的影响[J]. 水土保持通报,2018,38(1):47-55.
[27] 王萌. 磷和微生物协同作用对不同根系形态水稻生长和细菌群落结构多样性的影响[D]. 北京:中国农业科学院,2021.
[28] 翁泽斌. 不同施钾水平对烟草根际微生物生态及烟草生长的影响[D]. 福州:福建农林大学,2017.
[29] Patureau D, Zumstein E, Delgenès J P, et al. Aerobic denitri ̄fiers isolated from diverse natural and managed ecosystems[J].Microbial Ecology, 2000, 39: 145-152.
[30] Fatemi F R, Fernandez I J, Simon K S, et al. Nitrogen andphosphorus regulation of soil enzyme activities in acid forestsoils[J]. Soil Biology and Biochemistry, 2016, 98: 171-179.
[31] Xu W L, Tang G M, Ge C H, et al. Effects of long ̄term fertili ̄zation on diversities of soil microbial mommunity structure andfunction in grey desert soil of Xinjiang[J]. Acta Ecologica Sini ̄ca, 2015, 35(2): 468-477.
[32] Kefeli V I, Kalevitch M V. Phenolic inhibitors and abscisicacid during dormancy[M]∥Borsari B. Natural Growth Inhibi ̄tors and Phytohormones in Plants and Environment. Dordrecht:Springer, 2003: 81-104.
