小麦类病斑突变体lmpa1 的早衰特性研究
2024-04-01夏丹阳徐超文晓阳康国章王黎明
夏丹阳 徐超 文晓阳 康国章 王黎明

摘要:本研究以小麦品系KD527 及其经EMS 诱变创制出的类病斑型早衰突变体lmpa1 和两者的杂交F1、F2 群体为材料,分析其类病斑发生动态、农艺及产量性状,并进行相关光合指标测定与组织化学染色鉴定,以期分析lmpa1 发生类病斑早衰的生理生化机制。 结果表明,KD527 能正常完成生长成熟过程,而lmpa1在生长前期表现正常,挑旗后叶片受光诱导而发生类病斑反应,出现黄褐色类病斑,且随生育期延长,类病斑逐渐蔓延至叶鞘、茎秆和穗部,引发整株早衰直至干枯死亡,導致其产量降低;类病斑发生期间,lmpa1 叶片净光合速率、气孔导度和蒸腾速率显著低于KD527(P<0.01),胞间CO2 浓度显著高于KD527(P<0.01);总叶绿素量含量明显低于KD527,且二者之间的差异随类病斑发生程度的增加而增大;类病斑发生初期,lmpa1 的叶片过氧化氢(H2O2)含量及过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、过氧化物酶(POD)活性均较KD527高,随着类病斑扩散,其CAT、SOD、POD 活性急剧下降,H2O2 含量急剧增加;组织化学染色分析表明类病斑发生部位出现细胞死亡。 本结论为类病斑早衰基因Lmpa1 调控小麦早衰发生的生理生化机制研究奠定了理论基础。
关键词:小麦;类病斑型早衰;突变体lmpa1;生理生化;光诱导
中图分类号:S512.01文献标识号:A文章编号:1001-4942(2024)01-0058-08
衰老是作物器官发育的最后一个进程,这个时期叶片中积累的碳水化合物和矿物质向植物其他生长相对旺盛的部位分解运输。 植物衰老受内部基因调控和外部环境因素等的影响,在发育生物学上具有非常重要的意义[1] 。 早衰是指作物的生理生化过程提早结束,导致作物有效生长发育时间缩短,是造成作物产量和品质下降的重要原因[2-4] 。 对小麦而言,衰老过程伴随其灌浆期,小麦籽粒产量的70%来自于开花后光合器官所生产的干物质,过早衰老会限制其灌浆质量,影响小麦产量,是制约小麦高产稳产的重要因素[4] 。目前关于植物早衰的假说有基因调控假说、激素失衡假说、自由基损失学说和糖诱导假说等[5-6] ,但对于植物早衰机制的研究仍不够全面和深入。因此,发掘小麦早衰突变体并对其开展生物学特性研究,对于深入了解小麦早衰的发生机制和选育高产、稳产新品种具有非常重要的意义。
植物类病斑突变体能够在无病原体侵染的情况下自发产生类似病变的坏死性斑点,且病斑会逐步扩散至叶鞘、茎秆甚至整株,影响籽粒灌浆质量,最终影响产量和品质[7-8] 。 目前在拟南芥[9] 、水稻[10] 、谷子[11] 、小麦[12] 等作物中均有报道,其中水稻相关方面的研究最为深入。 小麦类病斑突变体的研究起步较晚,目前,主要涉及类病斑突变体的基因定位和遗传调控等方面,尚未有基因克隆的相关报道。 Li 等[13] 将源于自然突变体Ning7840 的类病斑基因lm 定位到2BL 染色体上;2016 年,Wang 等[14] 将自然突变体lm3 的类病斑基因定位在3BL 染色体上,杨佳秀等[15] 将类病斑突变基因Lm3 定位在3BL 染色体上;随后,lm4[16] 、Lm5[17] 也通过BSR-seq 等方法被精细定位;Zhang 等[18] 将来自亲本N07216 的类病斑显性基因TaSpl1 定位于3DS 染色体上,并发现该基因同时受TaSpl1-i1 和TaSpl1-i2 显性基因抑制。类病斑早衰突变体是一类特殊的类病斑突变体,在自发形成坏死性病斑的同时又伴有植株早衰现象,而在众多类病斑突变体中发生早衰现象的仅占极少数[19] 。 Kong 等[20] 在小麦突变体库中鉴定了首个类病斑型早衰突变体lmpa1,并将其早衰基因初步定位在5AL 染色体上。 但关于该突变体引起小麦早衰发生的相关生理生化机制尚未见报道,为此本研究对该突变体的衰老发生及不同衰老程度的生物学特性进行观察和分析,以期解析小麦类病斑型早衰的生理生化机制。
1 材料与方法
1.1 试验材料与概况
本试验以小麦新品系KD527、类病斑早衰突变体lmpa1(从KD527 的EMS 突变体库中筛选获得的稳定遗传的早衰突变体)及二者的杂交F1、F2 群体为材料。 所有供试材料均由河南科技大学小麦种质创新组提供,于2021 年10 月29 日种植于河南科技大学开元校区农场试验田。 行长1.2 m,行宽0.25 m,株距10 cm。 水肥管理同大田其他材料。
1.2 试验设计
2022 年4 月6 日,在类病斑发生初期,随机选取突变体lmpa1 植株上尚未出现斑点的旗叶,用锡箔纸包住叶片的一部分(约3 cm)进行黑暗遮光处理;待叶片其他部位均出现类病斑后,取下锡箔纸恢复光照,观察记录叶片遮光处理及恢复光照后该部位的类病斑发生情况。 重复3 次。
1.3 测定项目及方法
1.3.1 农艺及产量性状测定 灌浆后期,分别随机选取突变体lmpa1、KD527 及其杂交F1、F2 分离群体各20 株,调查株高、穗粒数、千粒重、穗长、单株产量、旗叶长等性状。
1.3.2 叶绿素含量测定 在lmpa1 类病斑发生前1 d 及发病5、10、15、20、25 d 共6 个时期,分别随机选取3 株lmpa1、KD527 的旗叶采样,剪碎研磨后称取0.1 g,丙酮浸泡后暗处理24 h,使用分光光度法测定叶绿素含量(SPAD)[21] 。
1.3.3 光合参数测定 在lmpa1 发病15 d 时,随机选取长势一致的KD527 与lmpa1 单株,用便携式光合仪LI-6400XT 测定旗叶净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间CO2 浓度(Ci)。
1.3.4 H2O2 含量及相关酶活性测定 分别剪取lmpa1 发病1、6、12、18、24 d 的旗叶,以KD527 为对照,参考Yin 等[24] 的方法,分别进行H2O2 含量和过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、过氧化物酶(POD)活性测定。 相关试剂盒采用北京索莱宝科技有限公司产品,所有操作均按试剂盒说明书进行。
1.3.5 组织化学染色 取lmpa1 发病15 d 和同时期KD527 的旗叶,参考Mahalingam 等[22] 的方法使用二氨基联苯胺(DAB)染色法检测叶片中过氧化氢(H2O2)积累量。 试剂盒来自北京索莱宝科技有限公司,观察叶片是否出现红褐色斑点并拍照记录。 参照Kong 等[23] 的方法,使用伊文思蓝(Evans blue, EB)染色法观察叶片上细胞死亡情况并拍照记录。
1.4 数据处理与分析
试验数据用SPSS 25.0 软件进行处理、统计分析和显著性检验。
2 结果与分析
2.1 lmpa1 类病斑早衰发生动态观察
对KD527 和突变体lmpa1 进行全生育期生长发育动态观察发现,KD527 全生育期未出现早衰现象。 由图1 可以看出,突变体lmpa1 在苗期表现正常;挑旗后整株叶片开始随机出现黄褐色类病斑,随着生育期延长,斑点扩大、数量增多,但是斑点在叶片上出现的位置、大小及强度是随机的;抽穗后类病斑迅速蔓延到所有叶片,甚至叶鞘、茎秆、穗部的颖壳及麦芒,直至灌浆中后期,突变体lmpa1 整株严重干枯至死亡。 表明突变体在挑旗前后开始出现早衰现象,灌浆中后期完全枯死。
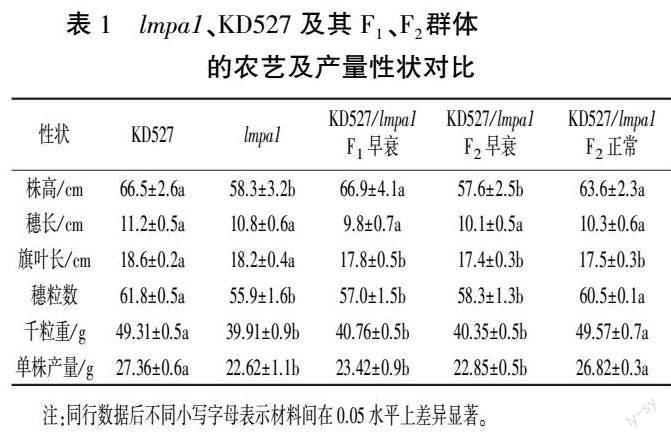
2.2 KD527、lmpa1 及其F1、F2 群体的农艺及产量性状分析
从表1 中看出,lmpa1 与KD527 的穗长、旗叶长无显著差异;KD527 的穗粒数、千粒重、单株产量分别为61.8 粒和49.31、27.36 g,lmpa1 的分别为55.9 粒和39.91、22.62 g,三者较KD527 分别显著下降9.5%、19.1%、17.3%。 表明,lmpa1 类病斑发生导致lmpa1 植株在灌浆末期干枯死亡,生育期缩短,直接影响其籽粒发育和灌浆质量。
在对KD527、lmpa1 进行农艺学鉴定基础上,对其杂交F1、F2 群体的农艺性状进行鉴定(表1)。 发现F1 群体单株全部出现类病斑而发生早衰,千粒重、单株产量较KD527 分别显著降低17.3%、14.4%;F2 分离群体中,有早衰和正常两种表型,其中早衰植株的穗长、旗叶长与正常植株相比无显著差异,穗长与KD527 相比也无显著差异,但其余性状显著降低,其中千粒重、单株产量分别为40.35、22.85 g,较正常植株和KD527 分别显著下降18.6%、14.8%和18.2%、16.5%。 说明突变体lmpa1 的早衰特性在后代群体中具有很强的遗传效应。
2.3 lmpa1 对光照的响应
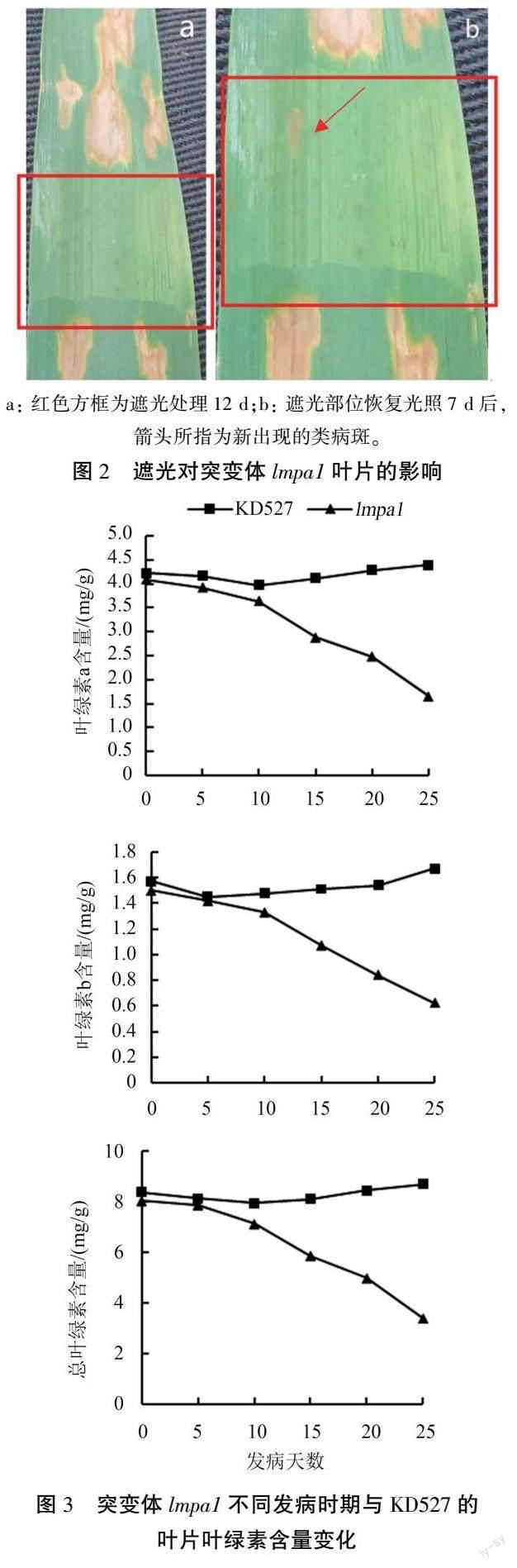
于孕穗期对lmpa1 尚未发生类病斑的叶片进行12 d 的锡箔纸遮光处理,取下锡箔纸后发现遮光部位没有类病斑出现(图2a),而自然光照下的叶片其他部位逐渐出现褐色斑点;遮光结束取下锡箔纸恢复光照7 d 后,原遮光部位也出現了斑点(图2b)。 这表明突变体lmpa1 类病斑的产生可能与光诱导有关。
2.4 lmpa1 叶片叶绿素含量分析
对lmpa1、KD527 挑旗后的旗叶进行叶绿素含量测定,结果(图3)表明,在类病斑发生前lmpa1叶片中叶绿素a、b及总叶绿素含量与KD527均无明显差异;类病斑发生后,随着类病斑扩散程度的加剧,突变体叶片中叶绿素含量下降明显,类病斑发生10 d 后突变体叶片中叶绿素含量比KD527 明显增加。 表明类病斑的发生导致突变体lmpa1 叶片逐渐失绿,光合色素含量呈下降趋势。
2.5 lmpa1 叶片光合参数分析
由表2 可知,KD527 叶片的Pn、Gs、Tr 均显著高于突变体lmpa1(P<0.01),Ci 显著低于lmpa1(P<0.01)。 说明lmpa1 的光合能力显著低于KD527。 类病斑早衰突变体的植株衰老提前,扰乱了光合生理过程,影响植株光合能力,进而影响其产量。
2.6 lmpa1 叶片衰老相关参数分析
lmpa1 类病斑发生后,对lmpa1、KD527 叶片抗氧化酶CAT、SOD、POD 活性和H2O2 含量的测定结果(图4)发现:类病斑刚出现时(1 d),lmpa1叶片酶活性和H2O2 含量与KD527 无明显差异;类病斑发生6~12 d 内,lmpa1 叶片H2O2 含量和CAT、SOD、POD 活性均高于KD527,表明发病初期,lmpa1 叶片活性氧含量增加的同时,体内清除自由基的能力增强;随着病程延长与类病斑扩散程度加深,lmpa1 叶片CAT、SOD、POD 活性均明显低于KD527,至发病24 d 时,分别较KD527 降低34.49%、35.71%、49.59%,而叶片H2O2 含量则逐渐升高,且明显高于KD527,至发病24 d 时较KD527 高68.62%。 说明突变体lmpa1 叶片活性氧清除系统严重受损,清除自由基的能力下降。H2O2 的过度积累可能导致细胞死亡。
2.7 lmpa1 叶片组织化学染色鉴定
对lmpa1 发病15 d 的叶片与同时期KD527相同部位的叶片分别进行DAB、EB 染色鉴定,结果(图5)表明,KD527 叶片未染上颜色;lmpa1 叶片的类病斑发生部位染色较深,表明叶片类病斑发生部位周围积累了大量的H2O2,而活性氧大量积累是细胞死亡的一个重要标志,这就说明lm ̄pa1 叶片已经发生了小面积的细胞坏死。
3 讨论
本研究结果表明,类病斑突变体lmpa1 的病斑在挑旗期出现,并随着生育期延长逐渐变大,甚至遍布整株,与他人关于突变体发病时期、部位及斑点颜色的报道存在不同。 如突变体lmpa1 与LF2010 的病斑都为黄褐色,但LF2010 的病斑发生在三叶期,且为普通斑点不存在坏死症状[25] ;类病斑基因lm4[16] 所控制的突变体与HLP[26] 的病斑发生时间一致,但HLP 与I30[27] 、wsl[28] 的病斑都为白色,与突变体lmpa1 病斑的颜色不同;Ning7840[13] 的病斑颜色、发病时期与lmpa1 相近,但其发病范围只在叶片,且病斑产生为氮依赖型。 这表明lmpa1 是与已报道的类病斑突变体不同的新型类病斑型早衰突变体材料。 水稻上突变体spl28[29] 、OsLMS[30] 等都出现叶片早衰现象,但在lmpa1 之前小麦上尚未报道过导致早衰的类病斑突变体。
突变体lmpa1 与其野生型KD527 相比,株高、穗粒数、千粒重和单株产量均显著降低,但穗长、旗叶长无显著差异,原因可能是lmpa1 的类病斑突变发生较晚,且前期主要发生在下部叶,当斑点蔓延到上部叶及茎秆时植株的农艺性状已基本发育完成,但灌浆期植株开始干枯,光合作用及籽粒灌浆受阻,表现为籽粒干瘪,籽粒品质和产量受影响显著。 Kong 等[20] 的研究中将控制lmpa1 早衰的Lmpa1 基因定位到小麦的5AL 染色体上,这为探究小麦衰老过程及及其光合代谢等生理生化特性提供了良好的种质基础,也为小麦早衰引起产量与品质降低等方面的研究提供了参考。
研究发现,强光条件下,植物叶片表面气孔关闭,发生光呼吸,叶绿体中CO2 含量减少,O2 含量增加,叶绿体的氧化活性增强,导致叶绿体中产生大量活性氧,引起生物膜脂过氧化,从而加速植物衰老[31-33] 。 这表明光照在调节光呼吸和氧化还原的稳态中起着重要作用。 有研究表明,类病斑突变体lm5[17] 、lmm4[34] 、spl34[35] 等的病斑产生受光诱导。 本研究中lmpa1 类病斑的形成也与光诱导有关,且类病斑周围出现过氧化氢积累和细胞死亡,这与前人研究[36-38] 的结果一致。 表明正常光照引发了lmpa1 植株内的氧化还原稳态失衡,过氧化氢大量积累导致细胞死亡,从而形成坏死性斑点。
对lmpa1 不同发病时期的生理生化指标的测定结果表明,在发病初期,突变体lmpa1 中活性氧清除机制未受到损伤,虽然体内活性氧含量增加,但CAT、POD、SOD 活性也均提高;随着类病斑扩散及早衰进程推进,活性氧含量逐渐增加,而抗氧化酶活性大幅降低,可能是活性氧积累量超出防御机制的调控范围,活性氧清除系统遭到破坏,过量的H2O2 积累使膜脂过氧化,细胞膜被破坏,导致细胞死亡。 此外由于类病斑的面积不断扩散,突变体lmpa1 因叶肉细胞减少而表现为绿色程度降低,光合色素含量降低,光合面积不断减少,光合性能全面下降,导致籽粒干瘪、产量降低、品质变劣。 本研究对lmpa1 早衰特性的生物学研究,可为类病斑早衰基因Lmpa1 调控类病斑早衰发生的生理生化机制解析奠定基础。
另外,在本研究的基础上,我们也在尝试利用RNA-Seq 与KASP 等技术筛选与类病斑早衰基因Lmpa1 紧密连锁的SNP 标记,完成其精细定位,筛选并克隆早衰相关的可能候选基因,验证其功能,并利用RNA-Seq 技术进行不同时期的转录组测序分析,以期揭示Lmpa1 调控小麦早衰的分子机制。
4 结论
突变体lmpa1 是一个具有类病斑表型并致使小麦衰老嚴重提前、籽粒产量和品质降低的特殊突变体。 本研究结果表明,突变体lmpa1 类病斑发生受光照诱导,在挑旗期自发产生黄褐色斑点,随生育进程推进斑点扩散至整株,导致光合色素减少,光合效率降低,同化能力减弱,严重影响籽粒灌浆;同时,植株体内清除活性氧的保护机制被破坏,H2O2 大量积累,死细胞增多,最终造成植株干枯早衰,产量显著降低。 本研究结果可为突变基因Lmpa1 的基因功能及分子调控机制研究奠定一定的理论基础。
参 考 文 献:
[1] 王鹏杰,吴殿星,舒小丽. 水稻衰老相关突变体的研究进展[J]. 核农学报,2018,32(3): 87-95.
[2] 吕国锋,范金平,刘业宇,等. 小麦品种(系)延绿性的遗传变异及其特征[J]. 麦类作物学报,2018,38(9): 1079-1092.
[3] 李亚婷,朱荣,李昱,等. 小麦早衰研究综述[J]. 农业科学研究,2015,36(3): 57-62.
[4] Zhang Y, Wang H L, Li Z H, et al. Genetic network betweenleaf senescence and plant immunity: crucial regulatory nodesand new insights[J]. Plants (Basel),2020,9(4): 495.
[5] Das S, Krishnan P, Nayak M, et al. High temperature stresseffects on pollens of rice (Oryza sativa L.) genotypes[J]. En ̄vironmental and Experimental Botany,2014,101: 36-46.
[6] 何丹,姜鸿瑞,叶亚峰,等. 水稻早衰快腐突变体ad1 衰老特性的研究[J]. 核农学报,2021,35(4): 769-779.
[7] 李可,禹晴,徐云姬,等. 水稻叶片早衰突变体的农艺与生理性状研究进展[J]. 中国水稻科学,2020,34(2): 104-114.
[8] Yang Y, Lin Q J, Chen X Y, et al. Characterization and pro ̄teomic analysis of novel rice lesion mimic mutant with enhanceddisease resistance[J]. Rice Science,2021,28(5): 466-478.
[9] 吴文娟,黄继荣. 拟南芥斑叶突变体及其斑叶形成机制研究进展[J]. 植物生理学报,2016,52(11): 1671-1680.
[10] 黄福灯,赵超越,吴鑫,等. 水稻黄叶早衰突变体osyes1 的生理特性和基因定位[J]. 中国水稻科学,2020,34(4): 307-315.
[11] 李伟,智慧,王永芳,等. 谷子类病斑突变体09- 1115 的发现及遗传分析[J]. 河北农业科学,2010,14(11): 89-91.
[12] Yao Q, Zhou R H, Fu T H, et al. Characterization and map ̄ping of complementary lesion ̄mimic genes lm1 and lm2 in com ̄mon wheat[J]. Theoretical and Applied Genetics,2009,119(6): 1005-1012.
[13] Li T, Bai G H. Lesion mimic associates with adult plant resist ̄ance to leaf rust infection in wheat[J]. Theoretical and AppliedGenetics,2009,119(1): 13-21.
[14] Wang F, Wu W Y, Wang D Z, et al. Characterization and ge ̄netic analysis of a novel light ̄dependent lesion mimic mutant,lm3, showing adult ̄plant resistance to powdery mildew in com ̄mon wheat[J]. PLoS ONE,2016,11(5): e0155358.
[15] 杨佳秀,耿皆飞,李倩倩,等. 小麦类病斑突变基因lm3 的定位[J]. 麦类作物学报,2016,36(12): 1578-1586.
[16] Liu R, Lu J, Zheng S G, et al. Molecular mapping of a novellesion mimic gene (lm4) associated with enhanced resistanceto stripe rust in bread wheat[J]. BMC Genom. Data,2021,22(1): 1-9.
[17] Li C, Liu H, Wang J, et al. Characterization and fine mappingof a lesion mimic mutant (Lm5) with enhanced stripe rust andpowdery mildew resistance in bread wheat (Triticum aestivumL.)[J]. Theor. Appl. Genet.,2022,135(2): 421-438.
[18] Zhang H, Xu X M, Wang M M, et al. A dominant spotted leafgene TaSpl1 activates endocytosis and defense ̄related genescausing cell death in the absence of dominant inhibitors[J].Plant Science,2021,310: 110982.
[19] 夏赛赛,崔玉,李凤菲,等. 水稻类病斑早衰突变体lmps1 的表型鉴定与基因定位[J]. 作物学报,2019,45(1): 46-54.
[20] Kong W W, Wang L M, Cao P, et al. Identification and genet ̄ic analysis of EMS ̄mutagenized wheat mutants conferring le ̄sion ̄mimic premature aging[J]. BMC Genetics,2020,21(1):1-11.
[21] 胡秉芬,黄华梨,季元祖,等. 分光光度法测定叶绿素含量的提取液的适宜浓度[J]. 草业科学,2018,35(8): 1965-1974.
[22] Mahalingam R, Jambunathan N, Gunjan S K, et al. Analysisof oxidative signalling induced by ozone in Arabidopsis thaliana[J]. Plant, Cell & Environment,2006,29(7): 1357-1371.
[23] Kong X P, Li D Q. Hydrogen peroxide is not involved in HrpNfrom Erwiniaamylovora ̄induced hypersensitive cell death inmaize leaves[J]. Plant Cell Reports,2011,30(7): 1273 -1279.
[24] Yin Y J, Chen C J, Guo S W, et al. The fight against Panaxnotoginseng root ̄rot disease using Zingiberaceae essential oils aspotential weapons [ J]. Frontiers in Plant Science,2018,9:1346.
[25] 杜麗芬,李明飞,刘录祥,等. 一个化学诱变的小麦斑点叶突变体的生理和遗传分析[J]. 作物学报,2014,40(6):1020-1026.
[26] Kamlofski C A, Acevedo A. The HLP mutation confers en ̄hanced resistance to leafrust in different wheat genetic back ̄grounds—Lesion ̄mimic mutation confers resistance in wheat[J]. Agricultural Sciences,2010,1(2): 56-61.
[27] 李倩倩,赵秋实,蒋宏宝,等. 小麦白斑突变体I30 的特征特性及遗传分析[J]. 麦类作物学报,2017,37(7): 871-879.
[28] Li H J, Jiao Z X, Ni Y J, et al. Heredity and gene mapping ofa novel white stripe leaf mutant in wheat[J]. Journal of Integra ̄tive Agriculture,2021,20(7): 1743-1752.
[29] Qiao Y L, Jiang W Z, Lee J H, et al. SPL28 encodes a clath ̄rin ̄associated adaptor protein complex 1, medium subunit μ1(AP1M1) and is responsible for spotted leaf and early senes ̄cence in rice (Oryza sativa)[J]. New Phytologist,2010,185(1): 258-274.
[30] Undan J R, Tamiru M, Abe A, et al. Mutation in OsLMS, agene encoding a protein with two double ̄stranded RNA bindingmotifs, causes lesion mimic phenotype and early senescence inrice (Oryza sativa L.)[J]. Genes Genet. Syst.,2012,87(3):169-179.
[31] Su Y, Hu S K, Zhang B, et al. Characterization and fine map ̄ping of a new early leaf senescence mutant es3(t) in rice[J].Plant Growth Regulation,2017,81(3): 419-431.
[32] Busch F A. Photorespiration in the context of Rubisco biochem ̄istry, CO2 diffusion and metabolism[J]. Plant Journal,2020,101(4): 919-939.
[33] 霍可以,羅充,高洁静,等. 外源激素对干旱胁迫下欧洲缬草种子萌发及幼苗生长的影响[J]. 山东农业科学,2023,55(4): 65-72.
[34] 邱结华,马宁,蒋汉伟,等. 水稻类病斑突变体lmm4 2病的鉴定及其基因定位
