应用STR 荧光标记分析烟台地区草莓种质资源遗传多样性
2024-04-01李恺睿史庆瑶樊铭玺谭浩然陈晓峰
李恺睿 史庆瑶 樊铭玺 谭浩然 陈晓峰


摘要:本研究以烟台地区1 份野生草莓种质和6 份常规栽培品种为试材,选取已发表具有扩增多态性的11 对STR 荧光标记引物进行扩增,采用多重荧光毛细管电泳检测,分析了该地区草莓种质的遗传多样性,并构建了其分子身份证。 结果表明,用这11 对引物从7 份草莓种质中共检测到60 个STR 等位基因位点,平均每对引物5.45 个,扩增片段长度在90~270 bp 之间,多态信息含量平均为0.676,可用于草莓种质的多态性检测。 聚类分析显示7 份草莓种质间的遗传相似系数为0.077~0.842,在遗传相似系数为0.257时,7 份种质被分为3 个类群,W1(野生草莓)与S2(丰香种质)同源性较高。 对7 份草莓种质进行不同等位基因编码,构建了分子身份证。 本研究结果可为烟台地区草莓种质资源鉴定、保护和开发利用提供重要依据。
关键词:STR 荧光标记;草莓;遗传多样性;聚类分析;分子身份证;烟台地区
中图分类号:S663.903文献标识号:A文章编号:1001-4942(2024)01-0043-07
草莓(Fragaria × ananassa Duch.)为蔷薇科草莓属草本植物,是栽培最多的小浆果,果实酸甜可口,栽培经济效益高,广泛受到消费者和生产者的青睐[1-3] 。 栽培草莓于20 世纪初引入我国,截至2018 年底,种植面积已达17.3 万hm2,年产量超过500 万t,我国已超越美国成为世界第一草莓生产和消费大国[4] 。 我国的草莓主栽品种多为引进种,存在不适应当地栽培条件的问题,在抗病性、抗寒性方面存在明显不足,而野生草莓(Fra ̄garia vesca L.)在抗性方面具有独特优势,可用作抗性育种的亲本。 开展草莓种质资源研究具有重要意义, 可为草莓品质改良提供丰富的资源库[5-10] 。
分子标记法是一种可以在DNA 水平上直接体现种质资源多态性的分析方法,具有多态性高、不受环境因素影响的优点,已成为种质资源遗传多样性研究的重要手段[11-13] 。 早期应用于草莓的扩增片段长度多态性(amplified fragment lengthpolymorphism, AFLP)[14] 、随机扩增多态性DNA( randomly amplified polymorphic DNAs,RAPD)[15] 分子标记存在技术繁琐、重复率差的问题, 而短串联重复序列( short tandem repeat,STR),又名简单重复序列(simple sequence re ̄peat, SSR),具有扩增稳定、准确、共显性、简单便捷的特点[16-18] ,近年来在草莓种质资源研究中的应用日益增多。 黄志城等[19] 筛选出20 对多态性高的引物,基于SSR 分子标记技术构建了96 份草莓种质的DNA 指纹图谱库;陈坚等[20] 利用SSR 分子标记对福建主栽的以及引进的11 个草莓种质进行分析,发现聚类结果与种质地理来源有高度相關性;刁霞[21] 利用EST-SSR 分子标记技术对采自中国西南地区的野生黄毛草莓种质资源进行遗传多样性分析,结果表明16 个黄毛草莓群体有较为显著的遗传变异。 目前,我国对于草莓种质资源遗传多样性的研究多集中于栽培种,对野生种的研究不足。
2022 年,我们从山东省海阳市招虎山采集到一份耐寒性强的野生草莓种质,为了深入开发利用该种质,本研究利用STR 荧光标记法,分析了其与6 份烟台地区主栽草莓品种的遗传多样性,并构建了它们的分子身份证,以期为烟台地区草莓种质资源保护和开发利用提供参考。
1 材料与方法
1.1 试验材料
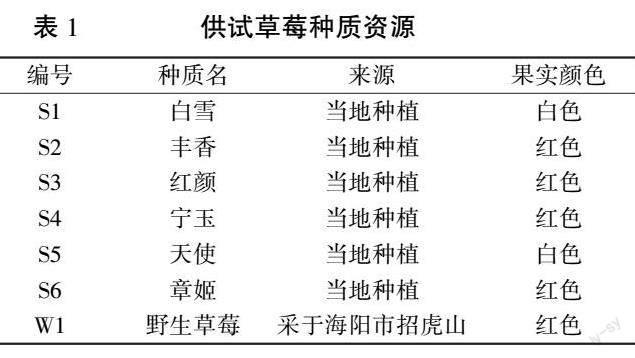
供试野生草莓种质( Fragaria vesca L.) 于2022 年采自海阳市招虎山,该野生种质匍匐茎较细,节间长,叶椭圆形、深绿色、较薄,具有较强耐寒性,果实近球形、红色、直径0.5~1.0 cm。 6 份栽培品种为烟台地区设施主栽品种。 7 份种质均定植在中国农业大学烟台研究院日光温室中,具体信息见表1。
1.2 试验方法
1.2.1 DNA 提取 采用Ezup 柱式植物基因组DNA 抽提试剂盒(EZ-10 Spin Column Plant Ge ̄nomic DNA Purification Kit,上海生工生物工程股份有限公司) 提取草莓叶片DNA。 对提取出的DNA 样本用1.2%琼脂糖凝胶电泳检测质量,用超微量分光光度计检测样本的浓度和纯度,经检测,OD260 / OD280值为1.92,在1.8~2.0 之间,符合实验要求。 将DNA 样本稀释至25 ng/ μL,置于-20 ℃冰箱保存,用于后续的扩增实验。
1.2.2 STR-PCR 反应体系的建立 从已发表文献中选出被证实具有多态性扩增结果的11 对引物(表2)进行后续实验,并使用不同荧光标记对11 对引物的正向5′端进行修饰,其中,引物ST1、ST3、ST5、ST7、ST8、ST10 使用FAM(蓝色)荧光标记,引物ST2、ST4、ST6、ST9、ST11 使用HEX(绿色)荧光标记。
STR-PCR 反应体系为25 μL,包括模板DNA1 μL,正、反向引物(10 μmol/ L)各0.5 μL,dNTP(5 μmol/ L) 0.5 μL,10 ×Taq Buffer(MgCl2 ) 2.5μL,Taq 酶(5 U/ μL)0.2 μL,ddH2 O 19.8 μL。 反应程序:95 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,10 个循环;94 ℃ 变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30 个循环;72 ℃修复延伸10 min。 电泳检测:加1.5%琼脂糖于1×TAE 溶液中,用4S Red Plus 染色,点入样品,在110 V、100 mA 条件下电泳20 min。
1.2.3 毛细管电泳检测 将分子量内标(LIZ500)和去离子甲酰胺(HIDI)按1∶99 的体积比混合,共1 000 μL;将混合液加到96 孔反应板中,每孔10 μL;将反应板迅速置于平板离心机中,1 200r/ min 离心15 s;在各孔板中加入1 μL 样品,1 200 r/ min 离心15 s;使用封板膜密封96 孔板,振荡后置于离心机中,1 200 r/ min 离心30 s,置于PCR 仪中;98 ℃变性5 min,PCR 反应程序结束后立即置于冰水混合物上急速冷却,待冷却后置于平板离心机中,1 200 r/ min 离心15 s,使用ABI3730 XL 型DNA 分析仪检测,进行电泳分析。
1.2.4 数据统计与分析 根据毛细管电泳结果,人工读取指纹图谱,并将指纹图谱转化为0、1 矩阵,运用DateFormater 将矩阵转换成相关软件可以识别的格式,利用PopGen32 软件计算观测等位基因数(Na)、有效等位基因数(Ne)、Shannons信息指数(I)、观测杂合度(Ho)、期望杂合度(He)、Neis 基因多样性指数(Neis),利用Pow ̄er Marker V3.25 软件计算多态信息含量(PIC),同时利用NTSYSpc 2.10 软件计算7 份草莓种质间的遗传相似系数,最后绘制UPGMA 聚类图。
1.2.5 分子身份证构建 参照唐玉娟等[26] 的方法,将每对引物检测出的等位基因按bp 值从小到大顺序排列,用阿拉伯数字1~9 依次赋值,超过9的从英文字母A 开始赋值,将每份种质经11 对引物检测出的等位基因按照赋值编码表赋值并串联,得到22 位特有的字符串,即为该种质的分子身份证。
2 结果与分析
2.1 STR 标记结果多态性分析
用11 对引物对7 份草莓种质进行扩增,共检测到等位基因60 个,各对引物检出等位基因数在2~10 个之间,平均每对引物5.455 个,其中,引物ST8 檢出的等位基因数最多,ST1、ST6、ST7 次之,ST2 检出的等位基因数最少(表3)。 每个引物的有效等位基因数介于2.000~8.167 之间,平均为4.255;Shannons 信息指数介于0.693 ~ 2.206 之间,平均为1.473;观测杂合度介于0.000 ~ 1.000之间,平均为0.664;期望杂合度介于0.648~0.945之间,平均为0.793;Neis 基因多样性指数介于0.500~0.878 之间,平均0.723;引物多态信息含量值介于0.375~0.866 之间,平均为0.676,证明所选引物的多态性良好,可以用于草莓种质的多态性检测。 图2 为用荧光引物ST1 扩增的毛细管电泳图谱。
2.2 草莓种质间遗传关系聚类分析
根据毛细管电泳结果读取扩增产物长度,构成7 份草莓种质的指纹图谱(表4),将其转化为0、1 矩阵,用DataFormater 将0、1 矩阵转化为NT ̄SYSpc 2.10 软件可以识别的格式,计算不同种质之间的遗传相似系数(表5),并构建遗传聚类图(图2)。
7 份草莓种质的遗传相似系数为0.077~0.842(表5)。 在遗传相似系数为0.257 时,7 份种质被分为3 个类群,Ⅰ类群包括白雪和天使2 份白草莓种质,占总数的28.6%;Ⅱ类群包括日本培育的红颜、宁玉、章姬3 份种质,占总数的42.9%;Ⅲ类群包含丰香和野生种2 份种质。 在遗传相似系数为0.441 时,Ⅱ类群又可被分为2 个亚群,Ⅱ-1亚群包括红颜、章姬2 份种质,其中章姬为红颜的育种母本,而Ⅱ-2 亚群仅宁玉1 份种质。 可见,具有相同果实颜色的种质被聚到一起,野生种质和丰香亲缘关系较近。
2.3 草莓种质分子身份证构建
将11 对引物按照扩增获得的等位基因数量从多到少排列,若有2 对及以上的引物具有相同的等位基因数量,则按照最小片段的大小进行排列,如本研究中引物ST4 和ST5 均检测出6 个等位基因,但引物ST4 的最小片段为111 bp,小于引物ST5 的最小片段163 bp,故引物ST4 排在第5位,ST5 排在第6 位。 再将各引物的等位基因按照从小到大的顺序排列,并从阿拉伯数字1 开始赋值,大于9 的部分从英文大写字母A 开始赋值,缺失条带记为0。 将每份种质读取到的等位基因片段按照表6 标准进行赋值,以种质S4 为例,其在11 个位点获得的等位基因分别为119/189、145/154、177/188、249/270、116/123、163/168、155/157、135、169、248、139,对应赋值分别为5A、14、12、47、35、14、23、44、11、22、22,得到其分子身份证为5A14124735142344112222。 依此类推,获得每份种质的分子身份证,见表7。 可见,11 对荧光引物可以完全区分开7 份草莓种质。
3 讨论与结论
物种遗传多样性的开发是改良现有种质的基础,研究技术和手段对遗传多样性评价的准确性有很大影响。 相较于表型性状研究,分子标记在基因水平上反映了不同种质的遗传差异。 STR 荧光标记检测技术结合了STR 技术和荧光检测技术的特点,解决了传统的聚丙烯酰胺凝胶电泳技术检测精度低和效率低的问题[23] ,近年来该技术在苹果[27] 、梨[28] 、欧李[29] 等植物上得到了广泛应用。 本研究选取11 对STR 引物对烟台地区1 份野生种质和6 份栽培品种进行分子标记,平均各对引物检测位点5.45 个,引物的多态性良好,该结果与李静[23] 的研究结果相符,检测位点数符合实验预期。 多态信息含量(PIC)是衡量标记多态性的指标,可用于反映基因的多样性,高度多态基因座的标准为PIC>0.5[30] 。 本研究选取的11 对荧光引物中,10 对荧光引物的PIC>0.5,即90.9%的引物为高度多态性位点。
分子身份证可以将指纹图谱转化为由数字和字母组成的字符串,并根据字符串生成可供快速识别的条形码或二维码,可以快速便捷地鉴别种质[31] 。 目前国内尚未见有关草莓分子身份证的研究,本研究根据毛细管电泳结果人工读取指纹图谱并编码赋值,构建了烟台地区7 份草莓种质的分子身份证,为草莓种质的准确鉴别提供了依据。
本研究建立了7 份草莓种质的聚类分析图,种质遗传相似系数范围为0.077~0.842,低于韩柏明等[32] 研究中草莓种质的遗传相似系数(0.62 ~1.00),说明这7 份草莓种质间的亲缘关系相对较远,这可能与所选引物数量较少且针对单一性状有关。 从聚类结果来看,具有相似性状的种质(白雪、天使)被聚到一类,引自日本的3 份种质(宁玉、红颜、章姬)被聚到一类,但具有同样亲本的种质(红颜、宁玉)遗传相似系数较小(0.471),没有归到同一亚类中。 该结果可能与栽培草莓遗传基础狭窄、栽培发展时间较短、人工选择因素有关[33] 。 野生种质虽然与丰香聚到一类,但两者遗传相似系数(0.296)较小,说明该野生种质具有独特于栽培种质的遗传特性。
烟台市是我国重要的果蔬生产基地,草莓种植面积约0.667 万公顷,占山东省草莓种植面积的1/5[34-36] 。 但目前对烟台地区草莓种质的相关研究不足,尤其对当地野生草莓种质资源的研究尚属空白。 野生种质资源中往往存在大量抗性基因,可通过远缘杂交用于培育抗性强的新品种,对草莓栽培种质改良和新品种选育有重要意义[37-40] 。 本研究首次对烟台地区1 份野生种质和6 份栽培种质进行STR 分子标记分析,构建了各种质的分子身份证,有助于当地草莓品种鉴定和拓宽草莓遗传基础[41] 。 烟台地区野生草莓具有抗性强、遗传特性独立的特点,可为培育更多优质的草莓新品种提供优良的种质资源。
参 考 文 献:
[1] 吴晓云,高照全,李志强,等. 国内外草莓生产现状与发展趋势[J]. 北京农业职业学院学报,2016,30(2):21-26.
[2] 姜莉莉,田中一久,盧小永,等. 我国草莓用农药登记现状分析[J]. 生物灾害科学,2021,44(2):159-162.
[3] 舒锐,焦健,臧传江,等. 我国草莓产业现状及发展建议[J].中国果菜,2019,39(1):51-53.
[4] 武冲,姜莉莉,宗晓娟,等. 中国草莓育种研究进展[J]. 落叶果树,2022,54(2):28-30.
[5] 陈洁,刘田田,徐雪平,等. 草莓品种资源和遗传育种研究进展[J]. 福建农业,2014(9):31-33.
[6] 侯丽媛,张春芬,聂园军,等. 草莓品种及其选育方法研究进展[J]. 山西农业科学,2017,45(12):2038-2043.
[7] 王建辉,李洪雯,刘建军. 利用野生种质进行草莓香味改良研究进展[J]. 中国农学通报,2016,32(22):189-193.
[8] 雷家军,代汉萍,谭昌华,等. 中国草莓属(Fragaria)植物的分类研究[J]. 园艺学报,2006,33(1):1-5.
[9] 赵密珍,王静,袁华招,等. 草莓育种新动态及发展趋势[J].植物遗传资源学报,2019,20(2):249-257.
[10] 董晨星. 草莓种质资源生物学鉴定及对激素的反应[D].泰安:山东农业大学,2020.
[11] 忻雅,方献平,王淑珍,等. 简单重复序列标记和序列相关扩增多态性标记在草莓遗传多样性分析中的比较[J]. 浙江大学学报(农业与生命科学版),2019,45(3):278-287.
[12] 张鹏,曾祥国,韩永超,等. 草莓新品种‘晶玉抗炭疽病相关的生理生化指标分析[J]. 中国农学通报,2015,31(34):197-202.
[13] 李志强,吴超,宫丽丹,等. 澳洲坚果优良单株的DNA 分子标记鉴定[J]. 热带农业科技,2023,46(1):7-10,14.
[14] 张运涛,冯志广,李天忠,等. 草莓品种亲缘关系的AFLP 分子标记分析[J]. 园艺学报,2006,33(6):1199-1202.
[15] 王志刚,张志宏,李贺,等. 利用RAPD 和SCAR 标记鉴定草莓品种[J]. 园艺学报,2007,34(3):591-596.
[16] Song X Y, Zhang C Z, Li Y, et al. SSR analysis of genetic di ̄versity among 192 diploid potato cultivars[ J]. HorticulturalPlant Journal, 2016, 2(3): 163-171.
[17] Ounii R, Zborowska A, Sehic J, et al. Genetic diversity andstructure of Tunisian local pear germplasm as revealed by SSRmarkers[J]. Horticultural Plant Journal, 2020, 6(2): 61-70.
[18] 吕伟,韩俊梅,任果香,等. 山西芝麻种质资源SSR 遗传多样性及群体结构分析[J]. 核农学报,2021,35(7):1495-1506.
[19] 黄志城,石敬韡,庞夫花,等. 基于SSR 标记的草莓品种DNA 指纹图谱的构建及应用[J]. 分子植物育种,2017,15(8):3097-3116.
[20] 陈坚,郑益平,郭文杰,等. 福建省草莓主栽与引进品种的SSR 分子标记鉴定[J]. 福建农业学报,2018,33(2):150-153.
[21] 刁霞. 黄毛草莓(Fragarian nilgerrensis Schldl)EST-SSR 引物开发及遗传多样性研究[D]. 昆明:云南大学,2019.
[22] 曹娴. 草莓抗灰霉病基因定位及榉树种质资源多样性的IS ̄SR 分析[D]. 上海:上海交通大学,2011.
[23] 李静. 草莓抗炭疽病遗传图谱构建和抗性相关基因的克隆与表达分析[D]. 南京:南京农业大学,2012.
[24] Honjo M, Nunome T, Kataoka S, et al. Simple sequence re ̄peat markers linked to the everbearing flowering gene in long ̄day and day ̄neutral cultivars of the octoploid cultivated straw ̄berry Fragaria×ananassa [ J]. Euphytica, 2016, 209 (2):291-303.
[25] Castro P, Bushakra J M, Stewart P, et al. Genetic mapping ofday ̄neutrality in cultivated strawberry[J]. Molecular Breeding,2015, 35(2): 79.
[26] 唐玉娟,罗世杏,黄国弟,等. 基于SSR 荧光标记的杧果种质资源遗传多样性分析及分子身份证构建[J/ OL]. 热带作物学报,2022(2022- 11- 24). https:/ / kns.cnki.net/ kcms/detail/46.1019.s.20221122.1956.004.html.
[27] 侯丽媛,董艳辉,聂园军,等. 苹果属种质TP-M13-SSR 亲缘关系及遗传多样性分析[J]. 山西农业科学,2020,48(9):1371-1378,1522.
[28] 高源,田路明,刘凤之,等. TP-M13-SSR 技术在梨遗传多样性研究中的应用[J]. 果树学报,2011,28(3):394-399.
[29] 刘国彬,姚砚武,曹均. 利用荧光SSR 标记构建欧李种质分子身份证[J]. 东北林业大学学报,2022,50(10):10-17.
[30] Botstein D, White R L, Skolnick M, et al. Construction of agenetic linkage map in man using restriction fragment lengthpolymorphisms [ J]. American Journal of Human Genetics,1980, 32(3): 314-331.
[31] 郭艳春,张力岚,陈思远,等. 黄麻应用核心种质的DNA 分子身份证构建[J]. 作物学报,2021,47(1):80-93.
[32] 韩柏明,赵密珍,王静,等. 基于SSR 标记的草莓品种亲缘关系分析[J]. 植物遗传资源学报,2013,14(3):428-433.
[33] 苗立祥,楊肖芳,张豫超,等. 基于草莓全基因组SSR 标记的开发和应用[J]. 分子植物育种,2021,19(4):1210 -1222.
[34] 张晓璐. 山东省水果产业竞争力研究[D]. 青岛:青岛农业大学,2023.
[35] 曲彦霖. 山东省水果业竞争力评价及布局优化[D]. 烟台:烟台大学,2021.
[36] 徐蕾. 山东省龙口市草莓生产主体经营现状及对策研究[D]. 大连:大连海洋大学,2023.
[37] 李辛雷,陈发棣. 菊花种质资源与遗传改良研究进展[J].植物学通报,2004(4):392-401.
[38] 雒新艳,王利红,刘英,等. 盆菊野生种质核心性状的综合评价研究[J]. 山东林业科技,2022,52(6):34-37,46.
[39] 李黎,潘慧,李文艺,等. 中国野生猕猴桃资源的溃疡病抗性种质筛选[J]. 植物科学学报,2022,40(6):801-809.
[40] 王洋,李锡香,王海平,等. 茄科蔬菜野生资源的研究与利用[J]. 植物遗传资源学报,2020,21(6):1468-1482.
[41] 刘国霞,张全芳,杨雪,等. 八倍体草莓DNA 指纹图谱的构建与初步遗传分析[J]. 中国农业大学学报,2023,28(2):35-42.
