牛乳中乳源糖巨肽及β-酪蛋白的分离纯化
2024-03-29潘学春钱成林
潘学春,黄 宇,钱成林
新希望乳业股份有限公司,四川成都 610011
0 引言
由于酪蛋白糖巨肽(CGMP)化学组成独特,不含苯环氨基酸,含有唾液酸和低聚糖,因此具有生理活性。从相关文献报道看,其活性(表达方式)主要有:①抗微生物活性;②糖巨肽中的唾液酸可抑制细菌和病毒在宿主细胞表面的附着和定植;③可与霍乱毒素和大肠杆菌毒素结合,降低其毒性;④能改善苯丙酮尿症患者的治疗效果[1~6]。由于CGMP具有生理活性,分离纯化CGMP具有一定的研究价值。
凝乳酶能特异性水解κ-酪蛋白,使牛乳中酪蛋白结构稳定性被破坏,得到酪蛋白沉淀和乳清层。κ-酪蛋白水解后得到疏水性副干酪和亲水性CGMP[7],由于CGMP的亲水性,使其存在于乳清液层中,因此可从乳清中分离CGMP。文献中报道CGMP分离方法有:沉淀法、层析法及超滤法等[8~10]。综合考虑成本、硬件投入及试验环境要求等因素,本试验采用以三氯乙酸(TCA)作为沉淀剂的沉淀法,探索不同浓度TCA对CGMP的溶解性影响,以期得到一套CGMP的分离纯化工艺。
凝乳酶处理牛乳,排出乳清后得到沉淀,其主要成分是酪蛋白,含有较高比例的β-酪蛋白。若能从中分离出β-酪蛋白,则可增加β-酪蛋白分离的新途径,同时也能提升CGMP提取副产物的利用率。结合张艳等[11]从牛乳中分离β-酪蛋白的方法,本试验探讨从凝乳酶酶解后沉淀中分离出β-酪蛋白的工艺路径。
从相关文献报道可知,CGMP的检测方法包括比色法、间苯二酚法、电泳法及高效液相色谱法;β-酪蛋白的检测方法包括高效液相色谱法和电泳法。从实验室硬件基础、技术难度等方面分析后,本试验采用高效液相色谱法来测定CGMP和β-酪蛋白含量和纯度[12~14]。
1 材料与方法
1.1 材料与试剂
新鲜牛乳。β-酪蛋白标准品(sigma),CGMP、氯化钠(GR级)、凝乳酶(35 万U/g)、三氯乙酸(色谱纯)、三氟乙酸(色谱纯)、甲酸(色谱纯)、乙腈(色谱纯)、95%乙醇(色谱纯)、丙酮(色谱纯)、β-巯基乙醇(色谱纯)、盐酸胍(色谱纯)。
1 mol/L氯化钠溶液:称取58.44 g氯化钠溶解于50 mL纯水中,纯水定容至100 mL混匀备用。
1%凝乳酶溶液:称取0.25 g凝乳酶溶解于15 mL 1 mol/L氯化钠溶液中,1 mol/L氯化钠溶液定容至25 mL,混匀备用,2~6 ℃保存。
1.2 仪器与设备
高效液相色谱仪(安捷伦1260)、LCMSMS(安捷伦6470)、恒温水浴锅、冷冻离心机、高速离心机、涡旋振荡器、0.45 µm PEFT滤膜。
1.3 方法
1.3.1 CGMP制备流程
新鲜牛乳→脱脂→加入凝乳酶→35 ℃酶解40~60 min→溶液B→加TCA溶液→离心→上清液C和沉淀D(含β-酪蛋白)。
上清液C→加TCA溶液→离心→CGMP沉淀→乙醇润洗→丙酮润洗→干燥→CGMP组分。
沉淀D→碱性复溶→降温→调节pH值(4.6)→冷冻离心→上清液→升温至30 ℃→常温离心→β-酪蛋白组分→纯水润洗→干燥→β-酪蛋白。
1.3.2 CGMP和β-酪蛋白分离
(1)TCA浓度对CGMP制备的影响
分别量取6 组相同体积、凝乳酶酶解离心后的上清液C,加入20%的TCA溶液或固体TCA,使上清液C中TCA[5]浓度分别为3%、5%、8%、10%、12%、14%,将6 组样品离心后,取上清液并用高效液相色谱法,测定溶液中CGMP含量。
(2)酶解后沉淀提取β-酪蛋白
沉淀D在pH值为11.0条件下复溶后,冷却至2~4 ℃,全程保持在5 ℃以下,调节pH值到3.5,经过4 ℃冷冻离心后,收集上清液至新的离心管中(如果是絮状物,可通过纱布或滤纸过滤)。水浴升温至35 ℃,如果室温较低(低于15 ℃),可将上清液温度升至40 ℃,常温离心得到β-酪蛋白固体,纯水润洗β-酪蛋白3 次以上,至纯水pH值为中性,60 ℃以下烘干,-18 ℃保存。
1.3.3 CGMP高效液相色谱法测定
(1)样品前处理
TCA沉淀后的CGMP溶液用0.45 µm PTFE滤膜过滤后,上机检测。
取适量待测CGMP样品,纯水溶解后,涡旋混匀,0.45 µm PTFE滤膜过滤后用于液相检测。
(2)液相色谱参数
色谱柱:300SB-CB 250★4.6 mm 5 µm;进样量:20 µL;柱温:40 ℃;检测波长:214 nm,辅助280 nm;流动相A:0.1 wt%三氟乙酸水溶液;流动相B:0.1 wt%三氟乙酸乙腈溶液;流速:1 mL/min。洗脱程序见表1。
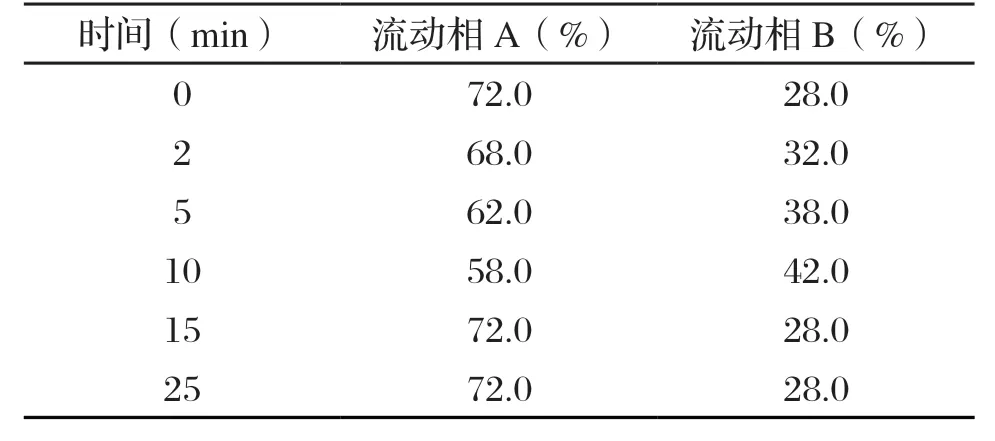
表1 CGMP 高效液相色谱法洗脱程序
1.3.4 β-酪蛋白高效液相色谱法测定
(1)样品前处理
取适量待测样品加入490 µL的6 mol/L盐酸胍静置30~60 min后,再加入490 µL的4.5 mol/L盐酸胍和10 µL的β-巯基乙醇,混匀,0.45 µm PTFE滤膜过滤后用于液相检测。
(2)液相色谱参数
色谱柱:Vydac Everest C18 column,250×4.6 mm,5 µm,300 Å;进样量:50 µL;柱温:40℃;检测波长:214 nm,辅助280 nm;流动相A:0.1 wt%三氟乙酸水溶液;流动相B:0.1 wt%三氟乙酸乙腈溶液;流速:0.7 mL/min。洗脱程序见表2。
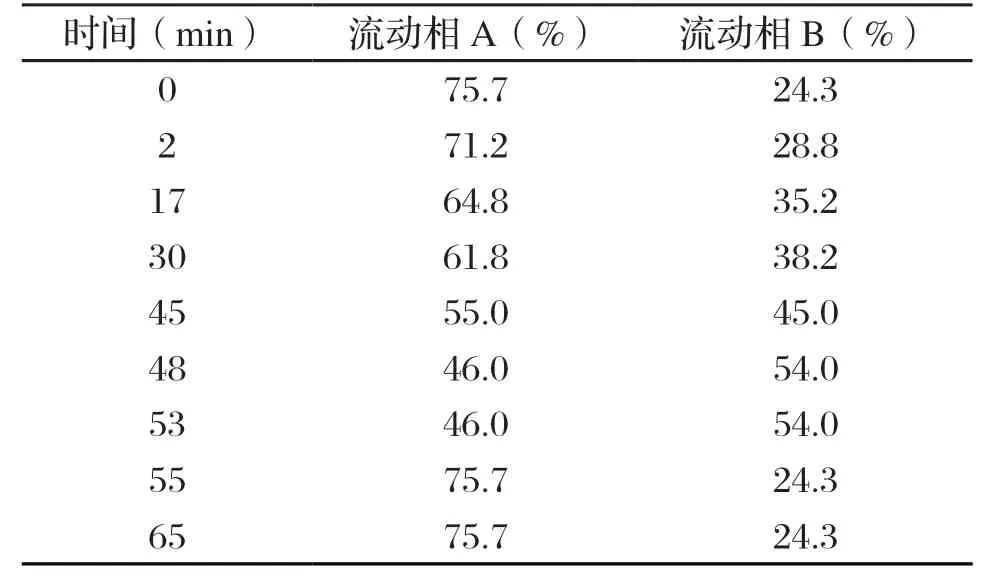
表2 β-酪蛋白高效液相色谱法洗脱程序
2 结果与讨论
2.1 不同TCA 浓度对CGMP 的影响分析
由表3可知,随着酶解液中TCA浓度逐渐升高,CGMP不断析出。当TCA浓度达到10%时,溶液中CGMP全部析出,因此选择10%作为CGMP的沉淀浓度能实现CGMP的最高回收率,同时消耗TCA最少。另外,对比不同TCA浓度处理酶解上清液检测色谱图(图1),当酶解液中TCA含量达3%时酶解液中CGMP的含量最高。
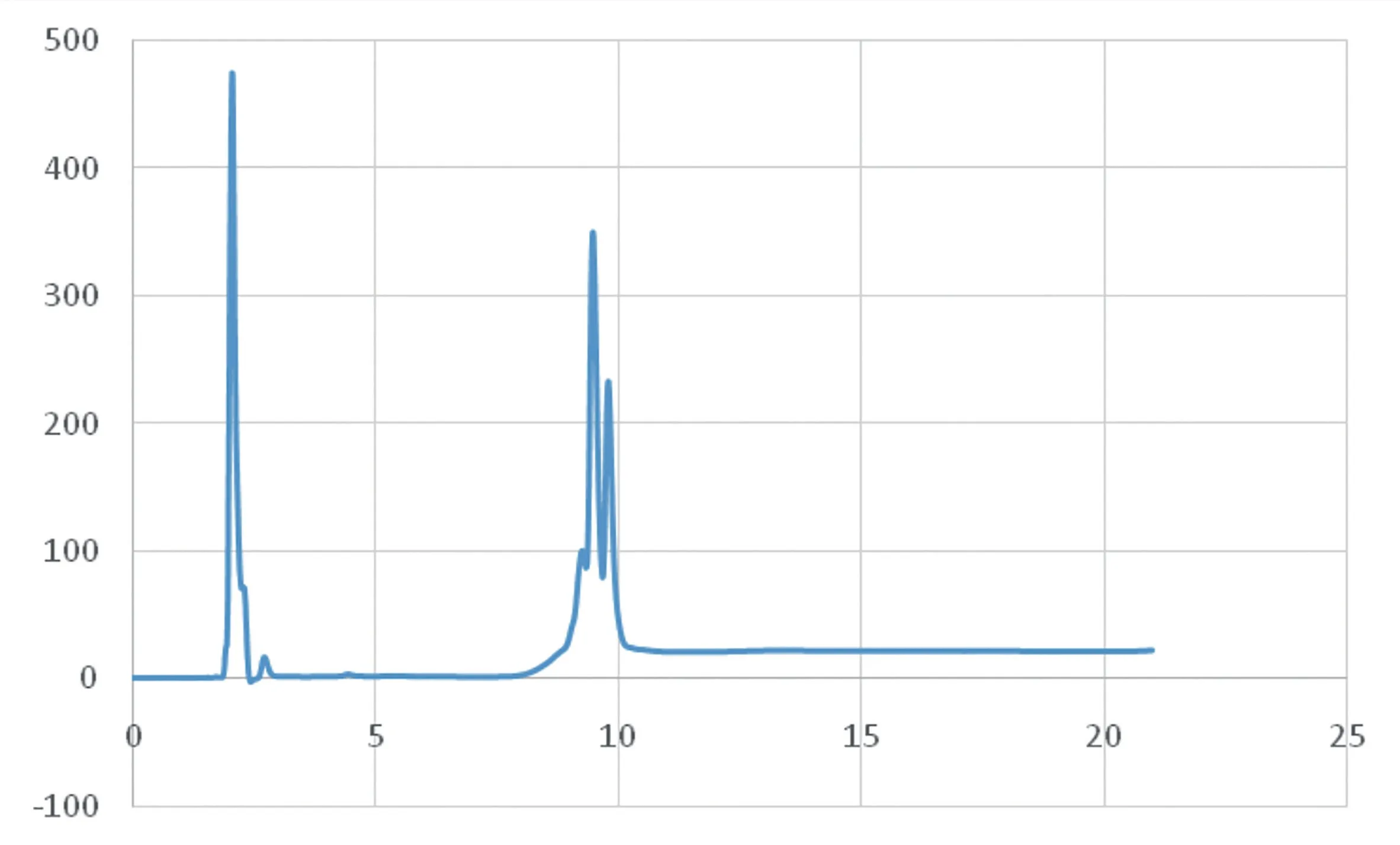
图1 CGMP 高效液相色谱图

表3 不同TCA 浓度对上清液中CGMP 含量测定汇总
综合上述结果,优化后的CGMP分离纯化工艺为:用3%的TCA沉淀酶解液中杂质,通过离心分离酶解后溶液中的杂质。继续提高上清液中TCA浓度到10%,离心收集沉淀,经过润洗后得到纯度较高CGMP固体。收集分离纯化后的CGMP固体,经高效液相色谱法检测,CGMP纯度为80%~90%。
2.2 β-酪蛋白的提取
牛奶经过凝乳酶酶解后得到沉淀D,在碱性条件下复溶后制备成蛋白液,经过低温处理、pH值调节、冷冻离心、升温及常温离心后得到最终β-酪蛋白固体,通过高效液相色谱法测定其纯度为8 5%~9 0%,高效液相色谱图见图2。

图2 β-酪蛋白高效液相色谱图
利用β-酪蛋白在低温低酸性条件下游离的特性,本文采用凝乳酶酶解后的固体产品为原料,通过碱性复溶、低温调酸、冷冻离心、升温、常温离心、水洗等操作后得到纯度较高的β-酪蛋白。对比张艳等[11]以酪蛋白为原料通过钙盐沉淀,经过多次溶解沉淀得到较高纯度的β-酪蛋白,本方法仅需要一次溶解和沉淀操作就能得到较高纯度的β-酪蛋白,操作方便,效率更高。另外对比李武祎等[15]通过尿素拆解法,不需喷雾干燥等操作。
3 结论
本文通过乳品生产中常见的凝乳酶处理后得到的液体和固体产物,利用CGMP在不同浓度TCA中的溶解度差异,对CGMP分离纯化,同时利用β-酪蛋白在低温低酸性条件下能游离的特性,实现β-酪蛋白的分离纯化。
通过增加TCA浓度实现CGMP的分离与纯化,对比试验结果显示,采用3% TCA可有效沉淀酶解后上清液中溶解的杂质(主要是牛乳中的乳清乳白类蛋白质),再经过离心后得到纯度较高的CGMP溶液,最后采用10% TCA沉淀出CGMP固体,得到的CGMP固体需通过乙醇和丙酮润洗去除沉淀中残留TCA,避免TCA对CGMP的分解。通过高效液相色谱法测定CGMP含量,考虑到无商品化的CGMP标准品,本试验通过高效液相色谱法测定目标物的峰面积进行辅助验证,通过色谱图峰面积比值来测算目标产品的色谱纯度,最终得到目标产物的色谱纯度为80%~90%。
采用酶解后的沉淀为原料直接分离得到较高纯度的β-酪蛋白,除试验方法简便高效外,扩展分离β-酪蛋白的原料选择。另外酶解后固体中除含有β-酪蛋白外,还含有αs-酪蛋白,对于固体中αs-酪蛋白的分离纯化,有待研究。
