紫花苜蓿 / 饲用玉米 / 高丹草彼此间的化感效应
2024-03-28刘旵旵师尚礼王文娟
刘旵旵,师尚礼,何 龙,王文娟,武 蓓
(甘肃农业大学草业学院 / 草业生态系统教育部重点实验室 / 中-美草地畜牧业可持续发展研究中心, 甘肃 兰州 730070)
植物化感作用,也称异株克生或相生,即一种植物通过自然挥发、茎叶淋溶、根系分泌和植株残体分解的方式向环境释放化学物质,对其他植物所产生的直接或间接的有利或不利的影响[1],这在高频次、长时间种植的农田系统中表现尤为明显[2]。
紫花苜蓿(Medicago sativa)是豆科多年生草本植物,以“牧草之王”著称,在畜牧业中起着不可代替的作用[3-4]。饲用玉米(Zea mays)是禾本科一年生草本植物,因其营养价值高、产量大等优点成为优良的粮食作物,同时也是畜牧业、养殖业等重要饲料来源[4-5]。 高丹草(Sorghum bicolor×Sorghum sudanense)是禾本科高粱和苏丹草的杂交品种,抗旱、耐瘠性强,用于青饲或青贮,也可以调制成干草[6]。三者均为饲草生产中常见且重要的高产优质饲草作物,对促进畜牧业发展,保障饲料安全具有重要意义[7-8]。目前,关于紫花苜蓿、饲用玉米化感作用研究报道较多,主要集中在紫花苜蓿、饲用玉米连作以及其化感物质的鉴定等方面,苏一诺等[9]研究发现紫花苜蓿多年生长会释放多种化感物质,极大地降低次代苜蓿种子萌发和幼苗生长。郑瑞[10]研究发现在肉桂酸、羟基苯甲酸、香豆素、苜蓿素等化感物质影响下,苜蓿发芽、生长受到了显著抑制,而通过小麦(Triticum aestivum)浸提液处理苜蓿种子,在适宜浓度下对苜蓿种子发芽具有一定的促进效果。刘贤文和郭华春[11]研究发现玉米连作会导致化感物质的积累,但经过马铃薯(Solanum tuberosum)与玉米复合种植后,可以降低化感物质在土壤中的积累,提高产量。但有关紫花苜蓿、饲用玉米与高丹草相互间可能存在的化感作用鲜见报道。本试验以紫花苜蓿、饲用玉米、高丹草为试验材料,通过模拟自然界中植物茎叶淋溶的化感作用方式,在不同浓度、不同种类植株水浸提液处理下,测定种子发芽及幼苗生长的相关指标,进行紫花苜蓿 / 饲用玉米 / 高丹草的化感效应研究,以期了解植物间的化感作用,为合理利用化感作用的促进与抑制效果,正确选择轮作、混播或间、套作植物以提高饲草产量及品质提供参考依据。
1 材料与方法
1.1 供试材料及获取方法
饲用玉米选用‘利单295’品种(审定编号:甘审玉2016006),购买于恒基利马格兰种业有限公司;高丹草选用 ‘陇草1 号’品种,由甘肃省农业科学院作物研究所提供;紫花苜蓿选用‘甘农9 号’品种,由甘肃农业大学草业生态系统教育部重点实验室提供。以上3 种作物抗病性强、产量高、抗逆性好,适宜在甘肃等活动积温2 300 ℃·d 以上地区种植。
2020 年4 月中旬将试验材料按条播、行距60 cm、株距10 cm,播种于甘肃农业大学草业生态系统教育部重点实验室兰州牧草试验基地,于饲用玉米、高丹草抽穗期前、紫花苜蓿初花期各采取以上3 种植物完整植株,将植株上的附土刷净后自然风干、粉碎、过筛(孔径0.5 mm)备用。
1.2 试验方法与测定指标
饲用玉米、高丹草、紫花苜蓿浸提液的制备参考周立业等[12]的试验方法,分别称取200 g 饲用玉米、高丹草、紫花苜蓿的全株粉碎风干样放入洁净锥形瓶中,均加入1 L 超纯水,封口,于摇床150 r·min-1、20 ℃震荡浸提24 h,定性滤纸过滤,0.45 μm 的滤膜二重过滤,获得200 mg·mL-1的浸提液母液。将母液定容获得200、150、100、50、25、12.5 mg·mL-1浓度梯度浸提液,放入4 ℃冰箱中保存。
指标测定参考李彦飞等[13]的试验方法,选取外观无破损、大小一致、饱满的种子,4%次氯酸钠浸泡10 min 后蒸馏水冲洗7 次,再用10%双氧水浸泡15 min后蒸馏水冲洗7 次,滤干备用。采用滤纸培养皿法,直径9 和13 cm 的洁净培养皿铺入双层滤纸,分别均匀放入30 粒苜蓿种子、20 粒高丹草种子和16 粒饲用玉米种子,用量筒测量出需要的浸提液后将其加入培养皿中,处理方式如表1 所列。处理重复3次,置于智能生长室内,培养条件:温度22 ℃、相对湿度80%、光周期14 h、光强20 000 lx、暗周期10 h[14]。
表1 浸提液对受体植物的试验处理Table 1 Experimental treatment of extract on receptor plants
测定指标:参照国际种子检验协会的方法[15-16],以胚根突破种皮、伸出1 mm 为发芽标准,每日进行计数,第7 天测定种子发芽率,每皿随机取10 株幼苗,称取鲜重、干重,在坐标纸上测定胚芽长和胚根长。
计算不同处理后的发芽率指标:发芽率为发芽终止时全部正常发芽的种子占全部供试种子数的百分比。
参照 Williamson 和Richardson[17]的方法,计算化感作用效应指数(response index, RI):
式中:T为测试项目的处理值;C为对照值;当RI>0 时,表示存在促进效应;当RI< 0 时,表示存在抑制效应。绝对值大小代表化感效应强度。
活力指数(vital index, VI):
发芽指数(germination index, GI):
式中:S为7 d 内幼苗长度(cm);Gt为不同时间(7 d)的发芽数;Dt为发芽日数[18]。
综合化感效应指数(synthetical effect, SE):是指同一处理浓度对同一个受体多个测试项目(发芽率、活力指数、鲜重、苗长等)的化感作用效应指数(RI)的均值。
计算后CK 即为0 刻度基准,SE在-1 至1 之间,SE< 0 表示抑制效应,SE> 0 表现促进效应,且SE绝对值大小表示化感效应作用强度,n是化感效应指数的个数[19]。
1.3 数据处理
采用SPSS 17.0 对受体植物发芽指标、幼苗生长指标、综合化感效应指数进行单因素方差分析、差异性检验及多重比较(Waller-Duncan 法),数据用平均值 ± 标准误表示,采用Prism 8 进行制图。
2 结果与分析
2.1 浸提液对种子萌发的化感效应
2.1.1 紫花苜蓿浸提液对高丹草、饲用玉米种子萌发的化感效应
除CK 外,随着浸提液处理浓度的升高,A-M和A-S 发芽率均呈先升高后降低趋势,A-S 活力指数、萌发综合化感效应指数总体呈降低趋势,A-M活力指数、萌发综合化感效应指数呈先升高后降低趋势(表2、图1)。

图1 浸提液影响种子萌发的综合化感效应指数Figure 1 Synthetical effect index of extract on seed germination
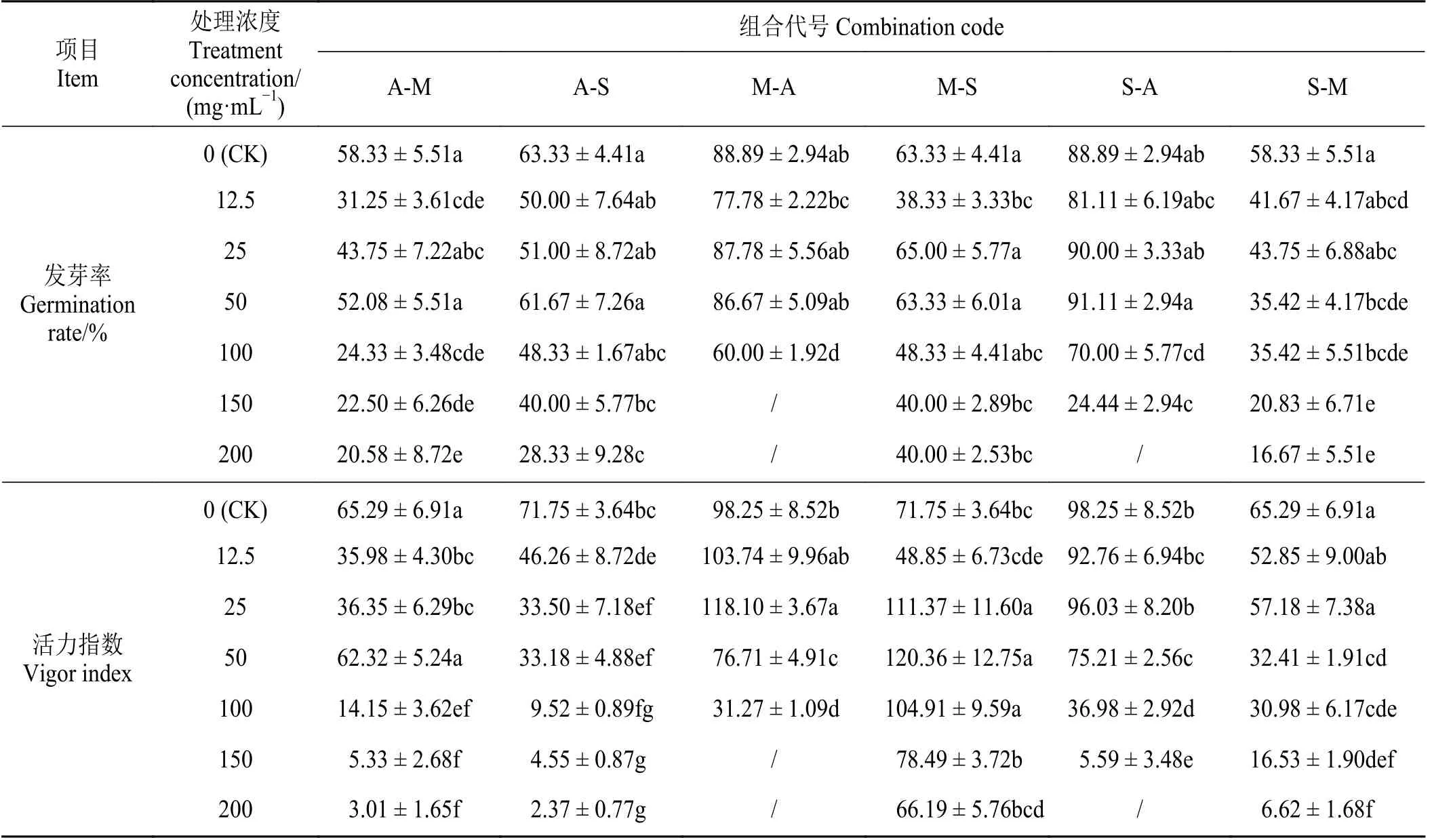
表2 浸提液对受体植物萌发的影响Table 2 Effect of extract on germination of receptor plants
除CK 外,A-S 发芽率于50 mg·mL-1处理达到最高,A-S 各浓度活力指数均显著低于CK (P<0.05)。A-M 发芽率、活力指数均于50 mg·mL-1达最高,处理浓度25 和50 mg·mL-1时的发芽率、50 mg·mL-1时的活力指数与CK 差异不显著,其余均显著低于CK (P< 0.05)。50 mg·mL-1时A-M 活力指数明显高于S-M。
A-S、A-M 的萌发综合化感效应指数于12.5、25 mg·mL-1处理时达到最高,与CK 相比降低了27.7%、12.12%,均呈现抑制效应。
2.1.2 饲用玉米浸提液对高丹草、紫花苜蓿种子萌发的化感效应
除CK 外,随着浸提液处理浓度的升高,M-S、M-A 发芽率、活力指数、萌发综合化感效应指数均呈先升高后降低趋势(表2、图1)。
除CK 外,M-S 发芽率于25 mg·mL-1处理达到最高,浓度为12.5、150、200 mg·mL-1时发芽率显著低于CK (P< 0.05)。M-S 活力指数于25~100 mg·mL-1时显著高于CK,50 mg·mL-1处理达到最高,提升了67.75% (P< 0.05)。M-A 发芽率于25 mg·mL-1时达最高, 100 mg·mL-1时发芽率均显著低于CK (P< 0.05),≥150 mg·mL-1时不发芽。M-A活力指数于25 mg·mL-1达最高且显著高于CK 20.20%,≥50 mg·mL-1时显著低于CK,25 mg·mL-1时M-A 的活力指数明显高于S-A。
M-S、M-A 萌发综合化感效应指数于25~100、25 mg·mL-1时为正值,呈现促进效应,最高与CK 相比提升了19.1%、7.8%。
2.1.3 高丹草浸提液对紫花苜蓿、饲用玉米种子萌发的化感效应
除CK 外,随着浸提液处理浓度的升高,S-A、S-M发芽率、活力指数和S-A 萌发综合化感效应指数呈先升高后降低趋势,S-M 萌发综合化感效应指数总体呈降低趋势(表2、图1)。
除CK外,S-A发芽率于50 mg·mL-1下达最高,≥100 mg·mL-1时发芽率显著低于CK,200 mg·mL-1时不发芽。S-A 活力指数于25 mg·mL-1处理达最高,≥50 mg·mL-1时活力指数显著低于CK (P< 0.05)。S-M发芽率、活力指数均于25 mg·mL-1下达最高,≥50 mg·mL-1时发芽率、活力指数显著低于CK,25 mg·mL-1时S-M 活力指数明显高于A-M。
S-A、S-M 萌发综合化感效应指数分别于25、12.5 mg·mL-1下达最高。
2.2 浸提液对幼苗生长的化感效应
2.2.1 紫花苜蓿浸提液对饲用玉米、高丹草幼苗生长的化感效应
除CK 外,随着浸提液浓度升高,A-M 幼苗鲜干比呈降低趋势,A-S 幼苗鲜干比呈先升高后降低趋势(表3)。A-M 胚芽长、胚根长总体呈先升高后降低趋势。A-S 胚芽长、胚根长呈降低趋势(表4)。
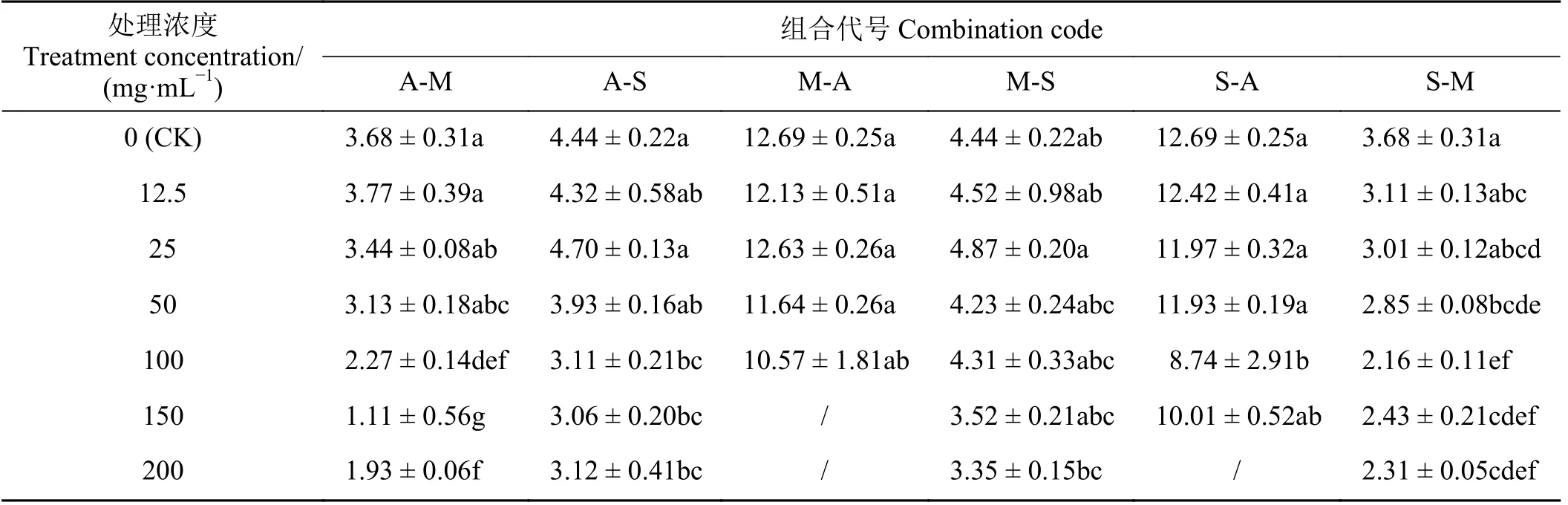
表3 浸提液对受体植物鲜干比的影响Table 3 Effect of extract on fresh-dry ratio of receptor plants

表4 浸提液对受体植物生长的影响Table 4 Effect of extract on growth of receptor plants
除CK 外,A-M 幼苗鲜干比于12.5 mg·mL-1处理达最高,≥100 mg·mL-1时鲜干比显著低于CK (P<0.05)。A-M 胚芽长、胚根长均于50 mg·mL-1处理达最高,≥100 mg·mL-1时均显著低于CK,50 mg·mL-1时A-M 的胚根长明显高于S-M。A-S 幼苗鲜干比于25 mg·mL-1达最高,≥100 mg·mL-1时幼苗鲜干比显著低于CK。A-S 胚芽长、胚根长均于12.5 mg·mL-1达最高,胚芽长≥100 mg·mL-1、胚根长大于等于50 mg·mL-1时均显著低于CK。
2.2.2 饲用玉米浸提液对高丹草、紫花苜蓿幼苗生长的化感效应
除CK 外,随着浸提液浓度升高,M-S 下,幼苗鲜干比、胚芽长、胚根长呈先升高后降低趋势。M-A下,幼苗鲜干比、胚芽长呈先升高后降低趋势,肧根长呈降低趋势(表3、表4)。
M-S 幼苗鲜干比均与CK 差异不显著(P< 0.05)。除CK 外,M-S 胚芽长于25 mg·mL-1时达最高,200 mg·mL-1时显著低于CK,胚根长于100 mg·mL-1时达最高并显著高于CK 35.04%,100 mg·mL-1时M-S胚芽长、胚根长明显高于A-S。M-A 幼苗鲜干比与CK 差异不显著,胚根长于50 mg·mL-1时显著低于CK。胚芽长于25 mg·mL-1达最高且显著高于CK 23.93%,明显高于S-A。
2.2.3 高丹草浸提液对紫花苜蓿、饲用玉米幼苗生长的化感效应
除CK 外,随着浸提液处理浓度的升高,S-A、S-M幼苗鲜干比整体呈降低趋势,S-A 胚芽长、胚根长呈波动趋势,S-M 胚芽长、幼苗胚根长整体呈先升高后降低趋势(表3、表4)。
除CK 外,S-A 幼苗鲜干比于12.5 mg·mL-1达最高,100 mg·mL-1时显著低于CK。S-A 幼苗胚芽长仅150 mg·mL-1时显著低于CK,幼苗胚根长除100 mg·mL-1外均显著低于CK (P< 0.05)。S-M 幼苗鲜干比于12.5 mg·mL-1达最高,≥50 mg·mL-1时鲜干比显著低于CK,150 mg·mL-1时S-M 鲜干比明显高于A-M。S-M 胚芽长于25 mg·mL-1达最高,≥150 mg·mL-1时胚芽长显著低于CK,胚根长在100 mg·mL-1达最高,12.5、200 mg·mL-1时胚根长显著低于CK,150 mg·mL-1时S-M 胚芽长、胚根长显著高于A-M。
2.3 植物生长发育的综合化感效应评价
随着浸提液浓度升高,总体上M-A、M-S、S-M植株生长综合化感效应指数呈先上升后下降趋势,A-M 植株生长综合化感效应指数呈先升高后降低再升高的趋势,而A-S、S-A 植株生长综合化感效应指数整体呈逐渐降低的趋势(图2)。

图2 浸提液对植株生长发育的综合化感效应指数Figure 2 Comprehensive allelopathy index of extract on growth and development
与CK 相比 ,A-M 植株生长综合化感效应指数,仅50 mg·mL-1时升高了2.74%。M-A、M-S 植株生长综合化感效应指数分别于12.5~25、25~100 mg·mL-1时为正值,最高与CK 相比升高了7.45%、9.94%。S-M、A-S、S-A 植株生长综合化感效应指数,分别于25、12.5、12.5 mg·mL-1达最高,与CK 相比降低了13.14%、14.40%、3.21%,呈生长抑制效果。
3 讨论
植物的发芽到出苗是整个植物生命中至关重要的一个阶段,同时也是植物化感作用主要起作用的阶段,易受外界影响[20-22],因此选择该阶段设置梯度浓度进行试验。本研究表明,紫花苜蓿、饲用玉米、高丹草相互间均具有化感效应,化感效应对种子发芽、出苗的改变,因受体植物种类、受体器官、浸提液浓度的不同而存在显著差异,当浸提液浓度保持在适宜区间内,对受体植物生长有一定的促进效果,而当浸提液浓度超出适宜范围时,对受体有明显抑制效果,会导致种子发芽率降低,出苗迟缓,改变了植物的生长基础,可能将严重影响到植物在环境中对生长资源的竞争能力。
首先,与饲用玉米和高丹草相比,紫花苜蓿作为受体植物时种子发芽和幼苗生长对浸提液浓度变化的响应更加敏感,同样的浸提液浓度范围,紫花苜蓿的综合化感效应指数的变化范围介于-1~0.075,大于饲用玉米(-0.071 ~0.028) 和高丹草(-0.58~0.1),这说明不同的植物间对化感效应的敏感程度不一致。该结果与前人对紫花苜蓿、高粱、小麦、黄瓜(Cucumis sativus)等多种植物的研究结果趋向一致[23-24]。
其次,相关研究表明,胚根比胚芽更易受浸提液影响[25-26],适宜浓度的浸提液可以在促进紫花苜蓿、饲用玉米等植物的胚芽生长的同时抑制其胚根长度[27-29]。在本研究中也得到类似结果,12.5~50 mg·mL-1的饲用玉米水浸提液可以促进紫花苜蓿幼苗胚芽生长,抑制其胚根生长;25 mg·mL-1的高丹草水浸提液可促进饲用玉米幼苗胚芽生长,抑制胚根生长,而浓度大于50 mg·mL-1时S-M 处理下幼苗胚芽、胚根生长将均受到抑制,这表明浸提液对受体植株的不同器官的化感作用不一致。
此外,在种子萌发以及出苗阶段初期,有机物主要靠种子内部提供,受外界影响较小,而促使种子萌发、维持细胞生理活动、保障幼苗各器官形态建成所需的水分,主要依赖于从外界吸收,此过程更易受到影响[30-31]。本研究发现,各受体植物的幼苗鲜干比在各组合、各浓度处理下存在一定差异,推测植株水浸提液有可能通过影响受体幼苗的水分吸收而表现化感效应。
最后,通常认为浸提液对受体植物呈低浓度促进而高浓度抑制的效果[32-34],但本研究发现,认定浸提液浓度的高与低并不能简单的以一个阈值浓度来划分,其效应随着浸提液浓度的变化而不断变化,这将会导致对一种植物的“低促”浓度却可能对另外的植物起到“高抑”的效果。例如,玉米水浸提液50 mg·mL-1时对高丹草幼苗长度呈促进效果,而对紫花苜蓿幼苗长度呈抑制效果,这与陈锋等[35]、张金花等[36]的研究结果保持一致。该结论充分说明采用合适植物搭配实现对目标作物增产、抑制其他植物抢夺营养的可行性。
研究紫花苜蓿、饲用玉米、高丹草的化感效应对3 种作物的科学耕种具有现实意义,研究表明,利用不同植物所产生的化感效应差异,合理安排前后茬轮作以促进目标植物生长。但本研究是在实验室条件下完成,因为化感物质作用的复杂性与浸提液渗透势定容时的误差干扰以及室内试验与大田试验的环境差异,因此本研究对3 种植物化感作用的特点,以及其相互促进或抑制生长的结论,还需要进一步细化浓度梯度、延长试验时间和增设试验地点,多方面测定指标开展深入研究。
4 结论
紫花苜蓿、饲用玉米、高丹草相互间均具有化感效应,其效应因受体植物种类、受体器官、浸提液浓度的不同而存在显著差异,影响植物生长。饲用玉米浸提液浓度25、50 mg·mL-1时分别对紫花苜蓿、高丹草达最佳促进效应。紫花苜蓿浸提液仅50 mg·mL-1时对饲用玉米植株生长有化感促进效应,对高丹草均为化感抑制效应。高丹草浸提液各处理浓度对紫花苜蓿、饲用玉米均为化感抑制效应。紫花苜蓿宜与饲用玉米、不宜与高丹草轮、套作或混播,以饲用玉米作为主要收获对象时不宜与高丹草轮作或混播。
