响应面法优化栗蘑多糖提取工艺及其抗氧化活性研究
2024-03-25牛牧青徐婉婷龙丽芳吕锐玲徐碧林郑永良
牛牧青 徐婉婷 龙丽芳 吕锐玲 徐碧林 郑永良


摘要:为优化栗蘑多糖提取工艺,以栗蘑子实体为研究对象,通过硫酸-苯酚滴定法,结合紫外分光光度法测定栗蘑多糖提取率。在单因素多水平实验的基础上,采用响应面法,利用Design-Expert软件,选取提取时间、提取温度、提取液料比3个因素,设置三水平实验方案优化提取工艺。结果表明,栗蘑多糖最佳提取工艺为提取时间1.9 h、提取温度80 ℃、提取液料比37∶1(mL/g),此条件下栗蘑多糖提取率为14.45%。抗氧化活性研究结果表明,栗蘑多糖对DPPH自由基和羟基自由基都具有较好的清除能力,在一定范围内,抗氧化活性随着多糖浓度的增加而提高。
关键词:栗蘑;多糖;响应面法;提取工艺;优化;抗氧化活性
中图分类号:TS201.1文献标志码:A 文章编号:1000-9973(2024)01-0183-06
Optimization of Extraction Process of Polysaccharides from Grifola frondosa
by Response Surface Methodology and Study on Their Antioxidant Activity
NIU Mu-qingXU Wan-tingLONG Li-fangLYU Rui-ling
XU Bi-linZHENG Yong-liang1,3*
Abstract: In order to optimize the extraction process of Grifola frondosa polysaccharides, with Grifola frondosa fruit body as the research object, the extraction rate of polysaccharides from Grifola frondosa is determined by sulfuric acid-phenol titration method combined with ultraviolet spectrophotometry. On the basis of single-factor and multi-level experiment, response surface methodology and Design-Expert software are used to select three factors such as extraction time, extraction temperature and extraction liquid-solid ratio. A three-level experimental scheme is set up to optimize the extraction process. The results show that the optimum extraction conditions are as follows: extraction time is 1.9 h, extraction temperature is 80 ℃, extraction liquid-solid ratio is 37∶1(mL/g), under such conditions, the extraction rate of polysaccharides is 14.45%. Antioxidant activity research results show that the polysaccharides from Grifola frondosa have good scavenging capacity on DPPH free radical and hydroxyl free radical. Within a certain range, the antioxidant activity increases with the increase of polysaccharides' concentration.
Key words: Grifola frondosa; polysaccharides; response surface methodology; extraction process; optimization; antioxidant activity
栗蘑(Grifola frondosa)俗稱灰树花,又名舞茸、贝叶多孔菌,是一种十分珍贵的药食同源蕈菌。野生栗蘑常见于板栗树下,具有好氧、喜光的生长特性[1]。随着栗蘑栽培技术的推广,栗蘑产业在河北迁西、浙江庆元已经形成了一定规模,我国栗蘑产量得到了极大的提升[2-3]。栗蘑有着独特的香味、脆嫩的口感,并且富含蛋白质、矿物质、维生素等物质,具有极高的营养价值。栗蘑除了可以食用外,还具有极高的药用价值,这得益于栗蘑中的生物活性成分,其中多糖作为栗蘑中含有的一种重要活性成分具有提高人体免疫力、抗氧化、抑菌、抗肿瘤等功效[4-5]。
多糖是一种具有复杂空间结构的天然大分子化合物[6],目前关于多糖的提取主要采取水提法、酶提法、超声波辅助提取法和超临界流体萃取法等[7]。水提法主要利用多糖易溶于水的特性,且操作简单、方便快捷,因此是一种常用于提取多糖的方法[8-10]。响应面法可以用于分析提取条件各因素之间的相互作用,是一种精密度高、可行性强的方法。为了提高栗蘑多糖的提取率,确保多糖活性的稳定,本实验选择热水浸提法对栗蘑多糖进行提取,运用Design-Expert 11软件优化提取工艺,得到最佳提取条件,并测定栗蘑多糖的自由基清除能力,进行抗氧化活性研究,为栗蘑及其相关功能产品的研发提供理论基础和技术支持。
1 材料与方法
1.1 材料与试剂
栗蘑菌种原种(Grifola frondosa JD01):由本课题组分离保藏;栗蘑子实体:由课题组实验基地生产提供。
1,1-二苯基-2-三硝基苯肼自由基(1,1-diphenyl-2-picrylhydrazyl radical,DPPH):上海源叶生物科技有限公司;抗坏血酸(VC)、无水葡萄糖、苯酚、浓硫酸、硫酸亚铁、水杨酸、无水乙醇、30%过氧化氢:沪试国药集团化学试剂有限公司;以上化学试剂均为分析纯。
1.2 实验仪器
V-5600紫外可见分光光度计 上海元析仪器有限公司;AB204-N电子分析天平 梅特勒-托利多仪器有限公司;RE-2000B旋转蒸发仪 上海亚荣生化仪器厂;3-18KS高速冷冻离心机 美国Sigma公司;MX-S涡旋振荡器 美国Scilogex公司。
1.3 方法
1.3.1 样品前处理
将所得栗蘑子实体表面清洗干净,烘干、粉碎成粉末状,备用。
1.3.2 栗蘑多糖提取工艺
称取栗蘑粉末5.0 g于锥形瓶中,按液料比40∶1 (mL/g)加入去离子水浸泡,随后放置在70 ℃的水浴锅中提取2 h,抽滤,弃去栗蘑废渣,保留上清液,并浓缩至1/3,醇沉,放于温度设置为4 ℃的冰箱中静置8 h。在转速为6 500 r/min的条件下离心10 min,保留下层沉淀,弃去上清液,再用无水乙醇洗涤3次后,重复上述操作,合并沉淀物,即得到栗蘑多糖。
1.3.3 标准曲线的绘制
按照苯酚-硫酸比色法[11]绘制出葡萄糖标准曲线。
1.3.4 栗蘑多糖提取率的测定
按照1.3.3中的方法,测定多糖溶液的吸光度值,以去离子水为对照,根据得到的回归方程计算得出栗蘑多糖提取率,计算公式如下:
栗蘑多糖提取率(%)=[(C×V×N)/(M×106)]×100%。
式中:C为回归曲线方程计算得到的栗蘑多糖的浓度,mg/mL;V为溶液体积,mL;N为稀释倍数;M为栗蘑粉末的质量,g。
1.3.5 提取条件的单因素实验
称取栗蘑粉末5.0 g,分别以提取温度、提取时间、提取液料比(去离子水体积与栗蘑粉末质量的比例)为因素,控制单一变量,进行单因素实验,探究多糖提取的最佳条件。
1.3.6 响应面优化设计
根据单因素实验结果,运用Design-Expert 11软件设置响应面实验设计方案,分析提取条件各因素之间的交互作用对多糖提取率的影响,响应面实验因素及水平见表1。
1.3.7 栗蘑多糖抗氧化活性研究
1.3.7.1 DPPH自由基清除率测定
参考薛小兰等[12]的方法,分别配制浓度为0.25,0.5,1,5 mg/mL的栗蘑多糖水溶液,计算栗蘑多糖的DPPH自由基清除率,同时以VC作阳性对照,计算公式如下:
DPPH自由基清除率(%)=A空白-(A样品-A对照)A空白×100%。
式中:A空白为不含样品的空白组的吸光度值;A样品为栗蘑多糖溶液的吸光度值;A对照为不含DPPH的对照组的吸光度值。
1.3.7.2 羟基自由基清除率测定
采用水杨酸法测定[13-14],分别配制浓度为0.25,0.5,1,5 mg/mL的栗蘑多糖水溶液,计算羟基自由基清除率,并以VC为阳性对照组,计算公式如下:
羟基自由基清除率(%)=A空白-(A样品-A对照)A空白×100%。
式中:A空白为不含样品的空白组的吸光度值;A样品为栗蘑多糖溶液的吸光度值;A对照为不含过氧化氢的对照组的吸光度值。
1.4 数据处理
利用Design-Expert 11软件对响应面实验得出的结果进行处理和分析,采用Origin 2021软件进行分析绘图[15-16]。
2 结果与分析
2.1 葡萄糖标准曲线的绘制
由图1得到回归曲线方程:Y=0.016 8X-0.016 6,R2=0.999 2,表明标准曲线线性关系良好。
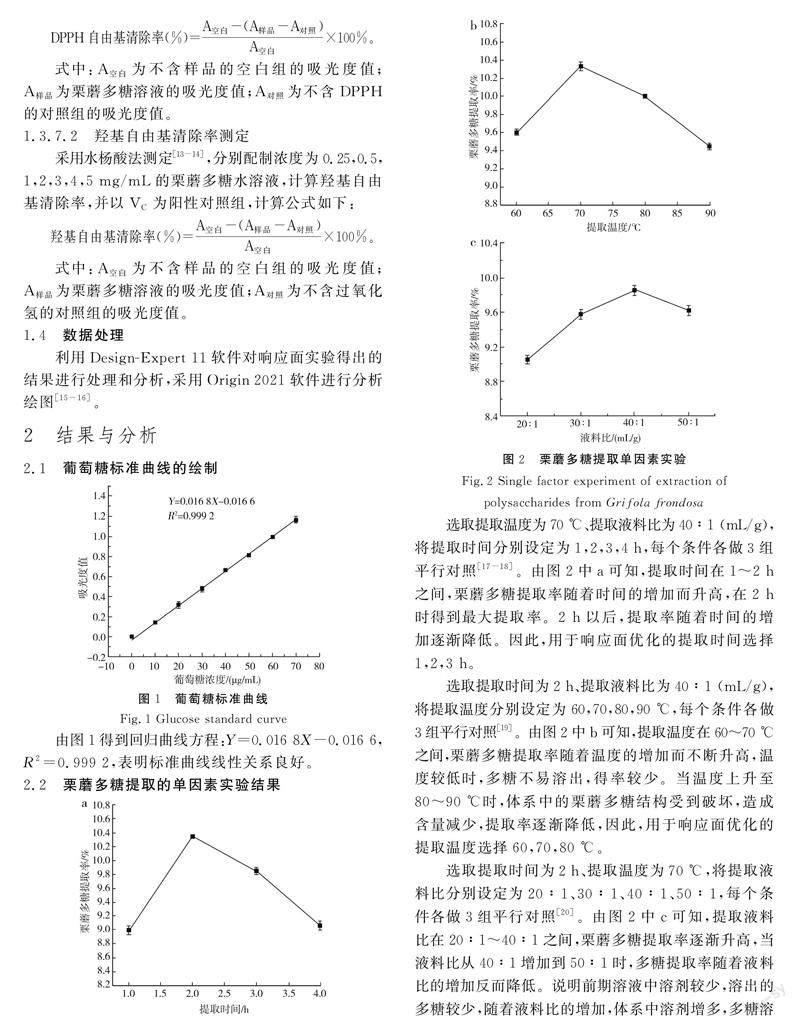
2.2 栗蘑多糖提取的单因素实验结果
选取提取温度为70 ℃、提取液料比为40∶1 (mL/g),将提取时间分别设定为1, 4 h,每个条件各做3组平行对照[17-18]。由图2中a可知,提取时间在1~2 h之间,栗蘑多糖提取率随着时间的增加而升高,在2 h时得到最大提取率。2 h以后,提取率随着时间的增加逐渐降低。因此,用于响应面优化的提取时间选择 3 h。
选取提取時间为2 h、提取液料比为40∶1 (mL/g),将提取温度分别设定为60,70,80,90 ℃,每个条件各做3组平行对照[19]。由图2中b可知,提取温度在60~70 ℃之间,栗蘑多糖提取率随着温度的增加而不断升高,温度较低时,多糖不易溶出,得率较少。当温度上升至80~90 ℃时,体系中的栗蘑多糖结构受到破坏,造成含量减少,提取率逐渐降低,因此,用于响应面优化的提取温度选择60,70,80 ℃。
选取提取时间为2 h、提取温度为70 ℃,将提取液料比分别设定为20∶1、30∶1、40∶1、50∶1,每个条件各做3组平行对照[20]。由图2中c可知,提取液料比在20∶1~40∶1之间,栗蘑多糖提取率逐渐升高,当液料比从40∶1增加到50∶1时,多糖提取率随着液料比的增加反而降低。说明前期溶液中溶剂较少,溶出的多糖较少,随着液料比的增加,体系中溶剂增多,多糖溶出量也随之增大,直至达到饱和状态,栗蘑多糖不再继续析出。因此,确定用于响应面优化的液料比选择30∶1、40∶1、50∶1。
2.3 提取条件的响应面优化实验结果
2.3.1 响应面模型拟合与显著性分析检验
采用Box-Behnken设计,依据方案开展实验,处理数据[21-22],结果见表2。
对表2中数据进行多元回归拟合分析,可得到方程:Y=13.80+0.79A+1.46B+0.61C-1.20AB-0.30AC-1.15BC-2.31A2-0.78B2-0.94C2。
该模型方差分析结果见表3。
由表3中方差分析结果可知,模型P<0.000 1,表明栗蘑多糖的提取率与各提取因素的回归方程关系极显著[23];失拟项的P=0.149 2>0.05,不显著,表明实验结果与该模型的拟合度良好。由可信度分析可知R2=0.984 5, RAdj2=0.964 6,二者的差值小于0.2,表明实际值与预测值十分接近,且C.V.为3.28%,表明可信度高,因此可以用该模型来进行栗蘑多糖提取工艺的优化。
一次项分析表明,各因素對多糖提取率的影响大小为提取温度>提取时间>提取液料比,由方差分析还可知,模型中AB、BC、A2、B2、C2对栗蘑多糖提取率的影响显著,AC对栗蘑多糖提取率的影响不显著。
2.3.2 响应面三维模型分析
根据该回归模型方程,绘制三维曲面图及等高线图,见图3。
在三维曲面图中可以得到一个开口向下的凸面,表明栗蘑多糖提取率存在一个极大值。图3中曲面坡度可以反映出所探究的因素对栗蘑多糖提取率影响的显著性大小,曲面坡度越陡,表明影响越显著;反之,曲面坡度越平缓,表明影响越不显著[24]。
由图3可知,3个实验因素中对栗蘑多糖提取率的影响大小为提取温度>提取时间>提取液料比,与方差分析结论一致。通过等高线图分析可以得到两个因素交互作用的程度大小,图3中d和f图更接近椭圆形,因此AB和BC的交互作用显著。
2.4 最佳提取工艺及验证实验
采用Design-Expert 11软件,以栗蘑多糖提取率最大值作为指标,根据所得拟合模型进行分析计算,可得到理论上最优提取条件为提取时间1.93 h、提取温度80 ℃、提取液料比37∶1 (mL/g),此时栗蘑多糖提取率为14.57%。为验证模型预测的可靠性,依据实际条件将提取条件优化为提取时间1.9 h、提取温度80 ℃、提取液料比37∶1 (mL/g),进行验证实验和重复实验,得到平均提取率为14.45%,与预测得出的栗蘑多糖提取率相差较小,表明通过优化后得到的提取工艺稳定可行。
2.5 栗蘑多糖抗氧化性研究
2.5.1 DPPH自由基清除率
DPPH自由基清除率越大,说明还原性越强,栗蘑多糖具有较好的抗氧化能力。不同浓度栗蘑多糖溶液的DPPH自由基清除率见图4。
在一定的浓度范围内,栗蘑多糖具有较好的DPPH自由基清除能力,且与多糖溶液的浓度呈现出量效关系。由图4可知,当栗蘑多糖溶液浓度为5 mg/mL时,其DPPH自由基清除率存在最大值,为87.5%,与阳性对照组VC的清除能力相差较小。综上所述,栗蘑多糖有较好的抗氧化活性。
2.5.2 羟基自由基清除率
还原剂的能力越强,对羟基自由基的清除效果越好,不同浓度栗蘑多糖溶液的羟基自由基清除率见图5。
由图5可知,低浓度的多糖溶液羟基自由基清除率较小,且与VC阳性对照组相差较大,但随着浓度的不断增加,栗蘑多糖的羟基自由基清除率呈现升高的趋势,且在浓度为5 mg/mL时达到94.36%,与VC的清除率逐渐接近,说明栗蘑多糖具有较好的羟基自由基清除能力。
3 结果与讨论
本实验利用水提醇沉法提取栗蘑多糖,在单因素实验结果的基础上,采用Box-Behnken方法对多糖提取条件进行响应面优化,得到最佳提取工艺,即在提取时间1.9 h、提取温度80 ℃、提取液料比37∶1 (mL/g)的条件下,栗蘑多糖提取率达到14.45%,且该工艺稳定可行。此外,抗氧化实验结果表明,栗蘑多糖具有较好的DPPH自由基、羟基自由基清除率,且在栗蘑多糖浓度为5 mg/mL时抗氧化能力最强,栗蘑多糖具有较好的抗氧化活性,是一种优质的天然抗氧化剂。
参考文献:
[1]陈强,黄晨阳.日本食用菌栽培历史、产业现状与启示[J].中国农业信息,2015(4):20-22.
[2]王亚敏,谢梦洲,张超文,等.药食用真菌灰树花防治肿瘤相关应用的研究进展[J].农产品加工,2019(3):83-86.
[3]阮海东,陈秀娟,林程,等.福建省灰树花工厂化栽培技术[J].东南园艺,2015,3(4):82-84.
[4]陈卓,吴克俭.灰树花多糖生物活性的研究进展[J].广东医学,2016,37(5):785-788.
[5]徐铮奎.灰树花多糖抗癌作用及相关产品开发进展[J].上海医药,2010,31(11):496-497.
[6]甘长飞.灰树花及其药理作用研究进展[J].食药用菌,201 22(5):264-267,281.
[7]胡玲玲,乌雪燕.枸杞多糖的水提醇沉法工艺优化[J].贵州农业科学,2021,49(7):128-133.
[8]刘思扬,陆雅琦,海日汉,等.功能性植物多糖及其应用研究进展[J].食品工业科技,2022,43(21):444-453.
[9]程婷婷,陈贵元.植物多糖提取及抗肿瘤研究进展[J].亚太传统医药,2022,18(2):225-229.
[10]陈红,杨许花,查勇,等.植物多糖提取、分离纯化及鉴定方法的研究进展[J].安徽农学通报,2021,27(22):32-35.
[11]曹丹,孙于寒,彭浩,等.均匀设计法优化灰树花多糖超声波辅助提取工艺及其抗氧化活性分析[J].食品研究与开发,2021,42(5):113-118.
[12]薛小兰,范瑜珊.灰树花粗多糖提取物体外抑菌及抗氧化活性初步探究[J].福建农业科技,2021,52(9):15-19.
[13]闫旭宇,李玲.水提醇沉法提取薏米多糖及其对羟自由基的清除作用[J].食品研究与开发,2019,40(18):1-5.
[14]YEH J Y, HSIEH L H, WU K T, et al. Antioxidant properties and antioxidant compounds of various extracts from the edible basidiomycete Grifola frondosa (Maitake)[J].Molecules,2011,16(4):3197-3211.
[15]CHEN Y H, HSU T H, LO H C. Submerged-culture mycelia and broth of the maitake medicinal mushroom Grifola frondosa (higher basidiomycetes) alleviate type 2 diabetes-induced alterations in immunocytic function[J].International Journal of Medicinal Mushrooms,2015,17(6):541-556.
[16]LI Q, WANG W, ZHU Y, et al. Structural elucidation and antioxidant activity a novel Se-polysaccharide from Se-enriched Grifola frondosa[J].Carbohydrate Polymers,2017,161:42-52.
[17]付佳樂,耿直.灰树花多糖体外抑菌及抗氧化活性研究[J].中国现代应用药学,2020,37(8):945-948.
[18]曹丹,孙于寒,彭浩,等.均匀设计法优化灰树花多糖超声波辅助提取工艺及其抗氧化活性分析[J].食品研究与开发,2021,42(5):113-118.
[19]申红林,王凤玲.灰树花多糖复合酶协同微波辅助提取工艺及抗氧化性研究[J].食品研究与开发,2020,41(22):124-131.
[20]喻治达,沈丹丹.海鲜菇多糖提取工艺优化及抗氧化性分析[J].中国调味品,2023,48(1):27-30.
[21]谢渟,肖春,王涓,等.灰树花活性多糖构效关系研究进展[J].微生物学通报,2022,49(8):3401-3419.
[22]张心驰,惠和平,李晓东,等.响应面法优化败酱草多糖超声提取工艺及其体外抗氧化活性研究[J].化学研究与应用,2022,34(9):2074-2081.
[23]胡栋宝,杜薇,杨猛.响应面法优化巨大口蘑多糖提取工艺及抗氧化活性[J].中国调味品,2021,46(10):78-82.
[24]王自凡,卢永仲,张振.响应面优化白芨多糖提取工艺及流变性研究[J].中国调味品,2022,47(7):58-63.
收稿日期:2023-07-12
基金项目:国家自然科学基金青年项目(32001207);湖北省中央引导地方科技发展专项资金(2019zyyd044);湖北省重点研发计划项目(2020BBB091)
作者简介:牛牧青(1997-),女,硕士,研究方向:食药用菌活性物质。
*通信作者:郑永良(1969-),男,教授,博士,研究方向:食药用菌及其功能。
