微生物合成血红蛋白的研究进展及其在食品中的应用
2024-03-25王庆沛宇光海廖爱美潘龙黄继红
王庆沛 宇光海 廖爱美 潘龙 黄继红

摘要:血红蛋白是存在于原核和真核细胞中由血红素辅基和珠蛋白肽链构成的血紅素蛋白,具有多种生理功能,常被用于医药与食品行业。在食品加工领域,其作为调味剂以提高代肉未来食品——植物蛋白肉的口感和拟真性可以满足有特殊营养要求的人们对肉类口感的需求。利用微生物发酵法生产血红蛋白相较于化学法提取具有操作方便、经济高效、环境友好等优势,近几年已经成为研究的热点。微生物高效表达血红蛋白的关键在于血红素的高水平供应与血红蛋白的正确表达两个方面,强化血红素合成途径、优化蛋白表达和发酵策略是实现血红蛋白高效表达的重要途径。文章围绕微生物高效合成血红蛋白最新研究进展、血红蛋白及其衍生物在食品中的应用开展综述,以期为促进微生物源血红蛋白在食品中的应用提供理论参考。
关键词:血红蛋白;血红素;植物蛋白肉;未来食品;食品调味品
中图分类号:TS201.1文献标志码:A 文章编号:1000-9973(2024)01-0189-09
Research Progress of Synthesis of Hemoglobin by Microorganisms and Its Application in Food
WANG Qing-peiYU Guang-haiLIAO Ai-meiPAN LongHUANG Ji-hong1, 4*
Abstract: Hemoglobin is a heme protein composed of heme subunits and globin peptide chains that exists in prokaryotic and eukaryotic cells. It has various physiological functions and is often used in the pharmaceutical and food industries. In the field of food processing, it can be used as a seasoning agent to improve the taste and authenticity of future meat substitutes — plant protein meat, so as to meet the needs of people with special nutritional requirements for meat taste. Using microbial fermentation method to produce hemoglobin has advantages compared with chemical method, it is easy to operate, economical, efficient and environmentally friendly, and has become a research hotspot in recent years. The key to efficient expression of hemoglobin by microorganisms lies in two aspects: the high-level supply of hemoglobin and the correct expression of hemoglobin. Strengthening the heme synthesis pathway, optimizing protein expression and fermentation strategies are important ways to achieve efficient expression of hemoglobin. In this paper, the latest research progress of the efficient synthesis of hemoglobin by microorganisms, as well as the application of hemoglobin and its derivatives in food are reviewed, in order to provide theoretical references for promoting the application of microbial derived hemoglobin in food.
Key words: hemoglobin; heme; vegetable protein meat; future food; food seasoning
随着消费水平的提高,人们对肉类食品的需求逐年增加,且受动物疫病[1]、生产周期[2]、气候变化[3]等因素的影响,传统的畜牧养殖业生产的肉类已无法满足人们的需要,养殖过程中产生的能耗与温室气体的排放也会对环境造成严重的负担[4]。且传统养殖肉导致人类“三高”患病率逐年增加,寻求一类既能满足人们对养殖肉营养元素的需要,又能减少患病率的代肉未来食品已成为科研人员研究的方向[5]。目前代肉食品主要分为两种:一种是以大豆等植物蛋白为原料的植物蛋白肉,另一种是从动物身上提取细胞组织培育成的细胞培养肉[6]。
细胞培养肉生产成本较高,无法实现规模化生产,因此目前代肉食品的研究主要集中在植物基代肉未来食品。且由于食品加工业的快速发展和健康饮食知识的渗透,民众的饮食要求已从之前的“吃得饱、吃得好”转变为“吃得安全、吃得营养”。植物蛋白肉作为未来食品产业发展的主要研究方向,不仅可以减少畜牧业对水和土地的需求,降低温室气体的排放量[7],而且能为对健康有特殊要求的消费者提供更多的选择。与真肉相比,植物蛋白肉具有丰富的植物蛋白,能降低心血管疾病和Ⅱ型糖尿病的患病风险[8]。
植物基蛋白肉是通过挤压技术和3D食品打印技术将植物蛋白加工成类似肉类的纤维结構,从而模拟真肉的质地与口感。虽然制造技术已经相当成熟,但是在色泽、风味及口感等方面仍然存在差异[9]。血红蛋白是肉类食品的调味剂和着色剂,使用血红蛋白作为添加剂可以极大地提高代肉食品的口感和风味,极具食品工业应用前景。但是化学法提取血红蛋白的难度大,不具有经济性,且需要大量的动物血液,同样会引起过度畜牧带来的土地、水资源的浪费及温室效应的加剧,从而造成环境恶化[10]。将微生物法发酵生产的血红蛋白应用于代肉制品,可以极大地提高代肉制品的口感和风味。微生物发酵法早在2016年就被应用于素肉汉堡中[11],也打开了微生物表达血红蛋白的热潮。本文对目前微生物合成的主要血红蛋白种类、微生物高效表达血红素及血红蛋白的研究进展进行了简要归纳和总结,为今后开发微生物源血红蛋白产品提供了理论基础,并简要归纳了血红蛋白及其衍生物在食品中的应用,以期促进血红蛋白在食品制造业中的进一步发展。
1 微生物合成的主要血红蛋白种类
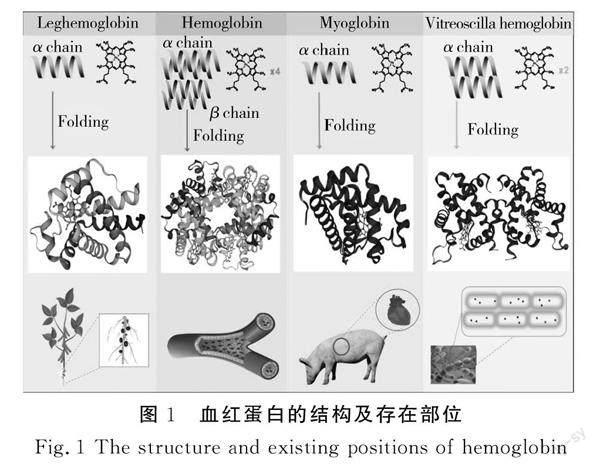
血红蛋白的结构及存在部位见图1。
目前已有15种不同来源的血红蛋白在微生物中表达[12],根据参与合成的生物体及组成结构的不同主要研究集中在动物血红蛋白、动物肌红蛋白、微生物血红蛋白及植物血红蛋白方面。动物血红蛋白(hemoglobin)是红细胞的重要组成成分,存在于血液中,是血红素辅基和珠蛋白组成的辅助因子蛋白,有输送和储存氧气等重要作用。动物血红蛋白是由两条α链和两条β链组成的四级结构[13],每条链含有一个血红素基团,其中血红素基团中心的亚铁离子承担机体氧气运输的功能[14]。动物肌红蛋白(myoglobin)存在于动物肌肉组织中,是一种结合蛋白,相比于血红蛋白的简单结构,由一条肽链和一个血红素辅基组合而成。肌红蛋白只存在于动物的心肌及骨骼肌肉中,在肌细胞中具有转运和储存氧的功能,在心肌受损时从心肌细胞中弥散出进入血液循环。动物肌红蛋白结构简单,微生物合成难度不大,目前的研究已经相对成熟。透明颤菌血红蛋白(vitreoscilla hemeglobin)是由2个相同的亚基组成的同型二聚体,透明颤菌血红蛋白被应用在天然产物药物、药物前体或医药中间体、保健品功能因子及生物医疗材料等生物医药生产应用研究中[15]。透明颤菌血红蛋白基因vgb在酿酒酵母中过表达可改变细胞的氧化状态,促进活性氧的累积,很好地解决了高密度发酵溶氧率问题[16]。透明颤菌血红蛋白的应用主要体现在提高微生物代谢产物的产量和增加生物修复能力上,将其应用于食品方面并没有研究。作为食品添加剂,豆血红蛋白(leghemoglobin)在食品制造行业中的应用最广泛。豆血红蛋白是单体血红蛋白,由一个血红素辅基和一条肽链组成,存在于豆科植物根上的固氮结节中,是根瘤菌感染大豆后产生的血红蛋白[17]。豆血红蛋白能赋予食品牛肉的风味与颜色,已经在食品制造业中作为添加剂得以应用。但是化学法提取豆血红蛋白的工艺复杂,且种植耗费的时间长,使得生产豆血红蛋白的成本过高[18]。微生物发酵法替代传统的化学法生产豆血红蛋白,可降低成本,提高工作效率,以其作为食品调味剂应用于食品中,已经获得了美国食品药品监督管理局的批准使用。
2 微生物高效表达血红蛋白的策略及研究进展
在微生物宿主方面,枯草芽孢杆菌、谷氨酸棒状杆菌、大肠杆菌、毕赤酵母、酿酒酵母等9种微生物已被应用于合成血红蛋白[12]。血红蛋白的高效表达依赖于血红素的高水平供应和蛋白的正确表达,主要通过以下3种策略实现:强化血红素的合成途径来提高血红素的供应;优化血红蛋白表达策略来提高球蛋白和血红素的结合率以保证血红蛋白的正确表达;优化微生物表达血红蛋白的发酵条件来进一步提高血红蛋白的表达量。
2.1 血红素合成途径的优化
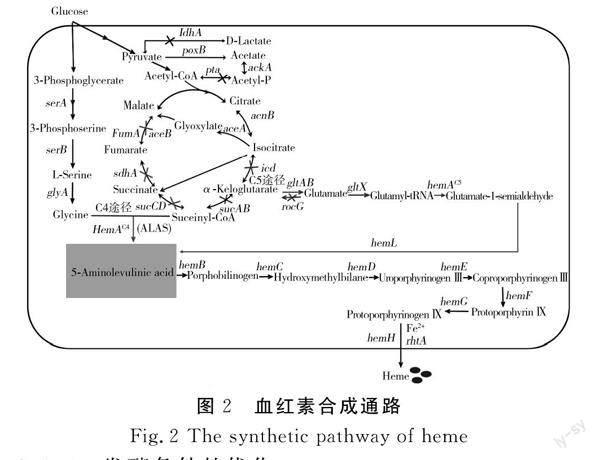
血红素是合成血红蛋白的辅基,具有携氧能力,是生命体代谢活动中不可缺少的小分子物质,它存在于动物、植物、细菌、真菌、蓝藻等生命体中。血红素是一种铁卟啉化合物,由卟啉和亚铁构成,通过改变侧链形成不同结构的衍生物[19]。血红素的基本结构是卟啉中心螯合亚铁离子形成的共轭结构,化学性质比较稳定[20]。大多数生物都可以内源合成血红素,主要分为两种途径:C4途径与C5途径。C4途径与C5途径的主要差别在于5-氨基乙酰丙酸(5-ALA)上游途径的不同。5-ALA是一种非蛋白氨基酸,是四吡咯途径中合成血红素、叶绿素、细胞色素及维生素B12的中间体,据研究,5-ALA与血红素的产量呈显著正相关[21]。
2.1.1 5-ALA上游途径的优化
2.1.1.1 C4途径5-ALA上游优化
C4途径也称Shemin途径(见图1),它存在于哺乳动物、鸟类、真菌等生物中[22]。在C4途径中,5-ALA是琥珀酰辅酶A与甘氨酸在ALA合成酶(ALAS)的作用进一步反应缩合而成的。提高血红素的产量首先需要筛选高效的ALA合成酶。在2014年,研究人员对荚膜红杆菌、农杆菌、球形红杆菌的ALA合成酶进行对比,发现荚膜红杆菌的ALAS活性最高,通过菌体利用C4途径异源表达后,获得了产量为8.8 g/L的5-ALA[23]。在2018年,张俊丽等[24]表达了来自酿酒酵母中的ALAS hemA基因并整合C5途径5-ALA合成途径,在添加前体物质甘氨酸和琥珀酸的条件下,ALA产量为525.8 mg/L,实现了在酿酒酵母中合成高产量的ALA。在2020年,Hsuan等[25]发现密码子优化的荚膜红杆菌ALAS异源表达可以获得更多的可溶性ALAS,并进一步产生高水平的5-ALA。由于ALA是由TCA循环中的甘氨酸和琥珀酰辅酶A缩合而成的,研究人员也对TCA代谢流进行了改造。研究发现在有氧条件下敲除琥珀酸脱氢酶(SDH1)和富马酸酶(FUM1),琥珀酸水平可增加2.7倍,SDH1的单独缺失可使其提高1.6倍,可提高琥珀酰COA的产量[26]。且SDH1基因的敲除并不会对细胞生长产生影响而敲除琥珀酸脱氢酶(SUC3)基因,促进碳通量流向5-ALA会明显抑制菌体的生长出现严重的代谢失衡,可能是由于琥珀酸脱氢酶在合成代谢中的特殊作用,无法合成琥珀酰COA将会抑制细胞的生长。在谷氨酸棒状杆菌中引入C4途径,并敲除琥珀酸脱氢酶(SdhA)和乙醛酸操纵子阻遏蛋白(IclR),进一步增强细胞中琥珀酰辅酶A的形成,同时抑制hemB基因表达,获得5-ALA产量为6.93 g/L[27]。在酿酒酵母中,ACO1和ACO2编码的乌头酸酶是甘氨酸充足时TCA循环中的限速酶,与野生菌株S288C相比,ACO1缺失会导致菌的最大发酵速率降低35%[28]。过表达ALAS时ACO2的过表达可进一步增加5-ALA的合成[29]。
2.1.1.2 C5途径5-ALA上游优化
C5途径主要存在于高等植物、藻类和多种细菌中,以谷氨酸为前体合成5-ALA需要3种酶的参与分别是谷氨酸-tRNA合成酶(gltX)、谷氨酸-tRNA还原酶(hemA)和谷氨酸-1-半醛转氨酶(hemL)。在C5途径的研究中,通过共表达SerA、SerB及SerC基因,5-ALA产量提高69%,在此基础上过表达glyA基因,使5-ALA产量提高1.5倍[30]。通过敲除乙酸和乳酸等副产物合成途径相关基因以减少乙酰辅酶A的转化,提高草酰乙酸含量也有利于5-ALA的产量[31]。5-ALA的合成与细胞内的氧化还原电势有关,共表达苹果酸酶基因maeB和hemA时,可以提高ALAS的活力[32]。同时发酵时添加甘氨酸和琥珀酸等前体物质、ALA脱氢酶的抑制剂左旋丙酸、乙酰丙酸、D-木糖等都可以增加5-ALA的产量[33]。且有研究显示5-ALA在碱性条件下容易降解,产量随着pH的降低而增加[34]。酿酒酵母作为一种耐酸菌株,由于其遗传可驯化性、生命周期短和成熟的高密度发酵技术,以其作为底盘细胞将有利于5-ALA产量的增加。
2.1.2 5-ALA下游途径的优化
除了提高前体5-ALA的产量外,控制血红素的合成和降解途径是最有效的手段。血红素在ALA前体充分存在的情况下,经过ALA脱水酶(hemB)脱水缩合形成胆色素原,经过羟甲基胆素合成酶(hemC)脱氨缩合形成羟甲基胆素,再经过尿卟啉原Ⅲ合成酶(hemD)的作用脱水环化形成四吡咯环的尿卟啉原Ⅲ,从此步骤开始形成卟啉环,也是生物体内所有四吡咯类物质合成的共同前体[33]。尿卟啉原Ⅲ经过尿卟啉原Ⅲ脱羧酶(hemE)将4个侧链脱羧合成粪卟啉原Ⅲ,粪卟啉原Ⅲ经过粪卟啉原Ⅲ氧化酶(hemF)对侧链进行氧化脱羧形成原卟啉原Ⅸ,再经过原卟啉原Ⅸ脱氢酶(hemG)催化脱氢成原卟啉Ⅸ,最后在亚铁螯合酶(hemH)的作用下,结合Fe2+形成血红素[35]。血红素的降解途径一般与血红素加氧酶(Hmx1)和参与有氧呼吸的Hap1p转录因子有关。血红素加氧酶参与血红素的氧化分解反应,分解产物为胆绿素、铁和一氧化碳,有研究表明Hmx1基因的缺失會使血红素的降解活动减弱,从而达到胞内的积累[36]。Hap1p是一种转录因子,参与有氧呼吸和氧化还原反应的激活,并负责血红素的动态平衡。当胞内血红素含量过高时,会诱导转录抑制因子Rox1p抑制血红素合成途径hemF转录形成负反馈以降低血红素的合成[37]。在2003年,Kwon等[38]首次利用三质粒系统在大肠杆菌中组装了整个血红素合成途径,得到的卟啉总浓度为90 μmol/L,血红素浓度为3.3 μmol/L。通过优化血红素合成基因的表达水平,删除竞争通路,过表达血红素输出蛋白,使大肠杆菌的血红素总产量达到1 034.3 mg/L[39]。过表达大肠杆菌的血红素输出蛋白ccmABC,血红素的分泌率可提高63%。血红素调节转运体hrtA、hrtB以及细胞色素输出蛋白ccsA可能参与细胞的分泌,重组过表达进行比较,显示hrtAB更利于血红素的产生,胞外分泌率达9.25%[40]。过表达C5途径从L-谷氨酸开始的ALA生物合成途径,敲除降解途径基因pta、IdhA和yfex,以阻断醋酸和乳酸的合成来优化代谢通量,过表达转运蛋白ccmAB,使其产生73.4 mg/L血红素,在培养基中添加ALA胞外血红素产量为151.4 mg/L,占总产量239.2 mg/L的63.3%[41]。在大肠杆菌中构建并筛选具有最佳RBS强度的hemBCDEFY组合菌株,获得的卟啉浓度为160.8 mg/L,再从诱变文库中获得了一个高活性的hemFECH变异体。对优化后的hemBCDEFY和hemFECH突变体的菌株分批发酵,得到最高产量为127.6 mg/L的血红素[42]。在酿酒酵母中,Hoffman等[43]通过构建酿酒酵母血红素合成基因过表达系统证明hemB、hemC为关键限速酶基因,同时hemE也具有限速酶的可能。Ishchuk等[44]对76个血红素单独敲除或者过表达,发现40个基因可增加血红素的产生,研究发现过表达hemF可使血红素产量提高300%,hemG、hemB、hemH、hemC及hemE也可使血红素产量增加20%~70%。敲除不利基因、组合过表达有利基因后血红素产量提高了70倍,血红素产量达到53.7 mg/L。血红素合成的最后一步是由铁螯合酶(hemH)介导亚铁插入卟啉环,从而产生血红素。研究人员发现hemH与Mic60的动态关联是线粒体接触位点和嵴组织系统(MICOS)的核心成分。MICOS的缺失会对hemH的活性产生负面影响,影响酵母中血红素的合成[45]。在谷氨酸棒状杆菌中,结合两种前体途径,共表达通路基因和转录调控因子DtxR,过表达血红素转运蛋白,敲除血红素结合蛋白实现了血红素产量为(309.18±16.43) mg/L,胞外浓度为(242.95±11.45) mg/L[46]。将血红素生物合成途径分为4个模块:内源C5途径、异源C4途径、尿卟啉原Ⅲ合成途径和下游合成途径。过表达谷氨酰t-RNA还原酶的hemA,敲除C5通路中谷氨酸脱氢酶rocG,血红素产量增加了427%;过表达hemC、hemD、hemB,使血红素的产量增加了39%;通过10 L发酵罐发酵,胞外血红素产量为(221.83±4.71) mg/L,总血红素产量为(248.26±6.97) mg/L[47]。这些研究均表明,在提高血红素产量方面针对一个基因的敲除或者过表达并不能产生明显的效果,当hemD表达量降低时,hemB会自发转化为尿卟啉原 Ⅰ 从而减少尿卟啉原Ⅲ的合成,继而减少血红素的合成[48]。高水平的hemD和hemF过表达也会导致ALA的积累,说明血红素的合成是由多个基因进行调控的,提高血红素的产量需要对每个基因的表达水平进行调整。血红素合成通路见图2。
2.1.3 发酵条件的优化
发酵优化也是提高血红素产量的重要手段。通过温度、溶氧及外源添加物对卟啉合成前体5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)及终产物血红素产量影响的分析,发现Fe2+、谷氨酸或葡萄糖均能提升5-ALA和血红素的含量,37 ℃、200 mL 装液量条件下添加0.2 mmol/L 葡萄糖,血红素产量最高,可达34.45 μmol/L,比对照提高了10.79倍[49]。对培养基改良发现添加碳酸氢钠和磷酸盐缓冲液可使血红素的生成速度提高60%,硫胺素等生长因子的添加使血红素生成量提高1倍[50]。因此,提高血红素产量的发酵策略基本是在培养基中补充前体物质、合成过程中的金属离子及一些促生长因子、改善发酵环境这几个方面。调整发酵工艺也能影响血红素基因的表达水平,从而提高血红素的产量[51]。研究人员运用分批补料的方法,在碳源耗尽和pH高于预设值时在发酵罐中自动添加培养基,使血红素产量进一步提升[41]。高水平的氧气会促进酵母细胞血红素的合成,因此在C4途径的优化中,除了添加前体ALA、琥珀酸和甘氨酸,控制溶氧率也能提高血红素的产量。
2.2 血红蛋白表达策略的优化
2.2.1 动物血红蛋白表达策略的优化
微生物法合成动物血红蛋白根據用途可以分为两种:应用于医学的人血红蛋白和应用于食品的动物血红蛋白。在人血红蛋白的研究中通过外源添加血红素,血红蛋白产量能达到细胞总蛋白产量的5%~10%,且只有50%的血红素被结合[52]。随后研究人员在大肠杆菌中添加ALA使血红素结合率从20%提高到68%[53]。但是研究发现细菌系统不能产生功能性的血红蛋白,因此构建血红蛋白真核表达系统来增加细胞内血红素的可用性是目前研究的热点。在酿酒酵母中,通过平衡球蛋白的表达和工程血红素生物合成途径,血红蛋白的表达水平显著提高到酵母细胞总蛋白的3%~4%,随后对酿酒酵母中限速酶hemC过表达来增加血红蛋白产量[54],再通过敲除异源蛋白降解途径使血红蛋白积累到总蛋白的18%[55]。在动物血红蛋白的研究中,薛继科等[56]在选择半乳糖诱导策略(pGAL1启动子)对球蛋白进行诱导表达、去除血红素合成过程中的空间屏障、增加5-ALA的合成、适度提高血红素合成的限速步骤后,实现了(19.3±2.8) mg/L的牛血红蛋白和(11.7±0.4) mg/L的猪血红蛋白的微生物合成。此外,还获得了产量为(108.2±3.5) mg/L的豆血红蛋白、(68.9±1.6) mg/L的牛肌红蛋白和(85.9±5.0) mg/L的猪肌红蛋白。在大肠杆菌和毕赤酵母中通过构建载体诱导表达使得鳄鱼血红蛋白的产量分别为3.0 mg/L和6.0 mg/L[57]。相比于动物肌红蛋白,动物血红蛋白的产量明显较低,可能是由于动物血红蛋白结构比较复杂,折叠形成正确的结构难度较大,所以在食品应用方面可以替代的动物肌红蛋白成为了研究的潜力方向。
2.2.2 动物肌红蛋白表达策略的优化
戎倩倩[58]在酿酒酵母中构建3种启动子调控下的8个血红素合成基因的质粒表达系统,敲除Hmxl、Hapl后组合调控获得了血红素产量为1.12 mg/(L·OD600),整合异源C5途径基因并优化,进一步过表达hemC,菌株发酵96 h时血红素产量达到104.5 mg/L,较摇瓶发酵结果提高了4.51倍。在此基础上,利用eGFP的荧光特性和6×His组氨酸标签,成功构建了普通牛肌红蛋白与豆血红蛋白的融合蛋白表达质粒,证明了辅基基团的生产可以用代谢工程的方式来实现,从而增加了高效生产含辅基基团的复杂蛋白质的可能性。利用促溶标签MBP、TrxA等融合表达不同来源血红蛋白毕赤酵母重组菌株,猪肌红蛋白、牛肌红蛋白、豆血红蛋白在摇瓶条件下产量分别达到42.0,20.0,100 mg/L;并进一步优化猪肌红蛋白在毕赤酵母中的分泌表达体系,最终构建得到的重组菌株48 h摇瓶发酵产量达到69.0 mg/L,较对照组提高了59.4%[59]。通过外源添加血红素,重组猪肌红蛋白增加到285.42 mg/L,在5 L发酵罐中血红素结合率从12.5%增加至22%[60]。张博涵[61]在毕赤酵母中优化了表达宿主引入信号肽构建最佳组成型表达体系后,引入强启动子GAP,经发酵优化后猪肌红蛋白的最高产量为576.42 mg/L。相比于其他血红蛋白,微生物合成的肌红蛋白具有产量高、操作简单、是动物源的血红蛋白等优势,更适用于食品的研究与开发。
2.2.3 豆血红蛋白表达策略的优化
目前表达豆血红蛋白的系统主要包括大肠表达系统和酵母表达系统,刘萌等[62]将携带豇豆血红蛋白Lb Ⅱ基因的质粒pET-15b转化进入大肠杆菌BL21中表达,并对表达条件进行优化获得了产量为7.30 μg/mL的大肠杆菌表达菌株。苏悦[63]以毕赤酵母为宿主,通过选择合适的启动子构建豆血红蛋白表达重组菌,通过提高抗生素浓度,筛选得到高效表达重组菌,然后经甲醇诱导后豆血红蛋白分泌表达量达到0.12 g/L,最后对发酵条件进行了优化,将重组菌豆血红蛋白分泌表达量提高了66.7%,达到0.2 g/L。在2022年通过增加豆血红蛋白基因拷贝数和强化内源血红素途径,构建了一株高效分泌活性豆血红蛋白的毕赤酵母工程菌株,使得血红蛋白最终产量达3.5 g/L,血红素结合率达93%,是迄今为止在微生物细胞工厂中血红蛋白的最高表达水平,有望实现工业化[64]。且该文章表示血红素通路的8个基因对活性豆血红蛋白的产生都具有积极作用,添加ALA可以增加细胞内血红素的产量,从而促进豆血红蛋白的正确折叠和分泌。但是添加ALA的豆血红蛋白的比活性比添加血红素的高42%,这是由于发酵液中血红素通过酵母细胞膜的效率较低,即使在发酵液中存在过量的血红素,也只能有小部分被转化为血红蛋白。随后新的研究证明了在真核系统中存在着转运血红素的膜蛋白基因TANGO2,TANGO2的缺失会导致线粒体中的血红素超载从而影响细胞的生长,且TANGO2可以结合血红素并将其转移到球蛋白并形成血红蛋白[65]。后续的研究可以在调整整个血红素合成通路基因的表达水平基础上,对膜蛋白基因进行强化表达以提高血红素的结合率及血红蛋白的产量,不同微生物宿主高效合成血红蛋白的技术策略见表1。
2.3 微生物表达血红蛋白发酵条件的优化
发酵条件的优化对于血红蛋白的合成也是比较重要的,陈林杰等[68]首先通过单因素试验研究蛋白胨种类、大豆蛋白胨浓度、铁盐种类及血红素浓度在诱导阶段对毕赤酵母产豆血红蛋白的影响,然后通过Plackett-Burman试验设计筛选出对豆血红蛋白产量影响最大的3个因素,得出4%大豆蛋白胨作为氮源、甲醇诱导浓度为1.5%、血红素浓度为5 μmol/L时发酵效果较好,最后根据响应面结果进行摇瓶发酵和发酵罐高密度发酵。经过响应面优化后得到蛋白胨浓度51.48 g/L、pH 5.66、培养基装液35.84 mL/250 mL 是最优发酵条件。在此条件下摇瓶发酵产量为191 mg/L,采用5 L发酵罐进行高密度发酵,豆血红蛋白产量最高,达到384 mg/L。张博涵[61]经摇瓶发酵,最终确定了发酵条件为1%酵母提取物、2%胰蛋白胨、1%甘油、0.4 mg/L生物素及40 mg/L氯化血红素,肌红蛋白最高产量为17.2 mg/L,在此基础上进行发酵罐水平发酵优化,经终浓度150 mg/L氯化血红素的流加发酵,肌红蛋白最高产量达到576.42 mg/L。由此可以看出血红蛋白的发酵也是从菌株对碳源、氮源、无机盐和生长因子等方面的需求来进行优化的。除此之外,提高微生物內源血红素的产量尤为关键,在血红蛋白发酵优化的基础上对血红素的表达条件进行优化,可以提高血红素的产量,进而保证血红蛋白的正确折叠与表达。在发酵工艺方面,采用发酵罐发酵、分批补料、高密度发酵等科技手段针对不同微生物的特性有效控制发酵的多个环节也可以提高血红蛋白表达量。
3 血红蛋白及其衍生物在食品中的应用
3.1 血红蛋白在传统食品中的应用
血红蛋白作为可食用调味品,已经广泛应用于传统食品领域。血红蛋白由于其稳定的着色效果、良好的感官评价常被作为着色剂应用于素肉制品、腌肉制品、猪肉脯制品中以提高代肉及肉制品的风味。血红蛋白作为着色剂用于肉制品中能完全替代亚硝酸盐,降低了肉制品中的亚硝酸盐残留量,显著增加了产品的安全性[70]。血红蛋白肽是血红蛋白的一种衍生物,是通过物理化学方法将血红蛋白中的珠蛋白分解成短肽段,再与血红素连接的生物活性肽。研究发现人类对活性蛋白肽的吸收率高,对于年老、体弱多病及术后人群直接摄入这种营养物质比经静脉注射的氨基酸更易快速吸收[71]。血红蛋白是一种溶解性良好的蛋白,经脱色得到珠蛋白,因其具有乳化脂肪的能力且稳定性良好常被应用于香肠和肉馅的制备中[72]。研究人员发现用酶水解技术可以提高猪血红蛋白的乳化特性,通过优化酶解条件可以得到高乳化性的蛋白类产物,将产物添加到烤肠中不但可以代替瘦肉蛋白,还可以提高烤肠的品质[73]。从营养学的角度来看,膳食铁通常可分为两种形式:血红素铁和非血红素铁。非血红素铁主要包括硫酸亚铁、葡萄糖酸亚铁等[74]。血红素铁由其具有较高的生物利用度和较少的副作用可以作为天然的补铁剂治疗营养不良或妊娠期贫血等疾病[75]。
3.2 血红蛋白在未来食品中的应用
现阶段向植物、动物、微生物要热量、要蛋白的未来食品的发展已启步,作为其代表的植物蛋白肉制品也逐渐出现在日常生活中。植物蛋白肉是利用大豆、小麦、豌豆等植物蛋白,通过合成、加工而形成的具有肉类营养价值、口感和风味的食品[76]。植物蛋白肉相较于传统养殖肉具有高植物性蛋白质、少量的脂肪、无激素、富含多种氨基酸、低饱和脂肪、无反式脂肪、富含膳食纤维、无胆固醇等优势,更适合于有特殊肉类需求的人群食用[77]。目前能有效形成纤维状蛋白质结构、规模化生产的植物蛋白肉加工工艺主要包括3种纺丝技术、挤压技术和食品3D打印技术[78]。食品3D打印技术采用逐层材料沉积模式,制造的食品在质构与外观上更加逼真,近年来也成为研究的热点[79]。除了质构外,口感和色泽也是人造肉制品获得市场认可度的关键,血红蛋白作为植物蛋白肉制品的显色及调味剂可以大幅改善口感及拟真性。利用毕赤酵母合成的豆血红蛋白早在2016年已被Impossible Foods 公司应用于植物基汉堡中。微生物法合成血红蛋白应用于植物蛋白肉制品已具备市场基础,其安全性也已被证实[11]。通过添加血红蛋白、风味肽、维生素等物质,科学复配使植物肉不仅与传统肉类的外观、色泽、口感高度相似,氨基酸组成更合理且降低了肉类带来的疾病患病率,为人们的健康生活方式提供了更多选择。未来的发展中可以对不同的人群进行评估,通过改变植物蛋白肉与真实肉的混合比例来控制蛋白质与氨基酸的摄入,将会更有利于人类的健康,血红蛋白及其衍生物在食品中的应用见图3。
4 结论与展望
微生物高效表达血红蛋白主要通过强化不同宿主内源血红素合成途径、敲除血红素加氧酶等策略来减少血红素的降解以提高血红素的产量;通过调整蛋白表达策略使血红素辅基与球蛋白高效结合,过表达血红素转运蛋白增加血红蛋白的产量;通过在培养基中添加血红素及血红蛋白合成相关的辅因子及前体物质来优化发酵条件等策略来提高微生物血红蛋白表达量。微生物法表达各种血红蛋白的研究已然相对成熟,但是依然存在着诸多问题,比如大肠杆菌细胞内还原性环境不利于蛋白质分子间二硫键的形成,会造成蛋白未折叠或折叠不完全使蛋白无功能性和活性,产品纯化比较困难[67];非食品级的毕赤酵母底盘细胞同样也能带来潜在的食品安全隐患;植物来源的豆血红蛋白在结构和功能上与动物来源的血红蛋白存在着一定的差异等。因此,未来应将寻找食品级底盘细胞、运用已成熟的血红素改造途径和蛋白表达策略生产动物来源的血红蛋白或者肌红蛋白作为研究的重心。
微生物表达血红蛋白作为未来食品的研究热点,是食品和生物技术的有效结合,其囊括了合成生物学、发酵工程、基因工程等,是多学科交叉融合的产物。利用微生物合成的方法不仅能够满足人类对食品营养、安全、美味等方面的需求,而且可以减少资源的消耗,降低对环境的影响。以其作为调味剂应用于植物基代肉未来食品中可满足大众对代肉制品视觉及口感上的需求,也证明了未来食品的生产模式可以更加绿色、高效和可持续。未来食品的发展前景非常广阔,加大对未来食品、植物蛋白肉及微生物合成血红蛋白的宣传,提高民众的关注与信任度,以促进未来食品行业的高质量发展。
参考文献:
[1]NIEMI J K. Impacts of African swine fever on pigmeat markets in Europe[J].Frontiers in Veterinary Science,2020,7:634.
[2]MCAULIFFE G A, TAKAHASHI T, LEE M R F. Framework for life cycle assessment of livestock production systems to account for the nutritional quality of final products[J].Food and Energy Security,2018,7(3):143.
[3]GODDE C M, MASON-D'CROZ D, MAYBERRY D E, et al. Impacts of climate change on the livestock food supply chain; a review of the evidence[J].Global Food Security,2021,28:100488.
[4]GIAMPIERO G, PIETRO G, ANDREA V, et al. Livestock and climate change: impact of livestock on climate and mitigation strategies[J].Animal Frontiers,2019,9(1):69-76.
[5]李德茂,童胜,曾艳,等.未来食品的低碳生物制造[J].生物工程学报,2022,38(11):4311-4328.
[6]李兆丰,孔昊存,刘延峰,等.未来食品:机遇与挑战[J].中国食品学报,2022,22(4):1-13.
[7]GOLDSTEIN B, MOSES R, SAMMONS N, et al. Potential to curb the environmental burdens of American beef consumption using a novel plant-based beef substitute[J].PLoS One,2018,12(12):189029.
[8]周景文,张国强,赵鑫锐,等.未来食品的发展:植物蛋白肉与细胞培养肉[J].食品与生物技术学报,2020,39(10):1-8.
[9]LYU X Q, WU Y K, GONG M Y, et al. Synthetic biology for future food: research progress and future directions[J].Future Foods,2021,3:100025.
[10]HERRERO M, THORNTON P K. Livestock and global change: emerging issues for sustainable food systems[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(52):20878-20881.
[11]JIN Y, HE X, KWAME A K, et al. Evaluating potential risks of food allergy and toxicity of soy leghemoglobin expressed in Pichia pastoris[J].Molecular Nutrition & Food Research,2017,62(1):1700297.
[12]ZHAO X R, ZHOU J W, DU G C, et al. Recent advances in the microbial synthesis of hemoglobin[J].Trends in Biotechnology,2020,39(3):286-297.
[13]李冀宏,呂桂香,马宁,等.利用PyMol软件绘图辅助血红蛋白立体结构教学[J].生命的化学,2021,41(7):1417-1421.
[14]李菂,韩樾夏,杨芳.血红蛋白氧载体的研究与应用进展[J].中国材料进展,2022,41(5):338-344.
[15]曹艳丽,朱兵峰,时明星,等.透明颤菌血红蛋白的结构与功能及其在生物医药生产中的应用[J].中国医药工业杂志,2022,53(1):37-47.
[16]薛志勇,代红生,张显元,等.表达透明颤菌血红蛋白基因对酿酒酵母生长及细胞内氧化状态的影响[J].中国生物工程杂志,2021,41(11):32-39.
[17]王龙龙.豆血红蛋白调控根瘤高效固氮的分子机制研究[D].武汉:华中农业大学,2019.
[18]赵亚兰,尉亚辉.豆血红蛋白的研究进展[J].西北植物学报,2000(4):684-689.
[19]宋艳群,祝融峰,陈鹏.血红素的生理分布与调控[J].中国科学:化学,2015,45(11):1194-1205.
[20]LEU B M, ZHANG Y, BU L, et al. Resilience of the iron environment in heme proteins[J].Biophysical Journal,2008,95(12):5874-5889.
[21]YI Y C, SHIH I T, YU T H, et al. Challenges and opportunities of bioprocessing 5-aminolevulinic acid using genetic and metabolic engineering: a critical review[J].Bioresources and Bioprocessing,2021,8:100.
[22]FRANKENBERG N, MOSER J, JAHN D. Bacterial heme biosynthesis and its biotechnological application[J].Applied Microbiology Biotechnology,2003,63(2):115-127.
[23]LOU J W, ZHU L, WU M B, et al. High-level soluble expression of the hemA gene from Rhodobacter capsulatus and comparative study of its enzymatic properties[J].Journal of Zhejiang University:Science B,201 15(5):491-499.
[24]張俊丽,康振,钱晟东,等.产5-氨基乙酰丙酸酿酒酵母工程菌株的构建[J].食品与生物技术学报,2018,37(3):232-239.
[25]HSUAN T, CHEN Y, TAI I, et al.Enhanced 5-aminolevulinic acid production by co-expression of codon-optimized hemA gene with chaperone in genetic engineered Escherichia coli[J].Applied Biochemistry and Biotechnology,2019,199(1):299-312.
[26]RAAB A M, GEBHARDT G, BOLOTINA N, et al. Metabolic engineering of Saccharomyces cerevisiae for the biotechnological production of succinic acid[J].Metabolic Engineering,2010(6):12.
[27]CHEN J, WANG Y, GUO X, et al. Efficient bioproduction of 5-aminolevulinic acid, a promising biostimulant and nutrient, from renewable bioresources by engineered Corynebacterium glutamicum[J].Biotechnology for Biofuels,2020,3(1):41.
[28]REZAEI M N, ASLANKOOHI E, VERSTREPEN K J, et al. Contribution of the tricarboxylic acid (TCA) cycle and the glyoxylate shunt in Saccharomyces cerevisiae to succinic acid production during dough fermentation[J].International Journal of Food Microbiology,2015,204:24-32.
[29]HARA K Y, MASARU S, HIROKO K, et al.5-Aminolevulinic acid fermentation using engineered Saccharomyces cerevisiae[J].Microbial Cell Factories,2019,18(1):194.
[30]ZHU C, CHEN J, WANG Y, et al. Enhancing 5-aminolevulinic acid tolerance and production by engineering the antioxidant defense system of Escherichia coli[J].Biotechnology and Bioengineering,2019,116(8):2018-2028.
[31]朱子薇.代谢工程改造解脂耶氏酵母生产5-氨基乙酰丙酸[D].济南:山东大学,2022.
[32]KANG Z, ZHANG J, ZHOU J,et al. Recent advances in microbial production of δ-aminolevulinic acid and vitamin B12[J].Biotechnology Advances,2012,30(6):1533-1542.
[33]朱子薇,张健,王倩,等.卟啉代谢途径高价值产物及其微生物合成研究进展[J].中国科学:生命科学,2020,50(12):1405-1417.
[34]ZHANG S H, ZOU Y L, SONG X, et al. Advances in 5-aminolevulinic acid microbial production[J].Chinese Journal of Bioprocess Engineering,2017,15(5):65-70.
[35]潘梅.大腸杆菌血红素合成调节及其对血红素过氧化物酶的影响[D].无锡:江南大学,2020.
[36]PROTCHENKO O, PHILPOTT C C. Regulation of intracellular heme levels by HMX1, a homologue of heme oxygenase, in Saccharomyces cerevisiae[J].Journal of Biological Chemistry,2003,278(38):36582.
[37]MARTNEZ J L, PETRANOVIC D, NIELSEN J. Heme metabolism in stress regulation and protein production:from Cinderella to a key player[J].Bioengineered,2016,7(2):112-115.
[38]KWON S J, DE BOER A L, PETRI R, et al. High-level production of porphyrins in metabolically engineered Escherichia coli: systematic extension of a pathway assembled from overexpressed genes involved in heme biosynthesis[J].Applied and Environmental Microbiology,2003,69(8):4875-4883.
[39]ROK K C, EUN H Y, HOSEONG L, et al. Improved production of heme using metabolically engineered Escherichia coli[J].Biotechnology and Bioengineering,2022,119(11):3178-3193.
[40]QIU Y Y, JUN T Z, YANG Y Z, et al. Microbial synthesis of heme b: biosynthetic pathways, current strategies, detection, and future prospects[J].Molecules,2023,28(8):3633.
[41]ZHAO R X, CHOI R K, LEE Y S. Metabolic engineering of Escherichia coli for secretory production of free haem[J].Nature Catalysis,2018,1(9):720-728.
[42]ZHANG J, LI Q, WANG Q, et al. Heme biosensor-guided in vivo pathway optimization and directed evolution for efficient biosynthesis of heme[J].Biotechnology for Biofuels and Bioproducts,2023,16(1):33.
[43]HOFFMAN M, GRA M, RYTKA J. Identification of rate-limiting steps in yeast heme biosynthesis[J].Biochemical Biophysical Research Communications,2003,310(4):1247-1253.
[44]ISHCHUK O P, DOMENZAIN I, SNCHEZ B J, et al. Genome-scale modeling drives 70-fold improvement of intracellular heme production in Saccharomyces cerevisiae[J].Proceedings of the National Academy of Sciences of the United States of America,2022,119(30):e2108245119.
[45]DIETZ J V, WILLOUGHBY M M, PIEL R B, et al. Mitochondrial contact site and cristae organizing system (MICOS) machinery supports heme biosynthesis by enabling optimal performance of ferrochelatase[J].Redox Biology,2021,46(9):102125.
[46]KO Y J, KIM M, YOU S K, et al. Animal-free heme production for artificial meat in Corynebacterium glutamicum via systems metabolic and membrane engineering[J].Metabolic Engineering,2021,66:217-228.
[47]YANG S, WANG A, LI J, et al. Improved biosynthesis of heme in Bacillus subtilis through metabolic engineering assisted fed-batch fermentation[J].Microbial Cell Factories,2023,22(1):102.
[48]PRANAWIDJAJA S, CHOI S I, LAY B W, et al. Analysis of heme biosynthetic pathways in a recombinant Escherichia coli[J].Journal of Microbiology & Biotechnology,2015,25(6):880-886.
[49]陈丹园.大肠杆菌血红素合成途径关键酶基因的表达与调控[D].无锡:江南大学,2018.
[50]LEE M J, CHUN S J, KIM H J, et al. Porphyrin derivatives from a recombinant Escherichia coli grown on chemically defined medium[J].Journal of Microbiology and Biotechnology,2012,22(12):1653-1658.
[51]刘佳萌,李雪莹,刘业学,等.微生物以5-氨基乙酰丙酸为唯一前体物合成血红素的研究进展[J].中国生物工程杂志,2022,42(3):99-109.
[52]HOFFMAN S J, LOOKER D L, ROEHRICH J M, et al. Expression of fully functional tetrameric human hemoglobin in Escherichia coli[J].Proceedings of the National Academy of Sciences,1990,87(21):8521-8525.
[53]KERY V, ELLEDER D, KRAUS J P. Delta-aminolevulinate increases heme saturation and yield of human cystathionine beta-synthase expressed in Escherichia coli[J].Archives of Biochemistry & Biophysics,1995,316(1):24-29.
[54]LIU L F, MARTNEZ J L, LIU Z H, et al. Balanced globin protein expression and heme biosynthesis improve production of human hemoglobin in Saccharomyces cerevisiae[J].Metabolic Engineering,201 21(1):9-16.
[55]ISHCHUK O P, FROST A T, MUIZ-PAREDES F, et al. Improved production of human hemoglobin in yeast by engineering hemoglobin degradation[J].Metabolic Engineering,2021,66(3):259-267.
[56]XUE J K, ZHOU J W, LI J H, et al. Systematic engineering of Saccharomyces cerevisiae for efficient synthesis of hemoglobins and myoglobins[J].Bioresource Technology,2022,370:128556.
[57]ANWISED P, JANGPROMMA N, TEMSIRIPONG T, et al. Cloning, expression, and characterization of Siamese crocodile (Crocodylus siamensis) hemoglobin from Escherichia coli and Pichia pastoris[J].The Protein Journal,2016,35(4):256-268.
[58]戎倩倩.产血红素和肌红蛋白酵母细胞工厂的构建及优化[D].北京:中国科学院大学,2021.
[59]王紫微,赵鑫锐,周景文,等.一种高效合成血红素的毕赤酵母重组菌株的构建:中国,CN114874929A[P].2022-08-09.
[60]ZHANG B H, ZHAO X R, WANG Z W, et al. Efficient secretory expression and purification of food-grade porcine myoglobin in Komagataella phaffii[J].Journal of Agricultural and Food Chemistry,2021,69(35):10235-10245.
[61]張博涵.毕赤酵母组成型高效分泌合成猪肌红蛋白[D].无锡:江南大学,2022.
[62]刘萌,王聪睿,刘波,等.豇豆血红蛋白Lb Ⅱ在大肠杆菌中的重组表达条件优化、纯化与鉴定[J].食品工业科技,2023,44(4):163-170.
[63]苏悦.微生物高效表达异源豆血红蛋白的研究[D].杭州:浙江大学,2020.
[64]SHAO Y R, XUE C L, LIU W Q, et al. High-level secretory production of leghemoglobin in Pichia pastoris through enhanced globin expression and heme biosynthesis[J].Bioresource Technology,2022,363:127884.
[65]SUN F X, ZHAO Z Z , WILLOUGHBY M M, et al. HRG-9 homologues regulate haem trafficking from haem-enriched compartments[J].Nature,2022,610(7933):768-774.
[66]JOS L M, LIU L, PETRANOVIC D, et al. Engineering the oxygen sensing regulation results in an enhanced recombinant human hemoglobin production by Saccharomyces cerevisiae[J].Biotechnology and Bioengineering,2015,112(1):181-188.
[67]EJIMA D, WATANABE M, SATO Y, et al. High yield refolding and purification process for recombinant human interleukin-6 expressed in Escherichia coli[J].Biotechnology & Bioengineering,1999,62(3):301-310.
[68]陈林杰,薛常鲁,苏悦,等.豆血红蛋白在毕赤酵母中的表达条件优化[J].微生物学通报,2022,49(6):2050-2061.
[69]SANNY T, ARNALDOS M, KUNKEL S A, et al. Engineering of ethanolic E. coli with the Vitreoscilla hemoglobin gene enhances ethanol production from both glucose and xylose[J].Applied Microbiology & Biotechnology,2010,8(5):1103-1112.
[70]张立娟,邢绍平,孔保华,等.糖基化血红蛋白着色剂在肉制品中的应用[J].肉类工业,2011(10):9-11.
[71]张立娟,夏继华,沈峰,等.猪血血红蛋白肽的研究进展[J].肉类研究,2011,25(6):54-57.
[72]宋璇,侯成立,高远,等.血红蛋白及其衍生物在食品中的应用[J].中国食品学报,2018,18(7):314-322.
[73]徐兴达.酶解法改善猪血红蛋白的乳化性及其在烤肠中应用效果研究[D].郑州:河南农业大学,2014.
[74]XING Y, GAO S, ZHANG X, et al. Dietary heme-containing proteins: structures, applications, and challenges[J].Foods,2022,11(22):3594.
[75]汪学荣,王飞.生物态补铁剂——血红素铁的研究进展[J].中国食品添加剂,2007(3):82-87.
[76]PAVAN K K, CHATLI M K, NITIN M, et al. Meat analogues: health promising sustainable meat substitutes[J].Critical Reviews in Food Science and Nutrition,2017,57(5):923-932.
[77]ANNALISA G, FRANCESCA G, RACHELE G D, et al. The rise of processed meat alternatives: a narrative review of the manufacturing, composition, nutritional profile and health effects of newer sources of protein, and their place in healthier diets[J].Trends in Food Science & Technology,2022,127:263-271.
[78]曾艷,郝学财,董婷,等.植物蛋白肉的原料开发、加工工艺与质构营养特性研究进展[J].食品工业科技,2021,42(3):338-345.
[79]TIAN X W, LOVEDEEP K, YASUFUMI F, et al. 3D printing of textured soft hybrid meat analogues[J].Foods,2022,11(3):478.
收稿日期:2023-07-17
基金项目:河南省重大公益专项(201300110300);中原学者工作站资助项目(224400510026);河南省中央引导地方科技发展资金项目(Z20221341069);功能糖发酵菌株创制及绿色生物制造关键技术研究与应用(231111310700);河南省重大科技专项(221100110700)
作者简介:王庆沛(1997-),女,硕士,研究方向:食品加工与安全。
*通信作者:黄继红(1965-),女,教授级高级工程师,博士,研究方向:农产品精深加工。
