复方健肾片的水提工艺研究
2016-11-30阿依古丽·穆太力普祖里皮亚·
阿依古丽·穆太力普++++++祖里皮亚·塔来提++++++斯拉甫·艾白
[摘要] 目的 通过高效液相色谱法和紫外分光光度法对毛蕊花糖苷和总多糖进行含量测定,优化复方健肾片的水提工艺条件,为复方健肾片的进一步研究奠定基础。 方法 采用Waters C18 色谱柱(4.6 mm×150 mm,5 μm),流动相:甲醇-0.1%甲酸溶液(35∶65);流速:1.0 mL/min;柱温:30℃;检测波长:330 nm处测定毛蕊花糖苷含量和以苯酚-硫酸法,在490 nm波长处测定总多糖含量。 结果 毛蕊花糖苷和总多糖分别10.4~104 μg/mL(r=0.9993,n=6),20~100 μg/mL(r=0.9995)范围内与峰面积线性关系良好。影响水提工艺各因素的作用主次为: A(提取次数)>B(提取时间)>C(溶剂用量),最佳提取工艺条件是A3B1C1,即用10倍量水,提取3次,每次1.5 h。 结论 本研究的含量测定方法符合要求,通过正交试验设计优选得到的复方健肾片的水提工艺条件稳定可行。
[关键词] 复方健肾片;毛蕊花糖苷;总多糖;正交设计;提取工艺
[中图分类号] R917 [文献标识码] A [文章编号] 1674-4721(2016)09(a)-0030-05
[Abstract] Objective To optimize an HPLC and UV Spectrophotometry method for the determination of ascoside and total polysaccharides for water extraction method in Fufang Jianshen Tablets and lay a foundation for its further study. Methods Waters C18 column (4.6 mm×150 mm, 5 μm) was used with the mobile phase of methanol-0.1% formic acid (35∶65) at a flow rate of 1.0 mL/min. The detection wavelength was set at 330 nm. The column temperature was maintained at 30℃. The extracting method of Fufang Jianshen Tablets was optimized by orthogonal design, taking the extraction rate of ascoside, total polysaccharides and extract yield as indexes. Results The results showed that the linear ranges of acteoside and total polysaccharides were in the range of 10.4-104 μg/mL (r=0.9993, n=6), 20-100 μg/mL (r=0.9995). The factors that influence water extraction: A(extraction times)>B (extraction time)> C (solvent consumption). The optimum extracting condition was A3B1C1: with the volume of 10 folds, extracting for 3 times, 1.5 hours one time. Conclusion The determination method of this study accords with the requirements, the optimum technology is stable and feasible for the extraction of Fufang Jianshen Tablets by orthogonal experiment.
[Key words] Fufang Jianshen Tablets; Verbascoside; Total polysaccharides; Orthogonal design;Extraction process
复方健肾片由肉苁蓉、白术、生地黄、枸杞子、杜仲、红参、鹿茸等药物组成,具有健脾益气、温肾助阳、调和肠胃,主要用于疲乏无力、畏寒肢冷、腰痛腿酸、性欲减退等症。复方健肾片为在自治区维吾尔医医院临床使用20 余年的院内制剂,现拟将其开发成新药。本实验在单因素实验的基础上,以毛蕊花糖苷和总多糖含量及出膏率为评价指标,采用L9 (34)正交实验设计对水提工艺进行优化,为复方健肾片的进一步研究提供参考依据。
1 一般材料
Waters alliance e2695高效液相色谱仪(美国Waters公司);Waters 2489紫外检测器,Empower 3数据采集系统;UPT-1-5T超纯水器(25 MΩ,四川优普超纯科技有限公司);SQP电子天平(1/10万,德国Sartorius 公司)、超声清洗器(北京市永光明医疗仪器有限公司)。GZX-9070MBE电热恒温鼓风干燥箱(上海博迅实业有限公司医疗设备厂),DZT-6020型真空干燥箱(上海博迅实业有限公司医疗设备厂);手提式高速粉碎机(DFT-100);XMTD-4000电热恒温水浴锅(北京市永光明医疗仪器有限公司);DZTW电热套(北京市永光明医疗仪器有限公司)。
毛蕊花糖苷对照品 (批号111530-201411),D-无水葡萄糖对照品(批号110833-201205)均购自中国食品药品检定研究院。所有药材均购自亳州金药堂中药饮片有限公司,经新疆维吾尔医药研究所希尔艾力主任药师鉴定,符合《中国药典》2015年版项下标准;甲醇(色谱纯,SIGMA公司);水为超纯水; 其他试剂均为分析纯。
2 方法与结果
2.1 试验设计
根据前期单因素试验结果,选取对提取工艺影响较大的提取次数(A)、提取时间(B)和加水量(C)为考察因素,以毛蕊花糖苷、总多糖提取量和出膏率为评价指标,按L9(34)正交表进行试验[1]。因素与水平设为:A 1、2、3次,B 1.5、2.0、2.5 h,C 10、12、14倍,本实验评价指标的权重系数为0.4、0.4、0.2。
综合评分=(毛蕊花糖苷含量/最大毛蕊花糖苷含量)×40+(总多糖含量/最大总多糖含量)×40+(出膏率/最大出膏率)×20。
2.2 毛蕊花糖苷含量测定
2.2.1 色谱条件与系统适用性试验 以十八烷基硅烷键合硅胶为填充剂;以甲醇-0.1%甲酸水溶液(35∶65)为流动相;检测波长为330 nm;流速为1 mL/min;柱温为30℃;进样量10 μL[2]。
2.2.2 对照品溶液的制备 精密称取毛蕊花糖苷对照品适量,置25 mL量瓶中,加50%甲醇制成每毫升含0.416 mg的溶液,即得。
2.2.3 供试品溶液的制备 取样液经微孔滤膜(0.45 μm)滤过,取续滤液,即得。
2.2.4 标准曲线的制备 分别精密吸取毛蕊花糖苷对照品溶液0.25、0.5、1.0、1.5、2.0、2.5 mL至10 mL量瓶中,加50%甲醇溶解,稀释至刻度,摇匀。精密吸取上述溶液各10 μL注入液相色谱仪,记录峰面积。以毛蕊花糖苷浓度为横坐标,峰面积为纵坐标进行线性回归,回归方程:Y=12 318X-33 456,r=0.9993,毛蕊花糖苷对照品浓度在10.4~104 μg/mL范围内与峰面积线性关系良好。
2.2.5 样品测定 精密吸取供试品溶液与对照品溶液各10 μL,依据“2.2.1”项下色谱条件进行测定。
2.2.6 精密度试验 取浓度为0.416 mg/mL的毛蕊花糖苷对照品溶液,按“2.2.1”项下色谱条件进行测定,连续进样6次,每次10 μL,6次进样峰面积的RSD=0.93%(n=6),表明操作过程中仪器精密度良好。
2.2.7 重复性试验 在优化的水提取工艺基础上进行提取的同一批提取液,按照上述“2.2.3”项下方法制成供试液,连续进样6次,每次10 μL,6次进样峰面积的RSD=1.1%(n=6),说明该方法的重复性良好。
2.2.8 稳定性试验 同一批供试品,别在同一天的不同时间0、2、4、6、8、12 h进样10 μL(每隔2 h),用含量测定方法重复测定,计算毛蕊花糖苷含量的RSD为2.3%;结果供试品溶液稳定。
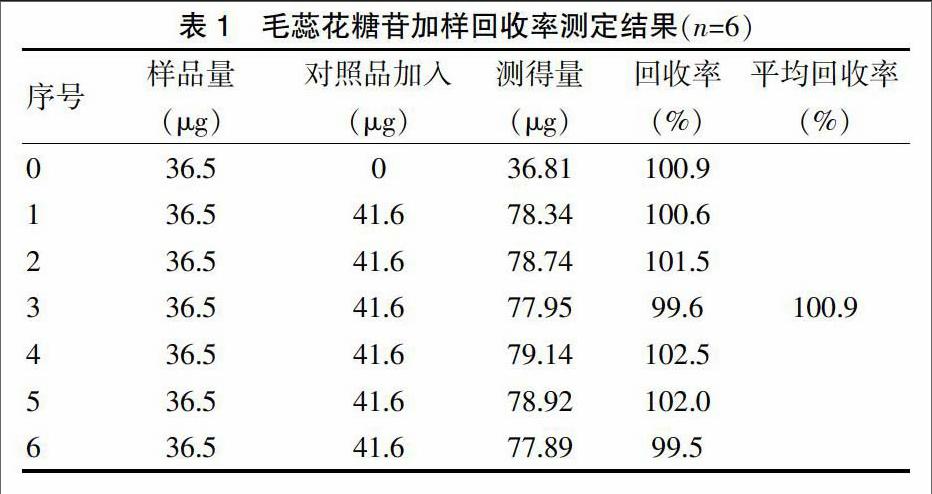
2.2.9 回收率测定 采用标准添加法测定回收率。取已知含量的样品供试液7份,每份1 mL,置于10 mL容量瓶中,第一份作为空白回收,其余6份分别准确加入浓度为41.6 μg/mL的毛蕊花糖苷对照品溶液1 mL,制备供试液,摇匀,用孔径0.45 μm微孔滤膜滤过,按“2.2.1”项下色谱条件测定,进样10 μL,提取液中毛蕊花糖苷平均回收率为100.9%,RSD为1.13%(n=6),表明本方法的回收率良好,准确度高。见表1。
2.3 总多糖含量测定(硫酸苯酚法)
2.3.1 D-无水葡萄糖对照品溶液的制备 精密称取无水葡萄糖对照品适量,置50 mL量瓶中,加适量水溶解,稀释至刻度,摇匀,即得(每毫升中含无水葡萄糖0.504 mg)。精密移取上述无水葡 萄糖对照品溶液10 mL,置50 mL量瓶中,用水定容至刻度,摇匀,即得(每毫升中含无水葡萄糖0.1008 mg)。
2.3.2 标准曲线的制备 分别精密吸取上述对照品溶液0、2.0、4.0、6.0、8.0、10.0 mL,分别置于10 mL的量瓶内,加水稀释至刻度,摇匀。分别吸取上述溶液1.0 mL于10 mL具塞刻度试管中,加入新鲜配制的5%苯酚试剂(精密称取苯酚试剂5 g,置于100 mL量瓶中,加水稀释至刻度,摇匀制备)1 mL,并迅速加入浓硫酸5 ml,静置10 min,摇匀,放置30 min,以第一份为空白对照液,在200~800 nm波长范围内进行光谱扫描,得最大吸收波长为490 nm。照分光光度法试验,在最大波长处测定各样品吸收度,以吸收度为纵坐标,浓度为横坐标,绘制标准曲线,得回归方程为Y=9.883X+0.0075,r=0.9995,在20~100 μg/mL范围内,线性关系良好。
2.3.3 供试品溶液制备 精密吸取提取液3 mL于25 mL量瓶中,加水稀释至刻度,摇匀,精密吸取稀释液1.0 mL于25 mL量瓶中,加水稀释至刻度,精密吸取稀释液1.0 mL于10 mL具塞刻度试管中,照标准曲线项下自“加入新鲜配制的5%苯酚试剂”起,依法测定吸收度,随行空白,照分光光度法(《中国药典》2015年版一部,附录通则0401)在波长490 nm处测定吸收度,依标准曲线计算总多糖含量。
2.3.4 精密度试验 取0.1008 mg/mL无水葡萄糖对照品溶液4.0 mL,置于10 mL的量瓶内,加水稀释至刻度,摇匀。吸取上述溶液1.0 mL于10 mL具塞刻度试管中,加入新鲜配制的5%苯酚试剂1 mL,并迅速加入浓硫酸5 mL,静置10 min,摇匀,放置30 min,以相应的溶剂为空白,于490 nm处连续测定吸光度值6次,计算RSD=0.38%(n=6),表明操作过程中仪器精密度良好。
2.3.5 重复性试验 在优化的水提取工艺基础上进行提取的同一批提取液,按照上述“2.3.3”项下方法制成供试液,连续测定吸光度值6次,计算RSD=1.23%(n=6),说明该方法的重复性良好。
2.3.6 稳定性试验 同一批供试品分别在同一天的不同时间0、2、4、6、8、12 h(每隔2 h),按照上述“2.3.3”项下方法制成供试液测定,计算总多糖含量的RSD为1.78%;结果供试品溶液稳定。
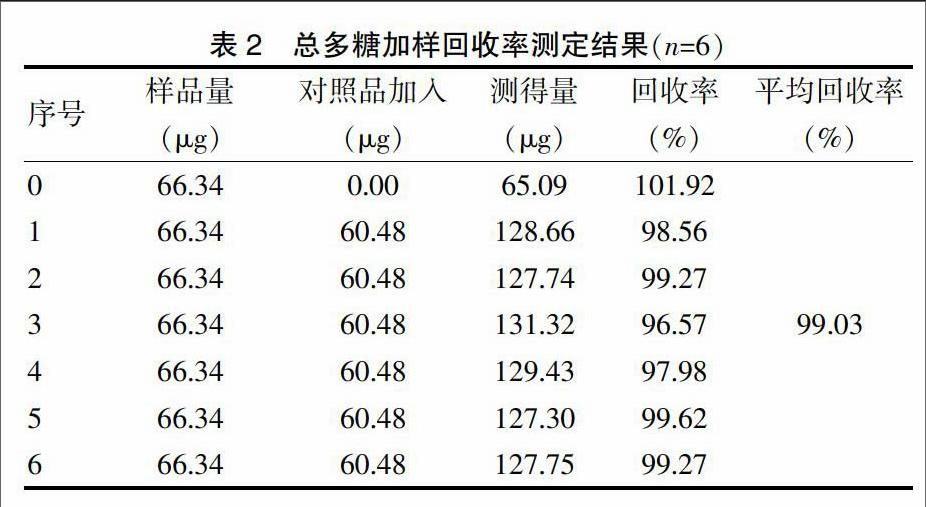
2.3.7 回收率测定 采用标准添加法测定回收率。取已知含量的样品供试液7份,每份1 mL,置于10 mL具塞试管中,第一份作为空白回收,其余6份分别准确加入浓度为60.048 μg/mL的无水葡萄糖苷对照品溶液1 mL,制备供试液,摇匀,按照标准曲线项下自“加入新鲜配制的5%苯酚试剂”起,依法测定吸收度。提取液中总多糖平均回收率为99.03%,RSD值为1.01%(n=6),表明本方法的回收率良好,准确度高。见表2。
2.4 出膏率的测定
精密吸取各提取液100 mL,置已干燥至恒重的蒸发皿中,水浴蒸干,于105℃烘内干燥至恒重,至干燥器中冷却30 min,迅速精密称定重量,计算出膏率。
2.5 正交试验优选最佳水提工艺
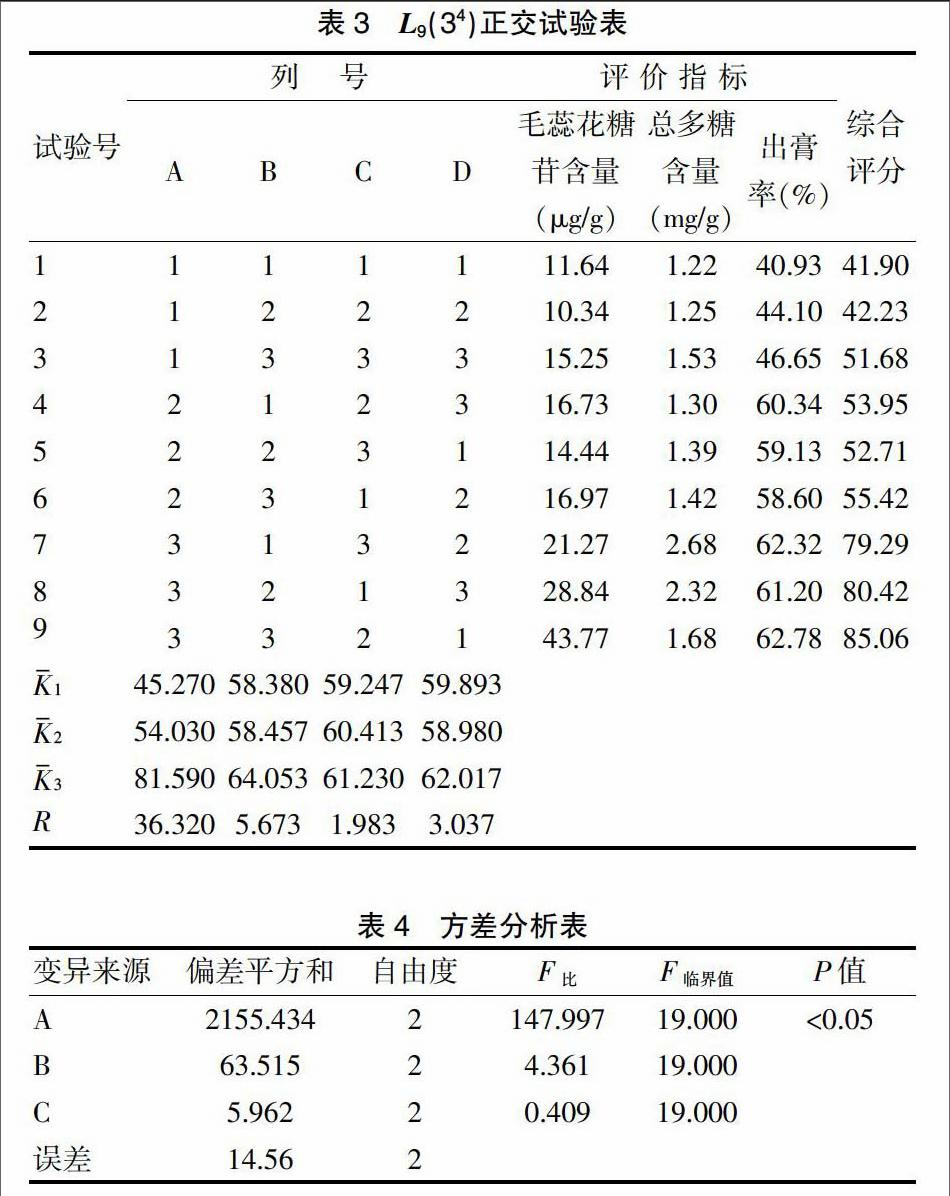
在前期单因素试验的基础上,按处方比例称取复方建肾片水提药材。按2.1中因素水平的设置进行L9(34)正交试验,提取液合并,滤过,滤液定容至2000 mL,分别测定毛蕊花糖苷、总多糖含量和出膏率。结果见表3~4。
由表3直观分析结果可知:各因素对试验结果的影响程度为提取次数>提取时间>加水倍量,各因素的最佳水平为A3B3C3。由表4方差分析结果表明,各因素对试验结果的影响程度依次为:提取次数>提取时间>加水倍量,提取次数对试验结果比较,差异有统计学意义(P < 0.05),A3优于A2和A1。而提取时间和加水倍量对试验结果比较,差异无统计学意义(P > 0.05)。结合单因素和生产成本综合考虑,确定最佳提取工艺为A3B1C1,即加水量为10倍,提取时间为1.5 h,提取次数为3次。以上结果说明,L9(34)正交表的9次试验中并没有优选工艺,因此还需要对优选工艺进行验证试验。称取3份1/4处方比例,结合优选的提出参数A3B1C1进行验证试验,毛蕊花糖苷、总多糖及出膏率含量数据较稳定,且出膏率和含量均较高。因此,我们认为该工艺合理、稳定。故确定A3B1C1为最佳工艺,即药材加水煎煮3次,每次10倍量,煎煮1.5 h。见表6。
3 讨论
肉苁蓉为复方健肾片的君药,大量研究表明,肉苁蓉有雌激素作用,肉苁蓉提取物能通过降低雌二醇量,升高促性腺激素和睾酮水平,从而发挥补肾助阳作用[3]。肉苁蓉由苯乙醇苷类、环烯醚萜类、挥发性成分和多糖等多种化学成分组成的,而苯乙醇总苷是肉苁蓉中的主要活性成分[4],而毛蕊花糖苷是肉苁蓉苯乙醇总苷类代表性化合物,研究报道毛蕊花糖苷能增加包皮腺和提肛肌的重量,为肉苁蓉雄性激素样作用的主要活性成分之一[5]。有研究报道,肉苁蓉中松果菊苷和毛蕊花糖苷都能结合雌激素受体 ERα和ERβ,可增强雌激素应答元件(ERE) 的荧光素酶活性、从而发挥雌激素作用[6]。毛蕊花糖苷还能显著缩短“肾阳虚”模型小鼠阴茎勃起潜伏期,可增加精子数量,提高性器官脏器系数,从而改善睾丸形态结构[7]。综上所述,毛蕊花糖苷文献报道的药理作用与本方功能主治相一致。现代研究表明,白术[8-9]、生地黄[10-11]、枸杞子[12-13]、杜仲[14-15]、肉苁蓉[4]等药材均含有多糖类成分组成学成分。研究报道,肉苁蓉多糖能显著提高东莨菪碱导致学习记忆障碍模型小鼠突触素(SYP)、促进相关蛋白43(GAP-43)的表达,可增多海马区突触数量,增强突触的可塑性,可以达到缓解学习障碍表现的目的[16]。白术水溶性多糖能刺激小鼠产生特异性IgG类抗体和非特异性交叉抗体,推测白术多糖可能是一种特异性免疫调节剂[17]。现代研究表明枸杞子以枸杞多糖(LBP)为主[18],枸杞多糖把血清TC、TG、LDL、FBG、FINS 、血清Cr 等明显降低,可明显减少肾脏LDL与OX-LDL[19],对肥胖大鼠肾脏有一定的保护作用。从已有研究报道得知,杜仲树皮中分离的多糖eucomman A(97)和eucomman B(98),都能明显增强网状内皮系统的活性,从而增强机体非特异性免疫功能[14,20]。
综上所述,肉苁蓉、白术、生地黄、枸杞子、杜仲等药材的多糖类成分,都具有与本方功能主治相关的药理作用。因此,在这个复方中以有效成分毛蕊花糖苷和总多糖含量及出膏率作为评价指标。
本制剂的水煎部分由肉苁蓉、白术、生地黄、枸杞子、杜仲等八种药材组成,此煎煮工艺研究是保障复方健肾片安全有效和质量控制的重要环节,故本研究以有效成分毛蕊花糖苷和总多糖含量及出膏率作为评价指标,通过正交设计法对复方健肾片的水提取工艺进行了优选。通过实验结果,本着节约能源、降低成本的原则,即将药材加水煎煮3次,每次1.5 h,每次加水量为药材量的10倍。
[参考文献]
[1] 罗海燕,申雨薇,毛彩霓,等.正交实验法优选海杞咀嚼片的提取工艺[J].工程技术,2016,35(4):92-95.
[2] 国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2015.
[3] 马建玲,陶大勇.肉苁蓉提取物对雄性小鼠性激素分泌的影响[J].中兽医医药杂志,2014(4):43-45.
[4] 胡佳琦,冯佳媛.肉苁蓉的化学成分和药理作用[J].中医临床研究,2012,4(15):26-28.
[5] 宋志宏,雷丽,屠鹏飞.肉灰蓉属植物的药理活性研究进展[J].中草药,2003,34(9):16-18.
[6] 王琳琳,李薇,宋新波,等.肉苁蓉中松果菊苷和毛蕊花糖苷的植物雌激素活性研究[J].天然产物研究与开发,2015,26(3):377-380.
[7] 马晶晶,赵帆,孙云.类叶升麻昔对肾阳虚小鼠补肾壮阳作用的研究[J].扬州大学学报:农业与生命科学版,2009, 30(1):22-25.
[8] 黄海英.白术活性成分的提取、纯化及功能性研究[D].南昌:南昌大学生命科学学院,2006.
[9] 董凤彩.白术不同化学成分的药理作用[J].中医临床研究,2015,14(7):28-29.
[10] 李建军,李静云,王莹,等.地黄药用研究概述[J].生物学教学,2013,38(3):4-6.
[11] 付国辉,杜鑫.地黄化学成分及药理作用研究进展[J].中国医药科学,2015,5(15):39-41.
[12] 如克亚·加帕尔,孙玉敬,等.枸杞植物化学成分及其生物活性的研究进展[J].中国食品学报,2013,16(8):161-172.
[13] 滕俊,袁佳,叶莎莎.枸杞子化学成分及药理作用相关性概述[J].海峡药学,2014,26(6):36-37.
[14] Gonda R,Tomoda M,Shimizu N,et al. An acidic polysaccharide having activity on the reticuloendothe-lial system from the bark of Eucommia ulmoides [J]. Chem Pharm Bull,1990,38(7):1966-1969.
[15] 冯晗,周宏灏,欧阳冬生.杜仲化学成分及药理作用研究进展[J].中国临床药理学与治疗学,2015,20(6):713-720.
[16] 尹若熙,李刚,俞腾飞,等.肉苁蓉多糖对东莨菪碱所致学习记忆障碍模型小鼠在突触可塑性方面的保护作用[J].中国药理学通报,2014,30(6):801-807.
[17] 孙文平,李发胜,侯殿东,等.当归、白术、制白附子多糖对小鼠免疫调节作用的影响[J].中国中医药信息杂志,2008,15(7):37-38.
[18] 陈立格.枸杞子的药理作用和临床应用价值分析[J].中医中药,2015,15(1):92.
[19] 陈武,马卫成,徐锦龙,等.畅枸杞多糖对肥胖大鼠肾脏的保护作用及机制的初步研究[J].中华中医药学刊,2013, 31(2):397-398.
[20] Tomoda M,Gonda R,Shimizu N,et al. A reticuloendothe-lial system-activating glycan from the barks of Eucommia ulmoides [J]. Phytochemistry,1990,29(10):3091-3094.
