长波紫外线对人黑素瘤细胞中视蛋白3的表达及细胞增殖的影响*
2024-03-13张玉蕾曾雯张伟董仙冯江龙靳姝琦罗欢欢刘婷陆洪光
张玉蕾, 曾雯, 张伟, 董仙, 冯江龙, 靳姝琦, 罗欢欢, 刘婷,陆洪光***
(1.贵州医科大学 临床医学院 皮肤病与性病学教研室, 贵州 贵阳 550004; 2.贵州医科大学附属医院 皮肤科, 贵州 贵阳 550004; 3.贵州医科大学附属医院 病理科, 贵州 贵阳 550004)
恶性黑色素瘤是一种具有高度侵袭性的皮肤肿瘤[1],也是致死率最高的皮肤恶性肿瘤[1]。从2008—2018年全球恶性黑素瘤发病率增加了44%,死亡率上升了32%[2-3],2018年全球共有60 712人死于恶性黑素瘤[2]。目前认为恶性黑素瘤来源于失控的黑色素细胞增殖[1]。既往研究已证实,遗传易感基因与环境暴露因素的相互作用是导致恶性黑素瘤发生、发展的关键因素,其中长期的紫外线暴露是诱发恶性黑素瘤的最重要原因[4]。目前认为,60%~70%的恶性黑色素瘤是由紫外线照射所致[4],长波紫外线(ultraviolet A, UVA)和短波紫外线(ultraviolet B, UVB)在恶性黑素瘤的发生中发挥了重要的作用[5],但到达地球表面的紫外线中UVA和UVB分别占90%~95%和5%~10%,紫外线诱发恶性黑素瘤主要通过直接和间接的脱氧核糖核酸(DNA)损伤所致[5-6]。UVA是否诱导间接DNA损伤发生的关键在于细胞能否感受UVA并及时转换为热能[4],真黑素可以将吸收的99.9%UVA转化为热能,从而避免DNA损伤发生[5],而UVA必须首先与内源性光敏剂(如卟啉、黑色素)反应,进而产生羟自由基和游离氧[7]。然而,这些光敏感分子的UVA吸收光谱是不同的[7],因此在UVA诱导恶性黑素瘤的发病过程中,感受UVA的细胞光敏感分子和蛋白发挥了关键的作用。细胞增殖是恶性黑素瘤的一个主要风险因素[8],在恶性黑素瘤的发生、发展及侵袭过程中发挥了关键的作用。UVA通过诱导癌基因包括B-Raf原癌基因,丝氨酸/苏氨酸激酶(B-Raf proto-oncogene, serine/threonine kinase,BRAF)、神经母细胞瘤病毒癌基因 RAS 同系物(neuroblastoma RAS viral oncogene homolog, NRAS)、细胞周期蛋白依赖性激酶抑制因子 2A(cyclin dependent kinase inhibitor 2A,CDKN2A)等的突变、活性氧(ROS)产生及光老化相关基质金属蛋白酶(MMP)的表达[9-10],促进细胞转录、翻译和细胞分裂[8],从而促进黑素瘤细胞的增殖和侵袭。细胞如何感受UVA,启动黑素瘤细胞的增殖,目前还有待进一步的研究。视蛋白3(opsin 3, OPN3)是人成纤维细胞感应UVA的光敏蛋白[11],参与肝癌细胞的耐药[12],介导蓝光诱导的结肠癌细胞自噬[13];既往研究报道证实,OPN3的表达与皮肤黑色素瘤及其他肿瘤发生和临床预后之间存在一定关联[14-15]。然而,OPN3是否介导UVA诱导的黑素瘤细胞增殖作用,迄今仍不清楚,本文拟检测长波紫外线诱导OPN3在人黑素瘤细胞系(A375细胞和MV3细胞)的表达和对细胞增殖的影响,探讨OPN3调控人黑素瘤细胞增殖的分子机制。
1 材料与方法
1.1 实验材料
1.1.1细胞株 人黑素瘤细胞系A375(货号BNCC352140)及人黑素瘤细胞系MV3细胞系(货号BNCC339913)购自北京北纳创联生物技术研究院,经短串联重复序列测序分析鉴定,A375及MV3 细胞不存在交叉污染,均为单一细胞系。
1.1.3主要试剂 抗体:兔抗人OPN3(货号DF4877,中国affinity公司),兔抗人Hippo信号通路相关大肿瘤抑制激酶 1(large tumor suppressor 1,LATS1;货号C66B5,美国Cell Signaling Technology公司),兔抗人磷酸化Yes相关蛋白(phospho-yes-associated protein, p-YAP;货号D9W2I,美国Cell Signaling Technology公司),兔抗人ras 同系物家族成员 A(ras homolog family member A,RhoA;货号67B9,美国Cell Signaling Technology公司),鼠抗人Yes相关蛋白(yes-associated protein, YAP;货号sc-101199,美国Santa Cruz Biotechnology公司),鼠抗人GAPDH(货号60004-1-Ig,中国武汉三鹰生物技术有限公司),辣根过氧化物酶(horseradish peroxidase, HRP)标记的山羊抗鼠单克隆二抗(货号ab6789,英国Abcam公司)以及 HRP标记的山羊抗兔单克隆二抗(货号ab6721,英国Abcam公司)。主要试剂盒:TRIzol(货号15596026,美国Invitrogen公司),FastKing 一步法除基因组 cDNA 第一链合成预混试剂(货号KR118,中国天根生化科技有限公司)、Talent荧光定量检测试剂盒(货号FP209,中国天根生化科技有限公司,);BeyoClickTM5-乙炔基-2′脱氧尿嘧啶核苷(5-ethynyl-2′-deoxyuridine,EdU)-594细胞增殖检测试剂盒(货号C0078S,中国上海碧云天生物技术有限公司),细胞增殖与活性检测试剂(cell counting kit-8,CCK-8)试剂盒(货号GK10001,中国GLPBIO公司),PierceTMECL Western Blotting Substrate(货号32106,美国赛默飞公司)。其他试剂:高糖杜氏改良Eagle培养基(dulbecco's modified eagle medium,DMEM;美国 gibco公司,货号C11995500BT)、胎牛血清(货号10099141C,美国 Gibco 公司);青链霉素混合液(100×;货号P1400,北京索莱宝有限公司)、苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)(100 mmol/L;货号P0100,北京索莱宝有限公司)、高效放射免疫沉淀法缓冲液(radioimmunoprecipitation assay buffer,RIPA;货号P0010,北京索莱宝公司)、免疫印迹法一抗稀释液(货号P0023A-100 mL,上海碧云天公司)、免疫印迹法二抗稀释液(货号P0023D-100 mL,上海碧云天公司);OPN1、OPN2、OPN3、OPN4、OPN5、GAPDH引物(上海生工生物工程股份有限公司)序列见表1。

表1 实时荧光定量PCR(real time quantitative PCR,RT-qPCR)序列Tab.1 RT-qPCR sequences
1.2 研究方法
1.2.1细胞培养 使用含10%胎牛血清及1%青链霉素的高糖DMEM培养基在37 ℃,5%CO2培养箱中培养A375、MV3细胞,隔日换液,细胞培养至80%~90%密度时使用含0.25%胰酶及0.01% EDTA的D-Hanks缓冲液消化传代,取对数生长期细胞进行实验。
1.2.2日光模拟器模拟UVA照射 将处于对数生长期的A375、MV3细胞使用胰酶消化铺板,待细胞贴壁后进行日光模拟器模拟UVA进行照射,将细胞培养皿或培养板中的完全DMEM吸丢后换入预热磷酸盐缓冲液(PBS),使用光功率计测量照射强度,根据所需照射剂量计算照射时间(min)=[照射剂量(J/m2)]/(600×照射强度)。根据照射剂量将细胞分为Control组(0 J/m2)、UVA照射组(包括0.75×104、1.5×104、3×104、6×104及9×104J/m2)照射距离10 cm,电压220 V,电流40 A。
1.2.3实时荧光定量 PCR(RT-qPCR)检测 A375、MV3细胞OPN1、OPN2、OPN3、OPN4、OPN5 mRNA表达水平 TRIzol 法提取各组细胞总RNA,根据逆转录试剂盒说明书以42 ℃ 15 min,95℃ 3 min逆转录成cDNA,以cDNA 为模板进行RT-qPCR实验。反应体系:SYBR Green Select Master Mix 6.25 μL,正反向引物各 0.4 μL,cDNA 1 μL,双蒸水 4.45 μL。荧光定量PCR程序:95 ℃ 3 min;95 ℃ 5 s,55 ℃ 15 s,共40个循坏;绘制扩增曲线及溶解曲线。mRNA相对表达水平=2-ΔCT,以GAPDH为内参计算基因相对表达水平。
1.2.4EdU实验检测A375、MV3细胞增殖情况 将A375、MV3细胞按3×103个细胞/孔接种于96孔板,24 h待细胞贴壁后吸去培养基换磷酸盐缓冲液(PBS),然后根据照射强度分组分别给予细胞0.75×104、1.5×104、3×104、6×104及9×104J/m2UVA辐照,辐照后将PBS更换为完全DMEM培养基继续培养48 h后,每孔加入20 μmol/L EdU工作液,然后继续培养2 h后,吸去培养基,PBS冲洗2次后用4%多聚甲醛固定细胞,去除固定液,每孔用100 μL含3% 牛血清白蛋白的PBS洗涤液洗涤细胞3次,每次5 min,去除洗涤液,每孔用100 μL含0.3% Triton-X 100的PBS室温孵育15 min,去除通透液,每孔用洗涤液洗涤细胞3次,每次5 min,每孔加入Click反应液50 μL室温避光孵育30 min,每孔用100 μL洗涤液洗涤细胞3次,每次5 min,Hoechst 33342 按1∶1 000稀释,每孔50 μL,室温避光孵育10 min,每孔用100 μL洗涤液洗涤细胞3次,每次5 min,后于荧光显微镜594 nm激发光下观察及拍照,使用Image J软件计算阳性细胞率。将过表达及沉默OPN3的A375、MV3细胞按6×103个细胞/孔接种于24孔板,待24 h细胞贴壁后吸去培养基换PBS冲洗2次,用4%多聚甲醛固定细胞,按上述方法进行后续操作。Merge图像为红色EdU阳性细胞及蓝色Hoechst 33342染色细胞融合形成。计算细胞增殖率:红色为EdU阳性细胞,蓝色为Hoechst 33342染色细胞,增殖率为EdU阳性细胞与Hoechst 33342染色细胞的比率。
1.2.5CCK-8法检测A375、MV3细胞增殖情况 将A375、MV3细胞按5×103个细胞/孔接种于96孔板,待24 h后细胞贴壁吸去培养基换PBS,然后进行细胞UVA辐照,剂量分别为0.75×104、1.5×104、3×104、6×104及9×104J/m2,辐照后将PBS更换为完全DMEM培养基继续培养48 h后,每孔加入10 μL CCK-8 溶液,37 ℃ 5%CO2培养箱继续培养2 h后,将样本置入酶标仪中测量 450 nm 处的吸光度。将过表达及沉默OPN3的A375、MV3细胞按5×103个细胞/孔接种于96孔板,接种后0、24、48及72 h分别进行CCK-8法检测,按上述方法进行后续操作。计算细胞存活率(%)= [(实验孔吸光度-空白孔吸光度)/(对照孔吸光度-空白孔吸光度)]×100。
1.2.6免疫印迹法(Western blot )检测LATS1、p-YAP、YAP、RhoA蛋白表达 用含 1 mmol/L PMSF 的RIPA裂解液冰上裂解细胞,在旋涡振荡器上反复充分振荡,冰上裂解30 min,4 ℃ 12 000 r/min离心15 min分离上清液至1.5 mL EP管中,于NanoDropTM2000/2000c分光光度计测蛋白浓度后,将30 μg蛋白样品加入5×变性上样缓冲液于100 ℃变性10 min。将蛋白样品进行10%浓缩胶、 8%分离胶 SDS-PAGE 凝胶电泳并转移到 PVDF 膜上,5%脱脂奶粉TBST缓冲液室温封闭1 h后用一抗工作液(OPN3、LATS1、p-YAP、YAP、RhoA为1∶1 000稀释,GAPDH为1∶10 000稀释)4 ℃摇床慢摇孵育过夜,TBST洗膜4次,每次5 min,然后用相应的兔鼠二抗工作液室温下摇床孵育 1 h,TBST洗膜6次,每次5 min。在PVDF膜上孵育发光底物,在bio-rad曝光成像系统检测目的条带,通过image J软件分析各目的蛋白灰度值进行统计分析。目的蛋白相对表达水平=目的蛋白分析灰度值/GAPDH分析灰度值。
1.2.7小干扰RNA( small interfering RNA,siRNA) 转染 特异性siRNA为上海权阳生物科技有限公司合成,siRNA-OPN3序列为5′-GUCACCUUUACCUUCGUGUTT-3′,对照序列为5′-UUCUCCGAACGUGUCA CGUTT-3′。SiRNA细胞转染:将处于对数生长期的A375、MV3细胞以 3×104细胞/孔接种在 6 孔板中,次日当细胞贴壁并处于对数生长期时,使用 Lipofectamine 2000 转染试剂协助siRNA转染细胞,使用siRNA-NC和siRNA-OPN3(终浓度为30 nmol/L)将细胞分为si-NC组和si-OPN3组,其中si-NC组为使用siRNA-NC转染的对照组,si-OPN3组为使用siRNA-OPN3的沉默OPN3组。在无血清的Opti-MEM 培养基中进行转染后 6 h,将细胞培养基更改为含血清的培养基继续培养 48 h,收取细胞进行Western Blot验证OPN3是否成功沉默。
1.2.8慢病毒感染 OPN3特异性沉默慢病毒hU6-MCS-CBh-gcGFP-IRES-puromycin及过表达慢病毒Ubi-MCS-3FLAG-SV40-EGFP-IRES-puromycin由上海吉凯基因医学科技股份有限公司合成。将MV3细胞按3×105个细胞/孔接种于12孔板内,12~16 h细胞进入对数生长期后进行分别加入过表达及沉默OPN3病毒液,根据MOI=10,计算加入病毒病毒体积(μL)=MOI×细胞数/病毒滴度×1 000,LV-NC、LV-RNAi-NC作为对照,过表达及沉默OPN3组分别为LV-OPN3组和LV-RNAi-OPN3组。转染48 h后加入10 mg/ L嘌呤霉素继续培养筛选稳定过表达及沉默黑素瘤细胞,于荧光显微镜下90%细胞可见绿色荧光后收取细胞进行Western Blot检测OPN3的表达变化。
1.2.9筛选关键通路 构建过表达及沉默OPN3的MV3细胞系,通过qRT-PCR验证后将样本进行RNA-seq检测,将过表达及沉默OPN3的交集差异基因的检测结果进入David网站[DAVID Functional Annotation Bioinformatics Microarray Analysis (ncifcrf.gov)]进行KEGG数据库分析,筛选P-adjust<0.05富集出相关信号通路进行后续验证。
1.3 统计学分析
所有数据采用GraphPad Prism 9.3软件进行统计分析,所有数据以均数表示,每组组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 UVA可诱导黑素瘤细胞发生增殖
将MV3、A375细胞暴露于0.75×104、1.5×104、3×104、6×104及9×104J/m2UVA辐射下48 h进行EdU实验,结果如图1所示。MV3细胞在1.5 ×104J/m2和3×104J/m2UVA辐照下细胞增殖率高于Control组,在6 ×104J/m2和9 ×104J/m2UVA辐照下细胞增殖率低于Control组,差异有统计学意义(P<0.05);在0.75×104J/m2UVA辐照下,细胞增殖率与Control组比较,差异无统计学意义(P>0.05)。A375细胞在0.75×104、1.5×104及3×104J/m2UVA辐照下,细胞增殖率高于对照,在9×104J/m2UVA辐照下细胞增殖率低于Control组,差异有统计学意义(P<0.05);在6×104J/m2UVA辐照下细胞增殖率与Control组比较,差异无统计学意义(P>0.05)。CCK-8法结果显示,MV3细胞在1.5×104J/m2和3×104J/m2UVA照射后细胞存活率高于Control组,差异有统计学意义(P<0.05);A375细胞在1.5×104J/m2UVA照射后细胞存活率高于Control组,差异有统计学意义(P<0.05)。见图1。提示黑素瘤细胞在适当UVA剂量照射后可发生增殖。
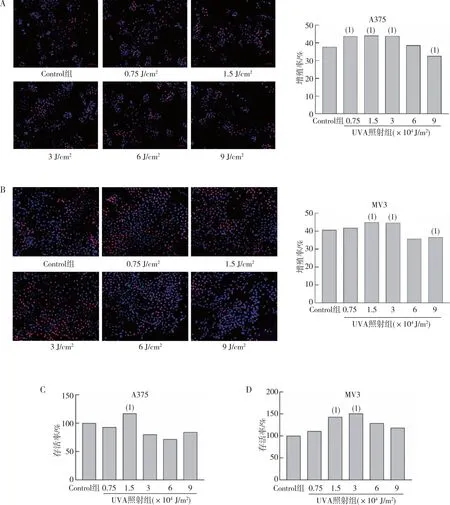
注:A、B分别为EdU检测下不同剂量UVA照射后的细胞增殖情况和各组细胞增殖率统计,图中红色为EdU阳性细胞,蓝色为Hoechst 33342染色细胞;C、D分别为CCK-8测定法检测下不同UVA剂量照射后48 h的细胞存活率统计。(1)与Control组比较,P<0.05。
2.2 UVA促进黑素瘤细胞中OPN3的表达
qRT-PCR检测结果(图2)发现,在A375、MV3细胞系中OPN3 mRNA表达水平明显高于其他OPN,差异有统计学意义(P<0. 05);MV3细胞在3×104J/m2照射剂量下OPN3表达增多(P<0.05),A375细胞在1.5×104J/m2和3×104J/m2UVA照射剂量下OPN3表达也增多,差异有统计学意义(P<0.05)。提提示OPN3在黑素瘤细胞中可能起重要作用,可能作为紫外线引起的黑素瘤细胞增殖的光感受器。
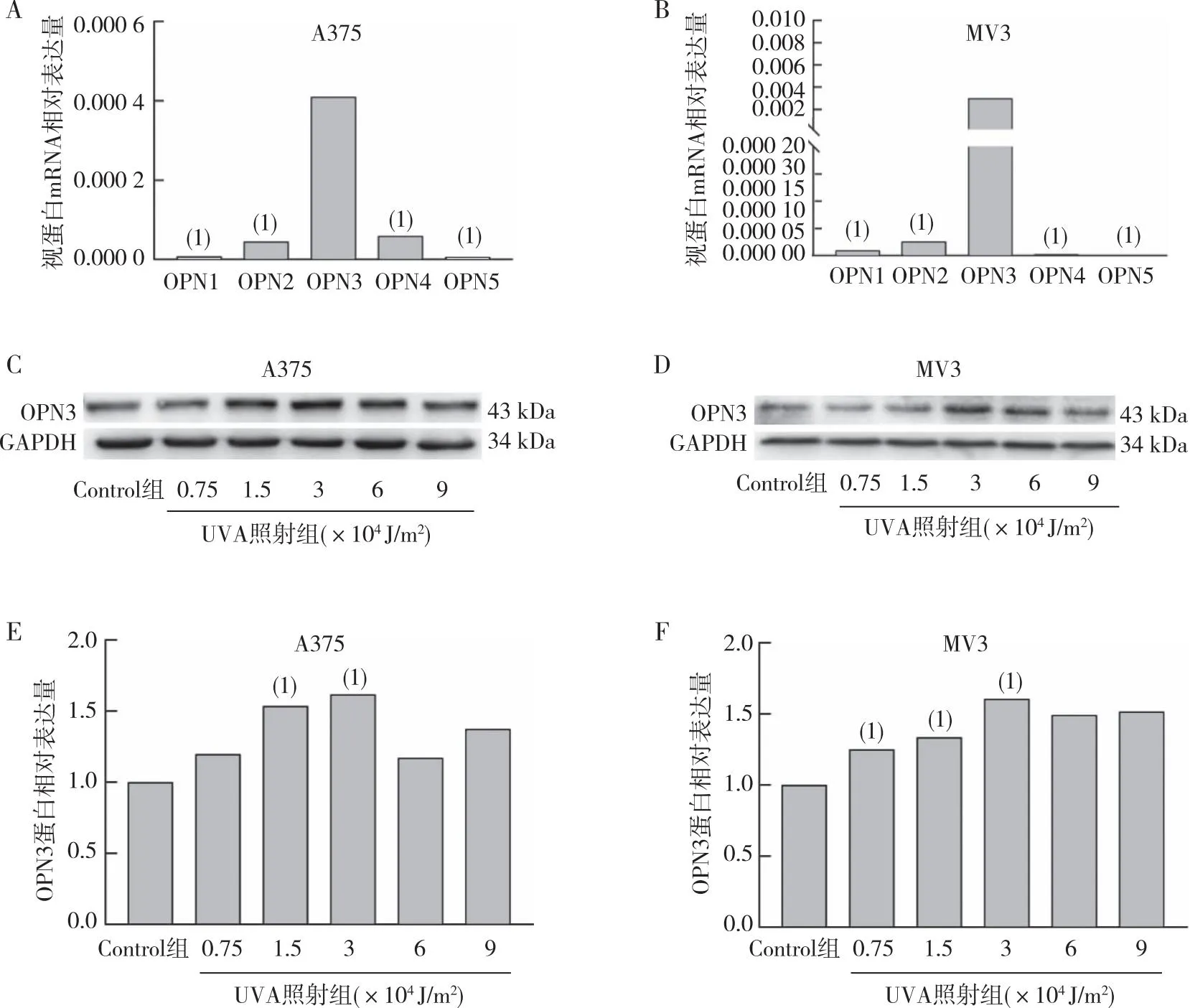
注:A、B分别为A375、MV3细胞中OPN1、OPN2、OPN3、OPN4及OPN5 mRNA相对表达量统计,(1)与OPN3相比,P<0.05;C、D分别为不同剂量UVA照射后细胞中OPN3蛋白的表达情况;E、F不同剂量UVA照射后细胞中OPN3蛋白的表达统计,(1)与Control组相比,P<0.05。
2.3 OPN3影响黑素瘤细胞的增殖功能
使用慢病毒感染构建过表达及沉默OPN3的稳转MV3、A375细胞系,过表达及沉默OPN3后进行qRT-PCR及Western blot实验,结果显示如图3所示,OPN3 mRNA和蛋白表达水平 与Control组比较有明显差异,差异有统计学意义(P<0.05);提示成功过表达及沉默OPN3。过表达及沉默OPN3的稳转株分别采用EdU实验及CCK-8法检测细胞的增殖率,可发现在EdU及CCK-8实验中过表达OPN3的细胞株增殖率高于Control组,沉默OPN3的细胞株增殖率低于Control组,差异有统计学意义(P<0.05),见图3。提示OPN3过表达及沉默可影响黑素瘤细胞的增殖功能。

注:A为通过RT-qPCR检测OPN3 mRNA表达的过表达和沉默,B、C、D为蛋白质印迹法检测OPN3蛋白表达的过表达和沉默;E、F为CCK-8测定法检测过表达和沉默OPN3 后24、48及72 h的OD值;G、H分别为EdU实验检测下OPN3过表达和沉默后的增殖情况及对应增殖率统计;(1) 与LV-NC组比较,P<0.05;(2)与Si-NC组比较,P<0.05。
2.4 UVA通过OPN3引起细胞增殖
将成功沉默OPN3的A375、MV3细胞予3×104J/m2UVA照射后通过Western blot 检测OPN3蛋白表达水平,发现在MV3细胞中LV-RNAi-OPN3组在UVA照射后OPN3蛋白表达水平增高,差异有统计学意义(P<0.05)。进行EdU实验及CCK-8法检测细胞的增殖率及存活率,发现A375、MV3细胞中LV-RNAi-OPN3组增殖率及存活率低于LV-RNAi-NC组细胞,差异有统计学意义(P<0.05);与LV-RNAi-NC组比较,LV-RNAi-NC+UVA 3×104J/m2组细胞增殖率及存活率增高,差异有统计学意义(P<0.05);与LV-RNAi-OPN3组比较,LV-RNAi-OPN3+UVA 3×104J/m2组细胞增殖率及存活率增高,差异有统计学意义(P<0.05),LV-RNAi-OPN3+UVA 3×104J/m2组增殖率及存活率低于LV-RNAi-NC+UVA 3×104J/m2组,差异有统计学意义(P<0.05)。见图4。提示UVA通过OPN3引起细胞增殖。
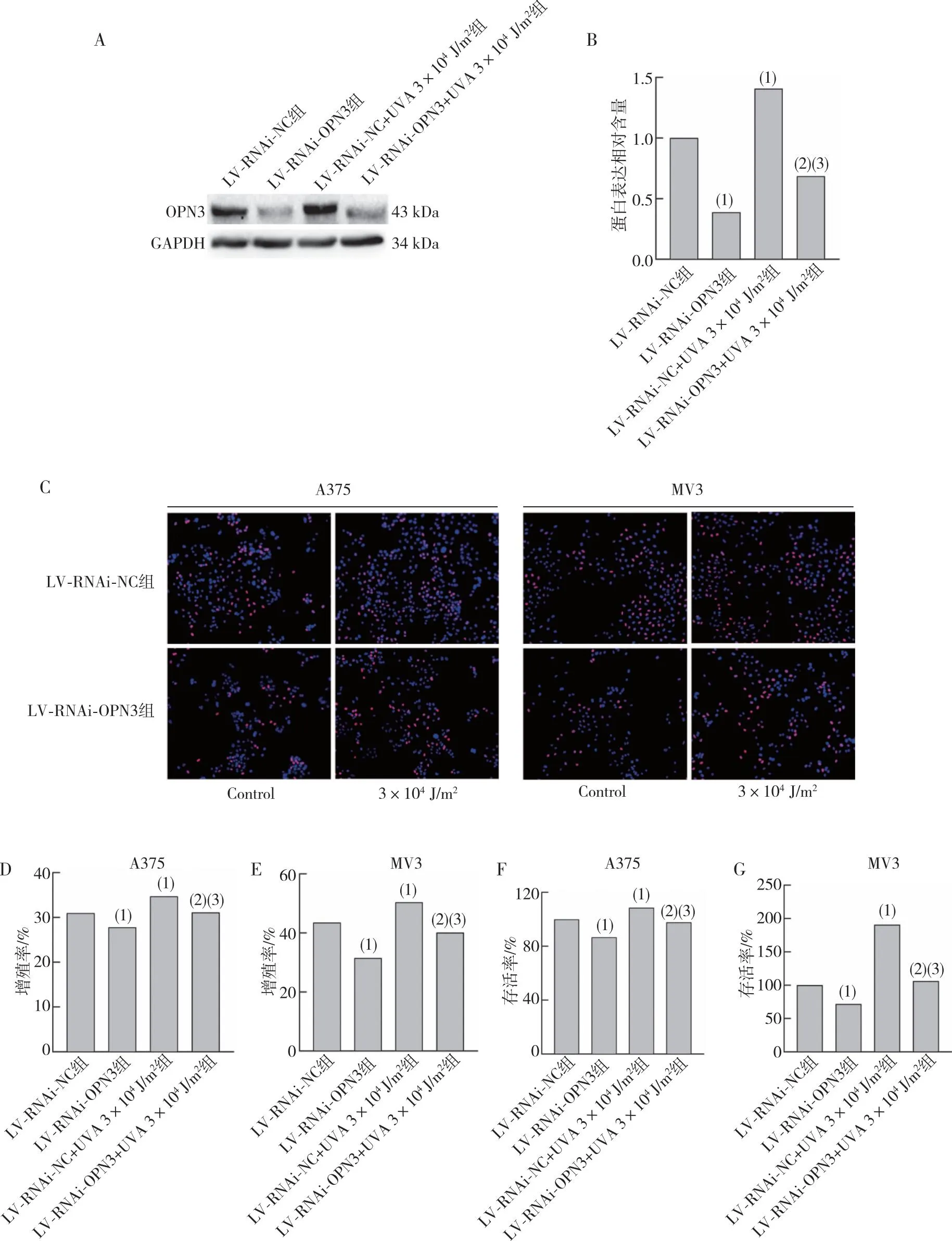
注:A、B为沉默OPN3的MV3细胞经过3×104 J/m2 UVA照射后OPN3蛋白表达水平及统计结果,C、D、E为A375、MV3细胞通过EdU实验检测沉默OPN3组细胞在经过3×104 J/m2 UVA照射后照射后的细胞增殖率及统计结果,F、G为使用CCK-8法检测沉默OPN3组细胞在经过3×104 J/m2 UVA照射后的细胞存活率;(1) 与LV-RNAi-NC组比较,P<0.05;(2)与LV-RNAi-OPN3组比较,P<0.05;(3)与LV-RNAi-NC+UVA 3×104 J/m2组比较,P<0.05。
2.5 OPN3可影响Hippo通路调控细胞增殖
将MV3细胞分别过表达及沉默OPN3后进行RNA-seq测序,将数据进行交集分析可得到141个差异基因,将差异基因进入David网站进行KEGG分析,筛选P-adjust<0.05可以发现过表达及沉默差异基因富集出9条信号通路,其中-Log10(FDR)值最高的为Hippo信号通路,提示OPN3可能通过Hippo信号通路发挥作用。随后分别在MV3、A375两株细胞系中使用siRNA沉默OPN3,通过 Western blot 检测了Hippo信号通路相关蛋白LATS1、p-YAP、YAP、RhoA的蛋白表达水平,与si-NC组相比,Si-OPN3 组中LATS1表达水平增高,p-YAP、RhoA表达水平降低,差异有统计学意义(P<0.05)。见图5。
3 讨论
既往研究表明紫外线辐射对黑色素瘤的发生、发展有着重要作用[16-17]。尽管长期以来人们都知道暴露于紫外线辐射是导致黑素瘤发生的最常见的原因,但紫外线辐射在黑素瘤进展中的确切作用仍然知之甚少,在分子、细胞及微环境水平上的研究还不够[18]。既往研究证实,UVA主要通过细胞黏附丧失[19-21]、细胞外基质降解[23]以及皮肤微环境改变[16]等方式促进黑色素瘤的进展。OPNs是G蛋白偶联受体超家族中的一员,最早在眼睛中被发现,其在视觉过程中的光转导中发挥关键作用[24]。已经发现 OPN3 与皮肤黑色素瘤、肺癌、肝细胞癌的肿瘤发生和临床预后之间密切相关[12-15]。近年研究也发现,OPN3可作为光感受器感受UVA诱导的人真皮成纤维细胞光老化[11],并且UVA可诱导黑素瘤细胞及结肠癌细胞在适当剂量下发生增殖[22],在本研究中也观察到紫外线可诱导黑素瘤细胞发生增殖,但感受UVA引起细胞增殖的光感受器尚未报道。
黑素瘤转移的两个重要特征是增殖和侵袭[23]。Pastila等[21]表明,单次8 J/cm2UVA可照射诱导小鼠黑色素瘤细胞钙黏蛋白E向钙黏蛋白N转换,导致其转移能力增强[21]。Kamenisch等[23]证实,UVA照射通过增加乳酸盐的生成直接上调黑素瘤细胞中的基质金属蛋白酶,从而增强黑素瘤的侵袭。Bald等[16]证明,紫外线照射损伤的角质形成细胞,从而激活中性粒细胞释放HMGB1,刺激黑色素瘤细胞向内皮细胞迁移和向血管浸润。本研究结果阐明OPN3 的转录表达水平和蛋白质表达水平均明显高于其他OPN,提示OPN3可能起重要作用。随后参考上述报道的UVA辐照剂量,在本实验中设置剂量梯度检测不同剂量下黑素瘤的增殖情况,发现在A375、MV3细胞中进行1.5及3 cm/J2的UVA辐照剂量后细胞出现增殖,并且OPN3表达明显增高,提示OPN3可能在UVA诱导的细胞增殖中起一定作用。
那么OPN3是否作为UVA光感受器直接参与黑素瘤细胞增殖过程有待进一步研究。既往研究证明,沉默OPN3的表达可影响人成纤维细胞、人血管内皮细胞的增殖功能[25-26];OPN3 的高表达与肢端雀斑样黑色素瘤的转移表型和预后不良有关,在此研究中来自同一患者的七个配对样本显示,OPN3表达随着从原发性到腹股沟淋巴结转移肢端雀斑黑色素瘤的进展而增加[14]。本研究通过过表达及沉默OPN3后可影响黑素瘤细胞的增殖能力,并且沉默OPN3后UVA引起细胞增殖的能力减弱。为进一步探讨OPN3调控黑素瘤细胞增殖的具体机制,通过过表达及沉默MV3细胞进行RNA-seq测序结果筛选出141个差异基因, KEGG分析筛选差异基因富集信号通路9条,其中最主要的是Hippo信号通路。既往研究表明,G蛋白偶联受体可以介导多种信号来调节Hippo 通路的活性[27]。本研究通过免疫印迹法检测沉默OPN3后Hippo信号通路相关蛋白的变化,发现RhoA降低、LATS1增加、磷酸化蛋白p-YAP降低、YAP降低。既往研究表明,G蛋白偶联受体可通过RhoA调节LATS激酶,从而调控YAP表达水平,YAP是Hippo通路下游关键的蛋白[28]。在小鼠中YAP的激活也会导致多种组织的过度增殖[29];YAP可促进黑色素瘤细胞侵袭和自发转移,是体外黑色素瘤细胞侵袭的必要条件和充分条件[30]。总而言之,本次研究发现,抑制OPN3可调控RhoA诱导LATS1表达增加从而导致YAP减少,然而OPN3具体如何调节RhoA、LATS1以及影响YAP激活还值得进一步研究。
综上所述,本研究提示在UVA照射A375和MV3细胞后OPN3蛋白表达水平明显升高,细胞增殖能力明显增强,而OPN3通过影响Hippo信号通路进而调节黑素瘤细胞的增殖功能, OPN3可能为黑素瘤的预防及治疗提供新的生物靶点和临床见解。
