过氧化物酶体增殖物激活受体γ对丙泊酚麻醉术后大鼠认知功能的影响*
2024-03-13陈筑梅黄淑花曾庆繁
陈筑梅, 黄淑花, 曾庆繁**
(1.贵州医科大学附属白云医院 麻醉科, 贵州 贵阳 550014; 2.贵州医科大学 麻醉学院, 贵州 贵阳 550001; 3.贵州医科大学附属医院 麻醉科, 贵州 贵阳 550001)
随着时代的进步和医疗技术的提高,越来越多的人愿意接受外科手术治疗,然而有些患者在接受手术与麻醉后会出现不同程度的认知功能改变,例如注意力不集中、记忆力下降、焦虑、语言理解能力下降及学习能力降低等[1]。这一系列的改变可认为是术后认知功能障碍(postoperative cognitive dysfunction,POCD)导致的,许多研究认为POCD的发生是多因素、多环节相互交叉作用所导致的,包括手术方式、手术体位、手术时间、患者基础情况、患者文化水平及麻醉方式等因素[2]。POCD与阿尔茨海默病(Alzheimer's disease,AD)的发病机制有着相似的病理基础,β-淀粉样蛋白(amyloid-β,Aβ)聚集形成的可溶性寡聚体和不溶性脑淀粉斑块被广泛认为是AD的潜在机制[3-4]。神经元中有一种微管相关蛋白(microtubule-associated protein,Tau),过度磷酸化Tau(phosphorylated Tau,P-Tau)可聚集为成对的螺旋状纤维,诱导神经元凋亡或死亡,导致神经功能紊乱,引发术后认知功能障碍[5]。近年研究表明,过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptors γ,PPARγ)有神经保护的作用,其水平与Aβ、Tau蛋白的聚集有着密切的联系[6]。吡格列酮是PPARγ激动剂,研究表明其有神经保护作用[7];在实验动物中长时间大剂量的使用丙泊酚麻醉会引起学习和记忆行为的损害,麻醉和手术创伤更有可能协同诱发POCD[8]。然而,关于提高PPARγ是否对丙泊酚麻醉手术后患者的认知功能障碍有保护作用,目前尚未有文献报道。因此,本研究采用丙泊酚麻醉诱导实施剖腹探查手术后的斯普拉格-道利(Sprague-Dawley,SD)大鼠,观察PPARγ水平对大鼠海马区Aβ的沉积和过度磷酸化Tau蛋白的影响,以及PPARγ激动剂吡格列酮和PPARγ抑制剂GW9662对术后神经功能的作用,为临床患者预防POCD提供新的方向。
1 材料与方法
1.1 实验材料
1.1.1动物来源 无特定病原体(specific pathogen free,SPF)级别健康雄性SD大鼠80只,18月龄,体质量(450±50)g,购自辽宁长生生物技术股份有限公司[SYXK(黔)2018-0001],于温度(23±1)℃、湿度(50±10)%的房间内正常饮食适应性喂养2周。
1.1.2主要药品 盐酸吡格列酮片(北京太洋药业股份有限公司),GW9662(上海芮晖化工科技有限公司),丙泊酚中长链脂肪乳注射液(奥地利Fresenius Kabi),生理盐水(贵州科伦药业有限公司),二甲基亚砜(dimethyl sulfoxide,DMSO;德国Amresco),盐酸利多卡因注射液(上海浦林州制药有限公司),复方利多卡因乳膏(同方药业集团有限公司)。
1.1.3主要试剂及仪器 Aβ和P-Tau蛋白酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测试剂盒(武汉赛培生物),PPARγ Western blot检测试剂盒(武汉伊莱瑞特生物),苏木精-伊红染色(hematoxylin-eosin staining,HE)试剂盒(博士德生物),4%水合氯醛和4%多聚甲醛(碧云天生物),75%酒精及碘伏(贵州鑫源生物)等;高速冷冻离心机(长沙湘仪),酶标仪(上海塞默生),Morriz水迷宫装置(上海吉良)。
1.2 研究方法
1.2.1分组及给药 80只SD大鼠随机均分为对照(C)组、吡格列酮(P)组、GW9662(G)组及生理盐水(N)组,连续处理5 d,各组给药方式如下:C组大鼠生理盐水10 mL/kg腹腔注射;P组大鼠吡格列酮溶解于生理盐水后,10 mg/kg腹腔注射;G组大鼠GW9662抑制剂100 mg溶解于DMSO 100 mL中,2 mg/kg腹腔注射;N组大鼠生理盐水10 mL/kg腹腔注射。
1.2.2丙泊酚麻醉手术 各组大鼠按“1.2.1”项下药物处理后第6天,P组、G组、N组SD大鼠常规注射药物后30 min,予丙泊酚75 mg/kg腹腔注射,待各组大鼠翻正反射消失后行剖腹探查术,麻醉时间2~3 h,每40 min追加丙泊酚100 mg/kg维持麻醉;期间观察各组大鼠呼吸、皮肤黏膜的颜色,切皮前以1%盐酸利多卡因注射液局部注射浸润切口,术后以利多卡因乳膏涂抹大鼠伤口镇痛,无菌纱布覆盖伤口。C组不进行麻醉和手术处理。
1.2.3ELISA检测海马区脑组织Aβ和P-Tau表达 取“1.2.1”项下术后24 h的各组大鼠8只,予4%水合氯醛腹腔注射,断头取海马区脑组织,加适量生理盐水捣碎,组织匀浆3 000 r/min离心10 min,取上清;设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μL;样本孔先加待测样本10 μL,再加样本稀释液40 μL;空白孔不加;除空白孔外,检测Aβ的标准品孔和样本孔中每孔加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的检测抗体100 μL,检测P-Tau的标准品孔和样本孔中每孔加入碱性磷酸酯酶标记的检测抗体100 μL,封板膜封住反应孔,37 ℃水浴锅或恒温箱温育60 min;弃液体,吸水纸上拍干,每孔加满洗涤液,静置1 min,甩去洗涤液,吸水纸拍干,反复洗板5次;Aβ检测孔中加入底物四甲替联苯胺50 μL、P-Tau检测孔中加入底物4-硝基酚磷酸盐50 μL,37 ℃避光孵育15 min;每孔加终止液50 μL,于450 nm波长处测定Aβ检测孔的光密度(optical density,OD)值,于400 nm波长处测定P-Tau检测孔的OD值。
1.2.4Western blot方法检测海马区脑组织PPARγ水平 取“1.2.3”项下的各组大鼠适量海马组织均浆,预冷放射免疫沉淀测定蛋白抽提试剂(radio-immunoprecipitation assay lysis buffer,RIPA),加蛋白酶抑制剂Protease inhibitor cocktail (roche体积比50∶1);5%牛血清蛋白缓冲液(bovine serum albumin-tris aminomethane hydrochloridel,BSA-TBST;NaCl,tween20)稀释一抗(稀释比例1∶1 000),4 ℃摇床孵育过夜;次日,洗膜;TBST洗3次,10 min/次;5%BSA-TBST稀释二抗,山羊抗兔,山羊抗鼠IgG(H+L)HRP 1∶10 000,室温孵育 40 min;TBST洗膜3次,10 min/次;化学发光试剂(electrochemiluminescence,ECL)滴加到膜的蛋白面,反应3 min;胶片曝光10 s~5 min(曝光时间随不同光强度而调整),显影2 min,定影;使用Gel Image ststem ver.4.00软件对图像提供灰度分析。
1.2.5HE染色观察大鼠海马体细胞形态 取“1.2.1”项下术后第5天的各组大鼠2只,予以4%水合氯醛腹腔注射,断头取脑,取完整海马区,制备海马体标本石蜡切片,HE染色,观察各组海马细胞变化情况[10]。
1.2.6术后认知功能评价 取“1.2.1”项下术后第7天的各组大鼠10只,采用Morris水迷宫实验(分为定位巡航实验和空间探索实验)测试术后认知功能情况。麻醉手术结束后,各组大鼠休息7 d后行Morris水迷宫实验,连续5 d,第1~4天为定位巡航实验,第5天为空间探索实验;定位巡航实验中逃逸潜伏期时间越长代表空间学习记忆能力越弱,时间越短代表空间学习记忆能力越强;第5天空间探索实验中,大鼠穿越目标平台次数越多、目标象限游动时间越长表示空间学习记忆能力越强[9]。
1.3 统计学分析

2 结果
2.1 海马区Aβ、P-Tau及PPARγ的表达
与C组比较,N组大鼠海马区Aβ、P-Tau表达水平增加(P<0.05);与N组比较,P组大鼠海马区Aβ、P-Tau表达水平减少(P<0.05),G组大鼠海马区Aβ沉积、P-Tau表达水平增加(P<0.05);与N组比较,P组大鼠海马区PPARγ表达增加(P<0.05),G组大鼠海马区PPARγ表达水平降低(P<0.05)。见图1和表1。

图1 各组大鼠海马区PPARγ蛋白的电泳Fig.1 PPARγ protein electrophoresis in hippocampus of each group
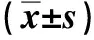
表1 各组大鼠海马区Aβ、P-Tau及PPARγ的表达Tab.1 Expressions of Aβ, P-Tau, and PPARγ in
2.2 认知功能评价
与C组比较,N组大鼠逃逸潜伏期延长、穿越平台次数减少、目标象限游动时间较短(P<0.05);与N组比较,P组大鼠逃逸潜伏期缩短、穿越平台次数较多、目标象限游动时间较长(P<0.05),G组大鼠逃逸潜伏期延长、穿越平台次数减少、目标象限游动时间较短(P<0.05)。见表2。
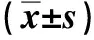
表2 各组大鼠术后Morris水迷宫实验结果Tab.2 The result of Morris maze test of each
2.3 海马区HE染色
HE染色观察各组大鼠海马体细胞损伤情况,与G组和N组相比,C组和P组大鼠海马体细胞相对排列紧密,膜清晰,而G组与N组的大鼠海马体细胞排列紊乱,细胞核核固缩。见图2。

图2 各组大鼠海马体的病理组织特点(HE,×400)Fig.2 Pathological characteristics of hippocampus of each group(HE,×400)
3 讨论
有研究表明,在动物实验中,吸入麻醉后实施剖腹探查手术会引起SD大鼠的认知功能障碍[11]。七氟烷使大鼠海马区Aβ和P-Tau蛋白沉积增加,而提高PPARγ水平减轻Aβ和P-Tau对神经的损伤[7]。本研究使用临床上常用于老年麻醉的静脉麻醉药物丙泊酚来实施麻醉[12]。丙泊酚是一种常用于临床的镇静催眠药物,通过激活γ-氨基丁酸A受体(γ-aminobutyric acid A,GABAA)维持麻醉[13]。Zhou等[14]研究显示,丙泊酚可通过对N-甲基-D-天门冬氨酸(N-methyl-D-aspartate,NMDA)和脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)-络氨酸蛋白激酶B(tyrosine related receptor kinase B,TrkB)-cAMP反应元件结合蛋白(cAMP response element binding protein,CREB)信号通路的相互作用损害大鼠的记忆和学习能力,并诱导出现认知功能障碍。也有研究显示[15],丙泊酚可能对支持记忆功能的神经基质产生了短暂的“药理损害”,它干扰了人类海马体对陈述性记忆(即指人对事实性资料的记忆)的完整性。丙泊酚麻醉也可能会使细胞凋亡相关基因表达增加[16]。近年来研究表明,在动物实验中,丙泊酚麻醉后实施手术更易使实验动物出现认知功能的改变和海马体的病理性病变[17]。接受手术与麻醉的N组大鼠认知功能较C组减弱,N组、P组和G组之间比较发现,吡格列酮干预后的P组大鼠其认知功能得到明显改善,G组大鼠认知功能损害最严重;由此说明,上调PPARγ水平有助于减轻麻醉和手术引起的认知功能障碍程度。
Aβ在海马体中沉积导致POCD,麻醉和手术会使Aβ在脑组织中的聚集增加[18]。Aβ在淀粉样变途径中是由β位淀粉样前体蛋白裂解酶1(beta-site amyloid precursor protein cleaving enzyme 1,BACE1)催化生成的[19]。Aβ在脑组织中能干扰突触与神经元之间的通信,甚至导致细胞死亡[20-21];Wang等[22]研究显示,减少海马体中的Aβ生成和抑制神经元凋亡有助于降低老年大鼠发生POCD的概率,起到神经保护作用;有研究表明,PPARγ可通过抑制Aβ生成途径的关键酶BACE1的活性来减少Aβ的生成。本研究结果表明,与P组比较,N组和G组大鼠海马中Aβ的表达较高,又以G组最高;PPARγ表达水平在P组中最高,G组中最低。Katsouri等[23]将过氧化物酶增殖物激活受体γ共激活因子1α(PPARγ-coactivator-1α,PCG-1α)的基因转移到小鼠的大脑皮质层和海马中,观察4个月后发现小鼠的空间记忆能力提高,Aβ沉积显著减少;通过上调PPARγ水平而减少Aβ沉积的机制是由于在BACE1基因的启动子中有过氧化物酶体应答原件(peroxisome proliferator-response element,PPRE),PPARγ与PCG-1α可通过与PPRE结合,阻断BACE1的转录和翻译,从而抑制了BACE1的活性,减少Aβ的生成[24]。也有学者研究显示,PPARγ还可通过提高胰岛素降解酶(insulin-degrading enzyme,IDE)的活性促进Aβ的降解[3];PPARγ在受到配体激活后转入细胞核中,通过与IDE基因启动子区的响应元件结合,从而激活IDE基因的转录活性,促进Aβ降解,减少Aβ沉积[25]。
除此之外,本研究还检测P-Tau。在AD小鼠大脑中,Tau蛋白被过度磷酸化并形成纤维,在轴突与树突之间表现为神经纤维缠结(neurofibrillary tangles,NFTs)[26]。P-Tau沉积形成成对的螺旋丝,以NFTs的形式沉积,损害神经元细胞[27]。在本研究中N组SD大鼠海马体中P-Tau浓度比C组高,有研究发现自噬功能障碍,会延迟Tau聚集物的清除和降解,使Tau蛋白磷酸化[28]。由此推断手术与麻醉可能是导致海马体中P-Tau聚集的危险因素。糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)在Tau蛋白磷酸化中有着重要作用[29]。GSK-3β可通过磷脂酰脂醇3-肌酶(phosphatidylinositol 3- kinase,PI3K)/丝氨酸/苏氨酸激酶(v-akt murine thymoma viral oncogene homolog,Akt)信号通路被激活,GSK-3β是Tau蛋白在丝氨酸/苏氨酸位点上磷酸化的中介[28]。在Tau蛋白磷酸化损伤神经细胞的过程中,有学者认为可能是通过细胞周期蛋白依赖性激酶5(cyclin-dependent kinase5,CdK5)激活Tau/GSK-3β信号通路实现的[30]。而PPARγ激动剂是GSK-3β的非竞争性抑制剂,提高PPARγ水平可抑制GSK-3β的活性,从而减少Tau蛋白的磷酸化。从N组、P组及G组大鼠的组间比较显示,使用PPARγ激动剂的P组大鼠海马中P-Tau较其他2组减少,使用PPARγ抑制剂的G组大鼠海马中P-Tau蛋白最多。提高PPARγ水平可减少海马中Tau蛋白的磷酸化。
综上所述,研究发现由丙泊酚麻醉诱导实施剖腹探查手术后的SD大鼠,其大脑海马区的Aβ和过度磷酸化的Tau蛋白沉积增加,引起海马区神经细胞的退行性变和死亡,导致其认知功能损害。本研究分别对大鼠腹腔注射PPARγ激动剂和PPARγ抑制剂后,发现上调PPARγ水平减少了Aβ和P-Tau在大鼠海马区的沉积,减轻了由丙泊酚麻醉手术后带来的神经损伤,可降低POCD发生的风险,为临床POCD的预防提供一个新的方向和理论依据,但对于彻底阐述清楚丙泊酚麻醉与手术所带来的认知功能障碍的机制仍然需进一步探索;由于大多数研究结果都是从动物实验和细胞实验得出的,还需在临床上进一步探索研究。
