正常足月新生儿出生3个月内肠道菌群的定植规律分析*
2024-03-13张金铃姜华杨萌婷马丽雷光霞杜欣欣冯梅余涵王鉴
张金铃, 姜华, 杨萌婷, 马丽, 雷光霞, 杜欣欣, 冯梅, 余涵, 王鉴***
(1.贵州医科大学 临床医学院, 贵州 贵阳 550000; 2.贵州医科大学附属医院 小儿外科, 贵州 贵阳 550004; 3.贵州医科大学附属医院 新生儿科, 贵州 贵阳 550004)
肠道菌群是人体最庞大、最复杂及最多样化的微生物群,在调节营养、代谢、免疫和生理功能以维持宿主健康方面发挥重要作用[1],其中新生儿肠道菌群的最初定植和演替规律一直是重要研究课题[2-3]。正常足月儿是指胎龄为≥37~<42周、出生体质量为2 500~4 000 g及无畸形或疾病的活产婴儿[4]。随着测序技术的发展和进步,特别是检测肠道菌群标记基因(如16S V3~V4区域)为对象的扩增子测序的广泛应用,使得人体肠道菌群的鉴定驶上快速道,包括很多以往基于培养法无法检测出来的菌群也能被很快鉴定出来[5]。然而,国内采用测序技术进行肠道菌群研究的报道不多,且结果差异较大[6-8],未能长期监测新生儿肠道菌群的演变过程[9]。因此,本研究运用16S 核糖体RNA(16S ribosomal RNA,16S rRNA)基因测序技术动态监测正常足月新生儿肠道菌群的定植规律,探索正常足月新生儿出生3个月内肠道菌群变化,为新生儿肠道菌群与疾病的研究提供基础数据。
1 对象与方法
1.1 研究对象
选取2021年11月1日—2022年4月30日本院分娩的正常足月新生儿,要求符合:(1)37周≤胎龄<42周,出生体质量≥2 500~≤4 000 g;(2)母亲无感染性疾病、新生儿无感染高危因素;(3)未使用抗生素;(4)病历资料、随访信息完整。排除有严重先天性消化道畸形及各种遗传代谢病者、生后使用微生态制剂者。正常足月新生儿20例,男婴10例(50.00%)、女婴10例(50.00%),出生胎龄37+1~40+6周、平均(38.78±1.53)周,出生体质量2 550~4 000 g、平均(3 158.00±431.02)g,1 min Apgar评分9.00(9.00,9.00)分,5 min Apgar评分均为10分,喂养方式为配方奶喂养2例(10%)、母乳喂养7例(35%)及混合喂养11例(55%),剖宫产14例(70.00%)、经阴分娩6例(30.00%)。本研究获医院伦理委员会批准(2022伦审第339号),所有研究对象的家属均签署知情同意书。
1.2 研究方法
1.2.1一般资料收集 查阅电子病例系统,收集孕母资料[年龄、孕产情况、无感染高危因素(母亲绒毛膜羊膜炎或产时发热、B族链球菌(Streptococcus)定植或菌尿症或既往新生儿B族Streptococcus感染、胎膜早破≥18 h、自发性早产、羊水胎粪污染)]和足月新生儿资料(性别、胎龄、出生体质量,分娩方式及喂养方式)。
1.2.2粪便标本收集及菌群检测 收集足月新生儿出生后第1天(C0)、第3天(C1)、第1周(C2)、第1个月(C3)及第3个月(C4)足够的粪便标本至无菌螺口冻存管,粪便采集后即刻放入装有冰袋的保温盒中,-80 ℃冰箱冷冻保存,采集过程严格遵循无菌操作原则;所有标本收集完成后,干冰运输至上海百趣生物医学科技有限公司,进行l6S rRNA V3+V4区测序及生物信息学分析。
1.2.3l6S rRNA测序 首先采用十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)方法提取粪便标本总脱氧核糖核酸(deoxyribonucleic acid,DNA),之后选择l6S rRNA V3+V4区域特定引物341F(5′-CCTACGGGNGGCWGCAG-3′)805R(5′-GACTACHVGGG TATCTAATCC-3′),进行聚合酶链式反应(polymerase chain reaction,PCR)扩增、定量并回收纯化,从而制备合格的测序文库上机测序;在NovaSeq PE250平台上进行16S rRNA基因测序。
1.2.4生物信息学分析 对测序获得的双端数据进行数据拆分、拼接和过滤、 采用区分扩增子降噪方程(divisive amplicon denoising algorithm 2,DADA2)去噪,获得扩增子序列变异体(amplicon sequence variants, ASV)特征(feature)序列和ASV (feature)丰度表格。根据ASV(feature)序列文件、ASV (feature)丰度表进行物种注释及计算各物种在各样本中的丰度,主要看门、属水平肠道菌群,观察其分布情况;通过Alpha多样性分析评估样本中肠道菌群丰富度、多样性(常用Chao1指数描述菌群丰富度,shannon、Simpson指数用于描述菌群多样性);通过Beta多样性分析对不同组间样本肠道菌群构成进行比较分析[常用方法为主坐标分析(principal coordinates analysis,PCoA)]。
1.3 统计学分析

2 结果
2.1 测序基本信息
20例正常足月儿5个时间点的样本均齐全,共收集100份粪便标本进行l6S rRNA基因测序,测得的序列长度在400~500 bp,占总序列的99.80%,共鉴定出39个门和1 021个属。
2.2 肠道菌群ASV分布
正常足月儿于C0、C1、C2、C3、C4时的粪便样本中含有ASV数目依次为2 722、1 828、1 930、1 970及1 940个,即出生第1天ASV数目最多(图1)。

注:绿色为C0,红色为C1,黄色为C2,蓝色为C3,紫色为C4,重叠部分为共有ASV数目。
2.3 肠道菌群Alpha多样性分析
采用Shannon、Simpson、Chao1指数来度量正常足月新生儿肠道菌群Alpha多样性(表1),结果显示,5个采样时间点的Shannon指数比较,差异有统计学意义(H=19.53,P<0.05),进一步做多重比较分析显示正常足月新生儿C1、C2及C4的Shannon指数均低于C0时间点(Padj.<0.05);5个采样时间点的Simpson指数比较,差异有统计学意义(H=12.66,P<0.05),进一步做多重比较分析显示,5个采样时间点的Simpson指数相互比较差异无统计学意义(Padj>0.05);5个采样时间点的Chao1指数比较,差异均无统计学意义(P>0.05)。

表1 正常足月儿出生后不同时间点粪便中肠道菌群的Alpha多样性指数[M(P25,P75)]Tab.1 Alpha diversity index of intestinal flora in feces of normal term neonates at different time points after birth[M(P25,P75)]
2.4 肠道菌群的Beta多样性
采用PCoA分析度量足月儿肠道菌群的Beta多样性,结果显示(图2),C0样本分布较为分散,提示差异较大;其他采样时间点样本间距离较近、分布较集中,提示差异较小。
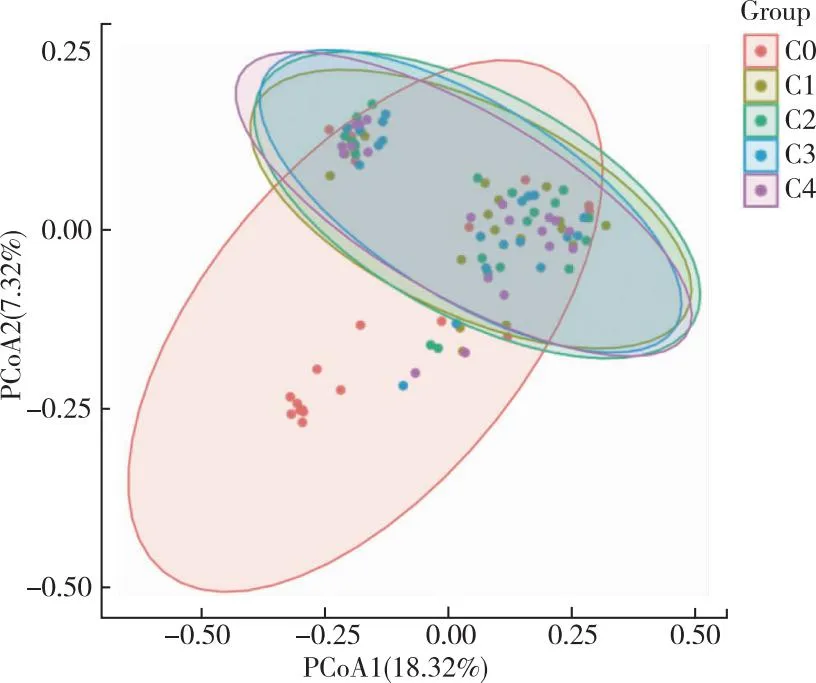
注:红色为C0,草黄色为C1,绿色为C2,蓝色为C3,紫色为C4;每1个点代表1份样本,相同的颜色代表同一采样时间,两点之间距离越近表示两者的肠道菌群结构差异越小;横纵坐标的百分比表示第一轴和第二轴对样本差异的解释度。
2.5 肠道菌群在门水平上的变化
所有样本中肠道菌群主要以厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)及拟杆菌门(Bacteroidota)4个菌门为主,占样本肠道菌群总数的95%以上,4种优势菌门相对丰度在不同采样时间点存在差异;正常足月新生儿生后3个月内Firmicutes相对丰度呈现先增加后降低的趋势,Proteobacteria相对丰度由高变低再逐渐增高,Actinobacteriota相对丰度呈现逐渐增加趋势、C4时与Proteobacteria共同成为优势菌门,Bacteroidota相对丰度一直处于低丰度状态。见表2。

表2 正常足月儿出生后不同时间点粪便中肠道菌群门水平的物种相对丰度Tab.2 Relative abundance of species at the level of the phylum intestinal flora in the feces of normal term neonates at different time points after birth
2.6 肠道菌群在属水平上的变化
在属水平,正常足月新生儿生后前3个月粪便标本中观察到10种优势菌属,其中罗尔斯通菌属(Ralstonia)、Streptococcus、双歧杆菌属(Bifidobacterium)为主要菌属,演变方向依次为:Ralstonia、Streptococcus、Bifidobacterium。另外,随日龄增加,埃希氏-志贺氏菌属(Escherichia-Shigella)相对丰度变化趋势表现为先增加后降低,C3后处于稳定状态;肠球菌属(Enterococcus)C2、嗜甲基菌属(Methyloversatilis)C1开始一直处于稳定低丰度状态;狭窄梭菌属-1(Clostridiumsensustricto-1)、克雷伯菌属(Klebsiella)、拟杆菌属(Bacteroides)、韦荣球菌属(Veillonella)生后一直处于低丰度状态。见表3。

表3 正常足月儿出生后不同时间点粪便中肠道菌群属水平的物种相对丰度Tab.3 Relative abundance of species at the level of the genus intestinal flora in the feces of normal term neonates at different time points after birth
3 讨论
学者们对人体肠道菌群的研究不仅仅局限于某种菌群的定植及其相对丰度比例,还会关注肠道菌群整体多样性及动态变化情况,从而探讨肠道菌群演替与人体健康、疾病的关系[10-11]。本研究对正常足月新生儿的粪便标本采用Illumina NovaSeq PE250进行16S rRNA基因测序,动态观察肠道菌群定植及演变过程,探索其变化规律,为今后肠道菌群与疾病的研究提供基础数据。16S rRNA基因V3~V4区域的DNA测序为当前研究肠道菌群的重要手段,无需分离培养细菌,便可对样本中的优势物种、稀有物种进行检测,获得肠道菌群组成、相对丰度、多样性分析,但是16S rRNA测序得到的序列很多注释不到种水平,且很难分析新的或高度分化的微生物,如病毒和真菌[12]。
本研究中,正常足月新生儿出生后C0时ASV数目最多,1个ASV代表1种菌群,故生后第1天菌群种类最丰富;5个采样时间点之间的肠道菌群丰富度和多样性存在差异,如Alpha多样性分析的Shannon指数所示,C0的Shannon指数数值最大(Shannon指数越大,多样性越高),即C0多样性最高;5个采样时间点样本间构成情况进行比较,本研究通过肠道菌群PCoA分析显示,C0样本整体上分布较为分散、提示肠道菌群结构差异较大,其余时间点分布较集中、提示肠道菌群结构差异较小。以上结果表明,出生后新生儿肠道含有种类丰富的菌群,且5个采样时间点的肠道菌群组成结构不同。
在门水平,正常足月新生儿出生3个月内以Proteobacteria、Firmicutes、Actinobacteriota及Bacteroidota为主,这一结果与Jia等[13]研究结果一致。本研究还观察到新生儿粪便以Proteobacteria为主,相对丰度高达59.18%,从生后C1开始相对丰度逐渐下降,有向Firmicutes转变的趋势,可能与肠道内环境变化有关,这一结果与Chernikova等[14]研究结果一致。另外,母乳中的低聚糖(human milk oligosaccharides,HMOs)、乳铁蛋白等成分对Proteobacteria有抑制作用[15-16]。本研究中,正常足月新生儿生后母乳和混合喂养比例为90%,这也可能是Proteobacteria相对丰度降低的另一个原因。
在属水平,本研究观察到10种优势菌属,其中Ralstonia、Streptococcus及Bifidobacterium为主要菌属,演变趋势依次为Ralstonia、Streptococcus及Bifidobacterium3个阶段。第1阶段在生后C0以Ralstonia为主。Ralstonia是一种机会致病菌,经常与院内感染有关,是无菌生理盐水、蒸馏水、雷尼替丁注射液及芬太尼麻醉剂的污染菌,可引起败血症、脑膜炎及脊髓炎等[17]。Lampropoulos 等[18]研究显示,新生儿败血症中检出了Ralstonia。本研究结果显示,Ralstonia仅在正常足月新生儿C0时相对丰度检出较高,其余时间点相对丰度均<2%,这可能与婴儿出生环境及健康状态有关。第2阶段从C1开始持续至C3,以Streptococcus为主。关于Streptococcus在新生儿的研究,多集中在B型Streptococcus引起的肺炎和脑膜炎,但研究者发现一些Streptococcus是无害的,如新生儿吸入的人乳中含有Streptococcus[19],剖宫产儿以葡萄球菌属、肠杆菌属及Streptococcus多见[20]。本研究中正常足月新生儿的母乳喂养、剖宫产分娩占比较高,这可能是Streptococcus在C1~C3时相对丰度较高的原因。第3阶段为C4时,Bifidobacterium占优势地位,在生长过程中,足月儿从C1开始,Bifidobacterium相对丰度逐渐增加至C4时相对丰度高达44.18%,这可能与本研究中母乳喂养儿占比较大有关。出生后婴儿喂养方式是推动早期肠道菌群定植和进化的主要因素,母乳喂养儿比配方奶喂养儿含有更丰富的Bifidobacterium,而配方奶喂养儿优势肠道菌群则为Bacteroides、肠杆菌属及梭状杆菌属[21-22];母乳中的HMOs含量丰富,能刺激Bifidobacterium及乳杆菌属的增殖与生长[23];母乳中含有的生物活性成分,如免疫球蛋白分泌型IgA、Bifidobacterium因子、乳铁蛋白、免疫活性细胞及溶菌酶等能为肠道Bifidobacterium、乳杆菌属、Bacteroides等有益菌群的定植、生长创造有利条件[24]。Bifidobacterium为新生儿肠道成熟的标志,研究报道Bifidobacterium具有以下功能[25-27]:限制病原微生物在婴儿肠道中的定植、增强肠道屏障功能、降解膳食纤维并提供必需的营养物质、具有抗炎特性。Bifidobacterium的这些作用对生命早期的健康意义重大。
综上所述,本研究使用16S rRNA基因测序揭示了正常足月新生儿出生3个月内粪便中肠道菌群演替方向,即Ralstonia、Streptococcus及Bifidobacterium3个阶段;随着日龄的增加,菌群组成结构、菌群相对丰度发生变化,为今后肠道菌群与疾病的研究提供基础数据。不过,本研究属于观察性研究,样本量相对较少,有一定的局限性,较难进行喂养方式、分娩方式与肠道菌群的相关性分析,且研究处于初级阶段,未涉及病毒、真菌的研究,因此,可以进一步扩大样本量进行研究,以及进行更加深层次的基础研究,比如进行宏基因组学的研究。
