载阿霉素纳米粒温敏凝胶的制备及评价*
2024-03-13杜华康陆苑金阳陈玉颖王永林李勇军刘文
杜华康, 陆苑, 金阳, 陈玉颖, 王永林,3, 李勇军,3, 刘文**
(1.贵州医科大学 贵州省药物制剂重点实验室 &省部共建药用植物功效与利用国家重点实验室, 贵州 贵阳 550004; 2.贵州医科大学 药学院, 贵州 贵阳 550004; 3.贵州医科大学 贵州医科大学民族药与中药开发应用教育部工程研究中心, 贵州 贵阳 550004)
肝细胞癌(hepatocellular carcinoma,HCC)是全球第五大常见癌症,也是癌症相关死亡的第二大常见原因[1]。早期HCC患者主要以手术切除治疗为主,但HCC具有高度隐匿性,患者发现时通常是中晚期,已失去根治性手术切除的机会[2-3]。经肝动脉化疗栓塞术(transarterial chemoembolization,TACE)是治疗中晚期HCC的首选方法[4-6],通过血管栓塞实现局部肿瘤组织缺血坏死,同时释放化疗药物杀伤肿瘤细胞[7-8]。传统TACE是以碘油和化疗药物水溶液简单混合得到的乳剂为栓塞载药材料,在临床上最为常用,但存在稳定性较差、释药快和末梢栓塞不完全的问题,一定程度上影响治疗效果[9]。为解决传统TACE的这些问题,现已开发和应用载药微球[10-13]。载药微球一般是由聚乙烯醇等有机材料构成,稳定性较好、能够栓塞末梢小动脉且可实现化疗药物的局部缓释,但载药微球材料不可降解,这往往会导致严重的炎症反应并阻碍后续治疗[14]。HCC易复发,意味着患者可能需要多次TACE治疗,因此载药栓塞材料的生物可降解性就显得尤为重要。因此,用于TACE治疗的载药栓塞材料需要具备可血管栓塞、长时间缓慢释放药物和体内可降解的特点。温敏水凝胶是一类可响应外界环境温度的变化,由液态转变为固态的水凝胶,具有可注射、栓塞血管和长滞留特性,可通过局部注射到达靶部位形成药物储库,实现缓慢释药[15]。其中以天然多糖聚合物,特别是以壳聚糖(chitosan,CS)为基质的温敏水凝胶,因具有制备工艺简单、成本较低、生物相容性好、生物可降解及抗菌等诸多优点而受到广泛关注[16-17]。课题组前期采用CS、β-甘油磷酸钠(β-sodium glycerophosphate,β-GP)和右旋酮洛芬氨丁三醇制备的右旋酮洛芬氨丁三醇温敏凝胶,具有良好的缓释性能和生物相容性[18-19]。纳米粒通常是指直径在10~1 000 nm的粒子,其可通过增加药物半衰期、提高药物稳定性和延长药物释放时间来提高药物的生物利用度[20]。肿瘤治疗中可利用肿瘤组织的增强渗透和滞留效应,将化疗药物制备成纳米粒(≤200 nm),使药物具有一定靶向性[21]。乳酸-羟基乙酸共聚物[poly (lactic-co-glycolic acid),PLGA)]是一种已通过FDA认证并广泛应用于制药领域的高分子材料,具有可降解性、良好的生物相容性和低毒性的特点[22]。近年来,一些研究结果表明通过将纳米粒和温敏凝胶相结合的方式,可实现药物在局部的缓慢释放[23-25]。因此,本研究以PLGA作为载体材料,以经典化疗药物阿霉素(doxorubicin,DOX)为研究对象,采用复乳法制备载阿霉素纳米粒(doxorubicin-loaded nanoparticles,DOX-NPs),经冷冻干燥后得DOX-NPs冻干粉,再将其分散于CS/β-GP温敏凝胶(thermosensitive gel,Gel)中,制备出具有可栓塞血管、皮下吸收和缓慢释药特性的TACE栓塞载药材料,为肝癌的TACE治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1仪器和试药 Forma 905-ULTS1490医用低温冰箱(美国Thermo Fisher公司),FDU-1100真空冷冻干燥机(日本东京理化器械株式会社),JY88-IIN细胞破碎机(宁波新芝生物科技股份有限公司),90Plus激光粒度仪(美国布鲁克海文仪器公司),R100旋蒸仪(瑞士步琦公司),Optima XPN-100超速离心机(美国贝克曼库尔特公司),JEM 1200EX透射电镜(日本电子株式会社),Merlin Compact扫描电镜(德国蔡司公司),CS501A恒温水浴槽(中国重庆银河试验仪器有限公司),MSC5R磁力搅拌器(群安实验仪器有限公司),UV-2700紫外可见分光光度仪[(岛津仪器(苏州)有限公司)],IMS-20制冰机(常熟市雪科电器有限公司),EL204电子天平(上海梅特勒-托利多仪器有限公司),2.7F SP微导管(日本泰尔茂株式会社)。酸多柔比星原料药(DOX,含量>98.0%,批号N1111A,大连美伦生物技术有限公司),CS(脱乙酰度≥95%,批号RH209117,上海罗恩试剂有限公司),β-GP(含量≥98.0%,批号BCCC6949,美国西格玛奥德里奇公司),PLGA(批号RJ0202007,相对分子量10 kDa,型号50∶50,西安瑞禧生物科技有限公司) ,卵磷脂(批号180701,供口服用药用辅料,江苏曼氏生物科技股份有限公司),聚山梨酯80(批号301C053,北京索莱宝科技有限公司),超滤管(截留分子量30 kDa,默克密理博公司),其余试剂均为分析纯。
1.1.2实验动物 本研究动物实验方案通过了贵州医科大学实验动物伦理委员会审查批准(编号2201022)。雄性ICR小鼠24只,体质量(20±2)g,购于斯贝福(北京)生物技术有限公司,生产许可号SCXK(京)2019-0010。新西兰大白兔3只雌雄随机,体质量(2.8±0.2)kg,购于贵州医科大学实验动物中心,生产许可证号SCXK(黔)2018-0001。
1.2 研究方法
1.2.1DOX-NPs的制备 采用复乳法[26]制备DOX-NPs:称取 PLGA 25 mg、卵磷脂30 mg溶解于3 mL二氯甲烷作为油相,将0.2 mL内水相(4 g/L的DOX溶液)滴入油相后,冰水浴条件下探头超声1 min即得初乳,将初乳转移至9 mL聚山梨酯80溶液(20 mg含聚山梨酯80)中,超声3 min即得复乳,减压蒸馏除去二氯甲烷后即得DOX-NPs混悬液。将DOX-NPs混悬液于31 200 r/min下离心1 h,吸除上清液后收集底部DOX-NPs加入冻干保护剂蔗糖(蔗糖终浓度50 g/L),真空冷冻干燥后得到DOX-NPs冻干粉。
1.2.2DOX-NPs的粒径测定及形态观察 按照最优处方工艺制备DOX-NPs,采用激光粒度仪对其粒径和Zeta电位进行检测。吸取少量DOX-NPs溶液,用蒸馏水稀释后,直接用扫描电镜观察、拍照;取 DOX-NPs溶液1滴,滴于300目的电镜制样铜网上,2%磷钨酸负染色50 s,滤纸除去多余的液体,室温下自然干燥后,透射电镜下观察、拍照。
1.2.3包封率和载药量的测定 精密称取适量DOX-NPs冻干粉于EP管中,用DMSO溶解后,通过紫外分光光度计测定484 nm处的吸光度,计算冻干粉中DOX的量,通过公式计算样品的包封率和载药量。包封率(%)=冻干粉中DOX的量/投药量)×100% ,载药量(%)=(冻干粉中DOX的量/DOX-NPs的重量)×100%。DOX-NPs的重量=冻干粉的量-蔗糖的重量。
1.2.4空白Gel、空白NPs-Gel和DOX-NPs-Gel的制备 空白Gel的制备:在实验室前期研究基础[18-19]上制备CS/β-GP温敏凝胶。将CS 1.0 g 溶于50 mL浓度为0.1 mol/L的冰乙酸溶液中,磁力搅拌至其完全溶解,得澄清透明的CS溶液;称取β-GP 溶于10 mL浓度为0.02 mol/L的NaOH溶液中,得56%的β-GP溶液;于玻璃小瓶中加入2 mL上述CS溶液,随后置于冰浴下搅拌,用注射器将56%β-GP 0.5 mL溶液极缓慢注入CS溶液中,继续在冰浴下搅拌30 min,即空白Gel。空白NPs冻干粉的制备:除将内水相改为纯水外,其他步骤与DOX-NPs冻干粉制备一致。空白NPs-Gel或DOX-NPs-Gel的制备:于玻璃小瓶中加入适量空白NPs冻干粉或DOX-NPs冻干粉(含DOX 5 mg)后继续加入2 mL上述CS溶液,随后置于冰浴下搅拌,用注射器将56%β-GP 0.5 mL溶液极缓慢注入CS溶液中,继续在冰浴下搅拌30 min,即得空白NPs-Gel或DOX-NPs-Gel。
1.2.5空白Gel、空白NPs-Gel和DOX-NPs-Gel的胶凝时间与温度考察 采用倒瓶法[27]考察温敏凝胶溶液37 ℃下的胶凝时间:将“1.2.4”项中制备的3种温敏凝胶从冰浴转移至室温静置10 min后置于37 ℃的恒温水浴槽中,每隔5 s倾斜瓶子,观察液态凝胶是否变为固态。如此反复直至固态,记录时间,即为37 ℃条件下温敏凝胶溶液的胶凝时间。平行测定3次,取平均值。使用试管翻转法[28-29]测定温敏凝胶溶液胶凝温度。“1.2.4”项中制备的3种温敏凝胶置于水浴中并在4 ℃下平衡10 min,然后以1 min/℃的速度程序升温,每个温度下放置1 min。将样品小瓶倒置后,如果温敏凝胶1 min内不发生通过流动,则认为其完成胶凝化,该温度即为温敏凝胶的胶凝温度。平行测定3次,取平均值。
1.2.6Gel和DOX-NPs-Gel的扫描电镜考察 按照“1.2.4项”所述制备空白Gel和DOX-NPs-Gel待其充分胶凝化后,-20 ℃下冷冻过夜,-40 ℃真空干燥24 h,将干燥后的凝胶通过液氮脆断、喷金塑形后,通过扫描电镜观察其微观形态结构。
1.2.7空白NPs-Gel血管栓塞性能和皮下吸收特性考察 由于DOX会导致严重的局部炎症反应,本部分实验采用空白NPs-Gel进行栓塞性能和皮下吸收特性的考察[30]。取3只新西兰大白兔进行兔耳中动脉血管栓塞实验,从兔耳中动脉远心端向近心端缓慢注入空白NPs-Gel 0.2 mL。分别在注射后10 min、第1、5、8天时仔细观察兔耳的缺血情况。在24只ICR小鼠的右后腿部皮下分别注射0.3 mL空白NPs-Gel,分别注射后1、3、5、10、15、20、25和30 d脱颈处死3只小鼠,观察皮下凝胶的吸收情况并拍照记录,随后小心取下空白NPs-Gel用滤纸擦干表面后称重,计算其吸收量。吸收量=(原始重量-剩余重量)/原始重量×100%。
1.2.8空白Gel和DOX-NPs-Gel体外微导管推注实验 由于血管栓塞及皮下吸收特性考察中注射所用的针头与TACE中实际注射所用的微导管存在较大区别,为更好的模拟TACE的使用环境,本实验通过使用2.5 mL注射器分别抽取适量空白Gel和DOX-NPs-Gel,连接2.7F微导管后向盛有37 ℃生理盐水的烧杯内推注,观察其导管内流通性和导管外的胶凝化行为。
1.2.9DOX-NPs-Gel体外释放考察 采用无膜溶出法[31]考察DOX-NPs-Gel的体外释放:吸取1 mL上述DOX-NPs-Gel于5 mL EP管中,置于37 ℃恒温水浴槽中待其完全胶凝后取出加入3 mL 体积分数为1% 的DMSO水溶液作为释放介质,避光置于37 ℃恒温振荡仪(50 r/min),分别在0.5、0.75、1、2、4、8、12、24、48、72、96、120、144及168 h时取样2 mL,同时补充相同体积和温度的释放介质。取出的释放介质平均分成两份;一份1 mL为样品A,包含DOX和DOX-NPs,用于计算DOX总释放率;另一份1 mL置于超滤管中,8 000 r/min离心15 min,下层滤液为样品B,为释放出的DOX,用于计算DOX释放率。样品A和B冻干后用2 mL DMSO溶解,通过紫外分光光度计测定484 nm处吸光度,计算各样品中DOX的浓度,计算DOX总释放率和DOX释放率。DOX总释放率减去DOX释放率为DOX-NPs释放率。
2 结果
2.1 DOX-NPs的表征、载药量和包封率
从图1中可以看出本研究制备的DOX-NPs的粒径主要在100~200 nm,且成均匀球形,形态规则无粘连,粒径分布均匀;通过激光粒度仪测定DOX-NPs的粒径为(186.68±5.99) nm,多分散系数(PDI)为(0.17±0.01),Zeta电位为(-23.33±1.54) mV,粒径分布见图2。紫外分光光度计测得DOX-NPs的包封率和载药量分别为(70.75±2.11)%和(2.70±0.29)%。

注:A为扫描电镜结果,B为透射电镜结果。

图2 DOX-NPs粒径分布情况Fig.2 Distribution diagram of DOX-NPs particle size
2.2 胶凝化时间与温度的测定
空白Gel平均胶凝时间为(65±5) s,胶凝前后性状对比分别见图3。空白NPs-Gel和DOX-NPs-Gel平均胶凝化时间均为(165±15)s,胶凝前后性状对比见图4和图5。试管翻转法测得胶凝化温度,空白Gel、空白NPs-Gel和DOX-NPs-Gel的胶凝温度分别为(27.67±0.94)℃、(34.44±0.47)℃和(34.67±0.47)℃。空白NPs冻干粉和DOX-NPs冻干粉的加入均使得胶凝温度上升约7 ℃。

注:A为液态凝胶,B为固态凝胶。
2.3 空白Gel和DOX-NPs-Gel扫描电镜考察
空白Gel和DOX-NPs-Gel扫描电镜图见图6,所有冻干凝胶都呈层状结构,与空白Gel和DOX-Gel不同的是DOX-NPs-Gel孔道更加密集完整,层状结构孔洞上均匀分布着纳米粒,因而证明复合体系是纳米粒嵌合到温敏凝胶的多孔结构中形成的较均匀状态。

注:A为空白Gel(200×),B为空白Gel(80 000×), C为DOX-NPs-Gel(200×),D为DOX-NPs-Gel(80 000×)。
2.4 空白NPs-Gel血管栓塞考察
如图7所示空白NPs-Gel室温下呈液态,黏度合适,易于注射(图7A);兔耳中动脉栓塞前,血管呈紫红色,触摸感软有弹性(图7B);注射空白NPs-Gel后10 min,兔耳中动脉血管发白,触摸感硬,说明空白NPs-Gel可以迅速凝固,能栓塞血管(图7C);栓塞后1 d,兔耳呈现缺血紫红色状态,兔耳中动脉血管触摸感硬(图7D);栓塞后第5天时,兔耳中动脉出现轻微坏死现象(图7E);栓塞后第8天时,兔耳明显发黑坏死,说明温敏凝胶的血管栓塞性能良好(图7F)。
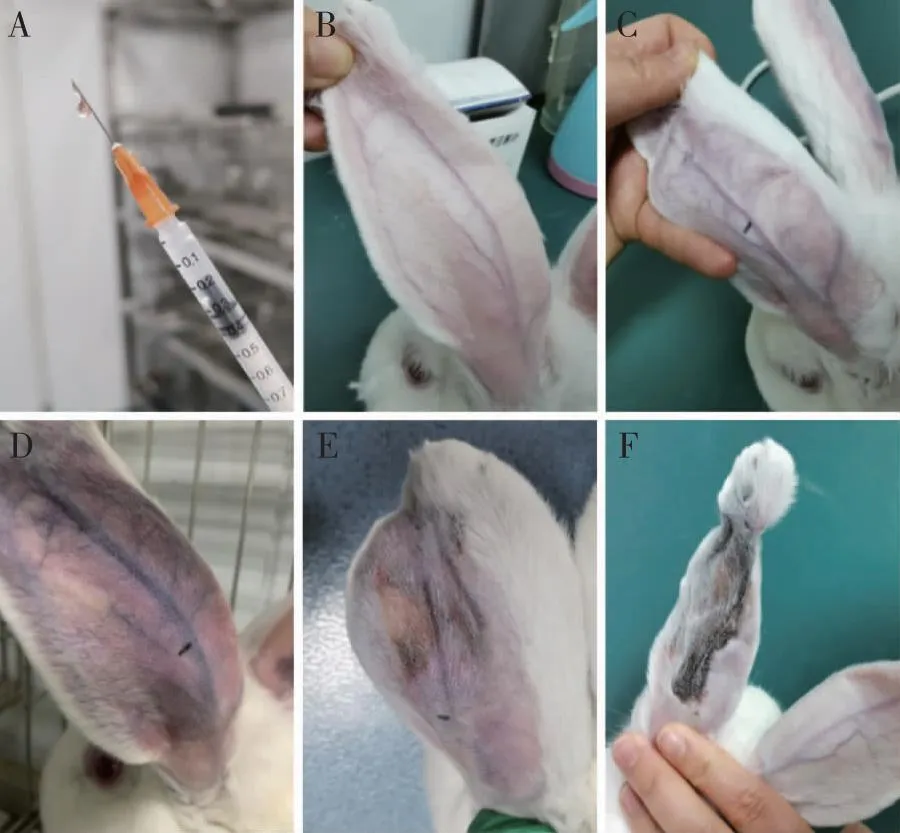
注:A为凝胶呈液态,B为栓塞前,C为栓塞后10 min,D为栓塞后1 d,E为栓塞后5 d,F为栓塞后8 d。
2.5 空白NPs-Gel皮下吸收特性考察
皮下注射空白NPs-Gel后小鼠精神状况良好,实验期间注射部位未见任何异常。空白NPs-Gel的外观和剩余质量的变化见图8(图中红色虚线与X轴平行)。第1 天时空白NPs-Gel外观为直径约1.3 cm的圆饼状,到第5天时直径缩小(不足1 cm),后续变化缓慢,第30天时直径约0.7 cm。第1和第5天时空白NPs-Gel分别被吸收43.13%和58.27%,后续变化缓慢,直到第30天时剩余(38.27±2.41)%。说明空白NPs-Gel可被缓慢吸收。
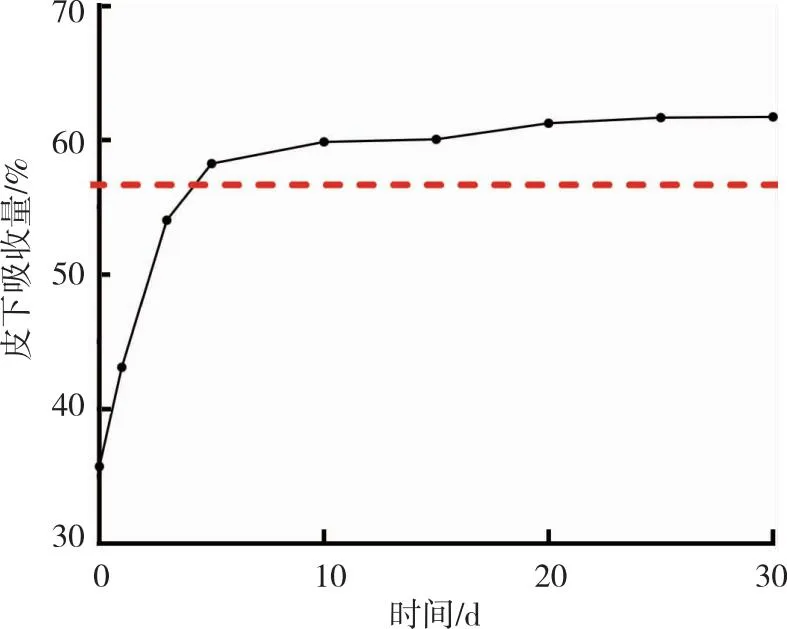
图8 空白NPs-Gel在小鼠皮下吸收量 Fig.8 Blank NPs-Gel absorbed subcutaneously in mice
2.6 空白Gel和DOX-NPs-Gel微导管推注考察
经2.7F微导管向盛有37 ℃生理盐水的烧杯内推注,观察其导管内流动性和导管外溶胶-凝胶转变行为,结果见图9。空白Gel和DOX-NPs-Gel均可顺利通过体外微导管注入37 ℃的生理盐水后会形成凝胶条带,未出现导管堵塞现象。

注:A为空白Gel推注中,B为空白Gel条带,C为DOX-NPs-Gel推注中,D为DOX-NPs-Gel条带。
2.7 DOX-NPs-Gel体外释放性能考察
第7天时,DOX-NPs-Gel中DOX的总释放率(包含DOX和DOX-NPs)为(53.41±6.09)%,其中DOX释放率为(6.16±0.19)%,DOX-NPs释放率为(47.25±7.29)%,结果见图10。

图10 DOX-NPs-Gel的体外释放率 Fig.10 In vitro release of DOX-NPs-Gel
3 讨论
前期摸索实验已通过单因素考察法对DOX-NPs制备中的初乳和复乳超声时间、卵磷脂用量、聚山梨酯80用量、外水相体积和投药量进行筛选,并筛选出最优冻干保护剂的种类及浓度。制备出的DOX-NPs粒径适宜,载药量较高,DOX-NPs冻干粉复溶前后粒径、PDI和Zeta电位无明显差异;DOX-NPs冻干粉稳定性较好,在-20 ℃下储存30 d,粒径、电位和PDI未发生明显变化。制得的空白NPs粒径为(176.19±2.36) nm,PDI为(0.17±0.01)。相较于DOX-NPs粒径略有减小,冻干前后粒径及PDI无明显变化,可以用于本实验。DOX-NPs-Gel与Gel相比表现为胶凝时间延长和胶凝温度升高,可能原因为引入了DOX-NPs和蔗糖。目前相关研究表明阴离子聚合物的引入有利于壳聚糖温敏凝胶胶凝的发生[32-34]。本文制备的DOX-NPs Zeta电位显示为(-23.33±1.54) mV,可以近似看作一种阴离子聚合物,理论上是有利于CS/β-GP温敏凝胶胶凝的发生。其机理为在CS/β-GP温敏凝胶胶凝过程中阴离子为质子的转移提供了更多选择,使得CS支链更快的析出和交联。前期预实验中,在空白Gel中添加相同量(与DOX-NPs-Gel一致)的蔗糖后,胶凝时间延长、胶凝温度升高,可能是因为蔗糖通过羟基与水的氢键增强了CS链的水化作用,同时蔗糖作为非电解质并不利于CS析出和交联,进而不利于胶凝行为的发生。因此推测DOX-NPs-Gel胶凝时间延长、胶凝温度升高是DOX-NPs和蔗糖共同作用结果。
扫描电镜考察结果中,与空白Gel 相比DOX-NPs-Gel的微观层状多孔结构更加整齐紧密,提示DOX-NPs冻干粉的掺入可能有助于多孔结构的建立。延长DOX的释放时间,从而增加治疗时间。血管栓塞与皮下吸收特性考察及微导管推注实验说明该复合体系可通过微导管注射、可栓塞血管、在体内可被缓慢吸收,可满足TACE给药要求。与目前常用的载药微球相比,本研究制备纳米粒温敏凝胶复合体系所用材料CS、β-GP和PLGA均具有良好的生物相容性和生物可降解性[35-37]。
在进行体外释放考察时,曾采用常规的PBS(pH7.2)作为释放介质,但释放1天后PBS中出现红色絮状沉淀。分析原因这可能是DOX·HCl在PBS中发生脱盐反应导致析出,这与相关研究一致[38]。后续根据文献[39]方法,采用以1% DMSO溶液为释放介质进行体外释放考察。DOX-NPs-Gel无明显突释现象且DOX主要以DOX-NPs形式从DOX-NPs-Gel中释放。以上结果均表明1%DMSO为释放介质并未造成DOX-NPs中药物的泄露。同时证明DOX-NPs可以从DOX-NPs-Gel中释放出来,基于PLGA优异的可修饰性,后续还可以引入甘草次酸或半乳糖衍生物等使DOX-NPs对肝癌细胞具有主动靶向性[40-42]。
综上所述,本研究制备的DOX-NPs-Gel具有可栓塞血管、皮下吸收和缓慢释药特性,具有一定的TACE应用前景,值得进一步研究。
