胃肠间质瘤良恶性认识的历史阶段
2024-03-07侯英勇
侯英勇,袁 伟,徐 晨
胃肠间质瘤(gastrointestinal stromal tumor, GIST)虽总体发病率低,但却是最常见的间叶源性肿瘤。1983年命名GIST时,将其作为未知明确分化方向、不同于平滑肌和神经源性肿瘤的排除性诊断。近数十年,对GIST多方面的认知取得了巨大进步,经历过程比较曲折,如GIST的分化、临床治疗、生物学行为和良恶性等。本文主要评述不同历史阶段对GIST良恶性的认识,以及需要反思的问题和现实意义。
1 GIST良恶性认识的历史阶段划分依据
1998年,日本学者Hirota等[1]发现GIST存在KIT蛋白表达和基因突变,该研究不仅获得了对GIST分化的正确认识,也在慢性髓细胞白血病伊马替尼分子靶向治疗临床试验成功的同时,将GIST引入分子靶向治疗的行列[2]。2002年2月1日,美国食品药品管理局(FDA)批准伊马替尼用于治疗晚期失去手术治疗机会的GIST患者,GIST一跃成为实体瘤中小分子酪氨酸激酶抑制剂伊马替尼大获成功的典范。此后,GIST的多个领域进展迅速,靶向治疗延伸至二线、三线、四线,甚至还出现多个一线靶向治疗药物。GIST持续的突破性进展以及由此引发多个学科的高度关注,是由GIST首个分子靶向药物治疗成功而引发的。因此,本文在评述GIST良恶性的历史阶段时,将其划分为伊马替尼治疗前时代(2002年之前)和后时代。
2 伊马替尼前时代GIST良恶性方法的探索
在伊马替尼用于治疗GIST之前,研究者不乏对GIST良恶性的探讨,并纷纷提出不同的方案(表1)[3-24],部分方案在伊马替尼后时代也得以发表。由于缺乏有效药物,GIST的治疗措施为相对单一的外科手术切除,这些探索良恶性的方案均未引起普遍重视。表1列举的GIST良恶性方案中,有些较含糊,如细胞丰富、核异型性、圆细胞等,无具体的定义;有些是根据原病理诊断结果,或某一病理医师进行切片复习后总结的结果;不同研究者的核分裂象和高倍视野数量定义均不一致;有些仅根据随访结局进行定义,因此这些方案较难推广。无论如何定义,在伊马替尼前时代的研究者,倾向采用良恶性对GIST的生物学行为进行描述,如良性、恶性、非恶性、交界性、中间性、肉瘤等。

表1 文献中判断胃肠间质瘤良恶性方法的汇总
3 伊马替尼后时代GIST生物学行为的解读以及存在的问题
伊马替尼的问世,极大地促进了针对GIST的多学科诊疗团队工作的进展,虽然在2001年之后的一段时间内其成为全球医疗的热点,但彼时仍然缺乏有效地区分GIST良恶性的病理学解决方案,在2001年GIST工作组会议上,撰写者将GIST的生物学行为描述为:一类具有潜在恶性的肿瘤[25],该文章于2002年发表在Human Pathology杂志上,认为至少在那个时代诊断“良性”GIST是不明智的。显然这种提法与伊马替尼前时代的认识相互矛盾。在追求简单可重复的原则下,催生了NIH妥协方案的诞生,仅仅采纳肿瘤大小和核分裂象的两项指标,结合特定的阈值分组,将GIST区分为十分低危、低危、中危和高危四个危险度,并迅速推行至全球的临床实践应用中。这形成了伊马替尼后时代学者们对GIST良恶性固定认知的框架:GIST均是恶性的,GIST有四个复发危险度。之后,WHO分类虽历经多次修订,增加纳入了肿瘤部位、肿瘤破裂等指标,仍然未纳入更多组织形态学特征。虽然有文献明确指出,NIH方案甚至不优于UICC/AJCC TNM系统[26]。事实上很少有实际工作者,尤其共识和指南撰写者关注此问题。
2013年,WHO骨与软组织肿瘤学分类第4版中,GIST上升为单独的一类疾病,Miettinen、Corless、Debiec-Rychter和Fletcher等作者在GIST生物学行为的描述上一度达成一致意见,将GIST描述为包括良性至恶性的具有广谱生物学行为的肿瘤,回归到伊马替尼时代前的认知,将GIST标注为0、1、3。如何区分良恶性呢?Miettinen采用的仍然是肿瘤最大径、核分裂象和部位这三项指标的组合,即Miettinen在WHO分类中给出的方案。但是在第5版WHO分类中却将GIST均标注为3,又推出了GIST均标注为恶性的认知。如此往复。
我们用不同阶段逐步积累的GIST数据和随访信息,12项临床和组织形态学指标进行验证。同时对NIH和WHO方案反复评估,始终揭示此两种方案存在明显的弊端:NIH危险度划分不清,十分低危、低危和中危三个组别间的预后无明显差异(图1),NIH前3个危险度的预后差异不明显,说明前3个组别阈值划分的临床意义有限;而高危组仍可划分出显著差异的级别(图2),且高危组中仍然存在非恶性病例;WHO分类中8个分组,预后并不随组别数字的增大而下降,也存在分级不清和反跳现象,如划分为4组的GIST,预后却优于2组和3组GIST,这就难以建立通常习惯上的概念(图3),如其他恶性肿瘤如食管癌、胃癌、肠癌等TNM分期系统中,指代组别数字的增大与生物学行为渐变相关,便于理解和记忆,而GIST的WHO各组就没有这样的对应关系,易导致对生物学行为理解的困惑,除此以外多个组别间预后差异不明显,难以有效地指导临床工作。
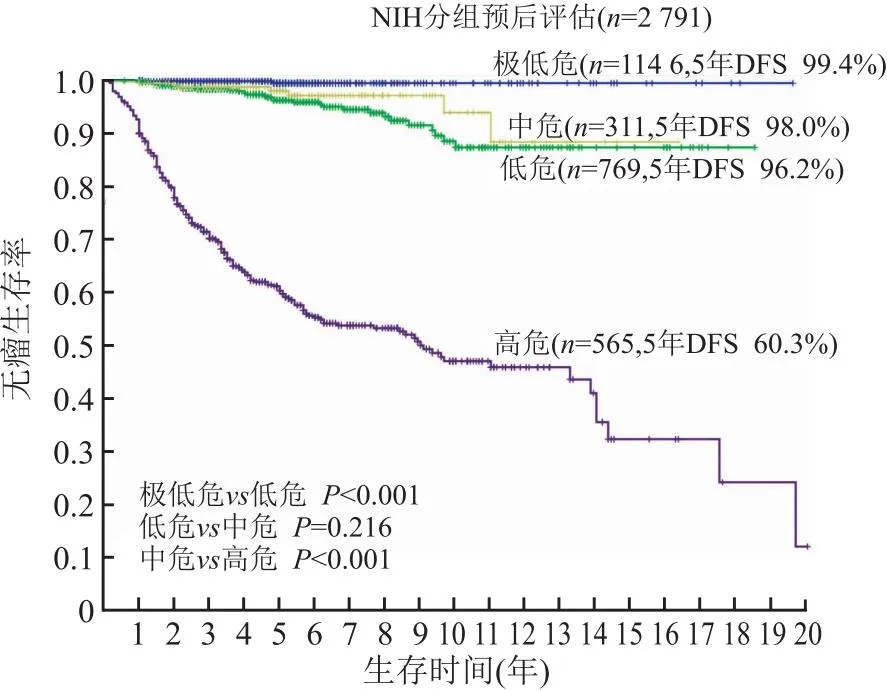
图1 按照NIH危险度的区分方法,对2 791例行单纯手术切除的胃肠间质瘤进行预后分析,前3个危险度5年无瘤生存率分别为99.4%、96.2%、98.0%,低危组和中危组预后相比,差异无统计学意义;DFS.无瘤生存
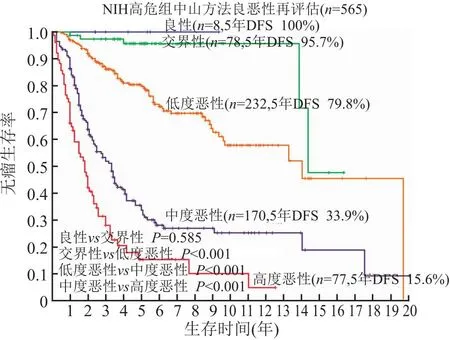
图2 565例行单纯手术切除的高危胃肠间质瘤用组织形态学方法进一步预后分层:高危组内包含不同恶性程度的胃肠间质瘤,其中8例良性病例均无疾病进展,交界性依次到低度恶性、中度恶性和高度恶性,不同恶性组别预后差异有统计学意义;DFS.无瘤生存
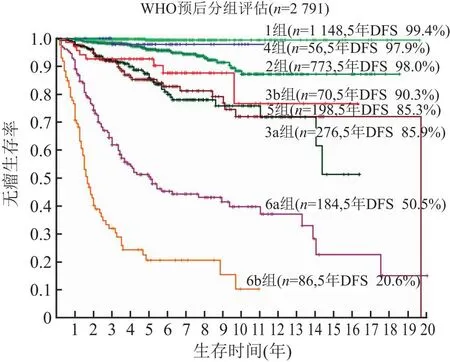
图3 WHO方法8个组别的预后分层,其中归为良性组的(1组、2组和3a组)5年无瘤生存率逐渐降低,差异有统计学意义;归为恶性潜能未定的4组5年无瘤生存率与良性组中的1组差异无统计学意义,却显著高于2组和3a组;归为恶性组的3b组和5组5年无瘤生存率与3a组差异无统计学意义;DSF.无瘤生存
毋庸置疑,组织形态学评估肿瘤的良恶性,仍然是病理科临床实践中的基本方法和有力支撑,而这些方法同样适用于GIST的良恶性评估,组织形态学评估不能解决所有GIST病例,但这不能成为否定组织形态学价值的依据。基于对恶性肿瘤侵袭和转移能力的理解,作者建立起来的组织形态学评估体系,能够将非恶性和不同恶性程度的GIST区分开来,可将良性、交界性、低度恶性、中度恶性和高度恶性的广谱生物学行为有效分层(图4)。按照中山方法可进一步解析发生于胃的按照NIH方案评价为中度危险度的GIST(图5)[27]。该评估体系也可对PDGFRA突变GIST病例进一步分层,解析PDGFRA突变GIST的良恶性构成比(图6)[28],而NIH方法不适合评估PDGFRA基因突变的GIST。同样,中山方法也能对发生于消化道其他部位的GIST、KIT基因不同外显子突变GIST、B-raf突变GIST等的良恶性进一步分层和构成比进行分析,助力临床实践精准决策。
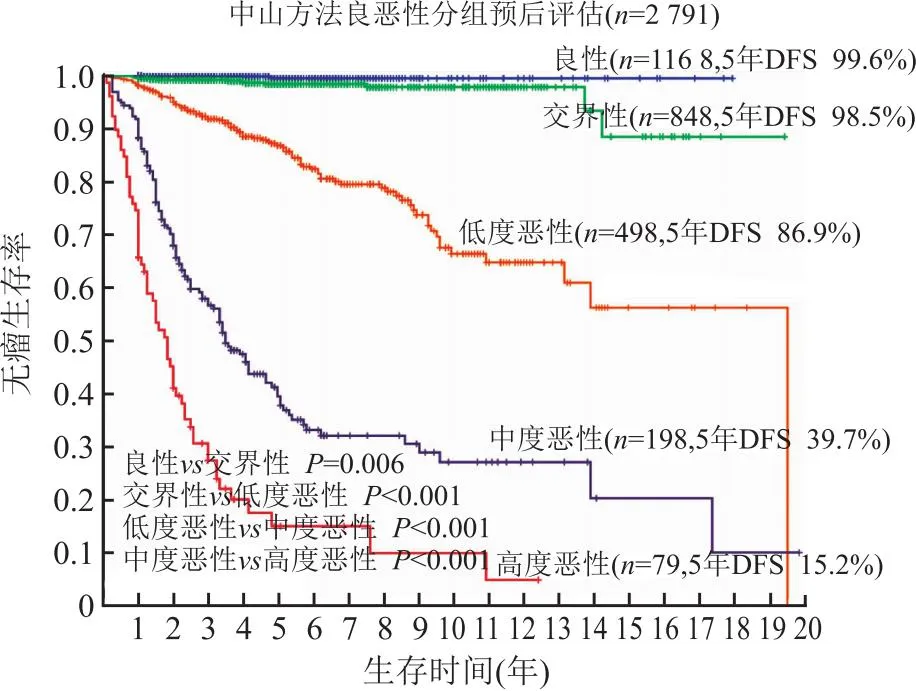
图4 中山医院组织形态学方法对单纯手术切除胃肠间质瘤良恶性和恶性程度的分层,形态评估为良性和交界性病例,疾病进展率极低,5年DFS分别为99.6%和98.5%,而低度恶性5年DFS为86.9%,中度恶性5年DFS为39.7%,高度恶性5年DFS为15.2%,各组间差异有统计学意义;DSF.无瘤生存

图5 中山医院组织形态学方法对中危胃肠间质瘤进一步分层,生存曲线图显示中危胃肠间质瘤囊括了从非恶性到高度恶性的广谱异质性生物学行为谱系,饼图显示非恶性占68%,低度恶性占28%,中-高度恶性占约4%
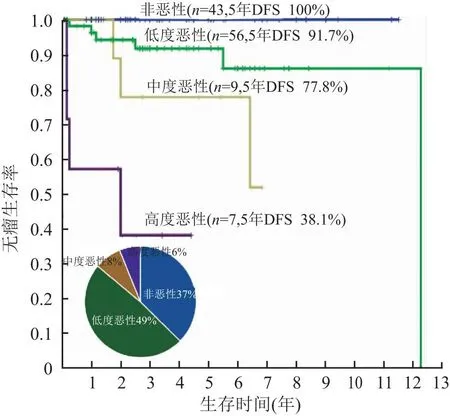
图6 中山方法还可对PDGFRA突变的GIST进一步分层,生存曲线显示PDGFRA基因突变的胃肠间质瘤也包含从非恶性到高度恶性广谱的异质性生物学行为谱系,饼图显示非恶性占比37%,低度恶性占比49%,中-高度恶性占比约15%;DSF.无瘤生存
4 GIST真实世界对病理诊断的需求以及解决办法
近20年来,GIST在多方面不断取得进步,治疗上仍不断取得突破,如除KIT和PDGFRA基因突变的分子亚型外,还包括NF1、SDH、B-raf等基因变异相关的亚型,随着二代测序技术的应用,GIST中发现越来越多的基因变异,如MAX、FGFR1等,甚至出现ALK基因易位的GIST。GIST中KIT和PDGFRA基因突变位点不同,肿瘤对伊马替尼的反应也不同,如KIT基因第11外显子突变的反应率高达90%,第9外显子突变者反应率约60%,而PDGFRA基因第18外显子D842V突变对伊马替尼原发耐药。2006年1月26日FDA批准索坦作为格列卫耐药后的二线分子靶向治疗(2007年2月在中国获批),2013年2月25日FDA批准瑞戈菲尼为GIST的三线药物(2017年3月24日在中国获批),又在一定程度上延长了格列卫耐药患者的生存期。2020年1月29日,FDA批准针对PDGFRA基因D842V突变的药物阿伐替尼用于晚期GIST(2021年3月31进入中国);2020年5月15日,FDA批准瑞派替尼作为GIST四线用药(2021年3月31进入中国),并随之开启了与索坦对照的二线优效性临床试验。除此之外,SDH缺陷型GIST可能从替莫唑胺中获益,而NTRK3-ETV6基因重排的患者可能从拉罗替尼治疗中获益,ALK基因融合的GIST可能需要选择克唑替尼等,分子靶向治疗上丰富的多线治疗方案,这些基础和临床领域的进展,带来了GIST新进展的迭代更新。在GIST外科手术治疗和药物治疗取得进步的同时,内镜治疗也突破了黏膜下肿瘤、包括GIST治疗的禁区[29-30],越来越多的GIST患者从极微创的治疗中获得治愈效果。GIST成为名副其实的可以全程治疗的肿瘤,治疗获益时间长,即使是恶性度高的患者,也有较大的机会存活5年,甚至10年以上,真正进入了慢性病的行列。
基于上述药物治疗进展,术前新辅助/转化治疗,以及术后辅助治疗逐步开展起来。因此,在GIST全程治疗的各个阶段,病理诊断在不同时间节点将会面临不同的,甚至是新的任务。如内镜下活检或瘤体穿刺组织,需要尽量评估良恶性以协助临床选择新辅助治疗方案;对于内镜下切除的GIST病灶,需要评估是否要追加手术治疗或药物辅助治疗;对于原发病灶外科手术完整切除的病例,需要评估是否追加辅助治疗、辅助治疗的药物以及辅助治疗的时间、能否停药等新问题。在每个时间节点的决策中,如何避免过度治疗和治疗不足,如何在寻求疗效、避免副作用、提高生活质量和生命长度,最大卫生经济学和人文关怀上取得平衡,以及哪些是当前还不能答复的问题,是对病理诊断效能的新考验,这些新需求,是现有NIH和WHO方案均难以应对的。
无论是NIH方案和WHO方案,以及TNM分期系统,均未纳入病理诊断中在判断良恶性上普遍通行的组织形态学结构的多项指标,NIH方案和TNM分期系统还省略了良恶性的基本步骤,直接对所有原发GIST进行危险度评估和肿瘤分期,对非恶性GIST导致评估过度。因此,打破NIH的认知框架,客观公正地重新定义和认识GIST生物学行为,与大多数肿瘤一样,除了肿瘤大小和核分裂象,接纳更多组织形态学与GIST生物学行为/良恶性的客观规律,在全程不同节点做出支持临床和患者的最佳病理诊断,是伊马替尼后时代新的任务。继续积累高质量GIST病例,梳理全程诊疗经过,获得真实世界的循证医学证据,是GIST的要务之一。